多频超声波辅助提取山茱萸多糖工艺研究
姚瑞祺,胡家栋,王锋,周博
(杨凌职业技术学院,陕西 杨凌 712100)
山茱萸是山茱萸科(Cornaceae)山茱萸属(MacrocarpiumNakai)山茱萸种(Macrocarpium offcinalis)的成熟果实,为中国传统名贵中药材,药用历史悠久,具有补益肝肾、调气补虚的有益功效,中国第一部药物典籍《神农本草经》中就有记载。山茱萸多糖是山茱萸果实重要的功效成分[1],在体内外免疫调节、预防及治疗肿瘤、预防衰老、神经保护和心肌保护等方面均效果显著[2-4],已成为科研工作者的研究热点,具有广阔的市场前景和应用价值。
超声波辅助提取是一种有效的物理加工技术,可用于植物功能因子(如多糖、黄酮、多酚、原花青素)的提取制备,不仅提高产品得率,且能改善功能性质,尤其是在苹果[5]、大枣[6]、枸杞[7]等果蔬中效果更为明显,展示了良好的应用前景。超声波频率有单频和多频之分,目前研究较多的主要为单频超声波。多频超声波辅助提取是基于多个频率的超声波组合[8],与传统单频超声相比,能耗低,噪声小,空化作用明显,可直接破坏植物细胞的细胞壁结构,有助于细胞内容物的渗出[9],能显著提高有效成分提取率,更有利于进行科学研究和工业生产。
本研究探讨多频超声波辅助对山茱萸多糖提取率的影响,通过正交试验确定超声波辅助提取山茱萸多糖最佳工艺条件,以期为超声波在山茱萸多糖工业生产中的应用提供一定的理论参考。
1 材料与方法
1.1 材料
山茱萸,产自陕西省周至县厚畛子林场;苯酚、浓硫酸、葡萄糖、活性炭、三氯甲烷、正丁醇、浓盐酸、NaOH、石油醚、95%乙醇,均为分析纯。
1.2 仪器
JM-15D-45/80型超声波萃取仪器、JM-07D-28/45型超声波萃取仪器、JM-20D-28型超声波萃取仪器、JM-16D-80型超声波萃取仪器、JM-16D-40型超声波萃取仪器,深圳市洁盟清洗设备有限公司;UV1901PCS型双光束紫外可见光分光光度计,北京普析通用仪器有限责任公司;SHZ-D(III)型循环水真空泵,巩义市予华仪器有限责任公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;LXJ-II型离心沉淀机,上海医用分析仪器厂;BSA423S-CW型分析天平,德国赛多利斯集团;FB-10T型过滤瓶,Automatic Science(TIAN JIN)Instrument Co.,Ltd。
1.3 方法
1.3.1 山茱萸多糖提取液制备参考张茜等[10]的方法。山茱萸鲜果无损采摘,清洗,置于50℃水中浸泡15 min,取出去核,保留果肉并在50℃下烘干备用。将山茱萸干果粉碎,过40目筛。称取适量山茱萸干果粉末,加入石油醚进行脱脂处理,50℃回流4 h后加入一定量的水,在超声波辅助条件下进行提取,提取液分别用纱布和滤纸抽滤1次,然后用旋转蒸发器在50℃下浓缩至提取液的1/5。在浓缩液中加入1/3的sevager试剂(正丁醇与三氯甲烷的比例为5∶2)进行脱蛋白处理,充分振荡15 min后置于分液漏斗中静置,待分层明显后收集上面水层,如此反复操作3次。在得到的水层溶液中按照5 g/L的用量加入活性炭进行30 min的脱色处理,过滤活性炭,所得即为山茱萸多糖提取液。
1.3.2 山茱萸多糖制备参考郭耀东等[11]的方法。按照“1.3.1”的步骤制得山茱萸多糖提取液,在提取液中加入3倍体积95%乙醇,静置5 h后离心,所得固体于50℃下干燥至恒重,即为山茱萸多糖。
1.3.3 山茱萸多糖含量测定
1)标准曲线制作。参考王彦平等[12]的方法。以葡萄糖为标准品,精密吸取7个浓度的葡萄糖供试液2.0 mL,分别加入5%的苯酚溶液1.0 mL,摇匀后迅速加入浓硫酸5.0 mL,摇匀,置于40℃水浴中显色30 min,取出置于冰水中快速冷却以终止显色反应,然后置于室温条件下10 min,于波长488 nm处用紫外可见分光光度计测定吸光度。以吸光度(A)为纵坐标,葡萄糖浓度(μg/mL)为横坐标绘制葡萄糖标准曲线,并得出回归方程。
2)换算因子计算。准确称取“1.3.2”中制得的山茱萸多糖10.0 mg,加水定容至100 mL。准确吸取该山茱萸多糖稀释液2.0 mL,按照标准曲线制作的步骤和方法加入苯酚、浓硫酸等试剂进行显色反应,于波长488 nm处测定吸光度,由回归方程得出山茱萸多糖中的葡萄糖含量C0,按式(1)计算换算因子f。

3)山茱萸多糖提取率的测定。利用“1.3.1”中得到的山茱萸多糖提取液,稀释至合适浓度。精确吸取2 mL稀释液,按照标准曲线制作的步骤和方法加入苯酚、浓硫酸等试剂进行显色反应,于波长488 nm处测定吸光度,由回归方程得出山茱萸提取液中的葡萄糖含量C,按式(2)计算山茱萸多糖提取率w。
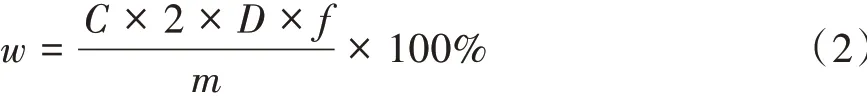
式中,C为稀释液的葡萄糖含量(mg/mL);D为稀释倍数;f为测算出的换算因子;m为称取的山茱萸干果质量(mg)。
1.3.4 超声辅助浸提单因素试验
1)超声频率的单因素试验。固定料液比1∶6,浸提时间30 min,浸提温度45℃,选择超声波频率28、40、80、28/45、45/80 kHz,进行山茱萸多糖的超声波频率单因素试验。利用苯酚-硫酸法测定山茱萸多糖提取率。以无超声波辅助提取作为试验对照。
2)料液比的单因素试验。固定超声波频率28/45 kHz,浸提时间30 min,浸提温度45℃,选择料液比1∶3、1∶4、1∶5、1∶6、1∶7、1∶8,进行山茱萸多糖的料液比单因素试验。利用苯酚-硫酸法测定山茱萸多糖提取率。以无超声波辅助提取作为试验对照。
3)浸提温度的单因素试验。固定超声波频率28/45 kHz,浸提时间30 min,料液比1∶6,选择浸提温度30、35、40、45、50、55℃,进行山茱萸多糖的浸提温度单因素试验。利用苯酚-硫酸法测定山茱萸多糖提取率。以无超声波辅助提取作为试验对照。
4)浸提时间的单因素试验。固定超声波频率28/45 kHz,浸提温度45℃,料液比1∶6,选择浸提时间30、45、60、75、90、105、120 min,进行山茱萸多糖的浸提时间单因素试验。利用苯酚-硫酸法测定山茱萸多糖提取率。以无超声波辅助提取作为试验对照。
1.3.5 超声辅助提取正交试验以超声频率、料液比、浸提温度、浸提时间为因素,设计L9(34)正交试验,探讨不同水平条件下这些因素对山茱萸多糖提取率的影响,并确定最佳浸提条件。因素与水平见表1。

表1 因素与水平
1.4 数据处理
采用SPSS 18.0软件进行数据分析,结果以平均值±标准差表示。
2 结果与分析
2.1 葡萄糖标准曲线制作
葡萄糖标准曲线如图1。由图1可知,葡萄糖含量在0.0~60.0 μg/mL范围内与吸光度呈良好的线性关系,吸光度为0.000~0.667,所得的回归方程如下。
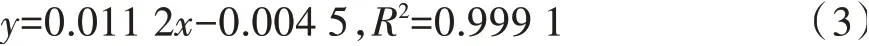

图1 葡萄糖标准曲线
2.2 单因素试验
2.2.1 超声波频率的单因素试验超声波频率对山茱萸多糖提取率的影响见图2。由图2可知,无论是单频超声波(28、40、80 kHz)还是双频组合超声波(28/45、45/80 kHz),与无超声波对照相比,超声波辅助提取均能提升山茱萸多糖的提取率。3种单频超声波中,低频率28 kHz超声波提取率高于40 kHz和80 kHz,山茱萸多糖提取率达15.72%,较对照组提高了60.1%。2种双频超声波提取率均高于单频28 kHz,其中28/45 kHz组合高于45/80 kHz组合,达18.72%,较对照组提高了90.7%。
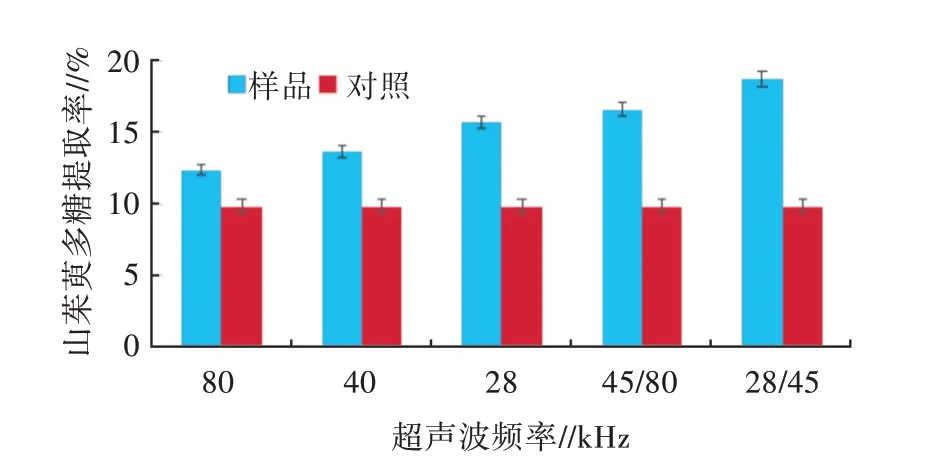
图2 超声波频率对多糖提取率的影响
有研究表明,空化效应是超声波的一种主要效应,与频率有密切联系。频率较低的超声波本身携带较强的能量,更容易直接作用于植物细胞,产生较为明显的破壁效果和空化效应[13]。但是,由于不同样品的内部组织结构存在差异,共振频率也不相同。当超声波频率与样品的共振频率接近时,样品体系才能积极响应超声波能量,达到理想提取效果[14]。在本研究中,可能是因为28/45 kHz双频组合超声波更加接近于山茱萸提取液的共振频率,所以较45/80 kHz双频组合和其他单频超声波,28/45 kHz双频组合超声波提取效果较佳。
2.2.2 料液比的单因素试验料液比对山茱萸多糖提取率的影响见图3。由图3可知,与无超声波辅助对照相比,在各料液比水平下,山茱萸多糖的提取率均明显提高,表明在1∶3至1∶8料液比范围内,超声波辅助提取能有效提高山茱萸多糖的提取率。另外,随着溶液体积的增大,山茱萸多糖提取率呈逐渐升高直至平稳的变化规律。当料液比从1∶3变化至1∶6时,出现拐点;而料液比1∶6以后的提取率,变化不显著。这可能是因为在超声波频率28/45 kHz,浸提时间30 min,浸提温度45℃的条件下,1∶6的料液比已经接近于最佳料液比条件,无需继续增大溶液的比例。
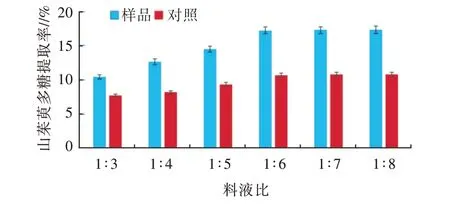
图3 料液比对多糖提取率的影响
2.2.3 浸提温度的单因素试验浸提温度对山茱萸多糖提取率的影响见图4。由图4可知,在30~55℃内,随浸提温度的升高,样品和对照的提取率均呈逐渐增大的趋势;与无超声波辅助对照相比,山茱萸多糖提取率明显提高。当浸提温度为50℃时,山茱萸多糖的提取率为17.28%,与对照相比,增加了59.8%。当浸提温度为55℃时,山茱萸多糖略有增加,但与50℃相比,差异不显著。考虑到升高浸提温度对山茱萸多糖的活性可能造成影响,以及增加能耗等问题,在后续的试验中,选择50℃进行进一步的研究。
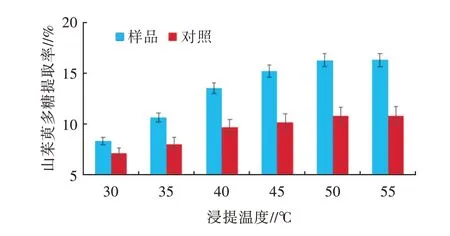
图4 浸提温度对多糖提取率的影响
2.2.4 浸提时间的单因素试验浸提时间对山茱萸多糖提取率的影响见图5。由图5可知,在30~120 min内,随浸提时间的延长,样品的提取率呈先增大后平稳最后趋于减小的趋势。在30~75 min时,山茱萸多糖提取率增加较为明显;75~105 min时,提取率基本趋于稳定;105~120 min时,提取率又有下降。而对于无超声辅助的对照而言,30~75 min时,提取率增加明显;75~120 min时,提取率趋势基本趋于平稳,无显著变化。这可能是因为在超声波频率28/45 kHz,浸提温度45℃,料液比1∶6的条件下,75 min的浸提时间已经基本达到了最大提取率,若继续延长一小段浸提时间,提取率基本没有变化;但若延长至105 min以上时,可能过长时间的超声波作用,会导致部分山茱萸多糖发生降解,反而使得山茱萸多糖的提取率下降。因此,在后续的试验中,选择75 min进行进一步的研究。
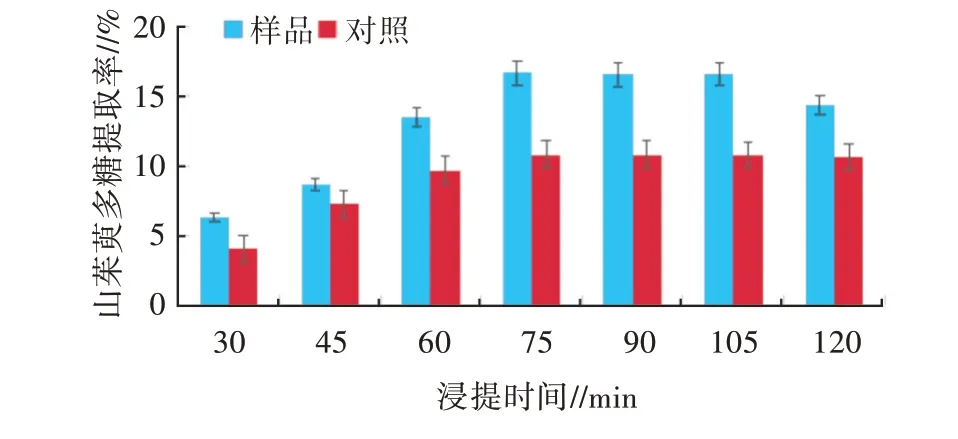
图5 浸提时间对多糖提取率的影响
2.3 正交试验设计
4因素3水平正交试验结果及极差分析结果见表2。方差分析结果见表3。由表2和表3可以看出,在超声频率(A)、料液比(B)、浸提温度(C)和浸提时间(D)4个研究因素中,超声频率(A)极显著(P<0.01),料液比(B)、浸提温度(C)和浸提时间(D)均显著(P<0.05)。影响山茱萸多糖提取率因素的主次关系是超声频率(A)>浸提温度(C)>浸提时间(D)>料液比(B),最佳工艺组合为A2B2C3D3,最佳工艺条件为超声频率双频28/45 kHz,浸提温度52℃,浸提时间80 min,液料比1∶6。在得出的最佳工艺条件下,平行进行3次山茱萸多糖提取试验,得出山茱萸多糖提取率为18.92%,优于表2中最高值,证实了正交试验结果的可靠性。
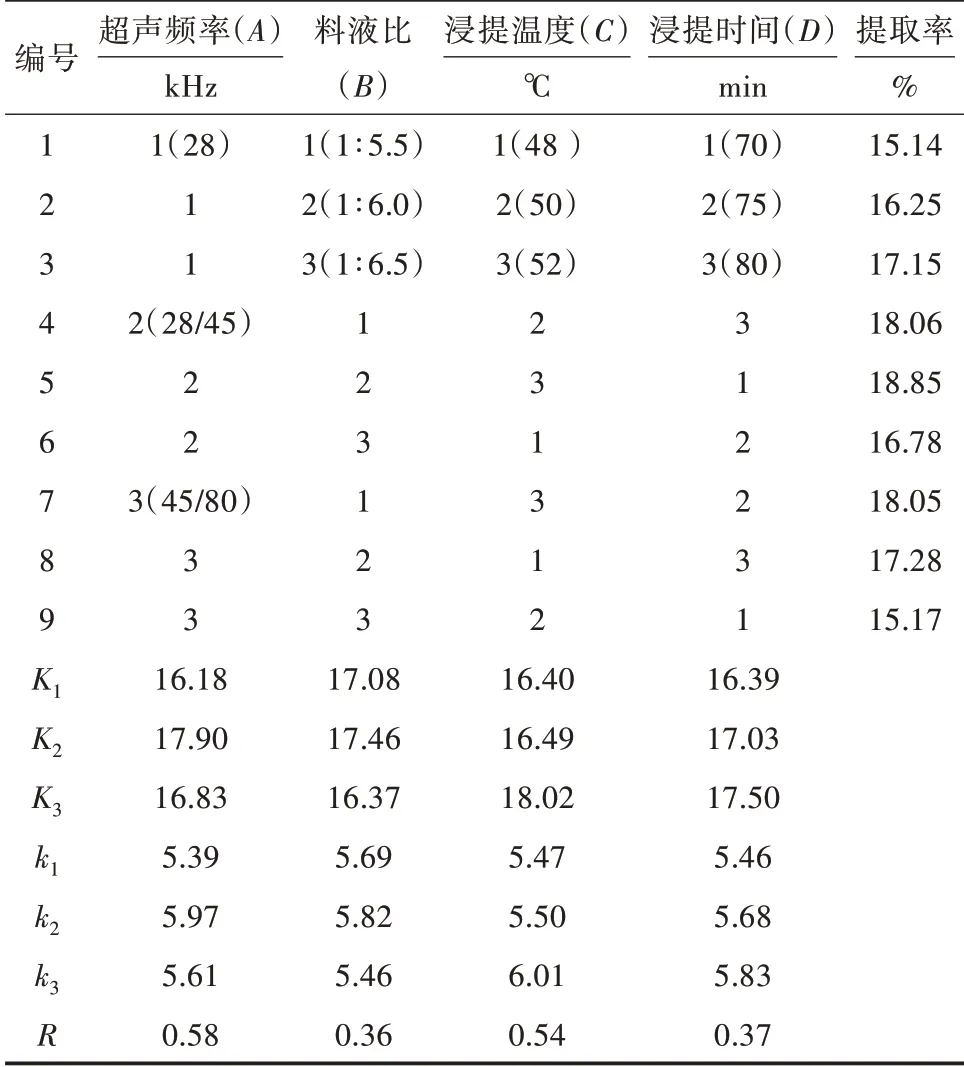
表2 正交试验结果及极差分析

表3 正交试验方差分析
3 小结
与无超声波辅助浸提相比,超声波辅助提取能有效提高山茱萸多糖的提取率,且双频组合超声波优于单频超声波。基于超声频率、料液比、浸提温度和浸提时间等因素对山茱萸多糖提取率影响的研究,发现影响主次关系是超声频率(A)>浸提温度(C)>浸提时间(D)>料液比(B),最佳工艺组合为A2B2C3D3,最佳工艺条件为超声频率双频28/45 kHz,浸提温度52℃,浸提时间80 min,液料比1∶6,山茱萸多糖提取率为18.92%。

