Cx43通过Erk1/2促进BMP-2诱导的人牙髓细胞成牙本质分化
丁灿灿 朱浩 张安妮 何圆培 聂敏海 李适廷
骨形态发生蛋白(bone morphogenetic protein,BMP)-2是转化生长因子-β超家族成员之一,它可以通过与胞膜上的受体相结合,激活胞质中Smad1/5/9复合体磷酸化及其核转运,促使靶基因转录,诱导骨细胞增殖、胶原分泌和骨形成等[1]。此外,BMP-2也可以激活MAPK通路(如:Erk1/2、p38和JNK),调节细胞和组织功能[2]。在牙髓损伤后修复过程中,BMP-2参与调控成牙本质分化标志性基因牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)的表达,并通过Smad1/5通路促进人牙髓细胞(human dental pulp cells,hDPCs)成牙本质分化[3]。
连接蛋白(connexin,Cx)43由Gja1基因编码,是机体表达最广泛的跨膜连接蛋白,它构成缝隙连接通道(gap junction,GJ)或半通道(hemichannel,HC),促使细胞间或胞内外传递分子量小于1 200的物质,介导多种组织细胞的生理和病理活动[4]。生理状态下,Cx43主要表达于牙髓组织内的成牙本质细胞层;在牙齿损伤过程中,成牙本质细胞排列模式发生轻微改变伴随Cx43的表达上调,并且在修复性牙本质形成过程中Cx43高表达于规则排列的成牙本质细胞样细胞内[5-6],表明Cx43参与调控了牙髓组织的损伤和修复过程。研究发现,胞外Ca2+通过BMP-2介导Smad1/5/9和Erk1/2通路促进hDPSCs成牙本质分化,Cx43介导Erk1/2信号促进胞外Ca2+诱导的hDPSCs成牙本质分化,并且Cx43的功能实现可能与其介导的GJ有关[7-8]。
以上研究表明,BMP-2和Cx43在hDPCs成牙本质分化过程中均起到重要的调控作用,并且均可通过Erk1/2信号发挥生物学功能。然而,两者在这一过程中是否相互调控还不明确。为此,本研究在hDPCs中过表达Cx43并施以BMP-2刺激,探讨BMP-2和Cx43在hDPCs成牙本质分化过程中的联系。
1 资料与方法
1.1 主要试剂
pLVX-GJA1-EGFP-3FLAG慢病毒(lv-Cx43)和对照空病毒(mock)(上海生博);DSPP抗体(Santa cruz公司,美国);Cx43和osterix抗体(Abcam公司,英国);p-Smad1/5/9和p-Erk1/2抗体(CST公司,美国);rhBMP-2、PD98059(Sigma公司,美国)等。
1.2 hDPCs提取和培养
选择14~28 岁患者因正畸或阻生拔除的完整、健康牙齿。收集样本前,所有患者知情同意且实验方案获得西南医科大学附属口腔医学院伦理委员会批准(批号:20180511001)。hDPCs参照文献报道的方法培养细胞[9]。以5×104/mL密度接种于无菌塑料培养瓶,细胞培养液为α-MEM+10%FBS,培养条件为100%湿度、37 ℃、5%CO2孵箱。每3 d换液。实验所用hDPCs为3~10 代。BMP-2刺激浓度为300 ng/mL,刺激时间为1 h[3]。
1.3 细胞转染
将hDPCs接种培养皿的30%~40%,更换为含有lv-Cx43和mock的培养液(滴度分别为40和20)感染细胞24 h,随后更换为生长培养基孵育3 d,0.6 μg/mL嘌呤霉素筛选阳性细胞5 d,qRT-PCR和Western blot检测转染效率。
1.4 实时定量聚合酶链式反应(qRT-PCR)
hDPCs培养至接近融合,提取细胞内总RNA。将0.5 μg RNA去除gDNA 污染,反转录cDNA,于-80 ℃冰箱保存、备用。qRT-PCR反应按照产品说明书使用(Takara公司)。应用PRISM®7500 Real-time PCR System(ABI,美国)进行扩增反应。每一样品做3 个复孔,取其平均值。引物序列见表1。
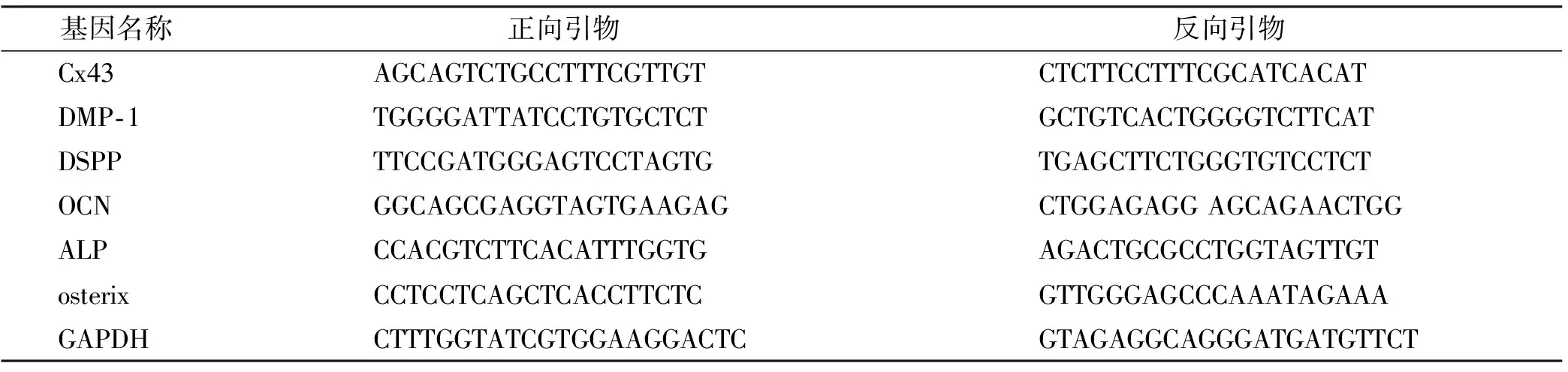
表1 qRT-PCR所用引物序列
1.5 蛋白质印迹法(Western blot)
提取细胞总蛋白,BSA法检测蛋白质浓度。取等量蛋白裂解液(50~100 μg)进行SDS-PAGE电泳、转膜和封闭;分别加入p-Smad1/5/9(1∶1 000)、p-Erk1/2(1∶1 000)和osterix(1∶500)一抗4 ℃过夜,TBST洗膜,浸入二抗稀释液,37 ℃孵育2 h,Image quant Las 4000数字成像系统采集影像,以β-actin为内参进行分析。蛋白条带使用Image J软件定量分析。
1.6 免疫荧光法(IF)
hDPCs接种于盖玻片,4%多聚甲醛固定20 min,0.1% Triton X-100可渗透化处理15 min,1% BSA封闭1 h。随后,细胞孵育一抗(DSPP 1∶10),4 ℃过夜,TBST冲洗,孵育FITC荧光二抗(1∶300)1.5 h,细胞核DAPI 复染5 min。激光共聚焦显微镜(upright DM4000B,Leica,德国)观察细胞荧光强度。
1.7 统计学分析

2 结 果
2.1 过表达Cx43上调hDPCs内Cx43表达
转染mock和lv-Cx43的hDPCs培养7 d,细胞接近融合,形态呈梭形,镜下呈绿色荧光(图1A);分别提取转染后的hDPCs RNA和蛋白,qRT-PCR和WB检测结果显示,过表达Cx43显著上调hDPCs内Cx43 RNA(P<0.05)和蛋白水平(图1B~C)。
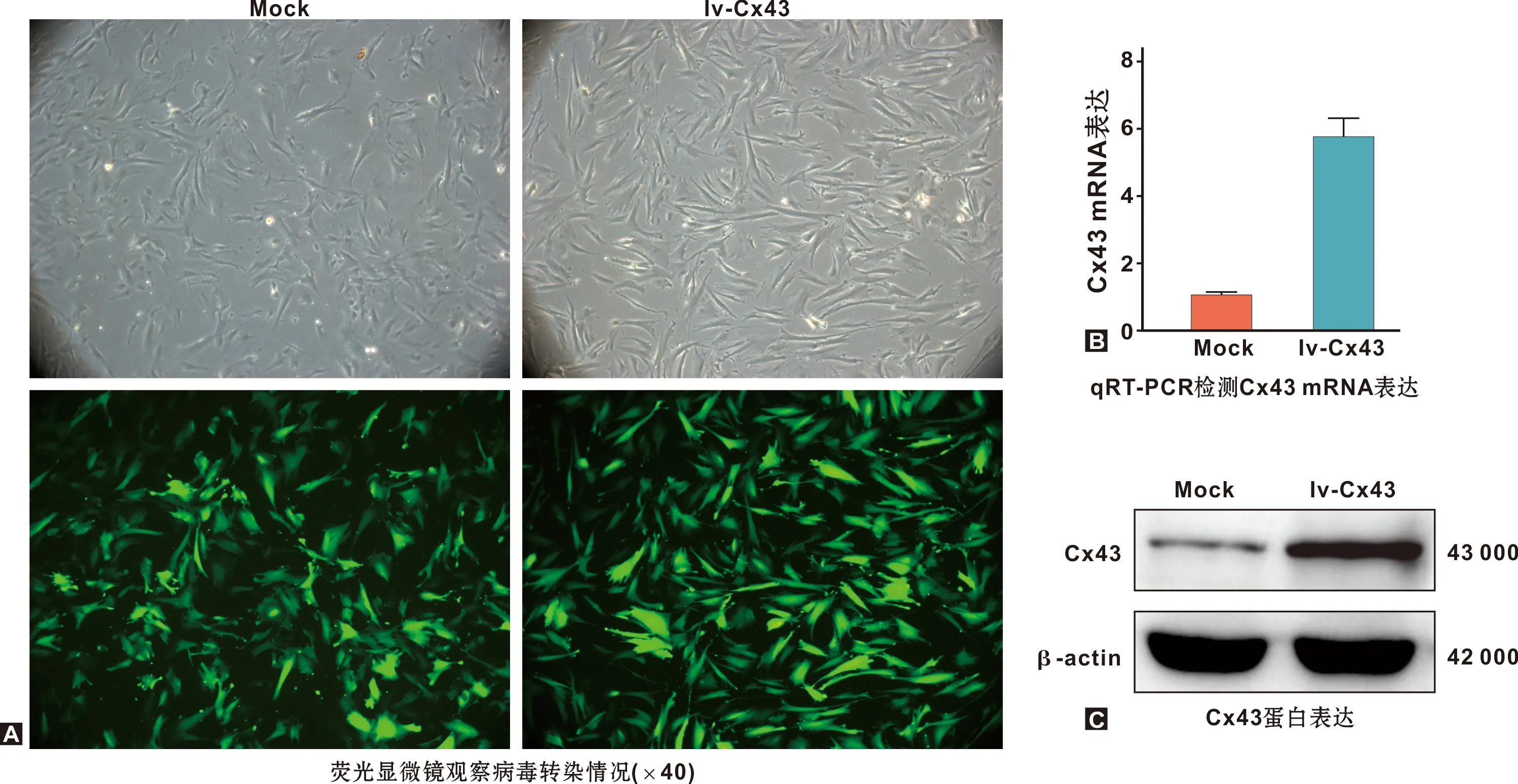
图1 hDPCs中分别转染lv-Cx43和mock
2.2 过表达Cx43促进BMP-2诱导的hDPCs成牙本质分化
与mock组相比,BMP-2刺激hDPCs 1 h显著上调hDPCs内osterix、DSPP、DMP-1、ALP和OCN RNA水平;过表达Cx43明显增强BMP-2对DSPP等的诱导作用(P<0.05),特别是osterix RNA表达为单独施加BMP-2刺激的2 倍,但仅过表达Cx43并未显著上调hDPCs内DSPP 等的表达水平(P>0.05)(图2A)。同样,BMP-2明显上调hDPCs内osterix蛋白水平,过表达Cx43增强hDPCs内BMP-2诱导的osterix蛋白表达。定量分析显示,其与BMP-2+mock组比存在显著性差异(P<0.05)(图2C);与mock组相比,过表达Cx43上调了osterix蛋白表达,但无显著性差异(图2B和C)。IF结果显示,DSPP表达于细胞质内;与mock组相比,BMP-2增强hDPCs内DSPP荧光强度,过表达Cx43促进BMP-2诱导的hDPCs内DSPP表达(图2D)。结果表明,BMP-2促进DSPP等的表达及hDPCs成牙本质分化;仅过表达Cx43不会上调hDPCs内DSPP等表达水平,但却增强BMP-2对hDPCs成牙本质分化的诱导作用。
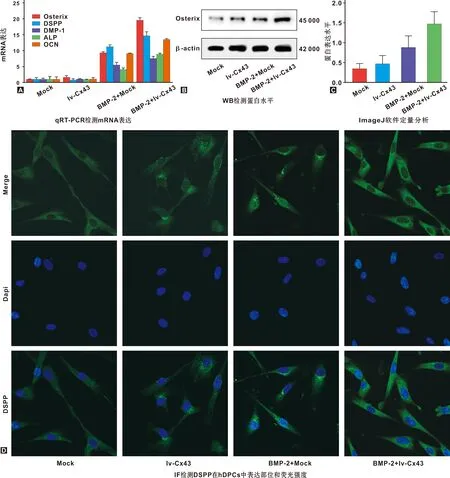
图2 过表达Cx43促进BMP-2诱导的hDPCs成牙本质分化
2.3 Cx43通过Erk1/2增强BMP-2诱导的hDPCs成牙本质分化
明确Cx43对BMP-2诱导hDPCs成牙本质分化的作用后,进一步探讨Cx43发挥功能的途径。前文已述,BMP-2与Cx43均可通过Erk1/2发挥生物学功能。由此推测:BMP-2与Cx43可能通过Erk1/2信号发生串联,实现对hDPCs成牙本质分化的促进作用。研究显示,在hDPCs中,BMP-2激活Smad1/5通路[3]。于是,分别检测了Smad1/5/9和Erk1/2。结果显示,BMP-2激活了hDPCs内Smad1/5/9信号;然而,与mock组相比,Erk1/2磷酸化水平无明显改变(图3A),提示BMP-2促进hDPCs成牙本质分化可能与Erk1/2无关联;过表达Cx43显著上调BMP-2刺激下Erk1/2磷酸化水平(P<0.05),但对Smad1/5/9无明显促进作用(P>0.05)(图3A)。结果表明,Cx43促进hDPCs成牙本质分化可能是通过Erk1/2,而与BMP-2介导的Smad1/5/9无关。
为进一步确定Erk1/2的作用,在BMP-2诱导前施加10 μM PD98059(Erk1/2抑制剂)刺激1 h。结果显示,与BMP-2+lv-Cx43组相比,抑制Erk1/2显著下调osterix、DSPP、DMP-1、ALP和OCN RNA水平(P<0.05)(图3B),且明显减弱osterix蛋白表达(图3C~D)和DSPP荧光强度(图3E),表明Cx43通过Erk1/2促进BMP-2诱导hDPCs成牙本质分化。
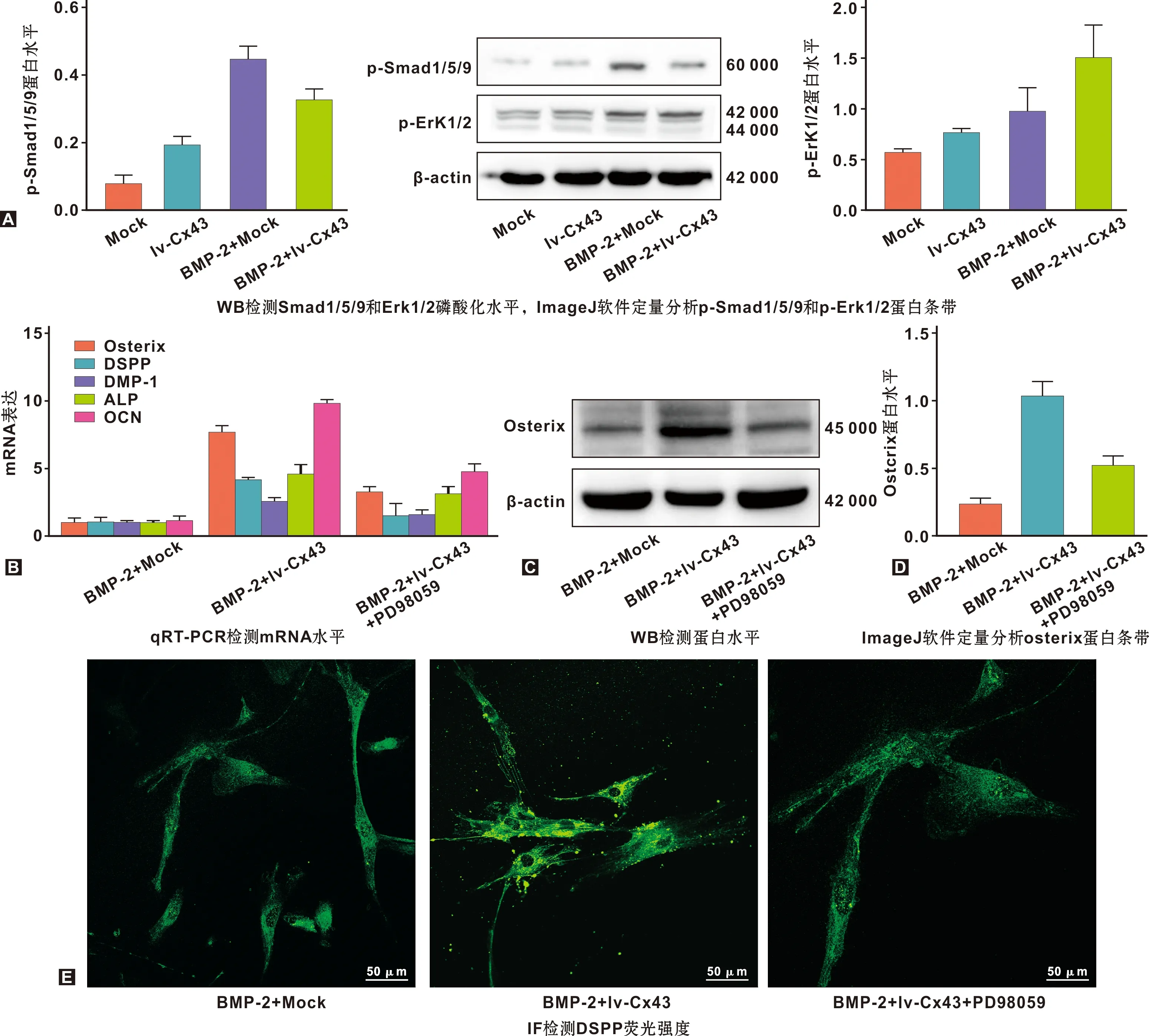
图3 Cx43通过Erk1/2促进BMP-2诱导hDPCs成牙本质分化
3 讨 论
Cx43表达于牙髓中的成牙本质细胞内。牙齿损伤过程中,Cx43表达水平上调[6],表明Cx43参与调控牙齿的损伤后修复,但作用机制不明。本研究显示,BMP-2激活hDPCs中Smad1/5/9信号,而不是Erk1/2;过表达Cx43不能上调DSPP等表达,但增强BMP-2诱导的hDPCs成牙本质分化,Cx43功能的实现与Erk1/2信号有关。
Runx2和osterix均为重要调节牙本质发生的转录因子[10-11]。项目前期研究发现,Runx2促进牙乳头细胞向成牙本质细胞分化,但抑制成牙本质细胞终末成熟,导致牙本质发生异常[12]。Osterix能够促进成牙本质细胞增殖和成熟,对牙本质发生不可或缺[13];此外,BMP-2通过osterix诱导成牙本质细胞DSPP表达[14-15]。因此,本研究仅检测了与BMP-2关系密切的osterix。
本研究发现,仅过表达Cx43未能上调DSPP等的表达,说明过量Cx43对hDPCs成牙本质分化无作用,但过表达Cx43却能促进BMP-2的诱导作用,提示Cx43功能实现可能是通过间接作用。研究显示,BMP-2可以通过Smad1/5促进hDPCs成牙本质分化[3]。本研究验证了前人的结果,并检测了Cx43对BMP-2介导的Smad1/5/9的影响。结果发现,过表达Cx43并未上调BMP-2介导的Smad1/5/9磷酸化水平,说明Cx43可能是通过其他途径发挥作用。因此,检测了Erk1/2信号的活性。结果显示,过表达Cx43显著上调了hDPCs中Erk1/2磷酸化水平。随后,施加了PD98059刺激,发现抑制Erk1/2减弱Cx43上调的osterix和DSPP等表达水平,表明Cx43促进BMP-2诱导的hDPCs成牙本质分化与Erk1/2有一定的关联。
然而,BMP-2并未上调hDPCs中Erk1/2的磷酸化水平,过表达Cx43又是如何通过Erk1/2促进BMP-2的诱导作用呢?Cx43主要通过形成缝隙通道在细胞间或胞内外传递小分子物质而发挥作用。在hDPCs中,BMP-2刺激可能激活了细胞内与Cx43相关的小分子物质,过表达Cx43上调其介导的通道活性,增加了细胞间的通透性,可能促进被BMP-2激活的小分子物质在细胞间传递,进而激活Erk1/2信号并促进hDPCs成牙本质分化,而跟BMP-2介导的Smad1/5/9可能不存在必然联系。因此,Cx43在hDPCs成牙本质分化中的机制还需进一步研究。
总之,本研究发现,BMP-2诱导hDPCs成牙本质分化与Smad1/5/9有关,非Erk1/2;过表达Cx43不能上调DSPP等表达,却通过Erk1/2促进BMP-2诱导的hDPCs成牙本质分化。

