LncRNA AC093818.1对口腔鳞癌细胞顺铂耐药的影响及作用机制
孙艳艳 翁涛 林海燕 姬海莲
顺铂(cisplatin,DDP)是一种广泛使用的抗癌药物,然而癌细胞对DDP耐药显著减弱口腔鳞癌化疗的疗效[1-2]。长链非编码RNA(lncRNA)是一种具有多种生物学功能的非编码RNA[3-5]。研究表明lncRNA可以通过多种途径参与肿瘤的发生与发展,并调控肿瘤对DDP耐药[6-7]。研究显示上调LncRNA CASC2C能够通过抑制Wnt/β-catenin信号通路逆转口腔癌DDP耐药[8]。下调lncRNA HOST2能够通过抑制PI3K/Akt信号通路增强卵巢癌细胞对DDP的敏感性[9]。此外,LncRNA NNT-AS1能够通过MAPK/Slug信号通路调控非小细胞肺癌的DDP耐药[10]。
LncRNA AC093818.1(AC09)作为一种天然反义长链非编码RNA,最早被发现在卵巢癌组织中高表达[11]。Ba等[12]研究显示AC09在胃癌组织高表达,过表达AC09能够调控PDK1促进胃癌细胞的侵袭和迁移。本研究拟探讨AC09对DDP的耐药进程的影响,通过体内细胞实验探讨低表达AC09对口腔鳞癌耐药细胞系增殖、凋亡的影响以及其潜在作用机制,为抵抗口腔鳞癌的DDP耐药提供理论依据。
1 资料与方法
1.1 细胞系及主要试剂
人口腔鳞癌细胞系Tca-8113、CAL-27、SCC-25、SCC-090、DDP耐药细胞系Tca-8113/DDP、CAL-27/DDP、人正常口腔上皮细胞NOK(中国科学院上海细胞库);qRT-PCR试剂盒、TRIZol试剂(上海联迈生物工程有限公司);NIBP、NF-κB p65、Ki-67、Caspase-3兔抗人多克隆抗体(上海研生生化试剂有限公司);BCA试剂盒(上海碧云天生物技术有限公司);CCK-8试剂盒、细胞凋亡试剂盒均(上海弗元生物科技有限公司)。
1.2 细胞培养或转染
将口腔鳞癌细胞系在含有10%FBS的DMEM培养基中培养,箱内温度设置为37 ℃和5%CO2,细胞密度达到80%进行传代。Tca-8113/DDP、CAL-27/DDP在相同培养液环境培养并加入0.2 mg/L DDP以维持其耐药性,最终获得能够稳定传代的耐药细胞株。根据Tca-8113/DDP、CAL-27/DDP转染质粒和药物不同将实验组分为DDP组(Ctrl+Cis,加入2.5 mg/mL DDP处理12 h)、si-NC+DDP组(si-NC+ Cis,转染si-NC质粒和等浓度DDP处理)、si-AC09+DDP组(si-AC09+ Cis,转染si-AC09质粒和等浓度DDP处理),并设置空白对照组(Ctrl)。
1.3 qRT-PCR
采用TRIZol试剂提取口腔鳞癌细胞和DDP耐药细胞中总RNA,参考试剂盒要求将总RNA合成cDNA。SYBRGreen实时荧光定量PCR(ABL公司,美国)检测AC09、NIBP和NF-κB p65 mRNA表达水平,使用GAPDH为内参,采用2-△△Ct法计算相对表达量。
1.4 CCK-8法
按照试剂盒要求对DDP耐药细胞系增殖能力进行检测。将细胞系接种到96 孔,分别在0、24、48、72 h时,向培养孔中加入10 μL的CCK-8溶液,孵育2 h后采用酶标仪测量450 nm波长光密度值。
1.5 流式细胞术
使用异硫氰酸荧光素(Annexin-V-FITC)和碘化丙啶(PI)试剂检测DDP耐药细胞的凋亡水平。收集细胞,PBS清洗2 次后,利用缓冲液重置,使用Annexin-V-FITC和PI对细胞在室温和避光条件下反应10 min,使用流式细胞仪(Bio-Plex200,Bio-Rad公司,美国)细胞不同周期的凋亡率。
凋亡率=早期凋亡比例+晚期凋亡比例。
1.6 Western blot
使用RIPA缓冲液提取各组细胞中蛋白质,采用BCA法测量各组蛋白的蛋白量。首先分离蛋白质SDS-PAGE转膜,在室温条件下脱脂奶粉处理1 h。随后加入NIBP、NF-κB p65、Ki-67、Caspase-3兔抗人多克隆抗体,于4 ℃温度条件下孵育过夜。最后在次日加入抗小鼠Ig二抗孵育2 h,使用发光液曝光显影。
1.7 统计学分析
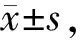
2 结 果
2.1 AC09在OSCC细胞系和DDP耐药细胞系中表达水平上调
qRT-PCR结果显示,口腔鳞癌细胞系Tca-8113、CAL-27、SCC-25和SCC-090中AC09的相对表达水平高于NOK中水平,差异具有统计学意义(P<0.05)。AC09在耐药细胞系Tca-8113/DDP的相对表达量高于Tca-8113,在CAL-27/DDP的表达水平高于CAL-27。转染si-AC09后,Tca-8113/DDP细胞系中AC09表达水平下降,CAL-27/DDP中AC09表达量也下调,差异具有统计学意义(P<0.05)(图1)。
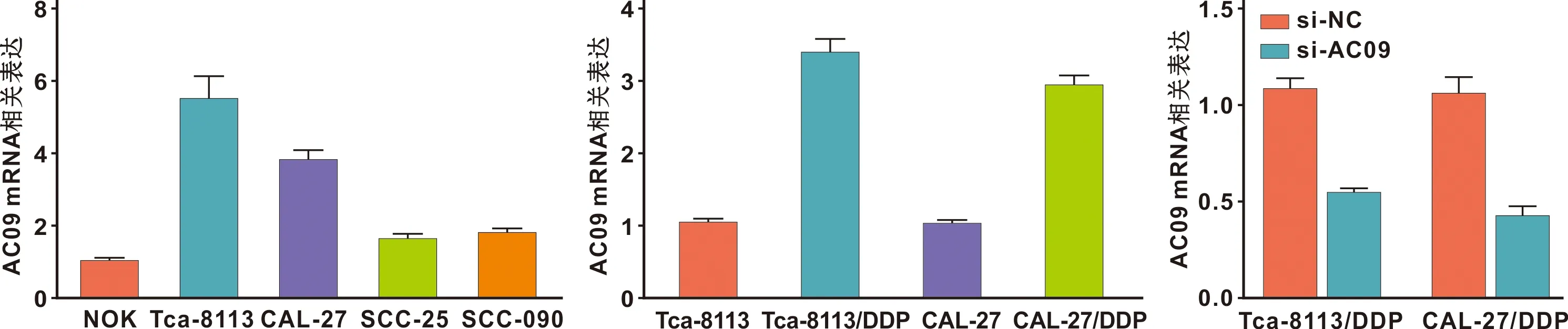
图1 OSCC细胞系和DDP耐药细胞系中AC09的表达水平
2.2 低表达AC09抑制OSCC DDP耐药细胞的增殖
采用CCK-8法检测Tca-8113/DDP和CAL-27/DDP在不同组情况细胞增殖能力。结果显示,与空白对照组比较,si-AC09组、DDP组和si-NC+DDP组的细胞增殖能力下降,Ki-67 mRNA表达水平下调。与si-NC+DDP组比较,si-AC09+DDP组的细胞增殖水平下调,Ki-67 mRNA表达水平下降。以上差异均具有统计学意义(P<0.05)(图2)。
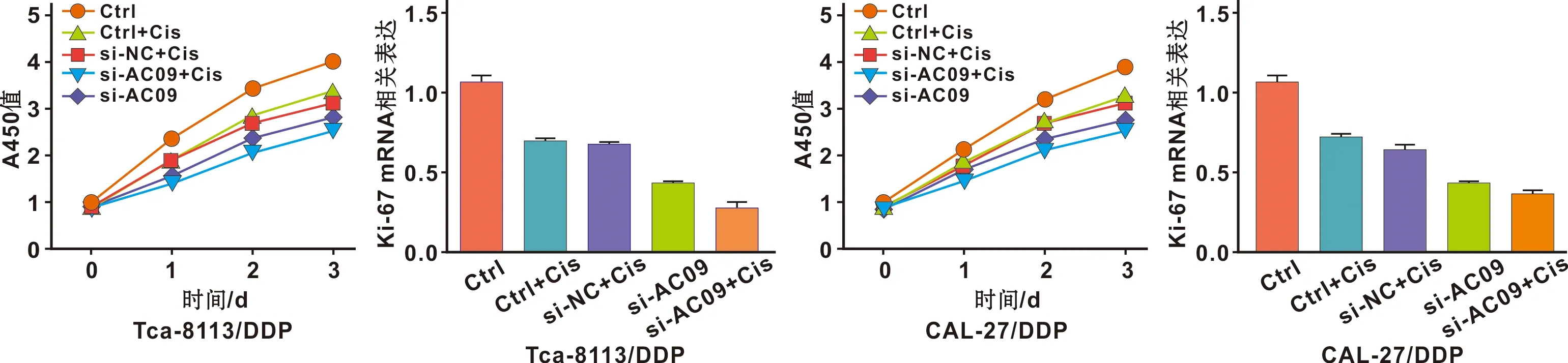
图2 Tca-8113/DDP细胞和CAL-27/DDP细胞在各组中的增殖能力
2.3 低表达AC09促进口腔鳞癌耐药细胞的凋亡水平
流式细胞术分别检测Tca-8113/DDP和CAL-27/DDP在不同组情况细胞凋亡水平的差异。Tca-8113/DDP中si-AC09组、DDP组和si-NC+DDP组的细胞凋亡水平高于空白对照组,Caspase-3 mRNA水平也高于空白对照组。而si-AC09+DDP组的凋亡水平高于si-NC+DDP组,Caspase-3 mRNA水平高于si-NC+DDP组。差异均具有统计学意义(P<0.05)(图3)。CAL-27/DDP中si-AC09组、DDP组和si-NC+DDP组的细胞凋亡率高于空白对照组,Caspase-3 mRNA水平差异表现相似规律。而si-AC09+DDP组细胞凋亡率高于si-NC+DDP组,Caspase-3 mRNA水平差异表现相似规律,差异均具有统计学意义(P<0.05)(图4)。
图3 Tca-8113/DDP细胞在各组中的凋亡水平
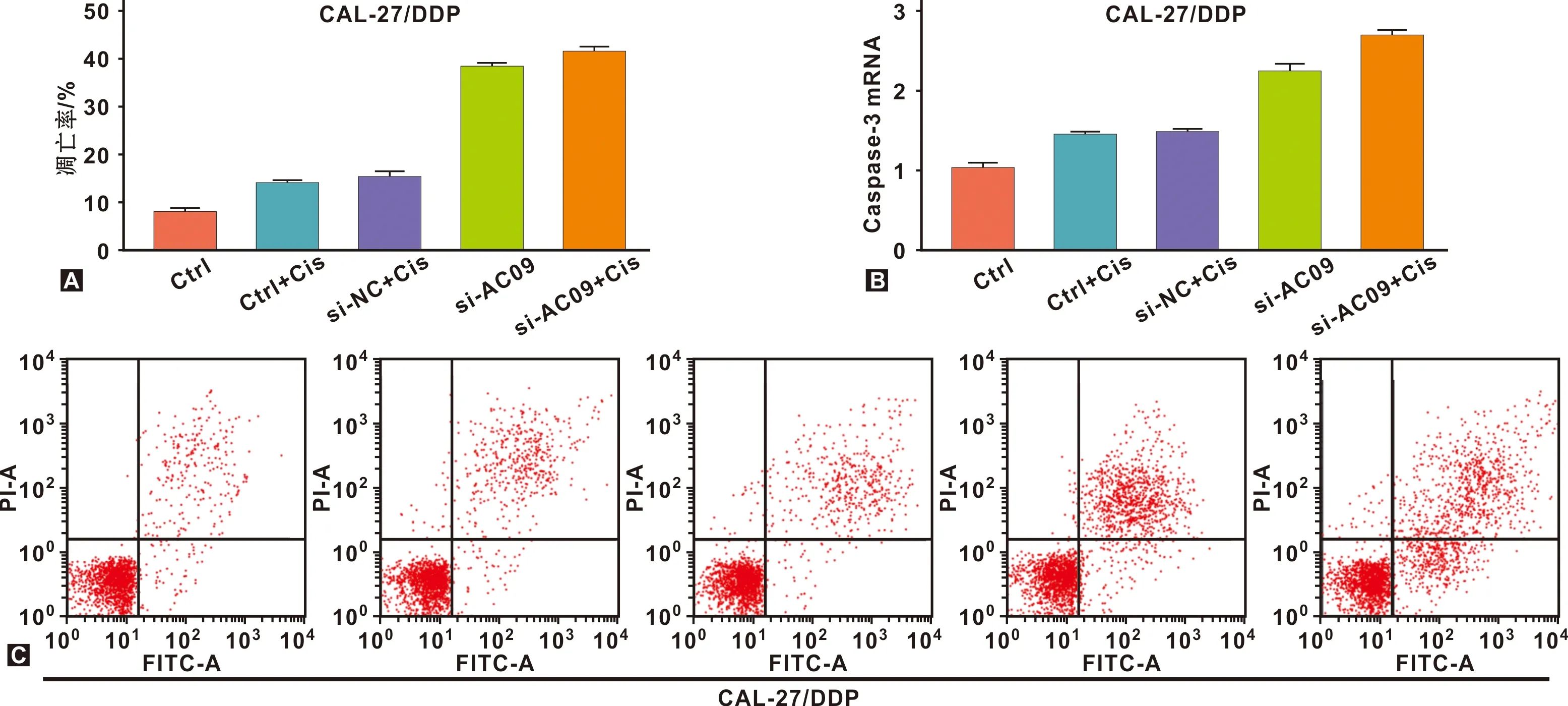
图4 CAL-27/DDP细胞在各组中的凋亡水平
2.4 低表达AC09抑制OSCC耐药细胞中NF-κB信号通路的活化
采用qRT-PCR和Western bolt检测口腔鳞癌亲本细胞系和DDP耐药细胞系中NF-κB通路相关蛋白的表达水平。结果显示,耐药细胞系转染DDP或si-NC+DDP后,NIBP mRNA和蛋白水平升高,转染si-AC09+DDP后,NIBP mRNA和蛋白水平下降,差异均具有统计学意义(P<0.05)(图5)。与空白对照组比较,DDP组和si-NC+DDP组的NF-κB p65 mRNA和蛋白相对表达量升高。与si-NC+DDP组比较,si-AC09+DDP组的mRNA和蛋白相对表达量下调,以上差异均具有统计学意义(P<0.05)(图6)。
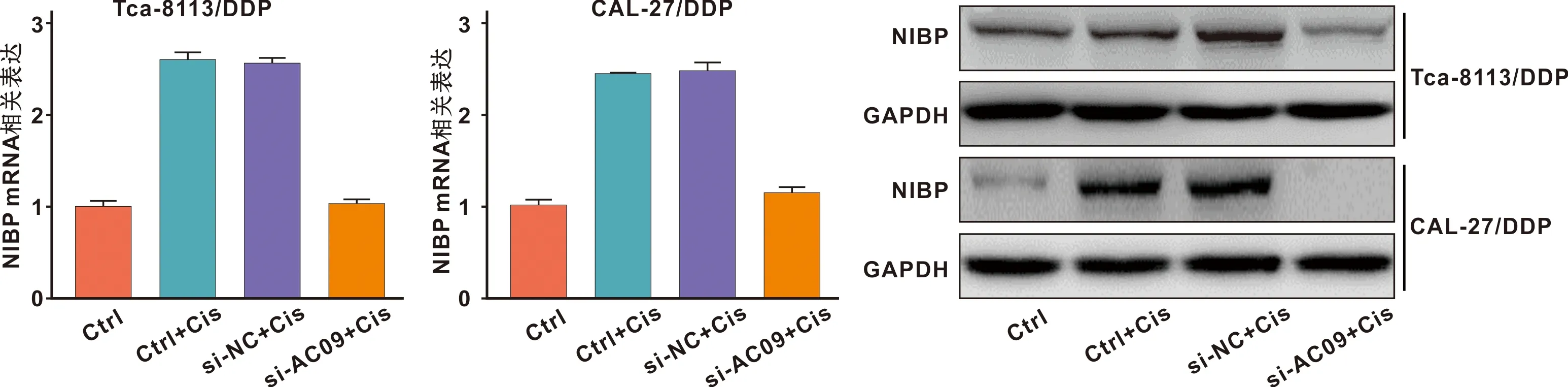
图5 NIBP在各组细胞中的表达水平

图6 NF-κB p65在各组细胞中的表达水平
3 讨 论
LncRNA是一种长度大于200nt的非编码RNA[13-14]。近年研究发现lncRNA可作为抑癌或促癌基因参与肿瘤的发生与发展,包括增殖、侵袭、迁移、转移等表型的机理和机制研究[15-16]。然而,lncRNA在口腔鳞癌的DDP耐药机制研究尚处于起步阶段,有待进一步探讨[17]。研究表明LncRNA XIST可通过调控miR-27b-3p增加口腔鳞癌细胞DDP的化疗敏感性[18]。LncRNA PVT1通过调控miR-194-5p/HIF1a轴参与口腔鳞癌细胞的增殖、侵袭和DDP化疗耐药[19]。本研究发现AC09在口腔鳞癌细胞中高于人正常口腔上皮细胞,口腔鳞癌细胞DDP耐药系中AC09高于亲本细胞系,低表达AC09后耐药细胞系中AC09下调。这说明AC09可能参与口腔鳞癌对DDP的化疗耐药进程。
低表达AC09抑制口腔鳞癌耐药细胞增殖,Ki-67 mRNA水平下降。低表达AC09后,口腔鳞癌耐药细胞凋亡水平升高,caspase-3 mRNA水平升高。这说明低表达AC09抑制了口腔鳞癌耐药细胞增殖、促进凋亡进程。同样有研究显示低表达MALAT1能够抑制PI3K/AKT/m-TOR信号通路进而抑制口腔鳞癌细胞的侵袭、迁移和转移[20]。然而,本研究侧重于对AC09在口腔鳞癌DDP耐药的影响。进一步的实验表明,DDP耐药细胞系中NIBP和NF-κB p65上调,而转染si-AC09后表达水平下调,这说明低表达AC09抑制了DDP耐药细胞中NIBP和NF-κB p65的表达水平。研究显示口腔鳞癌细胞或组织中NF-κB通路被激活后,可诱导NF-κB通路的关键酶NIK、IKKβ形成NIBP,从而影响口腔鳞癌细胞增殖、分化进程,这提示NF-κB通路在口腔鳞癌的发生发展中具有重要作用[21]。因此,低表达AC09抑制口腔鳞癌DDP耐药细胞中NF-κB通路的激活,从而抑制口腔鳞癌对DDP耐药进程。
综上所述,本研究发现低表达LncRNA AC093818.1通过抑制NF-κB通路延缓口腔鳞癌对DDP的耐药性,AC093818.1可能成为抵抗口腔鳞癌DDP耐药的潜在靶点。

