营养琼脂培养与R2A培养检测口腔诊疗用水比较研究
洪飞若 俞雪芬 金慧 陆烨 普睿 钱清
口腔综合治疗椅水路系统(dental unit waterlines,DUWLs)因治疗回吸等原因导致管道内壁细菌生物膜形成而污染诊疗用水[1],使得口腔诊疗存在院内感染的风险[2-3]。各级各类口腔医疗机构应定期对诊疗用水进行微生物检测,并实施有效的处理措施[4-6]。我国对口腔医疗机构诊疗用水的检测方法与标准要求均参照生活饮用水[7-8],其微生物检测方法采用的是营养琼脂(nutrient agar,NA)培养基,37 ℃、48 h培养后计菌落数,合格标准为≤100(CFU/mL)。而欧美等国家采用的是R2A(Reasoner's 2 agar)培养基[9],经20~25 ℃培养120~168 h后计菌落数,合格标准为≤500 CFU/mL[10]。本研究通过采用两种培养基平行培养口腔诊疗用水水样的方法,比较分析两者之间的培养结果,为口腔诊疗用水微生物培养探索合适的方法。
1 资料与方法
1.1 实验设备与材料
营养琼脂培养基(广东环凯);R2A培养基(北京陆桥);一次性培养皿、涡旋振荡仪、生理盐水、离心管、接种环、移液器、恒温培养箱、基质辅助激光解析电离飞行时间质谱仪(MALDI-TOF-MS,VITEK®MS, 法国)。
1.2 样本来源与采样方法
选取浙江大学医学院附属口腔医院8 个科室24 台牙椅,采样时间段为上午8:30~9:00,采样点选择每台牙椅的牙科手机连接管、三用枪和漱口处。放水冲洗管路30 s后各样本均取10 mL,每个出水端分别采集3 个样本,共采集水样216 份。同一部位的水样编写同一个序号,随机分为3 组,分别送至3 个实验室进行平行培养检测。所有水样采集后立即储存于4 ℃转运箱,4 h内完成平板接种。
1.3 菌落培养和计数
每份水样采用倾注法分别于NA和R2A培养基各接种1 mL。NA培养基稀释一个梯度接种,37 ℃下培养48 h后进行菌落计数。因R2A培养基培养菌落数可能较NA培养基多,为得到可分辨的计数结果,因此分别稀释1 个梯度和2 个梯度接种于R2A培养基,25 ℃下培养120 h。2 种方法均进行一份平行接种,并且设置空白对照。结果判断标准均参照国家生活饮用水卫生标准[7],即菌落计数≤100 CFU/mL为合格。
1.4 菌种检测
随机抽取96 份菌落计数结果不合格的培养皿,两种培养方法各48 份。使用一次性接种环选取同一培养皿上形态各异的单个菌落涂布于质谱仪靶板上,每个细菌靶点添加1 μL VITKE MS-CHCA基质液。待干后采用质谱仪对不同培养基中的菌种进行鉴定,质控菌株为大肠杆菌(ATCC-8739)。将所测得样本细菌的质谱图与数据库中所有参考图谱进行比对得到最终结果。
1.5 统计学分析
数据双盲录入后应用SPSS 23.0软件进行统计学分析,定量资料采用四分位数描述,菌落计数结果差异采用Wilcoxon符号秩检验进行分析,不同培养方法检测样本合格数量和机会性致病菌检出率的比较采用配对卡方检验及Kappa一致性检验进行分析。三处采集点菌落计数的差异采用Kruskal-WallisH检验进行分析。P<0.05为差异有统计学意义。由于菌落计数呈非正态分布,因此对两组菌落计数(CFU/mL)取对数,计算所得Log10(菌落计数),采用Bland-Altman图分析评价两种培养方法的一致性。
2 结 果
2.1 2 种培养基菌落计数结果分析
本研究采集216 份口腔诊疗用水样本,使用NA培养基和R2A培养基,在37 ℃和25 ℃条件下培养48和120 h,共检测样本432 份。培养结束后进行菌落计数,并计算同一平行样本的平均值为最终实验结果。
由表1可知,同一水样由R2A培养基检出的结果中位数较NA培养基显著增加,两者比值为20.56。Wilcoxon符号秩检验分析结果显示两组结果的差异具有统计学意义(P<0.001),分别对不同部位的菌落计数进行对比,均显示两种培养方法结果的差异有统计学意义(P<0.001)。

表1 口腔综合治疗台不同部位和不同培养基培养菌落计数的对比
配对卡方检验结果显示,采用McNemar精确检验发现两组培养结果合格率的差异有统计学意义(P<0.001),Kappa值=0.207,属于一致性较差(表2)。

表2 两种培养方法检出结果的合格情况
2.2 检出菌种构成比较
NA培养基共检出6 科、26 株机会性致病菌,R2A培养基共检出5 科、53 株机会性致病菌,检出率分别为47.92%(23/48)和66.67%(32/48),两者之间差异不具有统计学意义(P=0.211),Kappa值=-0.685,属于一致性较差,检出菌株均为革兰氏阴性菌(表3)。
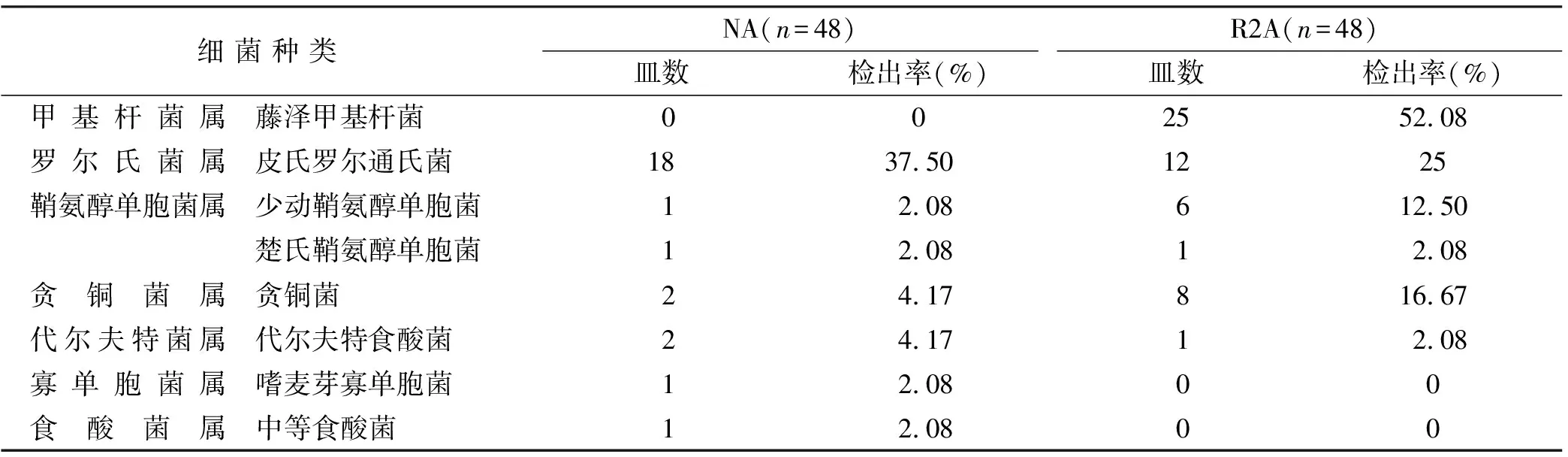
表3 口腔诊疗用水检出菌种构成的比较
2.3 Bland-Altman分析进行一致性比较
以检出菌落计数对数值的均值为横坐标,检出菌落计数对数值的差值为纵坐标,菌落计数的对数值差值在坐标系中以点的形式表示,做直线Y=D±1.96*SD划定一致性上限和下限,绘制Bland-Altman分析图(图1)。其中蓝色虚线为95%一致性界限,红色实线为菌落计数对数值差值的均数,黑色实线为0刻度线。
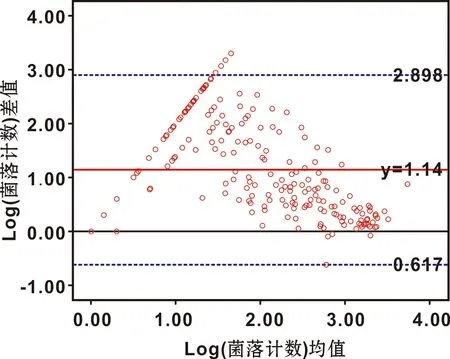
图1 Bland-Altman 图比较不同培养方法的一致性
结果显示,2.78%(6/216)的点分布在一致性界限之外,菌落计数对数值差值的均数为1.14(转换为菌落计数=13.80 CFU/mL),一致性上限为2.898(790.68 CFU/mL),下限为-0.617(0.24 CFU/mL),差值上下限范围为790.44 CFU/mL,为临床无法接受的差值范围。98.15%(212/216)的点在0刻度线以上,表示98.15%的R2A培养菌落计数结果较NA培养结果高。综上所述,两者一致性较差,不能相互代替使用。
2.4 不同采样部位菌落计数比较
Kruskal-Wallis H检验结果显示:3 个部位的水样通过NA培养所得的菌落计数差异无统计学意义(H=1.829,P=0.401),但R2A培养所得3 个部位的水样菌落计数的差异有统计学意义(H=8.394,P=0.015)。然而,进一步两两比较后发现,仅三用枪出水与漱口水的结果差异有统计学意义(校正后P=0.026),手机连接管出水与三用枪出水的校正后P值为1.000,漱口水与手机连接管出水校正后的P值为0.052。
3 讨 论
口腔综合治疗椅水路系统的微生物污染问题已成为口腔医护人员的共识,未经处理的水存在大量的致病菌[11-13],如嗜肺军团菌、铜绿假单胞菌、白色念珠菌、非结核分枝杆菌等。污染的诊疗用水通过牙科手机、三用枪等形成气溶胶,将医护人员及患者置于被感染的风险中。有研究者从牙科手术过程中产生的水和气溶胶中检测到高水平的细菌内毒素[14]。因此,定期检测并有效降低DUWLs中的细菌水平有重要意义。
细菌培养是监测医疗用水水质、评估微生物污染程度的基本方法。目前我国口腔诊疗机构基本采用富营养培养基进行细菌检测,即营养琼脂37 ℃、48 h培养;而欧美等则采用贫营养的R2A培养基20~28 ℃、5~7 d培养[9]。对于水生细菌而言,最理想的生长条件是营养成分相对较贫乏的培养基和与室温接近的环境温度[15];富营养培养基则会抑制水体中生长缓慢或处于受损状态的细菌生长,导致菌落计数偏低而影响感控管理的决策。除此之外,由于DUWLs多使用含氯消毒剂进行定期消毒,而R2A培养基中的丙酮酸钠成分能将受到含氯消毒剂损伤的存活细菌复苏,并在适宜条件下生长形成菌落[16]。因此,相较富营养培养基,R2A培养基能够提高水生细菌检测的灵敏度,尤其是经含氯消毒液处理后的水体。本研究细菌培养结果证实,同一水样分别用R2A培养基和NA培养基进行培养,前者检出的菌落数明显高于后者,且两者一致性较差。目前国内尚未有相关规范要求使用R2A培养基检测口腔诊疗用水,但已有研究证明了R2A培养基对血液透析用水和制药用水微生物污染水平检测的有效性[17-18]。本研究结果也进一步说明R2A培养基对医疗用水微生物检测的必要性。
菌种鉴定结果发现(表3),R2A培养基对机会性致病菌的检出率高于NA培养基,但两者间的差异不具有统计学意义,可能原因为检测样本的数量较小,后续研究可加大样本量的致病菌检测。R2A培养基中检出率最高的藤泽甲基杆菌在NA培养中未被检出。甲基杆菌属适宜在水中生长,易黏附于管道表面形成生物膜[19],是引起医疗机构相关性感染的条件病原体之一。有报道称多例骨髓移植术后患者因使用甲基杆菌属污染的自来水漱口导致嗜中性支原体引起的血液感染发生[20]。贪铜菌和少动鞘氨醇单胞菌在R2A培养样本的检出率同样高于NA培养。贪铜菌是一种非发酵革兰阴性杆菌,易引起免疫功能低下的人群感染。国外曾报道1 例由少见贪铜菌引起的幼儿肺炎[21],我国学者也曾报道一例由耐金属贪铜菌感染引起的婴儿脾脏多发脓肿[22]。另外,鞘氨醇单胞菌属被证明能够在各种输水管道(例如DUWLs)内壁形成生物膜,而少动鞘氨醇单胞菌则被认为是该菌属的主要条件致病菌,能引起液体相关的感染[23]。Santarelli等[24]曾报道1 例由少动鞘氨醇单胞菌感染导致的口腔溃疡,进而引起发热,这提示该细菌有可能通过口腔途径传播引起全身性感染的风险。虽然本研究未检测出非结核分枝杆菌,但有文献报道3 例因感染牙椅水路定植的非结核分枝杆菌而引起的牙源性面部窦道[25],同样说明单一的NA培养不能满足口腔诊疗用水微生物的检测。本研究结果表明目前我国口腔诊疗用水的NA培养方式不利于条件致病菌的检出,因此,有必要将R2A培养作为口腔诊疗用水微生物检测的常规培养方式,以期更准确地评估口腔诊疗用水的细菌污染情况和制定相应的干预措施。另外,R2A培养基的培养结果明显高于NA培养基,美国CDC制定的≤500 CFU/mL的合格标准可能更符合临床实际情况,但由于水生细菌在不同地域分布情况有所不同,因此采用R2A培养基的情况下应探讨制定更符合临床实际的菌落总数限值。
本研究发现接受定期消毒措施的DUWLs仍存在一定程度的微生物污染情况(表1)。比较不同部位水样的菌落计数时发现通过NA培养基培养的菌落计数差异无统计学意义,这与以往报道结果相似[26]。但在对通过R2A培养基培养的菌落计数进行比较时,发现三个部位的菌落计数差异有统计学意义,可能原因为NA培养基培养所得结果普遍低估水样中真实细菌总数,各数值之间的差距不足以造成显著性差异。通过事后两两比较发现仅三用枪出水与漱口水之间差异有统计学意义,分析认为可能与漱口水不存在回吸但存在水生微生物污染有关。另外,为了减少实验影响因素,本研究在进行两种培养方法时统一采取较简便的倾注法接种样本。有研究表明[27],不同的接种方法、温度和培养时间均会对水样中细菌培养结果产生一定的影响。因此,下一步研究可以探讨R2A培养条件下,不同接种方式(包括倾注法、涂布法和薄膜过滤法),不同温度(20~28℃)和不同培养时长(5~7 d)对口腔诊疗用水中细菌检出结果的影响。
综上所述,DUWLs污染问题普遍存在,并且有感染的风险。对微生物污染的控制重点在于定期的检测与有效的消毒,而选择合适的检测方式具有较大的临床实践意义。建议口腔诊疗机构在定期检测诊疗用水时应常规采用贫营养的R2A培养基,提高水生细菌的检出率,且制定限值规范时应参考不同地域临床实际情况。由于本研究用于菌株鉴定的水样均采集于经低浓度含氯消毒液处理后的DUWLs,而甲基杆菌和鞘氨醇单胞菌均为耐氯菌株,其高检出率也提示消毒DUWLs时应考虑细菌对消毒剂的耐受性。

