早期乳腺癌多基因检测2022版ASCO指南解读
李 诗,刘月平
乳腺癌是一组具有异质性的恶性肿瘤,目前传统的病理诊断和组织学分型已不能满足临床诊疗及预后评估的需要。而激素受体(hormone receptor, HR)阳性/人表皮生长因子受体-2(human epidermal growth factor receptor-2, HER-2)阴性型乳腺癌是最常见的乳腺癌分子亚型,占乳腺癌分子亚型的60%,该型患者的临床表现与基因复发风险因素、绝经状态等是目前决定治疗方案的重要因素。由于患者在分子水平上存在高度异质性,对治疗的反应差异较大。因此,以基因表达谱和基因芯片为基础的多基因检测应运而生,成为辅助乳腺癌治疗策略选择和预后风险评估的重要因素。目前,乳腺癌多基因检测已被美国国立综合癌症网络(NCCN)和美国临床肿瘤学会(ASCO)乳腺癌临床实践指南、中国临床肿瘤协会(CSCO)乳腺癌诊疗指南及中国抗癌协会(CACA)乳腺癌诊治指南与规范等列为协助早期乳腺癌术后辅助治疗方案制定和预后判断的重要依据。不同乳腺癌多基因检测工具有不同的研究背景、证据级别和适用人群,因此在选择多基因检测方法时需要考虑临床病理特征及不同检测平台的适用条件。本文通过乳腺癌多基因检测的临床价值和适用范围,针对2022年4月ASCO发布的关于如何科学应用生物学标志物以指导早期乳腺癌辅助化疗及内分泌治疗决策、不同多基因检测平台辅助评估早期乳腺癌预后的指南更新相关内容做出重点解读,从而实现对乳腺癌患者进行精准诊疗,以减少复发和远处转移风险,使更多的乳腺癌患者获益。
1 早期乳腺癌中多基因检测应用的临床意义
早期乳腺癌的治疗主要是根据肿瘤分期、是否存在临床复发风险高危因素和不同分子分型(Luminal A型、Luminal B型、基底样型和HER-2过表达型)等临床和病理因素决定术后是否联合辅助治疗,但早期乳腺癌患者对治疗的反应及预后存在差异。美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第8版乳腺癌分期系统中首次将多基因检测Oncotype DX(21基因)纳入Ⅰ类证据推荐[1]。2022年V2版NCCN乳腺癌指南[2]、2022年4月ASCO指南[3]均对Oncotype DX(21基因)、MammaPrint(70基因)、EndoPredict(12基因)、Prosigna(50基因)和乳腺癌指数检测进行了新的推荐和指导,具体见表1。国内对多基因检测同样给予高度重视,2022版CSCO乳腺癌诊疗指南[4]、2021版CACA乳腺癌诊治指南与规范[5]推荐多基因检测工具如Oncotype DX(21基因)、MammaPrint(70基因)用于HR阳性/HER-2阴性早期乳腺癌的复发转移风险评估和术后辅助化疗人群的选择。与国外指南相比,国内未增加EndoPredict(12基因)、Prosigna(50基因)的相关推荐内容,但今年乳腺RecurIndex(28基因)检测首次纳入CSCO乳腺癌诊疗指南[4](2022版),基于亚洲人群的多基因研究证实了其用于评估早期乳腺癌预后的有效性,为乳腺癌精准诊疗而助力;在Cut-off值的选择方面,NCCN指南[2]以15分和26分分别作为低+中、中+高复发风险的截断值,国内抗癌协会乳腺癌诊治指南与规范[5]则分别以16分和25分作为标准。总之,国内外指南对于Oncotype DX(21基因)、MammaPrint(70基因)检测的临床推荐内容基本一致,说明多基因检测的临床重要意义获得国内外的广泛认可。
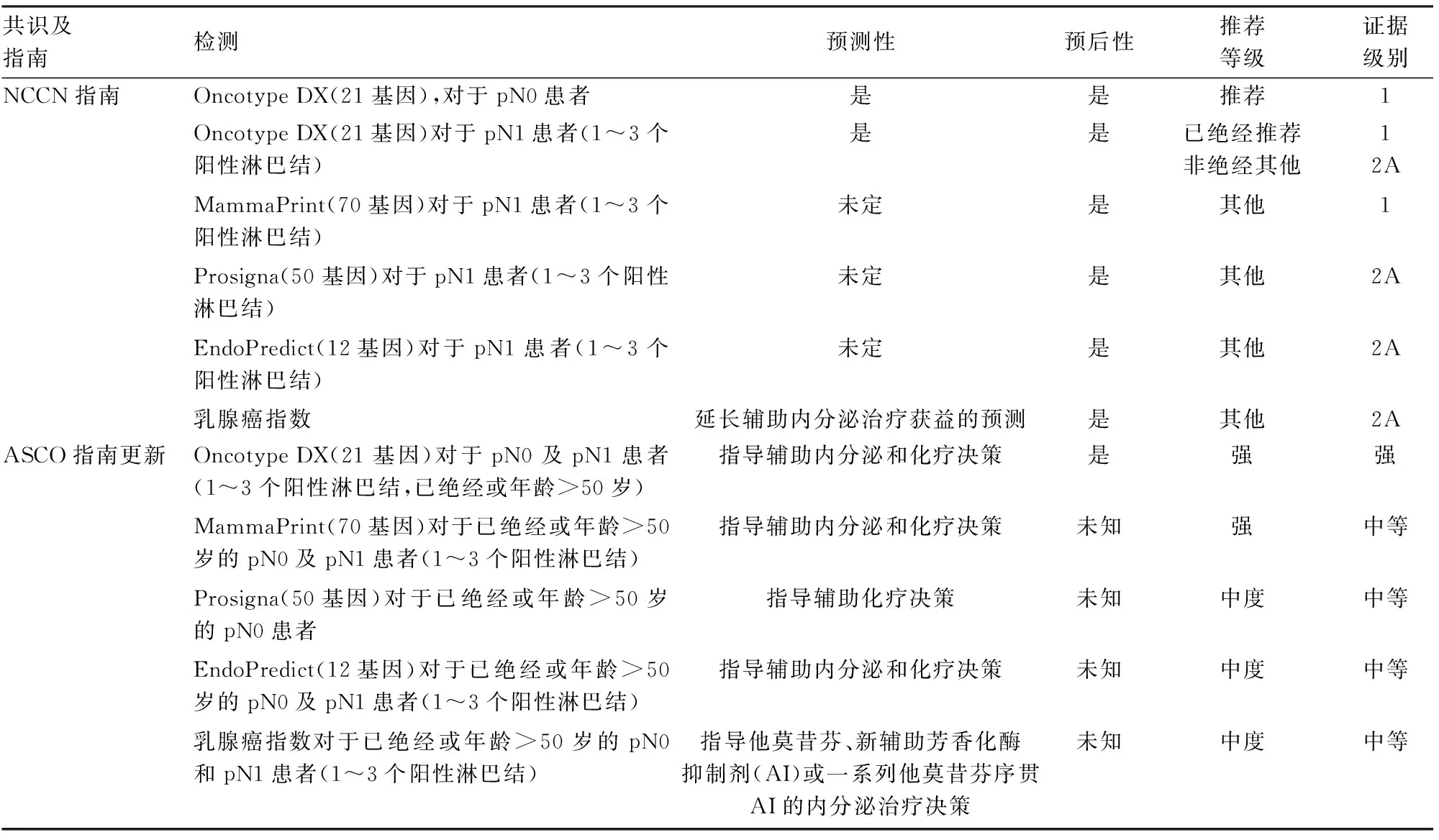
表1 NCCN及ASCO指南更新中关于多基因检测的应用推荐[2-3]
2022版ASCO多基因检测指南[3]根据2016年1月~2021年10月发表的随机临床试验和前瞻性-回顾性研究结果进行更新,优化了早期女性乳腺癌患者中生物学标志物的应用及检测流程(图1)。其中Oncotype DX(21基因)检测的证据强度和推荐等级依然最高,但在指导临床进行辅助治疗时仍需结合临床病理特征,而对HER-2阳性或三阴型乳腺癌则不推荐使用多基因检测指导辅助内分泌和化疗决策与否;无论多基因检测结果如何,1~3个阳性淋巴结的非绝经患者均可从化疗中获益;尚无多基因检测可以指导≥4个阳性淋巴结患者辅助化疗的数据。
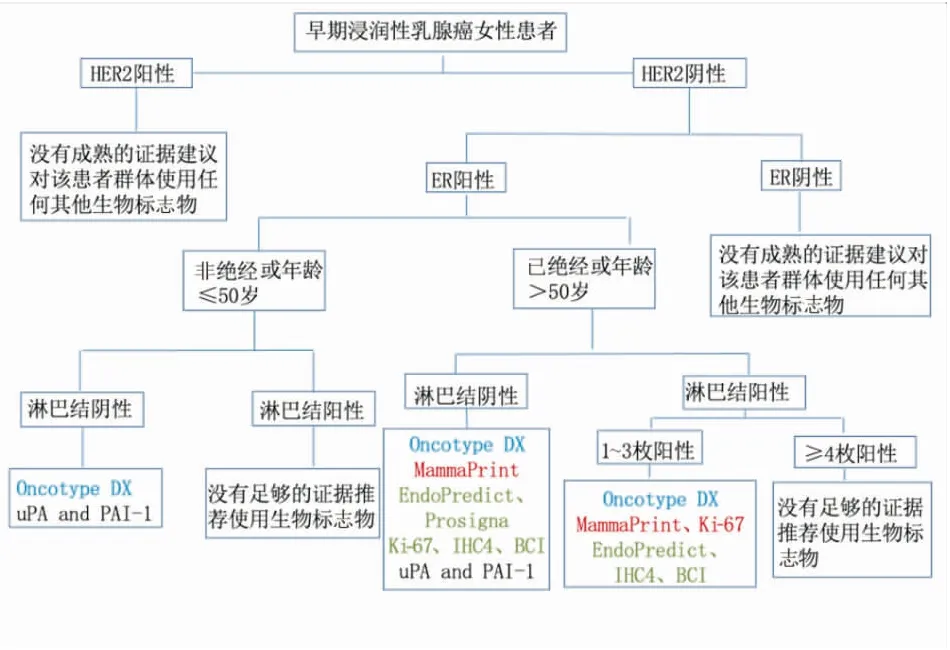
图1 早期浸润性乳腺癌患者多基因检测流程
2 早期乳腺癌中如何合理推荐多基因检测
早期乳腺癌多基因检测主要应用范围:对患者进行精细分层,评估预后风险,筛选可以豁免化疗的低风险患者,避免过度治疗,同时对辅助放疗和内分泌治疗也提供一定的参考。由于Oncotype DX(21基因)和MammaPrint(70基因)有前瞻性随机Ⅲ期临床试验的支持,在NCCN指南中获得了Ⅰ类推荐。此外,各项临床试验的结论均证明Oncotype DX(21基因)、MammaPrint(70基因)、EndoPredict(12基因)检测中复发风险高的患者,有更高的治疗获益且预后良好。
2.1 Oncotype DX(21基因)检测Oncotype DX(21基因)检测是用RT-PCR检测包括内参基因在内的21个基因的表达水平,根据权重代入计算公式得到复发风险评分(recurrence score, RS),其是目前国际上应用最广泛的预后复发风险评估的方法。WSG-Plan B和TAILORx大样本Ⅲ期临床试验均证明Oncotype DX(21基因)检测可以指导HR阳性/HER-2阴性早期乳腺癌治疗决策、预测患者预后。其中WSG-Plan B临床试验证明,低复发风险(RS﹤11分)患者即使伴有1~3个阳性淋巴结仍可以豁免化疗,仅使用内分泌治疗就可以有良好的预后,5年无进展生存率为94.2%(95%CI=91.2%~97.3%)[6]。TAILORx Ⅲ期随机对照研究中针对非绝经(年龄≤50岁)HR阳性/HER-2阴性早期乳腺癌患者预后和化疗疗效预测进行了前瞻性验证[7],同样提示低复发风险(RS﹤11分)患者可豁免化疗且预后较好(9年无进展生存率达84%±1.3%),而高复发风险患者从化疗中获益更多。此外,正在进行中的RxPONDER试验结果也支持RS≤25分的淋巴结阳性、非绝经HR阳性/HER-2阴性早期乳腺癌患者有更高的化疗获益,而RS≤25分的已绝经患者,即使存在1~3个阳性淋巴结也可豁免辅助化疗,考虑单独接受内分泌治疗[8]。需要注意的是,Oncotype DX(21基因)检测对于辅助放疗方案的选择并未区分患者是否绝经,中~高复发风险组(RS≥18分)患者较低复发风险组(RS﹤18分)患者的10年局部复发风险高2.36倍(P=0.04),低复发风险患者可在一定程度上免于术后辅助放疗[9]。
由于患者淋巴结状态和绝经状态对于化疗和内分泌治疗评估均有影响,因此在进行Oncotype DX(21基因)检测评估复发风险时需要考虑淋巴结状态和绝经状态两个因素。NCCN指南根据临床试验的结果,综合患者年龄、淋巴结转移状态和绝经状态等,对其Cut-off值进行进一步分层,低复发风险患者即使存在临床高危因素,在治疗策略选择上也不推荐进行辅助化疗,而高复发风险患者进行化疗+内分泌治疗有更高的获益,RS在16~25分之间的非绝经乳腺癌患者不能排除加用化疗的微小获益,是否由化疗诱导的卵巢抑制作用所致目前尚不清楚。因此,仍然要考虑辅助化疗的必要性。2022版ASCO指南更新[3]指出,综合患者是否绝经及临床/基因风险做出以下推荐:Oncotype DX(21基因)检测可以指导早期ER阳性和HER-2阴性乳腺癌患者的辅助内分泌治疗和化疗,已绝经且有1~3个阳性淋巴结和RS≥26分患者,推荐化疗+内分泌治疗(表2)。

表2 ASCO指南更新关于Oncotype DX(21基因)检测推荐
2.2 MammaPrint(70基因)检测MammaPrint(70基因)检测是预测乳腺癌转移风险的诊断工具,通过微阵列分析与乳腺癌关键特征相关的70个基因的表达水平,将乳腺癌患者分为低和高复发风险人群。前瞻性随机试验MINDACT研究[10]表明MammaPrint(70基因)检测可以预测HR阳性/HER-2阴性早期乳腺癌患者预后:低基因风险/高临床风险患者5年无远处转移生存率为94.7%(95%CI=92.5%~96.2%),在辅助内分泌治疗下,无论淋巴结状态如何,均有良好的无远处转移生存率;该组患者接受化疗与未化疗获益差异较小(92%vs89.4%),提示低基因风险患者可考虑豁免化疗,同时在接受化疗的患者中,年龄<50岁的患者获益更大。
MammaPrint(70基因)检测中未包含ER、PR、Ki-67及HER-2的表达水平,对患者的淋巴结状态也未进行分层统计,结果仅为高和低两类基因复发风险分级,低风险患者即使存在高危临床风险,也可以考虑豁免化疗,且预后较好。Oncotype DX(21基因)和MammaPrint(70基因)的一致性较高,对于有1~3枚阳性淋巴结或无淋巴结转移临床高风险的ER阳性/HER-2阴性乳腺癌患者,MammaPrint(70基因)是准确的预测工具。因此,2022版ASCO指南更新[3]中对MammaPrint(70基因)检测的基因风险做出以下推荐,年龄>50岁且高临床风险HR阳性/HER-2阴性早期乳腺癌患者,MammaPrint(70基因)检测指导治疗的证据强,低临床风险者中MammaPrint(70基因)检测指导临床治疗证据不足(表3)。
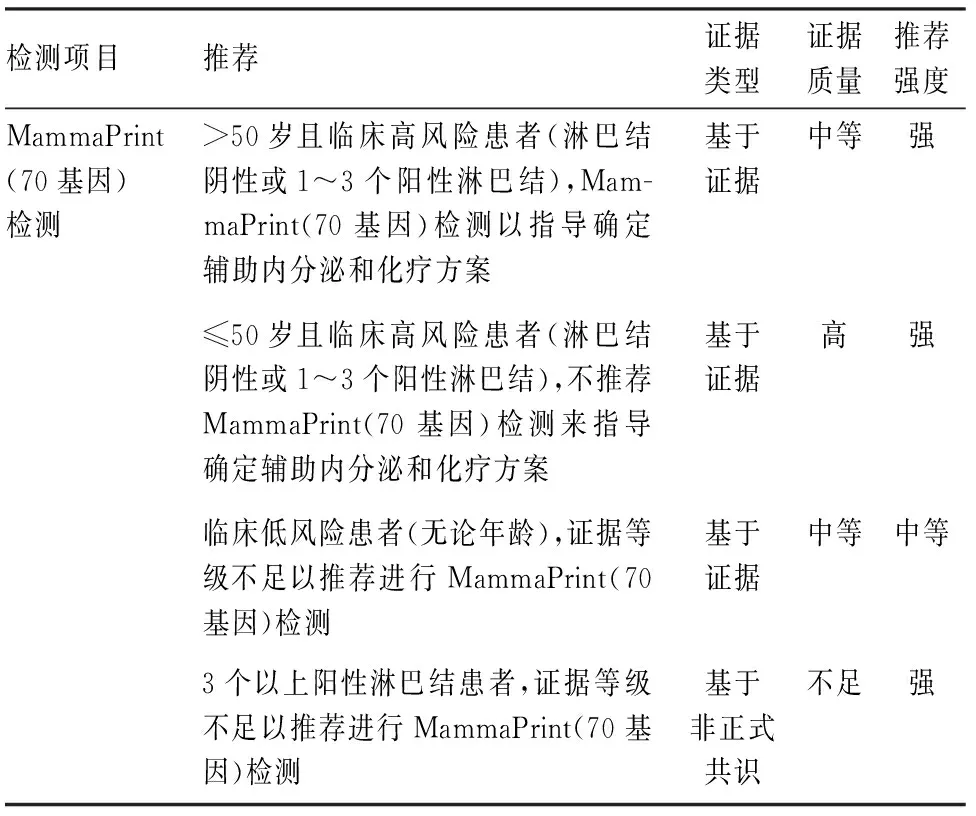
表3 ASCO指南更新关于MammaPrint(70基因)检测推荐
2.3 Prosigna(50基因)检测Prosigna(50基因)检测最初用于乳腺癌分型,后发展用于乳腺癌术后复发风险的评估,合计纳入50个检测基因和8个内参基因的RNA表达水平进行分析。进一步将Prosigna(50基因)检测判定的乳腺癌分子分型(Luminal A、Luminal B、基底样型和HER-2阳性型)、肿瘤大小和淋巴结状态均纳入并进行综合计算和评分(0~100分),评分与10年远处复发率相关。ABCSG-8临床试验中,应用Prosigna(50基因)评估已绝经且伴1~3个阳性淋巴结乳腺癌患者的预后,Luminal A型患者10年远处转移率低于Luminal B型患者,低风险组患者10年远处转移率显著低于高风险组,说明低风险组可以豁免化疗且预后良好[11]。Prosigna(50基因)检测也可以预测已绝经且HR阳性/HER-2阴性早期乳腺癌患者内分泌治疗后的复发风险,低风险者可以考虑豁免化疗。
因此,Prosigna(50基因)检测主要用于评估已绝经且HR阳性/HER-2阴性早期乳腺癌患者在辅助化疗和内分泌治疗后的复发风险,与其他多基因检测不同的是Prosigna(50基因)检测增加了乳腺癌分子分型的信息,可以根据不同的分子分型指导患者的治疗策略,并且低复发风险患者无论是否存在淋巴结转移,预后均良好。2022版ASCO指南更新[3]中认为已绝经且淋巴结阴性早期乳腺癌患者可使用Prosigna(50基因)检测来指导辅助全身化疗方案制定(表4)。
2.4 EndoPredict(12基因)检测EndoPredict(12基因)运用RT-PCR法分析12个基因(8个肿瘤相关基因,4个内参基因)表达水平,对HR阳性/HER-2阴性早期乳腺癌患者复发风险进行预测,被2018版NCCN指南作为2A类推荐。根据肿瘤相关基因表达水平同时考虑肿瘤大小和淋巴结状态,若EP(EPclin)评分为低风险,可考虑免除辅助化疗,仅行内分泌治疗。已绝经且ER阳性/HER-2阴性早期乳腺癌患者的EndoPredict(12基因)和Oncotype DX(21基因)检测对比分析显示,EndoPredict(12基因)低复发风险组远处转移率为5.8%,而Oncotype DX(21基因)中的低复发风险组远处转移率为10.1%[12]。但是EndoPredict(12基因)检测的相关研究和推荐均适用于已绝经患者,因此2022版ASCO指南更新[3]中认为已绝经且淋巴结阴性或1~3个阳性淋巴结的HR阳性/HER-2阴性早期乳腺癌患者可使用EndoPredict(12基因)检测来指导化疗和内分泌治疗决策(表4)。

表4 ASCO指南更新关于Prosigna(50基因)、EndoPredict(12基因)检测推荐
2.5 乳腺癌指数乳腺癌指数是基于HR阳性、淋巴结阴性、已绝经早期乳腺癌患者开发,利用RT-PCR技术测定11个基因(7个内参基因和4个肿瘤相关基因)的表达水平,结合分子等级指数(molecular grade index, MGI)和HOXB13与IL17BR两个基因的表达比例进行评分。乳腺癌指数主要针对HR阳性/HER-2阴性、区域淋巴结阴性或1~3个阳性淋巴结乳腺癌患者的辅助治疗方案的制定,也可以预测单独使用内分泌治疗的复发风险。高乳腺癌指数的HR阳性/HER-2阴性早期乳腺癌患者无论其临床风险评估如何,均有较高的远处复发风险,应考虑延长内分泌治疗,且在纳入583例HR阳性乳腺癌患者的Trans-aTTOM研究证明高乳腺癌指数患者延长内分泌治疗有更高的获益[13]。乳腺癌指数被认为是目前唯一能预测延长内分泌治疗的标志物,但目前尚无确切推荐乳腺癌指数可以指导HR阳性/HER-2阴性早期乳腺癌进行术后辅助放、化疗的选择。2022版ASCO指南更新[3]认为ER阳性/HER-2阴性早期乳腺癌患者可以使用乳腺癌指数检测来指导内分泌治疗决策(表5)。
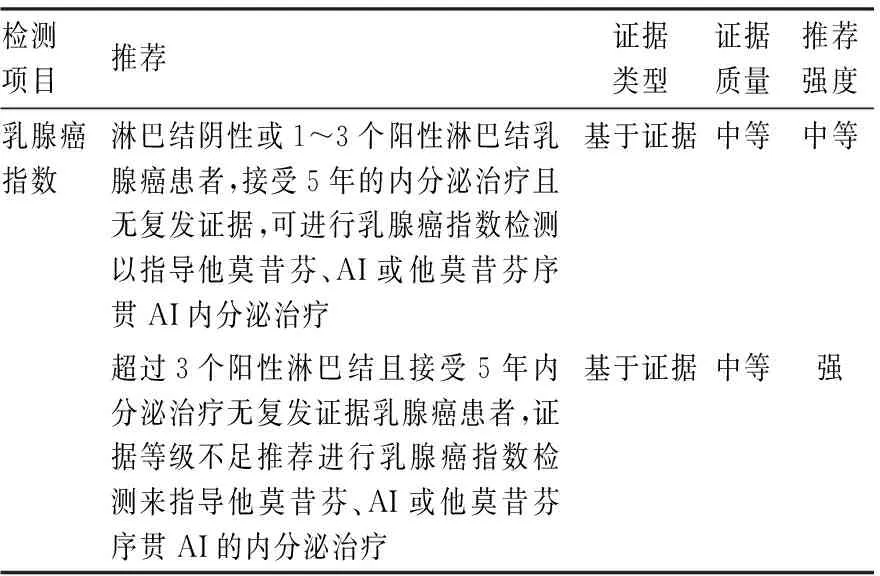
表5 ASCO指南更新关于乳腺癌指数检测推荐
3 乳腺癌RecurIndex(28基因)检测
RecurIndex(28基因)检测是我国自主研发,目前唯一一个基于亚洲人群样本可用于临床的多基因检测工具。RecurIndex(28基因)检测主要针对HR阳性早期乳腺癌患者,根据18个肿瘤相关基因和10个内参基因的表达水平,结合患者年龄、肿瘤大小、淋巴结状态、病理分级、有无脉管癌栓等临床指标进行综合分析,为评估HR阳性早期乳腺癌患者远处转移及局部复发风险以及是否进行辅助放、化疗提供参考依据。2022版CSCO乳腺癌诊疗指南[4]首次在多基因表达谱检测中新增RecurIndex(28基因)检测,为HR阳性患者是否需要术后辅助放、化疗的判断方面提供依据。
RecurIndex(28基因)检测可以预测HR阳性/HER-2阴性早期乳腺癌患者术后远处复发转移风险,对辅助化疗是否获益进行指导。2020年Huang等[14]研究发现,RecurIndex(28基因)检测可以准确预测不同分子亚型Ⅰ~Ⅲ期乳腺癌患者的局部复发风险,高风险组10年无远处转移率远低于低风险组(P<0.000 1),且高风险组存在更高的化疗获益,因此推荐高风险评分患者进行辅助化疗。除可以预测辅助化疗获益及患者生存外,RecurIndex(28基因)检测还可以筛选出具有术后辅助放疗获益的人群。有纳入N1~2期乳腺癌长达10年的随访研究证明[15]:RecurIndex(28基因)检测高复发风险患者接受术后放疗会有效降低复发率,而低复发风险患者则不能从放疗中获益。虽然在国外众多指南共识中均未明确对RecurIndex(28基因)检测进行推荐,但是一项RecurIndex(28基因)与Oncotype DX(21基因)检测的对比分析发现,两者一致性较高。
4 其他生物学标志物——Ki-67与IHC4
除多基因检测外,也有一些分子标志物可以指导乳腺癌治疗策略选择及预测预后,包括Ki-67、IHC4等。其中Ki-67可以应用在预测早期乳腺癌的预后、评估患者是否存在化疗或内分泌治疗获益等方面,Ki-67联合其他指标或免疫组化评分(IHC4),可辅助无法进行多基因检测的已绝经患者制定治疗方案。2021年国际Ki-67乳腺癌工作组(IKWG)[16]指南指出,Ki-67作为乳腺癌预后标志物可以在ER阳性/HER-2阴性早期乳腺癌患者中辅助区分化疗获益人群,Ki-67仅在增殖指数≤5%或≥30%时判读的一致性较高,即Ki-67增殖指数≤5%时可豁免化疗,Ki-67增殖指数≥30%时推荐进行化疗。CACA乳腺癌诊治规范和指南[5]认为Ki-67是乳腺癌的独立复发因素,但单一Ki-67不能区分高危Luminal型患者;目前尚无法通过单一Ki-67指标判定是否需要化疗,但Ki-67增殖指数越高,化疗的指示性越强。Ki-67是重要的预测预后指标,但其判读的准确性和可重复性存在一定的挑战,可以运用人工智能相关辅助工具,提高判读的准确性和可重复性。
IHC4评分是基于TransATAC试验的回顾性分析,根据ER、PR、HER-2和Ki-67表达情况,通过临床治疗评分进一步细化而建立的预后模型。与Oncotype DX(21基因)复发风险评分进行对比分析,表明IHC4可以提供早期乳腺癌的预后信息,协助乳腺癌辅助化疗方案的制定[17]。Sheri等[18]探讨IHC4评分预测ER阳性早期乳腺癌对新辅助化疗的反应,与单独使用Ki-67预测获益程度进行对比,发现IHC4对ER阳性早期乳腺癌新辅助化疗后的病理完全缓解率有较强的预测作用,Ki-67表达水平是IHC4中重要的组成部分,但其单独预测能力不如IHC4。2020年最新研究同样表明,IHC4评分可以更精准筛选化疗获益人群,有效区分乳腺癌化疗低获益人群(32%vs64%),从而避免过度治疗。
2022版ASCO指南更新[3]中指出已绝经早期乳腺癌患者在多基因检测未能完成时,Ki-67/IHC4结合其他临床和病理参数可以用来指导辅助内分泌和化疗的决策(表6)。
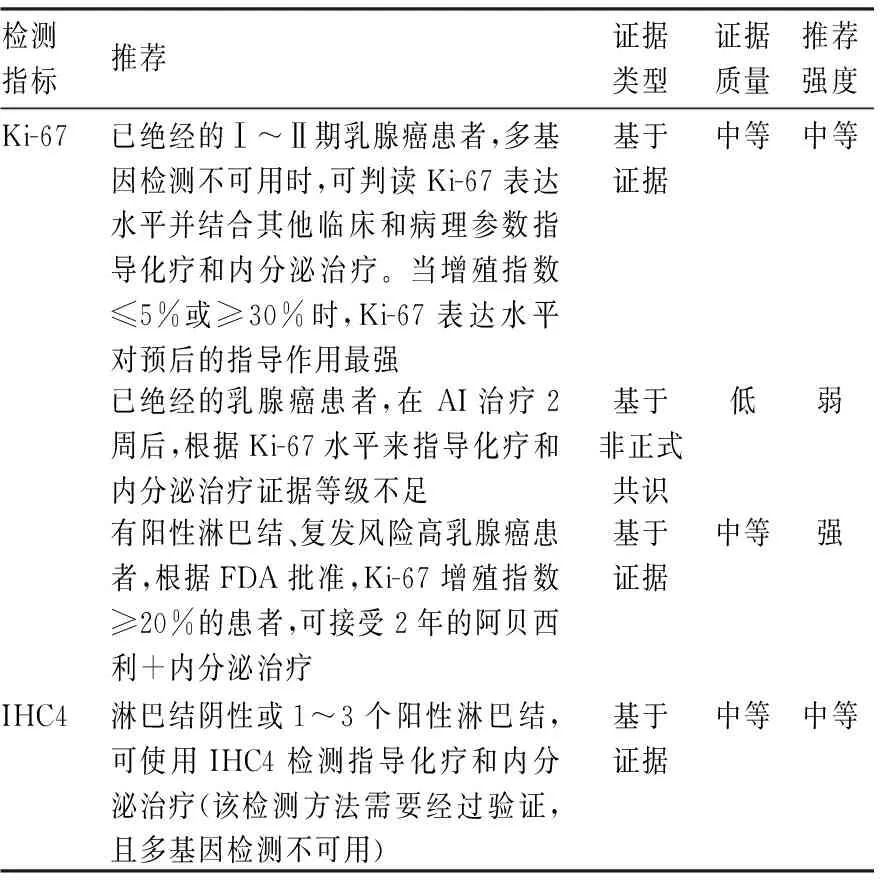
表6 ASCO指南更新关于Ki-67及IHC4检测推荐
5 多基因检测在导管原位癌(ductal carcinoma in situ, DCIS)中的预测作用
目前,DCIS治疗主要是手术切除,术后为降低局部复发风险可考虑进行辅助放疗,但DCIS的异质性强,仅凭传统病理评估并不能有效决定辅助治疗策略和准确预测预后。
Oncotype DX DCIS是2013年基于12基因建立的DCIS多基因检测评分系统,根据风险评分可以判断患者是否需要进行术后辅助放、化疗或内分泌治疗,防止过度治疗。ECOGE5194和Ontario DCIS cohort两个相关临床研究均证明对保乳术后患者进行Oncotype DX DCIS检测,高复发风险(RS≥55分)患者的局部复发率与低复发风险(RS﹤39分)患者相比明显升高,且高复发风险患者存在更高的放疗获益[19-20]。DCISionRT评分则是通过综合分析临床病理因素和分子表达水平评估保乳术后DCIS患者是否存在放疗获益,并预测保乳术后DCIS预后的多基因检测方法。在0~10分的综合评分中,分数越高,同侧DCIS复发风险越大。一项回顾性研究表明,与低风险患者相比,高风险患者的10年总复发风险至少高出2倍[21]。DCIS术后辅助治疗策略的选择及相关预后的判断对临床实施精准诊疗十分重要,因此DCIS的多基因检测具有较强的临床意义,但是由于DCIS的诊断有难度且常伴浸润癌的发生,相关报道较少。因此,DCIS的多基因检测仍然需要大量的临床试验进行验证。
6 多基因检测在靶向治疗及新辅助治疗中的预测作用
6.1 多基因检测在HER-2阳性乳腺癌疗效预测中的作用多基因检测能否帮助HER-2阳性乳腺癌患者获得更高的药物治疗获益、评估患者预后一直存在争议。TAILORx临床试验中纳入的病例均为HER-2阴性乳腺癌患者,MINDACT试验中仅纳入少量HER-2阳性患者且未进行单独分析,因此对于HER-2阳性早期乳腺癌患者,Oncotype DX(21基因)和MammaPrint(70基因)检测不推荐用于指导靶向治疗[5]。同样没有足够证据表明,Prosigna(50基因)、EndoPredict(12基因)及乳腺癌指数检测对于HER-2靶向治疗有指导意义。因此,2022版ASCO指南中不建议将这些检测用于HER-2阳性乳腺癌患者的治疗指导。
6.2 多基因检测在新辅助治疗疗效中的预测作用多基因检测可以预测HR阳性/HER-2阴性早期乳腺癌患者的术后辅助化疗和内分泌治疗的疗效,但HR阳性/HER-2阴性的早期乳腺癌能否从新辅助治疗中获益的相关研究尚不充分。TransNEOS临床试验[22]入组295例HR阳性/HER-2阴性、无淋巴结转移的已绝经乳腺癌患者,进行Oncotype DX(21基因)检测以预测患者使用新辅助内分泌治疗疗效,结果证明低复发风险评分(RS﹤18分)患者从新辅助内分泌治疗中获益更多。在Sella等[23]回顾性分析发现HR阳性/HER-2阴性早期乳腺癌中Oncotype DX(21基因)高复发风险评分与新辅助化疗的高病理完全缓解率相关,低复发风险评分患者新辅助化疗效果差。除Oncotype DX(21基因)检测外,EndoPredict(12基因)检测也在HR阳性/HER-2阴性早期乳腺癌患者新辅助治疗中进行探讨,结果显示EndoPredict(12基因)高风险评分患者有更好的化疗反应,而低风险评分患者则更有可能获益于新辅助内分泌治疗,并且EndoPredict(12基因)检测预测新辅助治疗疗效优于Oncotype DX(21基因)检测。因此,多基因检测在一定程度上可以预测新辅助治疗效果,但仍然需要更多的前瞻性研究的证实及探讨。
现有的多基因检测临床试验多纳入西方人群进行验证研究,虽然2022年CSCO乳腺癌诊疗指南[4]根据亚洲人群数据对中国乳腺癌治疗的价值及循证医学证据更新后首次纳入RecurIndex(28基因)检测,但目前仍缺乏充足的大样本、前瞻性亚洲人群的相关研究与数据,用以指导乳腺癌临床诊疗策略的选择与复发风险预测。另外,在相关算法、Cut-off值的确定等方面也存在部分空白,各项多基因检测结果之间也并不完全一致,由于存在以上诸多不足,多基因检测在临床指导疗效时需进行综合考虑和客观评价。不同多基因检测平台的临床试验中研究人群的纳入有各自的入组标准,尚没有一个多基因检测平台可以满足所有乳腺癌人群的检测需要,因此临床实际工作进行多基因检测平台的选择时,需考虑待检测人群相应的检测适用条件。在精准医疗和当代综合治疗的模式下,结合基因工具的检测结果及临床病理特征共同分析和制定临床决策将成为大势所趋。多基因检测虽然经过大数据的验证研究,但各项基因检测并非尽善尽美,仍然不能完全取代诊断病理的地位和价值,将多基因检测成熟的转化到临床仍然需要更多研究的支持。

