一株耐酸锰氧化菌的分离鉴定及去除Mn(Ⅱ)行为研究
莫忠耿,李勇超,2,陈丽苹,徐政
(1.湖南科技大学土木工程学院,湖南湘潭 411201;2.浙江科技学院环境与资源学院,浙江杭州 310023)
锰(Mn)是我国重要的矿产资源之一,其中广西 和湖南两省占全国锰矿储量的70%〔1〕。我国锰矿资源以碳酸锰矿和氧化锰矿为主〔2〕,在开采、选矿等矿石采集加工过程中,Mn被溶出释放,不同工艺条件下锰矿废水中Mn2+浓度有所差别〔3-4〕,流出控制点约20~200 mg/L,未经处理锰矿废水中Mn2+浓度更高〔5-6〕。由于锰矿石一般会伴生黄铁矿,大部分锰矿废水呈酸性〔2-6〕。虽然Mn是人体生理活动必须微量元素,但是Mn含量过高不仅对人和动物的神经系统产生毒害,而且会导致许多出生缺陷、恶性肿瘤的发生〔7-8〕。因此,锰矿区大规模酸性含锰废水亟需妥善处置。
化学沉淀法是处理矿山废水最常用的方法,但是该方法工艺较长、废渣多、易导致二次污染〔6〕。吸附法可去除多种金属污染物,但是成本高并不适合处理大量锰矿废水〔9-10〕。生物除锰法具有效率高、成本低、能耗少、出水水质好等优点〔11〕。已知某些微生物可以氧化溶解态Mn2+形成不溶的锰氧矿物Mn(Ⅲ)、Mn(Ⅳ),同时Mn2+的生物氧化速率比化学氧化高几个数量级〔12〕。目前从环境中分离出锰氧化菌主要有生盘纤发菌属(Leptothrixsp.)、恶臭假单胞菌属(Pseudomonassp.)、芽孢杆菌属(Bacillussp.)等〔13〕。
文献〔12-14〕表明:绝大多数锰氧化菌的最适pH约为6.5~8.5,强酸强碱环境会影响其氧化Mn2+活性。Danhua ZHOU等〔15〕研究了恶臭假单胞菌MnB1在不同pH条件下对15 mg/L Mn2+的氧化行为,发现当pH为7.5时,反应约30 h后无定形β-MnO2的质量浓度可达10 mg/L,然而当pH降为5.6时,反应40 h后,仅有2 mg/L的锰氧化物生成。郑金〔16〕从山东泰安棕壤结核分离出了芽孢杆菌T1151,该菌在pH为7.0的条件下对82 mg/L Mn2+的氧化率最大,然而当pH条件为4.0或9.0时,几乎检测不到高价锰的存在。由此可见,尽管在中性条件下生物氧化除锰法具有环保高效的优点,但是我国锰矿废水酸性强,将严重抑制锰氧化菌的氧化活性。因此,从特定环境中筛选耐酸锰氧化菌并研究其氧化行为、动力学过程对生物除锰法处理含锰酸性废水具有重大意义。
因此,本研究以中国锰都湘潭污水处理厂的活性污泥为菌株来源,筛选耐酸性锰氧化菌,考察其生长能力,以及pH、溶液初始Mn(Ⅱ)浓度、接种量等因素对锰氧化菌除锰行为的影响,结合产物形貌、物质形态与化学组成,以及反应过程动力学分析,揭示该耐酸性锰氧化菌除锰特性,从而为生物锰氧化法处理酸性含锰废水的大规模应用提供研究基础和科学依据。
1 材料和方法
1.1 锰氧化菌的富集与分离
首先,量取15 mL湘潭市(河西)污水处理厂曝气池的活性污泥,加入含有90 mL无菌水的锥形瓶中,振荡45 min,静置30 min;然后,取1 mL上清液接种于PYCM液体培养基中,置于培养箱中于30℃、150 r/min条件下培养1~2 d;最后,取0.1 mL上清液稀释为原有浓度的10-1、10-2、10-3,分别涂布在PYCM固体平板培养基上,培养48 h后,挑取单菌落在JFM固体培养基平板上进行平板划线纯化培养,直到长出单个菌落。
PYCM培养基:蛋白胨0.8 g,酵母浸膏0.2 g,K2HPO40.1 g,MgSO4·7H2O 0.2 g,MnSO4·H2O 0.2 g,CaCl20.1 g,(NH4)2SO40.1 g,NaNO30.2 g,去离子水1 L,调节pH至7.0。
JFM培养基:MgSO4·7H2O 0.5 g,(NH4)2SO40.5 g,NaNO30.5 g,CaCl20.2 g,K2HPO40.5 g,柠檬酸铁铵10 g,MnSO4·H2O 0.5 g,去离子水1 L,调节pH至7.0。
1.2 筛选所得耐酸性锰氧化菌形态特征与菌种鉴定
菌株形态特征测试:首先,用0.1 mol/L pH为7.35的磷酸盐缓冲液清洗菌体,将离心管里的微生物轻轻吹散后转移到1.5 mL的EP管内,自然沉降1 h后轻轻弃去上清液;然后,沿管壁缓缓加入1 mL新预冷2.5%戊二醛进行固定,再采用透射电镜TEM(FEI:Tecnai F20 S-TWIN)观察菌株细胞结构特征。
菌种鉴定:首先,将纯化得到的菌体接种至JFM培养基,培养至对数期后离心收集菌体,其次,提取微生物为扩增模板中提取其DNA,选用16SrRNA基因V3 V4区正向引物341F和反向引物805R对样品DNA进行PCR扩增;PCR扩增条件为94℃预变性5 min、35个循环变性(94℃变性45 s,56℃退火45 s,72℃延伸90 s);然后,对产物进行电泳检测,并用DNA Gel Extraction Kt进行凝胶回收,由上海生工生物工程公司完成测序;最后,将获得基因序列上传NCBI并与已有的相似度高的序列进行比对、BLAST分析和同源性分析,再用MEGA软件构建发育树。
1.3 不同条件下锰氧化菌氧化除Mn(Ⅱ)行为特征
研究不同pH、污染物浓度、接种量条件下锰氧化菌去除溶液中Mn(Ⅱ)行为,通常将菌株按2%接种率接种到Mn(Ⅱ)溶液中,在30℃、150 r/min条件下培养,取样周期为168 h,每次间隔24 h。在探究pH对生物氧化除锰的影响实验中,Mn(Ⅱ)初始质量浓度为10 mg/L,pH分别为2.0、3.0、4.0、5.0、6.0、7.0和8.0;在探究Mn(Ⅱ)浓度对锰氧化菌除锰的影响实验中,于培养基pH为7.0条件下,配制初始Mn(Ⅱ)质量浓度分别为10、20、30、40、50 mg/L;在探究菌液接种量对锰氧化菌除锰的影响实验中,于培养基pH为7.0,Mn(Ⅱ)质量浓度为20 mg/L条件下,按照体积分数分别为0.6%、1.0%、1.4%、2.0%、3.0%、4.0%的接种量,考察生物氧化除锰的行为。
1.4 产物SEM-EDS、XPS及FTIR表征
反应后,对固体产物进行离心收集、充分洗涤后干燥并研磨。对上述样品采用扫描电镜-能谱(SEM-EDS日立:S4800 JEOL:7800F)分析其形貌特征与物质组成;采用X射线光电子能谱仪(赛默飞世尔:Escalab 250Xi)进行X射线光电子能谱(XPS)分析;采用美国赛默飞世尔公司的Nicolet 670型傅里叶红外光谱仪,将样品与KBr以1∶100的质量比混合后进行压片处理,在波数为400~4 000 cm-1的扫描范围内进行测试,获得样品的化学结构和化学键的信息。
2 结果和讨论
2.1 筛选所得锰氧化菌的形态特征与鉴定
经过富集、分离培养后筛选得到了7株菌株,对Mn(Ⅱ)的耐受性与氧化性能对比,筛选得到一株具有高氧化活性的锰氧化菌菌株。图1(a)为该锰氧化菌菌株在JFM培养基上的生长特征图,菌落呈圆形红褐色金属光泽,表面光滑且较湿润。这与刘颜军〔17〕筛选所得芽孢杆菌属锰氧化菌的菌落特征相似。图1(b)为菌株的TEM图,可见该菌株为短杆菌,无芽胞,无鞭毛,有较厚的荚膜,有菌毛,细菌长度约为(0.5~0.8)×(1.0~2.0)µm。
对菌株进行生理生化分析,将PCR产物的16SrDNA基因序列上传到GenBank,获得GenBank登录号为MW725160。通过Neighbor-Joining Tree法构建系统发育树,见图2。
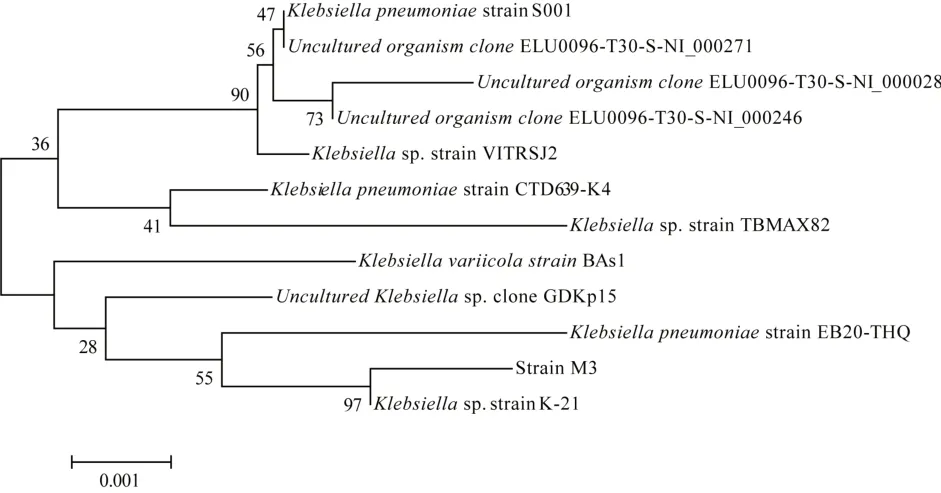
图2 基于16SrDNA基因序列构建的系统发育树Fig.2 Phylogenetic tree based on 16SrDNA gene sequence
该锰氧化菌菌株M3与Klebsiellasp.具有99%的同源性,命名为Klebsiellasp.Strain M3。在中国典型培养物保藏中心(CCTCC)获得细菌保藏编号:CCTCC M2021261。尽管到目前为止极少报道Klebsiella属锰氧化菌,已有林海等〔18〕从铜矿山排放废水的沟渠污泥中筛选了克雷伯氏杆菌,在酸性矿山废水中表现出了极强的耐酸性以及良好的吸附性能。
2.2 锰氧化菌氧化除Mn(Ⅱ)行为特征
2.2.1 pH对锰氧化菌除锰效果影响
由于我国锰矿废水大部分偏酸性,笔者主要考察了pH为2.0~8.0时,锰氧化菌氧化去除Mn(Ⅱ)效果,结果见图3。
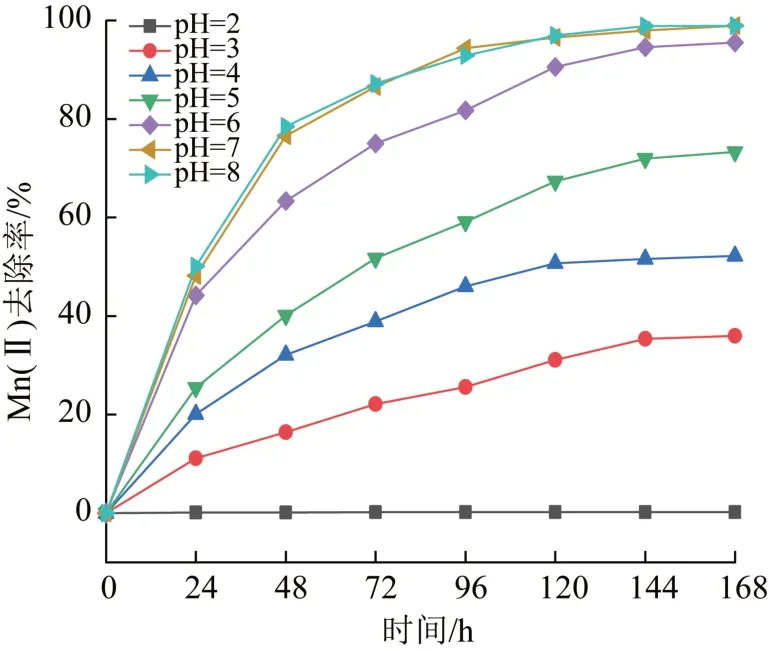
图3 pH对Mn(Ⅱ)去除率影响Fig.3 Effect of pH on Mn(Ⅱ)removal rate
由图3可知,当pH为6.0~8.0时,反应168 h后,菌株的Mn(Ⅱ)去除率为95.51%~98.93%,然而当pH分 别 为5.0、4.0、3.0、2.0时,除 锰 率 分 别 为73.33%、52.2%、36.01%、0%,可见在pH为中性的条件下,菌株除锰效果不错,然而随着pH的降低,去除率显著下降,这是因为在中性条件下绝大部分微生物的生长状态良好且活性强〔19〕,过酸条件会抑制锰氧化菌分泌多酮氧化酶从而导致对于Mn(Ⅱ)的去除效果下降。一般当pH为5.0时,锰氧化菌几乎不具有氧化性能〔20〕,然而在本研究中,当pH为3.0~5.0时,菌株M3仍然能够去除36.01%~73.33%的Mn(Ⅱ)。总之,与已发表的锰氧化菌相关研究〔21-22〕相比,本研究所获得的Klebsiellasp.Strain M3在酸性条件下氧化Mn(Ⅱ)能力明显增强。
2.2.2 Mn(Ⅱ)初始浓度对锰氧化菌除锰效果影响
Mn(Ⅱ)初始浓度对菌株除锰效果影响见图4。
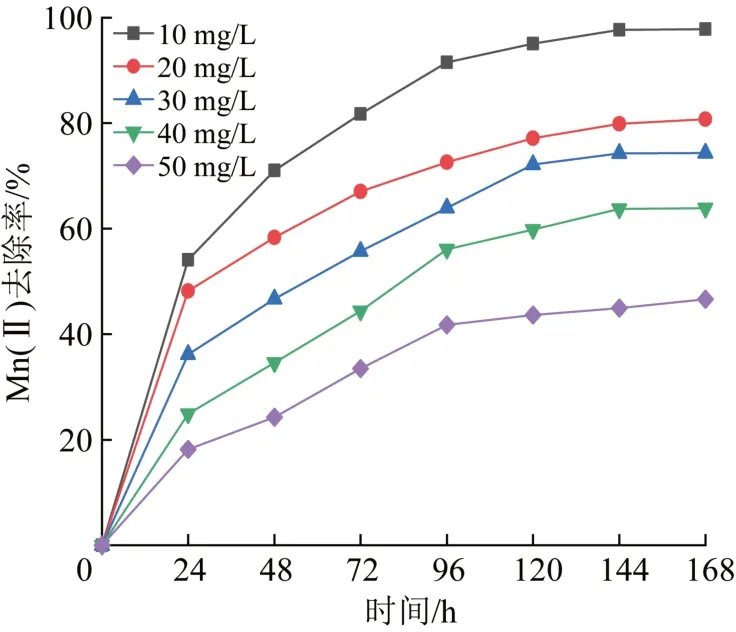
图4 Mn(Ⅱ)初始浓度对锰氧化菌除锰效果的影响Fig.4 Effect of Mn(Ⅱ)concentration on Mn(Ⅱ)removal of strain
由图4可知,不同污染物浓度条件下,菌株除锰行为具有一定的相似性,即Mn(Ⅱ)去除率在初期快速升高,后续反应速率随时间逐渐趋于平缓。此外,Mn(Ⅱ)初始浓度较低时,锰氧化菌对Mn(Ⅱ)的去除率明显要好于初始Mn(Ⅱ)浓度高时的去除率,Mn(Ⅱ)初始质量浓度为10 mg/L时,最终除锰率能达到95%以上,这是因为重金属扰乱微生物的酶功能〔21〕,Mn(Ⅱ)浓度升高会对锰氧化菌菌株的生长与活性产生抑制效果。
2.2.3 接种量对锰氧化菌除锰效果的影响
接种量对锰氧化菌除锰效果的影响见图5。
由图5可知,菌液接种量较低时,锰氧化菌对Mn(Ⅱ)的去除率明显要差于菌液接种量较高时;随着菌液接种量升高,Mn(Ⅱ)的去除率逐渐上升,且接种量越高,Mn(Ⅱ)浓度随时间降低得越快,除锰率越早趋于平缓,接种量在20%以上最终去除率都能达到95%以上。另外,当锰氧化菌菌液接种量只有0.6%时,经过7 d去除反应后Mn(Ⅱ)溶液质量浓度从10 mg/L降低到4 mg/L以下,去除率高达61.3%,再次表明锰氧化菌菌株耐锰性强,即使投加很少的量在锰溶液中也能体现出较好的Mn(Ⅱ)去除效果。
2.3 表征结果
锰氧化菌氧化锰后产物的扫描电镜图(a)及EDS(b)结果见图6。
由图6(a)可知,有大小约为0.5~1µm的块状物质生成,可能为细菌菌体,且菌体表面有许多纳米级颗粒物质;由图6(b)可知,产物主要有C、O、Mn和Fe等元素组成,其中,O的吸收峰最高,质量分数达到22.73%,结合C元素的存在,分析原因可能是有大量的菌体在沉淀物中的缘故,Mn、Fe质量分数分别为17.03%、50.17%,Mn元素的出现表明了锰氧化菌能够吸附并氧化Mn(Ⅱ)产生了生物氧化锰沉淀,与晏平等〔19〕的描述一致,Fe元素的吸收峰较高,主要是因为培养基含有一定量的铁盐,所以通常锰氧化菌同时具有氧化铁的能力。
锰氧化菌除锰产物的XPS全图谱见图7(a),反应后产物Mn 2p的高分辨图谱见图7(b)。
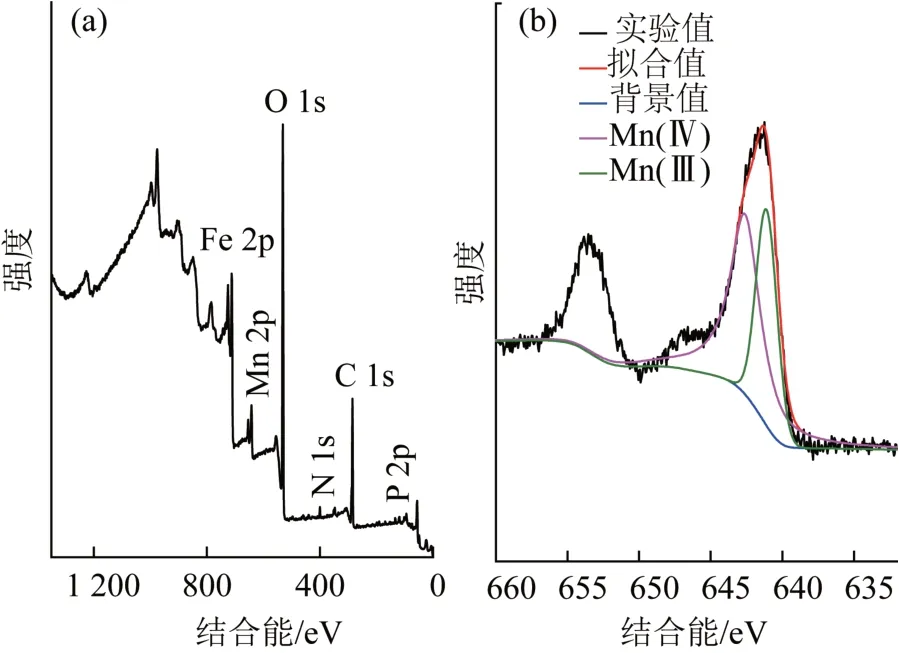
图7 锰氧化菌除锰产物XPS全图谱(a)和反应后产物Mn 2p高分辨图谱(b)Fig.7 XPS spectrum of manganese removal products by manganese oxidizing bacteria(a)and high resolution spectrum of Mn 2p after reaction(b)
由图7(a)可知,出现的特征峰有Mn 2p、O 1s、Fe 2p、N 1s、C 1s、和P 2p,其中Mn 2p特征峰的出现再次表明锰氧化菌与溶液中Mn(Ⅱ)发生作用,从而有效地将Mn(Ⅱ)从溶液中转移到沉淀物。由图7(b)可知,Mn 2p结合能有两个主峰Mn 2p1/2和Mn 2p3/2,Mn 2p1/2和Mn 2p3/2的电子结合能分别为653.35 eV、641.65 eV,其中Mn 2p3/2在图谱中的谱峰不对称,Mn可能存在不止一种化学价态。后续使用XPS Peak软件对Mn 2p的特征峰进行分峰拟合,其中,电子结合能642.6 eV和641.1 eV分别对应Mn(Ⅳ)和Mn(Ⅲ)的特征峰〔22〕,Mn(Ⅳ)和Mn(Ⅲ)峰面积比约为1.71∶1,说明溶液中Mn(Ⅱ)确实被大量氧化成高价态MnO2与MnOOH。晏 平〔19〕研 究 发现 菌 株Aminobactersp.H1对Mn(Ⅱ)氧化后所产生的固体产物主要成分为MnCO3、MnOOH、Mn3O4和MnO2。本 研 究 所 筛 菌 株除锰机理主要以生物氧化为主,目前一般认为微生物在繁殖过程中产生的胞外锰氧化酶可催化相关反应直接氧化Mn2+,其中多铜氧化酶在细菌氧化锰过程中起重要的作用〔17,19〕。
锰氧化菌除锰后产物的FTIR结果见图8。
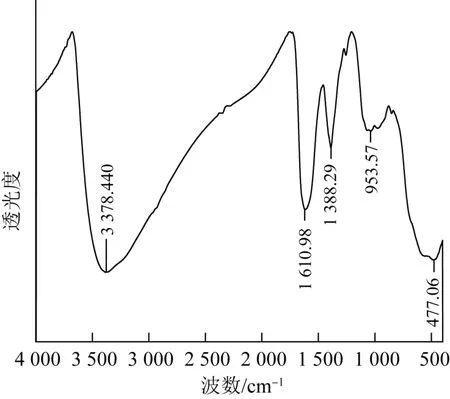
图8 锰氧化菌除锰后产物的FTIR结果Fig.8 FTIR results of manganese oxide products after manganese removal
由图8可知,在3 378.40、1 610.98、1 388.29、953.57、477.06 cm-1处出现明显的特征峰,其中在3 378.40 cm-1处可能是结合水中—OH的伸缩振动峰引起的〔23〕,在1 610.98 cm-1处的峰可能是C==O键的伸缩振动产生的〔24〕,1 388.29 cm-1处的峰应是C—H键弯曲振动引起的〔25〕,在953.57 cm-1处的峰可能是归因于C==C的弯曲振动,上述化合键都和微生物的有机成分有关。在477.06 cm-1处的峰应是由Mn—O健、Fe—O键的伸缩振动引起的〔26〕,表明产物中存在铁锰氧化物〔27〕。
2.4 生物除锰动力学
常用的生物反应动力学方程有细胞生长动力学模型、底物消耗动力学模型、产物形成动力学模型〔28〕,本研究属于生化反应底物消耗动力学模型,主要采用假一级动力学研究菌株在不同污染物浓度范围内的去除特性。即ln(C/C0)=Kt,整理后得:
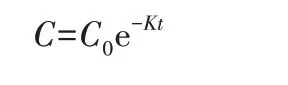
式中:K——反应速度常数,min-1;
C——剩余锰质量浓度,mg/L;
C0——初始锰质量浓度,mg/L;
t——反应时间,min。
且半衰期(τ)=0.693/K
本实验采用假一级动力学方程对锰氧化菌除锰进行动力学拟合分析,将实验得到的剩余锰浓度随菌液接触时间的变化曲线进行指数函数拟合,拟合结果见图9。
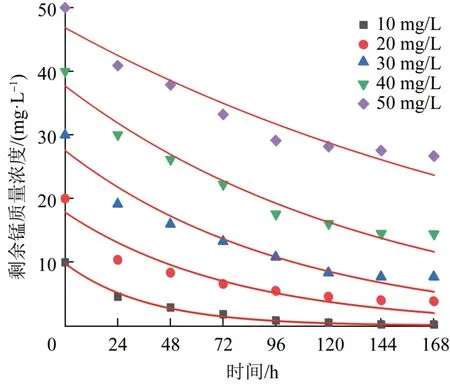
图9 剩余锰浓度随接触时间的变化Fig.9 Residual manganese concentration changes with contact time
由图9可知,本实验中生物除锰动力学过程基本遵循一级反应,其对应的假一级动力学常数及R2如表1所示,说明在生物除锰规律中,锰初始浓度越高,对Klebsiellasp.Strain M3除锰效果的抑制就越强,半衰期也越长。
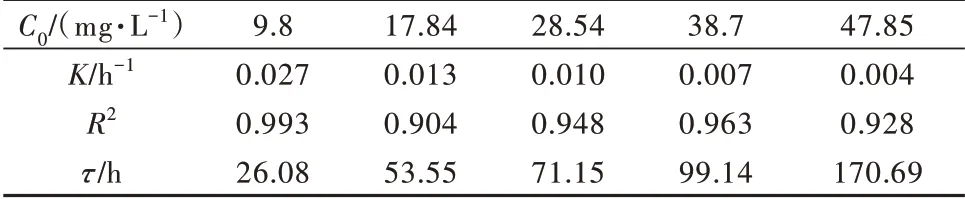
表1 生物氧化锰动力学参数Table 1 Biomanganese oxide reaction kinetic parameters
3 结论
(1)分离筛选出一株耐酸性锰氧化菌菌株(命名为Klebsiellasp.Strain M3),其在固体培养基上呈凸起状,红褐色且具有金属光泽。Mn(Ⅱ)质量浓度达到1 000 mg/L时,菌株生长受限但依然能够生长,具有很强的锰耐受能力。
(2)Klebsiellasp.Strain M3最适pH为7.0,去除率能达到98.93%。Mn(Ⅱ)初始浓度越高,菌株除锰率越低,随着接种量的增加,除锰率则会上升。
(3)通过产物SEM-EDS、FTIR、XPS表征发现:锰氧化菌氧化Mn(Ⅱ)后菌体表面有纳米级颗粒物产生,Fe、Mn含量较高,Mn—O健、Fe—O键的伸缩振动表明产物中存在铁锰氧化物,反应产物中Mn主要以Mn(Ⅲ)和Mn(Ⅳ)价态存在,证实了溶液中Mn(Ⅱ)确实被大量氧化成高价态MnO2及部分MnOOH。
(4)该生物氧化锰动力学遵循假一级动力学方程,随着Mn(Ⅱ)初始浓度的增加,反应速率常数降低。

