定量CT参数联合血生化指标对体检肺气肿人群骨密度的评估
谢思艺,冯蕾,杨营营,朱乐乐,查晓娟,周运锋
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)不仅表现为气流受限,还可引起具有全身特征的肺外改变,如恶病质、肌肉萎缩和骨质疏松症等,并增加死亡率[1,2]。骨质疏松症是COPD的重要并发症之一,可导致骨折,降低生活质量[3]。相关研究表明,与健康人群相比,骨密度(bone mineral density,BMD)异常在COPD患者中更为常见[4]。吸入皮质类固醇激素、吸烟、严重的肺气肿等均可引起伴有肺气肿的COPD患者BMD的减低[5-7],且肺气肿的存在是COPD患者骨质疏松的显著预测因素[7]。此外,肺气肿会带来一系列身体成分改变,这些因素与BMD变化似乎存在共同的生理机制。
目前对肺气肿与BMD关系的研究多基于COPD患者,且多采用双能X线吸收检测法(dual-energy X-ray absorptiometry,DXA)测量BMD。定量CT(quantitative CT,QCT)较DXA能更准确测量BMD,并能精准计算出扫描范围内脂肪和肌肉的含量[8,9]。相对于COPD患者而言,健康体检人群的肺气肿程度往往较轻。因此,本研究试图在健康体检发现肺气肿的人群中联合QCT参数和血生化指标建立预测模型,以期早期发现此类人群的BMD异常改变。
材料与方法
1.研究对象
回顾性分析2018年7月-11月在皖南医学院弋矶山医院健康管理中心体检人群的病例资料。病例纳入标准:低剂量胸部CT(low-dose chest CT,LDCT)扫描并发现有肺气肿的人群。病例排除标准:①先前有骨质疏松症诊断史或当前正在进行骨质疏松症的预防;②患有间质性肺疾病、COPD、慢性肾疾病、甲状旁腺功能亢进等;③有影响BMD的药物(皮质类固醇激素、抗骨质疏松药物)治疗史、恶性肿瘤放疗或化疗史;④影像或临床资料不齐全,或未进行QCT分析。12802例健康体检者中有637例CT发现肺气肿,其中COPD患者7例,合并间质性肺疾病21例,QCT或临床资料不齐全333例,最终共有276例患者纳入本研究(肺气肿组),其中男244例(88.41%),女32例(11.59%),年龄为27~94岁,平均(61.1±12.0)岁。采用个案精确匹配方法,按照同性别、同年龄1:1匹配体检胸部CT未发现肺气肿的276例健康受试者(对照组)。
2.一般资料和血生化指标
测量研究对象的身高、体重及静息态血压,并计算体质量指数(body mass index,BMI)。血生化指标包括总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白(low-density lipoprotein cholesterol,LDL-C)、白蛋白(albumin,ALB)及空腹血糖(fasting blood glucose,GLU)。
3.胸部及腰椎CT数据采集
采用GE16排CT扫描仪对研究对象进行LDCT扫描,扫描范围为肺尖至第二腰椎体(L2)下缘。扫描参数:管电压120 kV,采用自动毫安技术,螺距1.75:1,扫描视野500 mm×500 mm;图像重建矩阵512×512,层厚1.3 mm,层间距1.3 mm。
4.肺气肿分型与程度
由一位胸部放射医生对肺气肿进行评估,设定窗宽1000 HU,窗位-700 HU。根据Fleischner协会制定的标准[10],肺气肿定义为CT值<-950 HU且占全肺容积>6%。肺气肿分型包括小叶中心型(centrilobular emphysema,CLE)、间隔旁型(paraseptal emphysema,PSE)和全小叶型(panbobular emphysema,PLE)。将所有研究对象的DICOM格式图像数据导入3D Slicer 4.11软件,使用Chest Imaging Platform软件包定量分析肺气肿程度,并以全肺低衰减率(the percentage of low-attenuation area,LAA%)表示。
5.QCT参数测量和BMD分组
将LDCT扫描重建图像传输至QCT工作站,采用Mindways公司QCT PRO软件进行腰椎BMD、腹部脂肪和肌肉的定量分析,具体测量内容与王硕等[11]的方法相同(图1)。
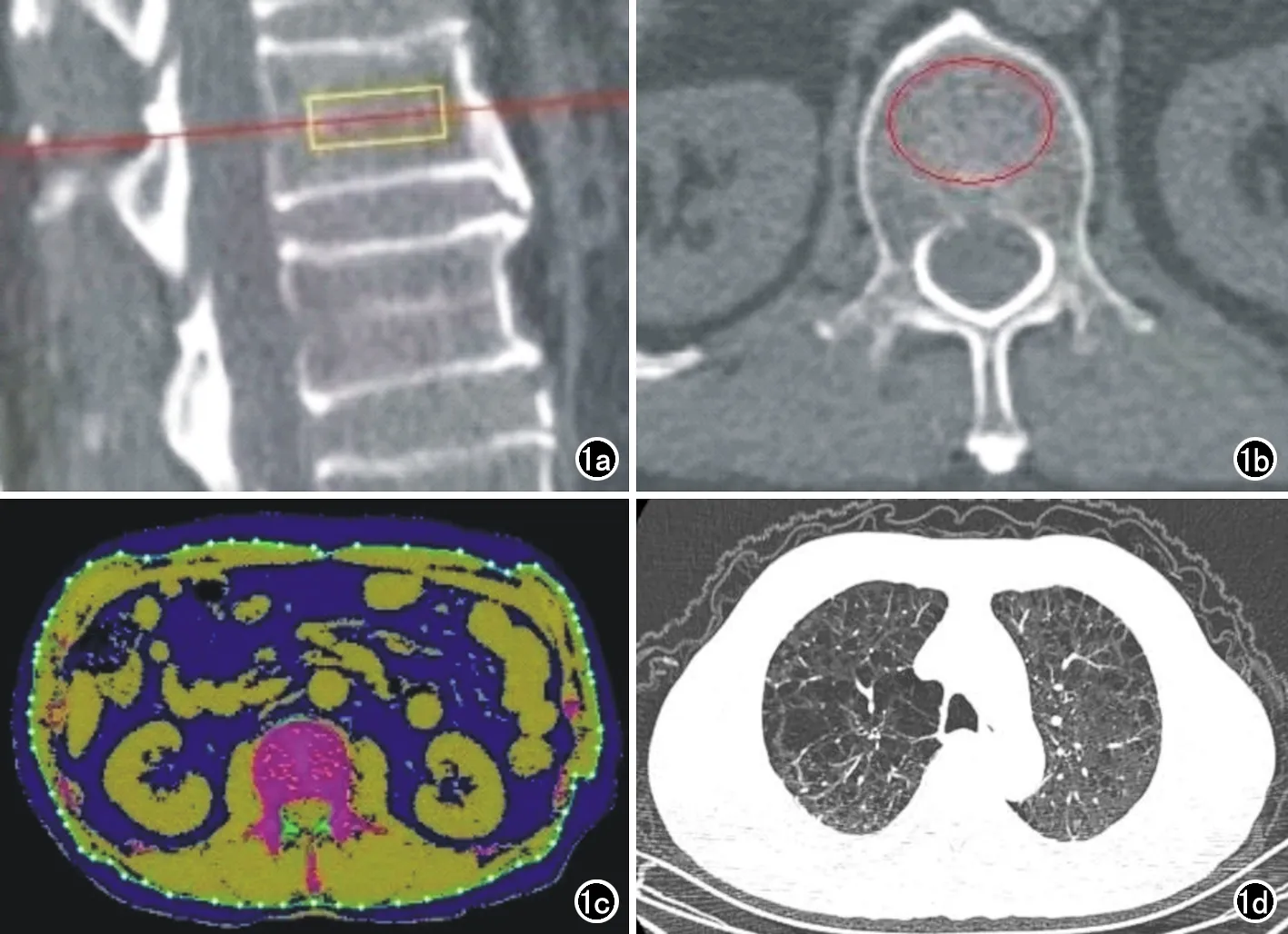
图1 QCT参数测量方法及肺气肿的评估。67岁男性健康体检者,BMD平均值63.85mg/cm3, SMA 209.7cm2, LAA% 26.73%。a) L1椎体矢状面图像;b) L1椎体横轴面图像;c) L2椎体水平脂肪和肌肉面积的测量;d) CT示患者同时合并有小叶中心型肺气肿及间隔旁型肺气肿。
根据国际临床骨密度学会(ISCD) 2007年制定的标准[12],将研究对象分为BMD正常组(BMD>120 mg/cm3)与BMD异常组,后者又包括低骨量(80~120 mg/cm3)和骨质疏松(BMD<80 mg/cm3)。
6.统计学分析

结 果
1.肺气肿组与对照组间之间的一般资料、血生化指标及QCT参数比较
与对照组相比,肺气肿组患者相对消瘦,BMI较低,差异有统计学意义(P<0.001)。肺气肿组患者的腹部总脂肪面积(total fat area,TFA)、内脏脂肪面积(visceral fat area,VFA)低于对照组,皮下脂肪面积(subcutaneous fat area,SFA)高于对照组,但仅VFA在两组间的差异具有统计学意义(P=0.004);肺气肿组的骨骼肌面积(skeletal muscle area,SMA)高于对照组,BMD低于对照组,差异均有统计学意义(P值分别为0.022和0.001)。肺气肿组患者的TC、HDL-C及ALB水平均低于对照组,差异均有统计学意义(P值均<0.05,表1)。
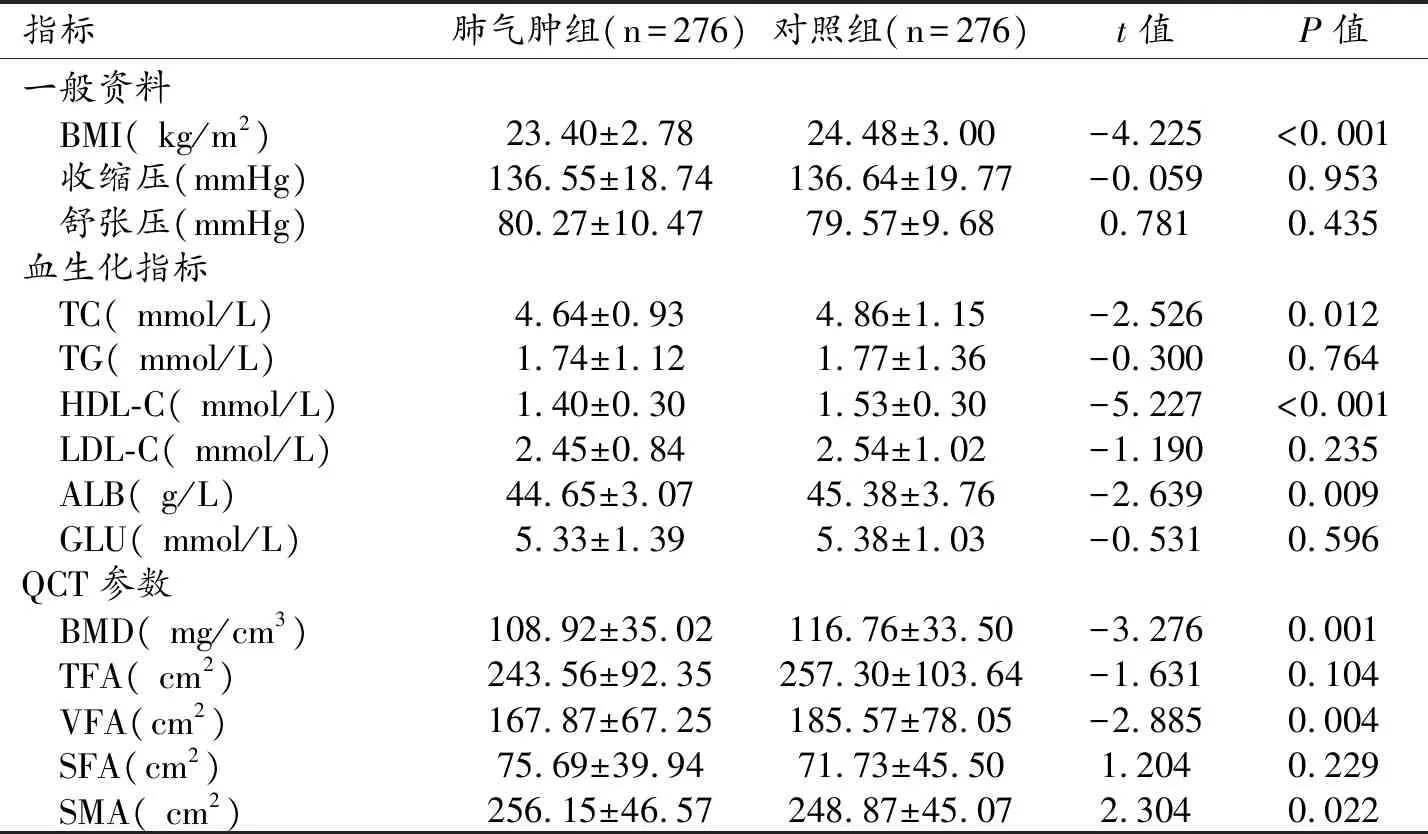
表1 肺气肿组与对照组间的一般资料、血生化指标和QCT参数的比较
2.肺气肿人群中BMD正常组与BMD异常组之间的一般资料、血生化指标及QCT参数比较
BMD异常组患者的年龄显著高于BMD正常组,差异有统计学意义(P<0.001);BMI及舒张压低于BMD正常组,差异均有统计学意义(P值均<0.05)。血生化指标中,BMD异常组的TG、ALB低于BMD正常组,TC、HDL-C及LDL-C高于BMD正常组,差异均有统计学意义(P值均<0.05,表2)。
BMD异常组的LAA%高于BMD正常组,差异有统计学意义(P<0.001),且LAA%与BMD之间呈现较弱的负相关性(r=-0.283;P<0.001),而肺气肿分型在两组间的差异无统计学意义(P=0.506,表2)。BMD异常组的SMA显著低于BMD正常组,差异有统计学意义(P<0.001),而两组间TFA、VFA及SFA的差异均无统计学意义(P值均>0.05,表2)。
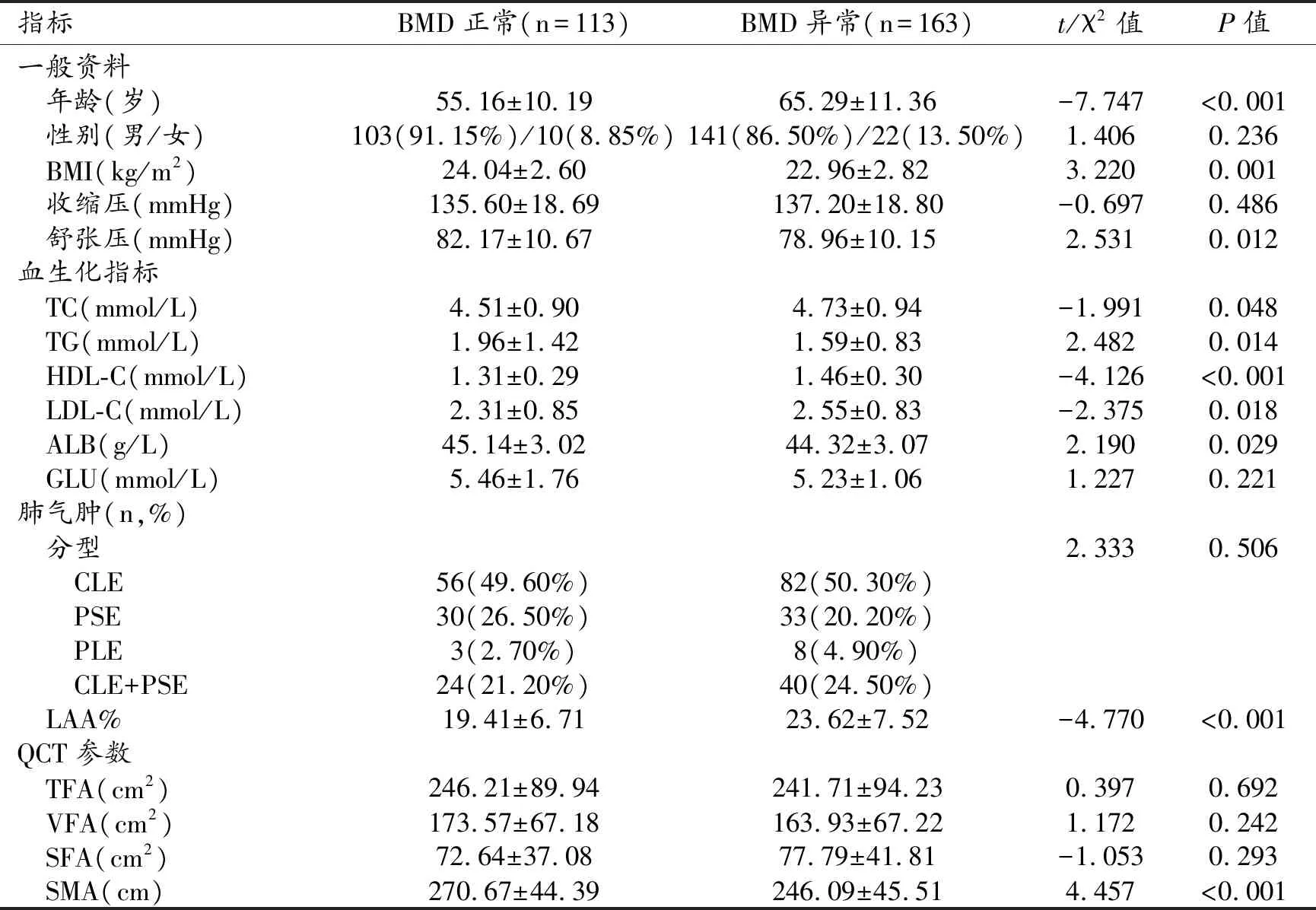
表2 一般资料、血生化指标、肺气肿分型及程度、QCT参数在肺气肿人群中BMD正常组与异常组间的比较
3.肺气肿人群BMD异常的单因素Logistic回归分析
高龄(P<0.001)、相对较低的BMI(P=0.002)和舒张压(P=0.013)与BMD减低相关。高LAA%时BMD减低的风险更高(P<0.001)。此外,在血生化指标和QCT参数中,TC(P=0.049)、HDL-C(P<0.001)和LDL-C(P=0.020)是BMD异常的危险因素,而TG(P=0.011)、ALB(P=0.031)和SMA(P<0.001)则是其保护因素(表3)。
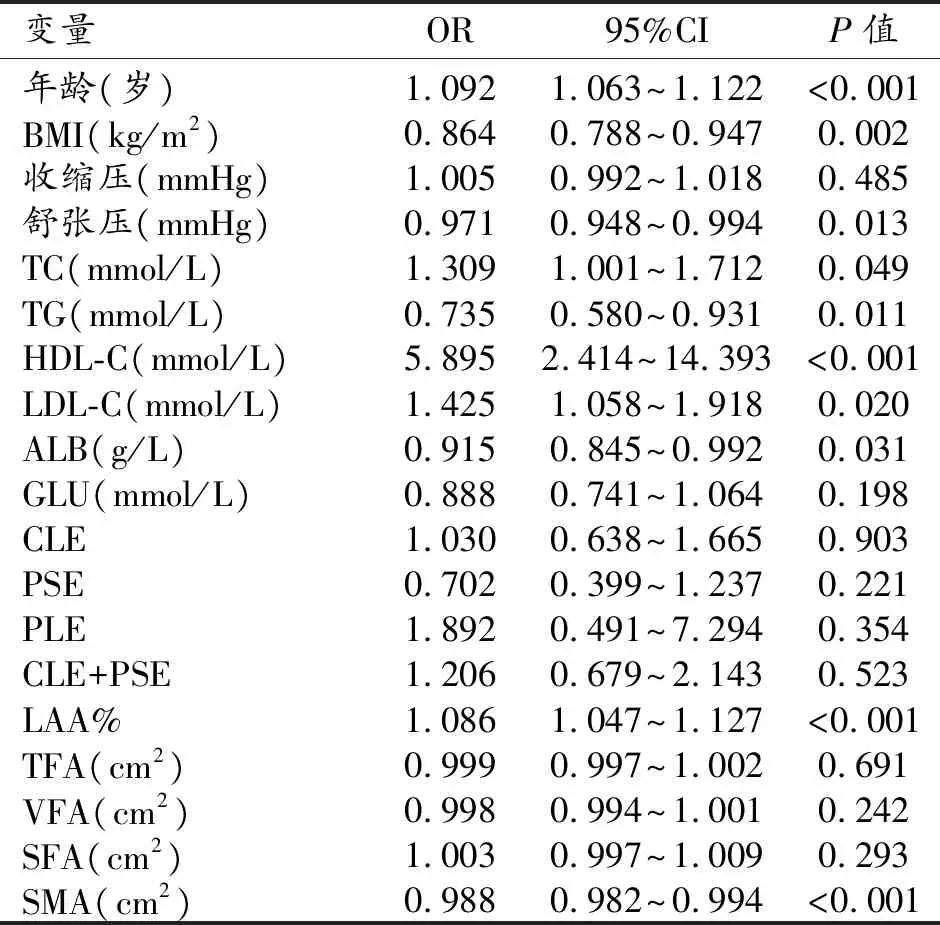
表3 肺气肿人群BMD异常的单因素Logistic回归分析
4.肺气肿人群BMD异常的多因素Logistic回归分析及预测模型的建立
将单因素分析中P<0.05的因素纳入多因素Logistic回归分析,结果显示年龄年龄(OR=1.087,95%CI:1.053~1.121,P<0.001)、TC (OR=1.735,95%CI:1.258~2.393,P=0.001)及LAA% (OR=1.056,95%CI:1.008~1.106,P=0.023)是BMD异常的危险因素,而BMI (OR=0.885,95%CI:0.787~0.995,P=0.042)及SMA (OR=0.992,95%CI:0.985~0.998,P=0.015)是BMD异常的保护因素。将上述因素所对应的加权系数乘积线性组合,得到每个研究对象BMD异常的危险得分Logit(P):Logit(P)=-3.280+0.083×年龄-0.122×BMI+0.551×TC+0.054×LAA%-0.008×SMA。预测模型的AUC为0.806(95%CI:0.755~0.858),阈值为0.503时,敏感度为0.742,特异度为0.761(图2)。
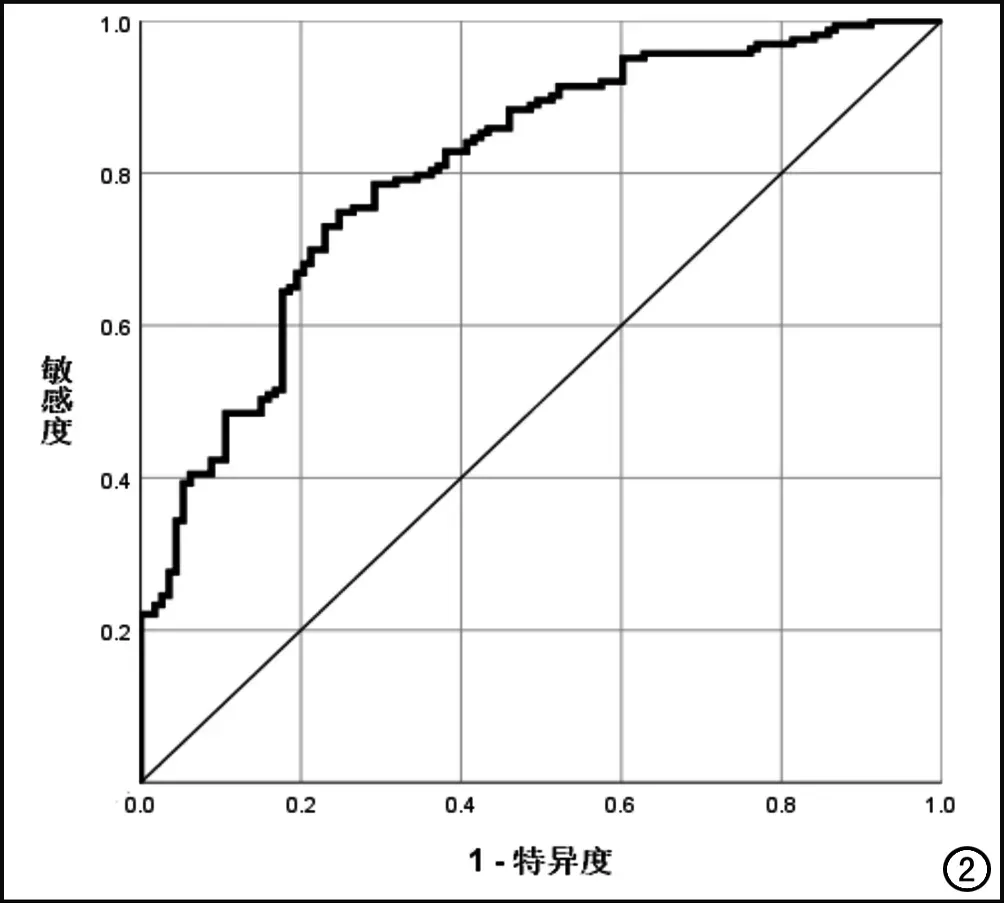
图2 基于年龄、BMI、TC、LAA%、SMA建立的预测模型的ROC曲线。
讨 论
骨质疏松症是一种以低骨量和骨组织微结构恶化为特征的全身性骨骼疾病,可导致骨折风险显著增加[13]。然而骨质疏松症的早期预防和治疗未得到有效重视,这使得存在潜在骨折风险人群的生活质量大大减低。高龄、绝经女性雌激素水平减低、脂代谢异常均可对普通人群BMD产生不同程度影响[11,14]。相关研究表明,在引起肺功能异常的同时,肺气肿可导致BMI减低[5]、脂肪和肌肉含量减少[5,15]、运动功能减退[5,7]等,这些改变均被证实会造成BMD异常。本研究结果显示健康体检CT发现肺气肿的人群较对照组更消瘦(低BMI),脂肪面积更少,但肌肉面积较高;同时年龄、BMI、TC、LAA%及SMA是肺气肿人群BMD异常的独立影响因子。
高龄是公认的骨质疏松危险因素,不论是伴有肺气肿的COPD患者还是正常人群[6,11],高龄都更多出现在BMD异常患者中。本研究结果显示肺气肿人群中BMD异常组患者更年长,且年龄独立影响BMD水平。老龄时期破骨细胞活性仍相对较高,而成骨细胞活性明显减低,骨重建功能显著衰退,骨代谢处于较低状态[16]。
身体成分的改变是肺气肿带来的肺外表现之一。笔者发现肺气肿人群尤其是BMD异常者BMI更低,高BMI是BMD异常的保护因素,这与多数对伴有肺气肿的COPD患者的研究结果一致[5,6]。来源于脂肪组织的脂联素可能在其中发挥作用:肺气肿人群较高的血浆脂联素水平可诱导成骨细胞增殖分化[17],并间接刺激破骨细胞形成[18],而后者的作用似乎更为显著;同时,脂联素水平与BMI呈负相关,其可增加组织对胰岛素的敏感性,并抑制脂肪合成,从而降低血脂[19]。不难推测,肥胖人群BMI的增加可以预防骨质疏松症。严重肺气肿患者脂肪和肌肉含量均减少[15,20],这可能是组织异常维持的表现[20]。高脂联素水平可引起内脏脂肪含量减低[21],这与本研究结果一致。同时,本研究结果还显示肺气肿组SMA较高,这可能意味着在肺气肿较轻时机体的脂肪消耗可能先于肌肉。此外,本研究中BMD异常的肺气肿人群SMA明显减少,此时机体抵抗负荷和重力的Ⅰ型肌纤维萎缩[22],可引起骨骼肌功能障碍、运动能力减退,从而增加骨折风险。
在血生化指标中,血脂和白蛋白参与机体基础代谢,维持营养。然而,血脂与BMD之间的关系尚无定论,即使在正常人群中,两者间的相互影响也可因年龄、性别、生活习惯的不同而有所差异[11,23]。本研究结果显示仅TC及HDL-C在肺气肿组与对照组之间的差异具有统计学意义,但肺气肿组的血脂水平均随BMD改变而有所不同,且TC是BMD异常的危险因素。肺气肿可影响脂代谢,特别是在严重疾病阶段,脂质底物的消耗以及炎症因子水平升高对血脂水平影响显著[24]。脂代谢和骨代谢的关系是复杂的:高脂血症时骨皮质的脂质通透性受限从而影响骨细胞的代谢功能[25];反之,成骨细胞也会产生和分泌各种形式的脂质,并可通过释放代谢因子,引起脂蛋白的氧化反应[25]。脂蛋白是运输脂溶性维生素D的载体,后者又可促进钙盐吸收及新骨形成。此外,在本研究中,ALB在肺气肿人群尤其是BMD异常者中减低。目前尚无研究分析肺气肿人群ALB与BMD的关系,ALB是否能影响肺气肿人群的BMD,还有待进一步探索。
肺气肿是COPD常见的表现形式之一,其程度与BMD呈负相关[5,6]。本研究发现,肺气肿人群BMD轻微减低,LAA%与BMD具有弱负相关性,且能有效预测BMD异常。肺气肿人群体内高水平的炎症因子IL-1β、IL-6、TNF-α与OPG/RANK/RANKL蛋白系统产生协同作用[6],刺激破骨细胞分化[26];同时,破骨细胞因子基质金属蛋白酶-9(MMP-9)等多种MMP也参与肺气肿时的炎症反应[27,28]。目前LAA%与BMD的负相关性基本取得较为统一的认识,但关于肺气肿分型与BMD关系的研究甚少。最近一项对吸烟者的研究首次分析了肺气肿分型与BMD的关系,发现了CLE对BMD独特的影响作用[13]。本研究结果并不支持上述观点。CLE是肺气肿最常见的类型,与吸烟的关系最为密切[9,13]。本研究中尚存在部分非吸烟者,这可能在很大程度上会导致差异性结果的产生。
本研究存在一定局限性:首先,研究对象中男性占绝大多数,性别分布不均衡,因此笔者未针对不同性别具体分析,这可能使得某些影响女性BMD的因素被忽略;其次,本研究为单中心回顾性研究,结果仅能反映局部地区健康体检CT发现肺气肿人群的状况。
综上所述,年龄、BMI、TC、LAA%及SMA对健康体检CT发现肺气肿人群的BMD均有不同程度影响,基于上述因素建立的预测模型对评估BMD异常有一定价值。通过体检时的健康评估,有利于早期发现尚未进展至COPD的肺气肿患者BMD异常的情况,在配合积极预防并及时治疗的基础上,降低骨质疏松症的发病率和骨折风险,提高生活质量。

