肝囊型包虫病与粘液性囊性肿瘤的影像学鉴别诊断
任阿红,刘军,杨大为,徐辉,贾素兰,王振常,杨正汉
肝囊性病变在临床上很常见,普通人群的发病率高达20%[1-3],其中囊型包虫病(cystic echinococcosis,CE)是由细粒棘球绦虫所致的感染性病变,65%~80%发生于肝脏,基本病变为肝囊性占位[4]。肝粘液性囊性肿瘤(mucinous cystic neoplasm,MCN)是一组罕见的起源于肝胆管的囊性肿瘤(以前称为胆管囊腺瘤/癌),在病理学上分为低级别上皮内肿瘤、高级别上皮内肿瘤和浸润癌,影像学上常表现为多房囊性肿块[2,5]。肝囊型包虫病与粘液性囊性肿瘤在影像学上均可表现为复杂囊性病变,术前影像学检查有助于治疗方案的选择[1,2,5,6]。本文旨在总结分析肝囊型包虫病与粘液性囊性肿瘤的CT、MRI鉴别诊断要点。
材料与方法
1.病例资料
回顾性分析2015年1月至2022年4月在我院接受 CT 和/或 MRI 检查并发现肝囊性病变患者的临床、影像学和病理资料。病例纳入标准:①患者行肝 CT 或 MRI 增强扫描发现肝囊性病变;②经肝穿刺活检或局部切除手术明确肝内囊性病变的病理诊断为囊型包虫病或粘液性囊性肿瘤者。病例排除标准:①患者术前CT或MRI增强扫描图像不全或图像质量差无法评估;②肝内囊性病变数目>5 个。
2.检查方法
CT检查采用Aquilion One (Cannon Medical Systems USA)、LightSpeed VCT (GE Healthcare,Boston) 或 Brilliance iCT 256 (Philips Healthcare)CT扫描仪,患者取仰卧位。扫描范围自膈顶至肝右叶下缘,常规扫描层厚5 mm,层间隔5 mm,管电压120 kV,管电流使用自动调节控制技术,扫描时相包括平扫、动脉晚期和门脉期,部分病例包括延迟期,分别在注射对比剂后25~35 s、60~70 s、3~5 min进行扫描;每期图像均可进行多平面重组。增强扫描对比剂采用欧乃派克(350 mg I/mL),以 2~3 mL/s流率注射80~100 mL。
MRI检查采用1.5T(GE Signa HDxt)或3.0T(GE Discovery 750W、Simens Prisma和Philips Ingenia)MR扫描仪,采用8通道或16通道体部相控阵线圈。检查前患者空腹4 h以上,采用仰卧位、头先进。常规扫描序列包括定位相、横轴面和冠状面T2WI、同反相位横轴面T1WI及屏气动态增强T1WI。增强扫描对比剂采用马根维显,经手背静脉由高压注射器推注,剂量0.1 mmol/kg,注射流率2.0 mL/s。在预扫描后,采用LAVA、VIBE或e-THRIVE序列行动态增强扫描,在注射对比剂后25~35 s、60~70 s、3~5 min分别行动脉晚期、门脉期和延迟期扫描,扫描范围自膈顶至肝右叶下缘。
3.图像分析
在不知道病理结果的前提下,所有患者的CT或MRI图像由两位分别具有14、15年腹部影像诊断经验的副主任医师在PACS工作站上采用盲法共同阅片并获得一致意见。CT或MRI图像判读内容包括:肝内囊性病变的数目、位置、形态、最大径、有无囊壁、囊壁有无强化、囊液是否均匀、囊内有无出血,有无壁结节、壁结节有无强化、有无分隔、分隔有无强化,肝静脉/门静脉/下腔静脉有无血栓或癌栓,以及病变上游肝内胆管有无扩张。另外,在CT图像上判读囊壁有无钙化,在MRI图像上判读囊液有无T1WI高信号,病灶在DWI及ADC图像上有无扩散受限。
4.统计学分析
采用SPSS 26.0软件进行统计学分析。 对CT和MRI图像上肝囊型包虫病与粘液性囊性肿瘤的临床和影像学特征进行比较,所有计量资料均以均值±标准差表示,计数资料以计数或百分比表示。计量资料的组间比较采用Mann-WhitneyU检验,计数资料的组间比较采用卡方检验。以P<0.05为差异有统计学意义。
结 果
1.临床特征
本研究最终纳入22例患者(表1),其中包括 12 例囊型包虫病患者(共20个病灶)和10例粘液性囊性肿瘤患者(10个病灶)。在12例肝囊型包虫病患者中,7例为单发病灶,4例有2个病灶,1例有5个病灶。10例肝囊型包虫病患者(17个病灶)和9例肝粘液性囊性肿瘤患者(9个病灶)行CT增强检查。9例肝囊型包虫病患者(12个病灶)和6例肝粘液性囊性肿瘤患者(6个病灶)行MRI增强检查。肝囊型包虫病与粘液性囊性肿瘤在病灶数目和形态上差异有统计学意义(P<0.05),而在患者年龄、性别和病灶大小上差异无统计学意义(P>0.05,表 1)。
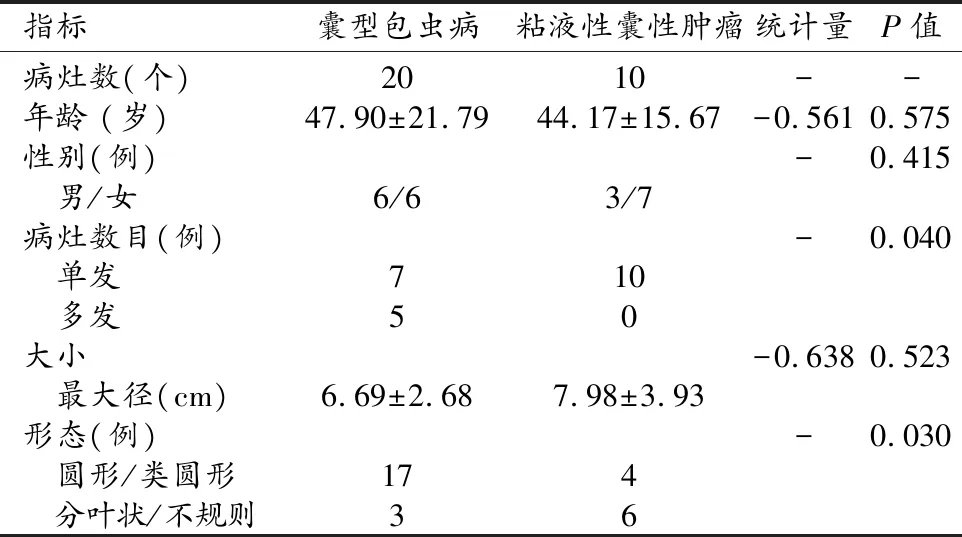
表1 肝囊型包虫病与粘液性囊性肿瘤患者的基本资料比较
肝粘液性囊性肿瘤以单发为主,病灶形态多为分叶状或不规则形;而肝囊型包虫病常为多发病灶,病灶形态以圆形或类圆形为主。

图1 经手术病理证实的肝囊型包虫病患者,男,26 岁,超声体检发现肝占位1个月。a) T2WI示肝S7/8交界处囊性病变,内见分隔(箭);b) DWI(b=800mm2/s)图像示病变内无扩散受限; c) ADC图像示病变内无扩散受限; d)蒙片; e)延迟3 min增强扫描示病变囊壁可见强化,囊内分隔无强化;f)冠状面T2WI示病变内剥脱的内囊膜(箭);g)轴面CT平扫图像,肝囊性病变的囊壁可见弧形钙化(箭);h)矢状面重组图像,肝囊性病变的囊壁可见弧形钙化(箭)。
2.肝囊型包虫病与粘液性囊性肿瘤的CT特征比较
肝囊型包虫病与粘液性囊性肿瘤的CT特征见表2。肝囊型包虫病与粘液性囊性肿瘤在囊液密度是否均匀、囊壁有无钙化和强化、有无壁结节及壁结节有无强化、有无分隔、分隔有无强化以及病变上游肝内胆管扩张等方面差异均有统计学意义(P<0.05)。肝囊型包虫病的囊液多不均匀,囊壁多伴钙化,一般无壁结节,内囊膜剥离可形成分隔,但分隔无强化(图1);而肝粘液性囊性肿瘤的少数病灶囊壁可伴钙化,囊壁多有强化,常有壁结节及分隔并伴明显强化(图2)。
3.肝囊型包虫病与粘液性囊性肿瘤的MRI特征比较
肝囊型包虫病与粘液性囊性肿瘤的MRI特征见表3。肝囊型包虫病与粘液性囊性肿瘤在囊液信号是否均匀、有无壁结节、壁结节有无强化及扩散受限、有无分隔及分隔有无强化等方面差异均有统计学意义(P<0.05),而在囊壁有无强化、T1WI有无高信号以及上游肝内胆管扩张等方面差异无统计学意义(P>0.05,表3)。肝囊型包虫病一般无壁结节,分隔无扩散受限,也无强化(图1);而肝粘液性囊性肿瘤内常有壁结节及分隔,均可见强化及扩散受限(图2)。
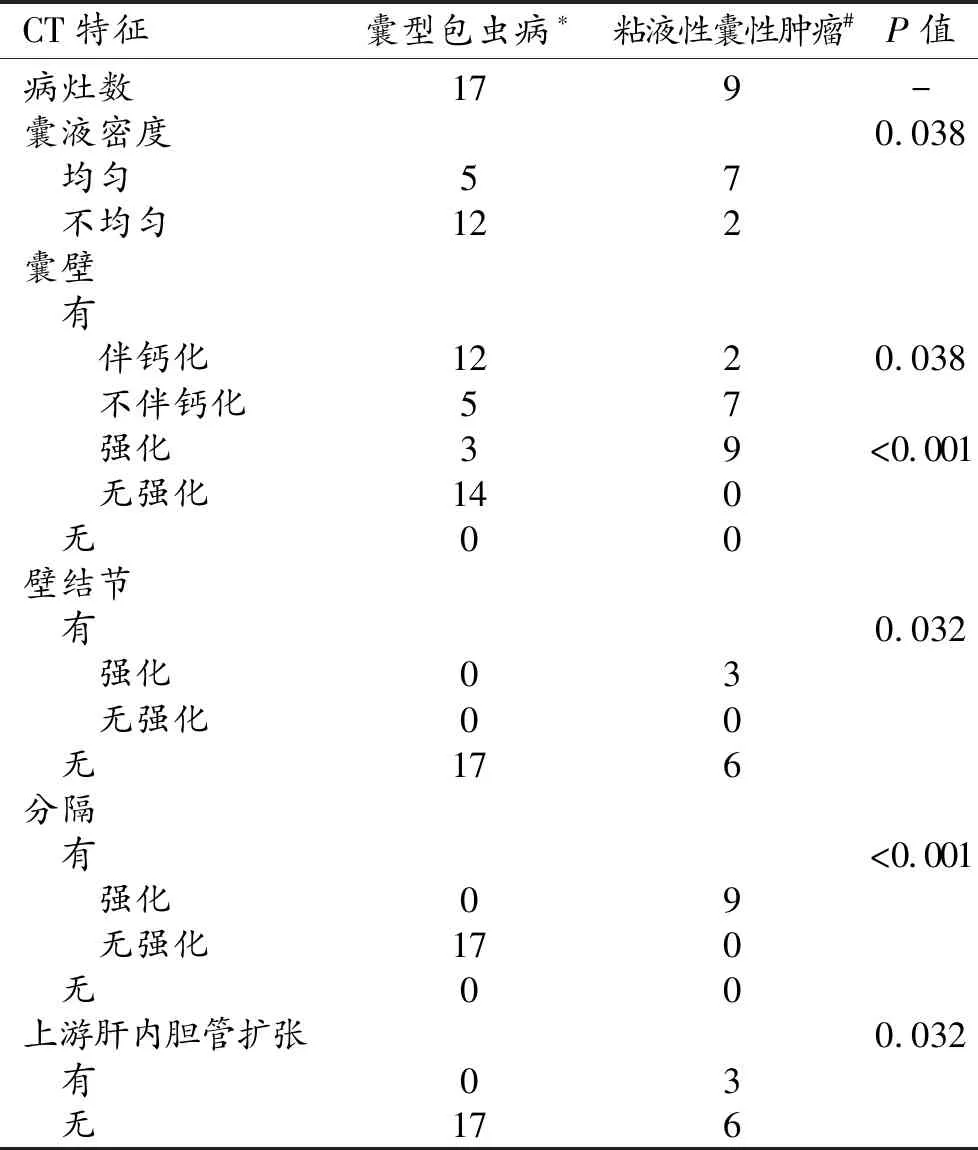
表2 肝囊型包虫病与粘液性囊性肿瘤的 CT特征比较 (个)
讨 论
肝囊型包虫病和粘液性囊性肿瘤在影像学上均可表现为复杂囊性病变,两者鉴别困难[7]。本研究结果显示,肝囊型包虫病与粘液性囊性肿瘤在囊液密度/信号是否均匀、囊壁有无钙化、囊内有无壁结节、壁结节有无强化及扩散受限、有无分隔及分隔有无强化等方面差异均有统计学意义(P<0.05)。肝粘液性囊性肿瘤以单发为主,病灶形态多为分叶状或不规则形,少数病灶囊壁可伴钙化,囊壁多有强化,常有壁结节及分隔并伴强化和扩散受限;而肝囊型包虫病常为多发病灶,病灶形态以圆形或类圆形为主,囊液密度/信号多不均匀,囊壁多伴钙化,一般无壁结节,内囊膜剥离可形成分隔,但分隔无强化。
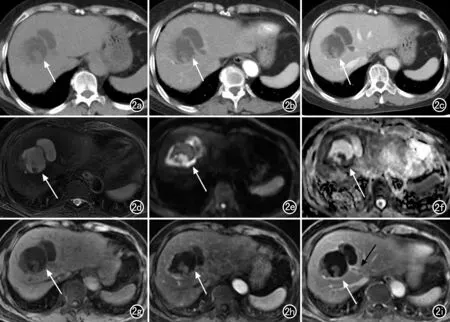
图2 患者,女,63岁,超声体检发现肝病变1个月,CA15-3升高(48.8U/mL)。手术病理证实为肝粘液性囊性肿瘤,伴浸润癌。a) CT平扫示肝S4/8 交界处多房囊性为主病变,内见壁结节及分隔(箭);b)CT增强扫描动脉晚期壁结节及分隔可见强化(箭);c)CT增强扫描门脉期壁结节及分隔可见强化(箭);d)T2WI示肝S4/8 交界处囊实性病变(箭);e)DWI(b=800mm2/s)图像示病变的囊壁及壁结节可见扩散受限(箭); f) ADC图像示病变的囊壁及壁结节可见扩散受限(箭);g)蒙片病变可见壁结节、分隔及囊壁;h)增强扫描动脉晚期壁结节、分隔及囊壁可见强化(箭);i)增强扫描延迟3min壁结节、分隔及囊壁可见强化(白箭),肝中静脉可见癌栓形成(黑箭)。
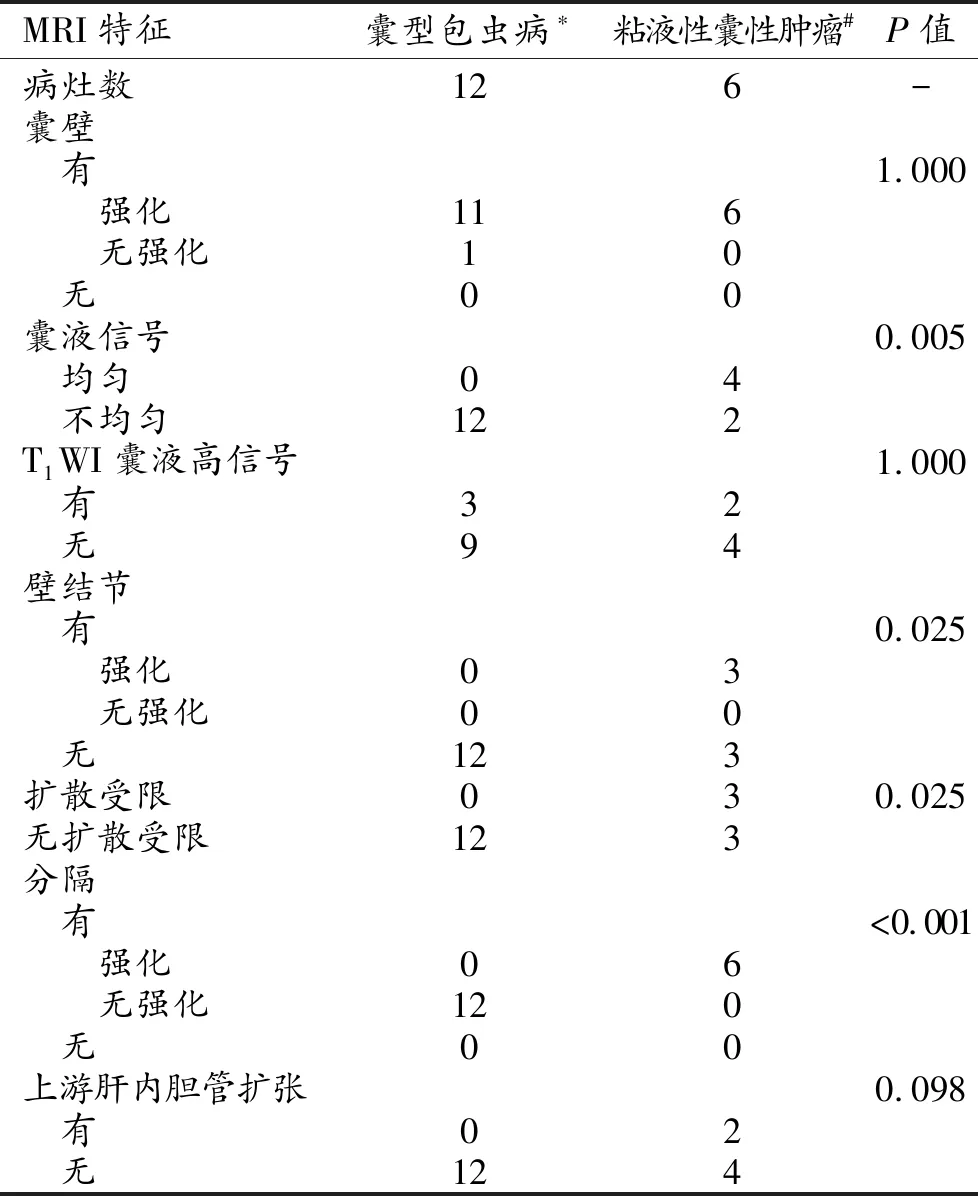
表3 肝囊型包虫病与粘液性囊性肿瘤的MRI特征比较 (个)
肝粘液性囊性肿瘤是2010年WHO首次规范命名的少见肿瘤,在肝囊性肿瘤中占比<5%[8,9]。根据消化系统肿瘤WHO 2019版分类,肝粘液性囊性肿瘤为起自肝胆系统的上皮性粘液性囊性肿瘤,病理上可见上皮下富含卵巢样间质,典型病变与胆管不相通[9]。肝粘液性囊性肿瘤好发于中年女性(87%~100%),男性罕见[5],而本研究中30%为男性,所有病例均经手术病理证实。影像学上通常表现为单发、大的多房囊性肿瘤,左半肝好发,囊壁及分隔可见钙化,病变内常见分隔且分隔厚薄不一,其内可见壁结节,囊壁、分隔和壁结节均可见强化及扩散受限[10],本研究结果与文献报道基本一致。3例肝粘液性囊性肿瘤在CT上可见上游肝内胆管扩张,2例在MRI上可见上游肝内胆管扩张,术中均未见病变与肝内胆管明确相通,考虑是由于肿瘤占位效应压迫邻近的肝内胆管所致。文献报道有少数个案报道病例与肝内胆管相通[11-14]。
肝囊型包虫病的基本病变是圆形或类圆形、边缘光滑锐利的囊性占位,特殊征象包括:①囊壁显示,常伴钙化;②含子囊型呈多房囊性病变;③内囊膜从外囊剥离形成分隔,悬浮于囊液中形成“飘带征”[4,15,16]。本组肝囊型包虫病病例均未见上游肝内胆管扩张。王佳等[17]报道囊型包虫病中48.1%压迫胆道,51.9%破入胆道,CT联合磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)对术前临床准确评估肝包虫病胆道并发症具有重要价值。
肝囊型包虫病与粘液性囊性肿瘤的鉴别要点主要包括以下几点:①囊壁钙化。前者常见,后者可有但相对较少;②壁结节。前者一般无,后者可有并伴强化;③分隔。前者可有但无强化,后者常见且伴强化。本研究中,肝囊型包虫病与粘液性囊性肿瘤的包膜强化在CT上有差异,而在MRI上无差异,原因是MRI增强扫描显示囊型包虫病的囊壁强化优于CT。因为MRI的软组织分辨率优于 CT,肝囊型包虫病的最外层是纤维包膜,在MRI增强扫描时显示延迟强化[18,19]。CT 对肝内囊性病变与周围结构的解剖关系显示清楚,对囊壁钙化显示良好,但对囊内容物的成分显示欠佳。MRI对肝囊性病变的囊内容物、分隔及壁结节和包膜的强化显示良好。
本研究存在一定局限性:①本研究为单中心研究,样本量有限,可能会对结果产生影响。②本研究为回顾性研究,在选择研究对象时难以避免可能存在的选择性偏倚。未来的研究中,我们将扩大样本量,纳入多中心病例。③肝内胆管导管内乳头状肿瘤的部分亚型在影像学上也可表现为肝内囊实性肿块,但多伴上游和/或下游胆管扩张。笔者回顾分析了我院近8年来的病例,仅有1例胆管导管内乳头状肿瘤表现为肝内囊实性肿块不伴上游胆管扩张,故未纳入研究。胆管导管内乳头状肿瘤起源于胆管上皮细胞并与胆管相通,病理上以胆管内肿瘤细胞乳头状或绒毛状增生为特点,伴特征性的纤维血管核心,30%~40%分泌粘液,导致病变远端胆管扩张[5]。
综上所述,肝粘液性囊性肿瘤在影像学上以单发为主,病灶形态多为分叶状或不规则形,少数病灶囊壁可伴钙化,囊壁多有强化,常有壁结节及分隔伴明显强化和扩散受限;而肝囊型包虫病常为多发病灶,病灶形态以圆形或类圆形为主,囊液密度/信号多不均匀,囊壁多伴钙化,一般无壁结节,内囊膜剥离可形成分隔,但分隔无强化。

