盐度对湛江等鞭金藻生长、脂肪酸及藻际菌群的影响
叶凌志 张 琳,2,* 田娇娇 杨永艺 徐继林,2
(1 宁波大学海洋学院,浙江 宁波 315211; 2 浙江省海洋生物工程重点实验室(宁波大学),浙江 宁波 315211)
海洋微藻种类繁多,营养丰富,兼具易培养、易摄食等特点,被广泛用作鱼、虾和双壳贝类等水产养殖动物的开口饵料[1-3]。尤其是海洋微藻富含的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)有利于提高水产动物幼体的生长速率、成活率和变态率,是评价饵料微藻的重要指标之一[4]。湛江等鞭金藻(Isochrysiszhanjiangensis)是一种海洋真核单胞藻,无细胞壁,易扩繁,其作为优质饵料微藻之一已得到广泛应用[5]。
海洋微藻生长和脂肪酸积累受多种环境因子影响,而盐度是其中之一[6-7]。Salehipour-Bavarsad等[8]探究了不同盐度(0.5~2.5 mol·L-1NaCl)培养基对杜氏藻(Dunaliellapseudosalina)的影响,结果显示2.5 mol·L-1NaCl下其生物量最高且棕榈酸和α-亚麻酸显著积累。据Canavate等[9]报道,巴夫藻(Diacronemavlkianum)在盐度20时生物量最高;在盐度5、20和35时脂肪酸组成差异不大;在盐度50时部分PUFA含量显著提高,而饱和脂肪酸(saturated fatty acid,SFA)含量显著下降。类似地,对舟形藻(Naviculasp.)施以盐度胁迫(盐度45)可有效提升其PUFA含量[10]。目前,光照、氮浓度、磷浓度等对湛江等鞭金藻生长及脂肪酸组成的影响均有报道[11],而盐度鲜有涉及。
近年来,研究发现藻际菌群自身的生长及其胞外分泌物会影响微藻生长和代谢活动[12]。Koedooder等[13]发现不同底栖硅藻的藻际菌群组成各异,呈现种属特异性。Ling等[14]分析了包括2株微拟球藻(Nannochloropsisoceanica)、3株球等鞭金藻(Isochrysisgalbana)和2株假微型海链藻(Thalassiosirapseudonana)在内的7株常见饵料微藻的藻际菌群组成,发现不同微藻间藻际菌群组成差异明显,进而将藻液中分离的海杆菌(Marinobactersp.)分别与7株饵料微藻进行共培养,结果表明7株微藻的生长均得到有效促进。Krug等[15]将甲基杆菌(Methylobacteriumsp.)分别与空泡栅藻(Scenedesmusvacuolatus)和湖泊红球藻(Haematococcuslacustris)共培养,显著提高了微藻生物量,并促进了微藻维生素和植物激素合成相关基因表达。Wang等[16]将从废水中分离出的克雷伯氏菌(Klebsiellasp.)与蛋白核小球藻(Chlorellapyrenoidosa)共培养,显著提高了蛋白核小球藻的生物量和脂质含量。针对上述现象,有研究者推测,在藻菌共生系统中,藻类排放到环境中的天然有机物可被细菌分解为可溶性有机碳供藻类再度利用,同时细菌产生的CO2可被藻类吸收利用,提高藻类光合效率,进而促进其生长代谢[12]。目前,只有少量研究涉及环境因子对藻际菌群的影响[17],而盐度对藻际菌群的影响尚鲜见报道。
鉴于此,本研究选取湛江等鞭金藻为研究对象,分析不同盐度(12、18、24和30)下其生长、脂肪酸组成及藻际菌群的差异,旨在解析盐度与脂肪酸及藻际菌群之间的关系,为湛江等鞭金藻的培养方案优化提供数据支持。
1 材料与方法
1.1 藻种及培养条件
试验所用藻株为湛江等鞭金藻(编号FACHB-1750),由中国科学院水生生物物种种质库提供。采用新鲜灭菌的大三号(NMB3#)培养基[18],培养条件为温度25℃、盐度20、光照强度60 μmol·m-2·s-1、光暗比12 h:12 h。每日摇藻数次以防藻细胞贴附于瓶壁。
1.2 试验设计
培养湛江等鞭金藻至指数生长中期,收集藻细胞,并分别转移至4个不同盐度(12、18、24和30)的新鲜NMB3#培养基中(编号IZ12S、IZ18S、IZ24S和IZ30S,开始半连续培养,即隔天更换体积新鲜NMB3#培养基(稀释率50%),且盐度与更换前一致。每天测定藻液的细胞密度(OD750)和叶绿素荧光参数,以判断藻液是否达到稳定生长状态。达到稳定状态后,分别离心收集各组藻细胞进行脂肪酸组成和藻际菌群分析。除盐度外,温度、光照和光暗比等均与原藻液一致。每组设置3个平行。培养基盐度调节通过添加不同比例海水晶(保嘉X号,上海保嘉工贸有限公司)实现。
1.3 细胞密度测定
藻细胞密度测定采用分光光度法,使用UV-5200型紫外分光光度计(上海元析仪器有限公司),以750 nm波长下的吸光度值(OD750)反映藻细胞密度情况。
1.4 叶绿素荧光参数测定
使用AquaPen-C AP 110-C手持式叶绿素荧光仪(Photon Systems Instruments公司,捷克)测定叶绿素荧光参数。取一定量藻液置于仪器配套的样品杯中,使用强饱和脉冲光(4 000 μmol·m-2·s-1)激发测定光系统II最大光化学效率(maximal photochemical efficiency,Fv/Fm)、有效光化学效率(effective photochemical efficiency,F′v/F′m)和非光化学淬灭系数(non-photochemical quenching,NPQ)[19]。测定Fv/Fm前,藻液样品需暗处理15 min。测定F′v/F′m前,藻液样品需光适应处理15 min。
由仪器自动测算得出
NPQ = (Fm-F′m)/F′m
(1)
式中,Fm表示藻液样品暗适应15 min后的最大荧光产率,F′m表示光照下瞬时最大荧光。详情遵照仪器说明书。
1.5 脂肪酸提取与测定
脂肪酸提取依照Lepage等[20]的方法并适当优化。首先,将各组藻液离心(8 000 ×g5 min)收集各组藻细胞,冷冻干燥后得到藻粉。称取10 mg藻粉,加入3 mL 2 mol·L-1KOH-CH3OH,涡旋震荡后75℃温育30 min。再加入1.5 mL 3 mol·L-1HCl-CH3OH,75℃温育30 min。最后,将脂肪酸甲酯溶于色谱级正己烷中,低温保存。脂肪酸组成测定使用7890B/7000C三重四极杆气相色谱-质谱分析仪(美国安捷伦科技公司)[21]。采用面积归一法计算每种脂肪酸的相对百分含量。气相色谱条件:进样口温度250℃,载气为高纯氦,恒定流量0.80 mL·min-1,柱起始温度140℃,保持5 min,以4℃·min-1升至240℃,保持20 min;采用分流进样,分流比1∶5,进样量1 μL,接口温度250℃。质谱条件:用电子轰击电离源分析,电子能量70 eV,离子源温度230℃,四极杆温度150℃,选取SCAN模式,质量扫描范围40~600 m/z,溶剂延迟13.7 min。
1.6 16S rDNA扩增子测序及数据分析
采用0.22 μm聚碳酸酯膜(Millipore,美国)在无菌环境中对各组藻液依次进行过滤,获得藻际细菌,进而将滤膜置于无菌离心管中,液氮速冻保存。采用CTAB法提取每组样品的基因组DNA,并检验其浓度和纯度。后续的16S rDNA扩增子测序由北京诺禾致源科技股份有限公司完成。采用带有Barcode的特异引物341F:5′-C C T A Y G G G R B G C A S C AG-3′和806R:5′-G G A C T A C N N G G G T A T C T A AT-3′,对16S rDNA基因的V3~V4区域进行PCR扩增。对检测合格的PCR产物,使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒(Illumina,美国)构建小片段文库,进而使用Illumina NovaSeq测序平台对该文库进行双末端测序。原始数据经过Qiime软件[22]拼接过滤后,利用Uparse软件进行操作分类单元(operational taxonomic units,OTU)聚类分析并注释物种分类水平[23]。使用Qiime软件和R软件进行Alpha多样性指数组间差异分析和Beta多样性指数组间差异分析。
1.7 统计分析
所有数据均采用平均值±标准差表示。采用SPSS 20软件进行单因素方差分析及差异显著性分析(One-Way ANOVA,Tukey检验),以P<0.05表示差异显著。采用GraphPad Prism 7软件制图。
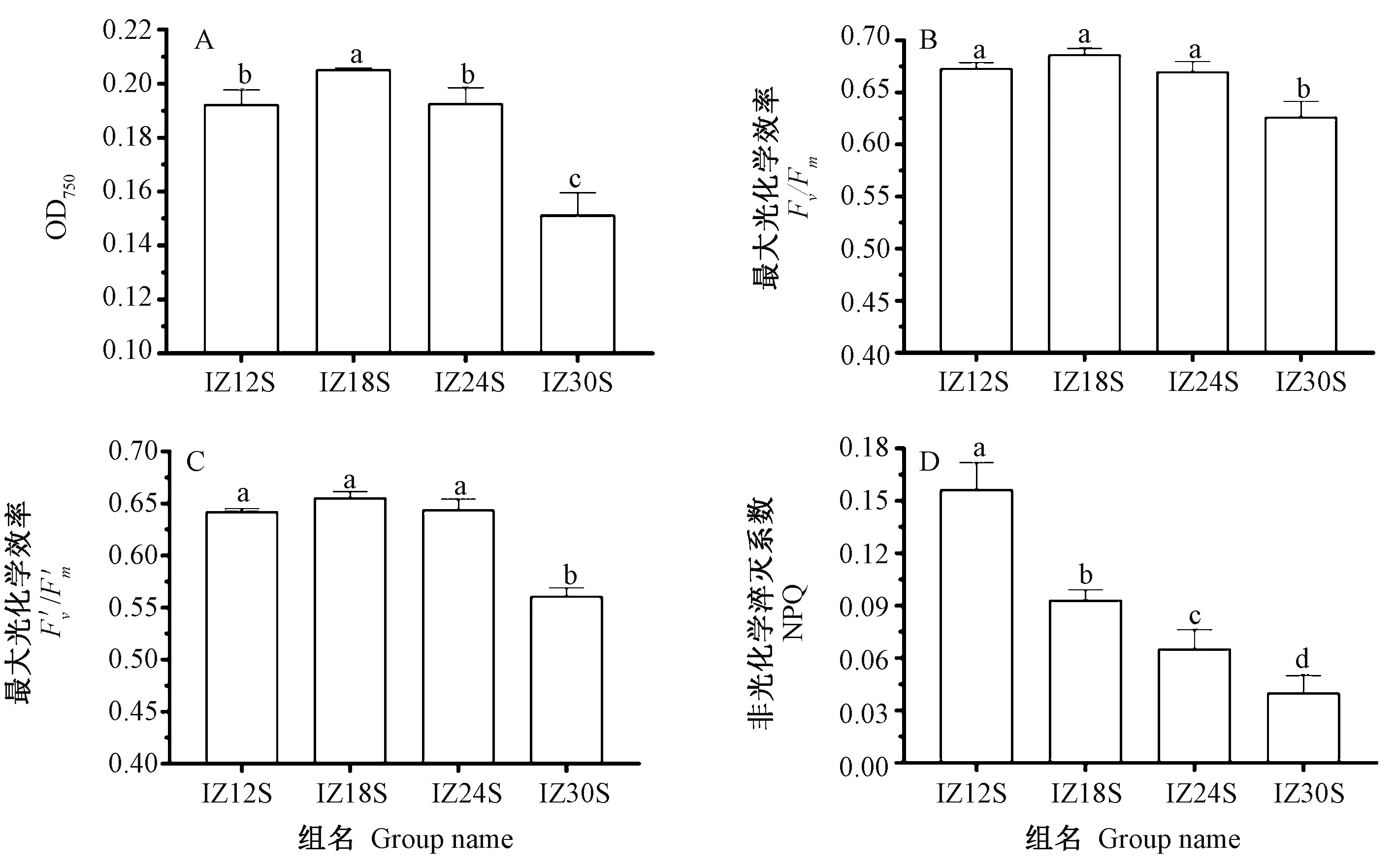
注: 不同小写字母表示组间有显著性差异(P<0.05)。下同。Note: Different lowercase letters represent the significant difference at 0.05 level. The same as following.图1 不同盐度组湛江等鞭金藻生长状况Fig.1 Growth of Isochrysis zhanjiangensis in different salinity groups
2 结果与分析
2.1 不同盐度组生长差异分析
图1显示了培养终点时不同盐度组湛江等鞭金藻的细胞密度和叶绿素荧光参数。在本试验所设4个盐度下,IZ18S组藻细胞密度最大,生长速率最块,显著高于其他组;IZ12S和IZ24S组藻细胞密度无显著性差异;IZ30S组藻细胞密度最小,生长速率最慢,显著低于其他组(图1-A)。Fv/Fm和F′v/F′m2个参数的变化趋势近似(图1-B、C),中低盐度(12、18和24)下湛江等鞭金藻的Fv/Fm和F′v/F′m无显著差异。盐度30下,Fv/Fm和F′v/F′m都处于最低值,显著低于其他组。说明盐度30下湛江等鞭金藻光合效率受到了显著抑制。由图1-D可知,随盐度增加,湛江等鞭金藻中NPQ逐渐降低,且各盐度组间差异显著。NPQ值可反映植物将过剩光能耗散为热能的能力,因此推测随盐度降低,湛江等鞭金藻中热耗散增多。IZ12S组中NPQ最高,说明盐度12不利于湛江等鞭金藻光合作用,且该盐度下采用热耗散方式以保护藻细胞光合结构的作用最明显。
2.2 不同盐度组脂肪酸组成分析
在培养终点,收集各组藻细胞测定脂肪酸组成,共鉴定出9种脂肪酸,其中饱和脂肪酸(SFA)3种,包括C14:0、C16:0和C18:0;单不饱和脂肪酸(monounsaturated fatty acid,MUFA)2种,包括C16:1和C18:1;多不饱和脂肪酸(PUFA)4种,包括C18:2、C18:3、C18:4和C22:6。C14:0、C16:0和C18:0均在IZ30S组中含量最高,显著高于其他组(P<0.05)。C16:1在IZ30S组含量最低,显著低于其他三组(P<0.05)。此外,C18:1、C18:2和C22:6在4个盐度组间均无显著差异。C18:3在IZ12S组中含量最高,与IZ18S组无显著性差异,与IZ24S组和IZ30S组有显著性差异。C18:4在IZ18S组中含量最高,与IZ24S组无显著差异,与IZ12S组和IZ30S组差异显著。总体而言,IZ12S、IZ18S和IZ24S组中SFA、MUFA和PUFA含量无显著差异,而IZ30S组SFA含量显著提高,MUFA和PUFA含量显著降低。说明盐度30有利于饱和脂肪酸的积累,而不利于不饱和脂肪酸的积累。

表1 不同盐度下湛江等鞭金藻脂肪酸组成Table 1 The fatty acid composition of Isochrysis zhanjiangensis treated with different salinities /%
2.3 不同盐度组藻际菌群分析
2.3.1 OTU聚类分析 四组样品的16S rDNA扩增子测序结果经拼接过滤处理后,平均每个样品得到 65 866 条有效数据(effective tags),平均有效数据占比为74%(表2)。OTU聚类分析结果采用花瓣图展示(图2),结果显示四组共有的OTU为106个,IZ12S组特有的OTU数量最多达163个,IZ18S、IZ24S和IZ30S组特有的OTU数量较少,分别为32、54和34个。可见低盐(12)下湛江等鞭金藻藻际菌群丰富度较高,中高盐度(18、24和30)下湛江等鞭金藻藻际菌群丰富度较低。
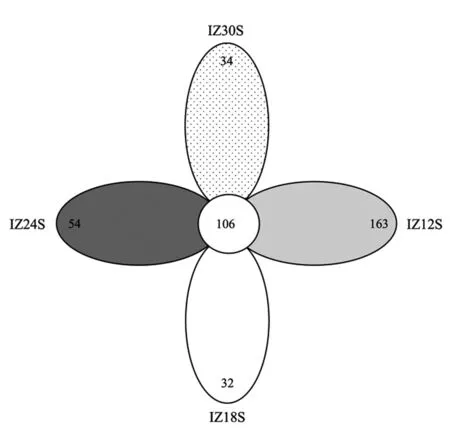
图2 各组样品获得的OTU数量花瓣图Fig.2 Flower diagram of OTU amount obtained in each group
2.3.2 Alpha多样性分析 Chao1指数和ACE指数反映了各组组内菌群的丰富度。如表2所示,IZ12S组Chao1指数和ACE指数均显著高于其他三组,即菌群丰富度最高;而IZ18S、IZ24S和IZ30S之间无显著差异,且菌群丰富度较低。Shannon指数不仅反映菌群丰富度,还可表征菌群均匀度,用于综合分析各组内菌群多样性。由Shannon指数可知,IZ12S组内菌群多样性最高,显著高于其他组;IZ18S、IZ24S和IZ30S组之间无显著差异,且多样性低。综上,由Alpha多样性分析可知,四组样品在组内菌群多样性比较上可分为2个水平。IZ12S组中菌群的多样性显著高于其他组;IZ18S、IZ24S和IZ30S之间无显著差异,且菌群多样性低。
2.3.3 Beta多样性分析 基于Weighted Unifrac距离对四组样品进行主坐标分析(principal ca-ordinates analysis, PCoA),如图3所示。不同形状的点代表不同组,点与点之间距离越近,表明菌群组成越相似。IZ18S、IZ24S和IZ30S三组样品的代表点相对集中于坐标轴1的正半轴,远离IZ12S组样品的代表点,说明中高盐度(18、24和30)下湛江等鞭金藻的藻际菌群组成较为相似,与低盐(12)条件下藻际菌群组成差异明显。
2.3.4 藻际菌群组成分布情况分析 在门水平上(图4-A),菌群总体主要集中在变形菌门(Proteobacteria)和蓝菌门(Cyanobacteria)。各组中优势菌不同,IZ12S组以变形菌门为优势菌,相对丰度占92.70%;其他三组以蓝菌门为优势菌,其中IZ18S和IZ24S组中以蓝菌门最多,占比近97%,IZ30S组次之,占比93.51%。可见,对湛江等鞭金藻而言,盐度12和盐度≥18是差异明显的生长环境,可使其藻际菌群中的优势菌发生剧烈变化,与Alpha和Beta多样性分析结果吻合。
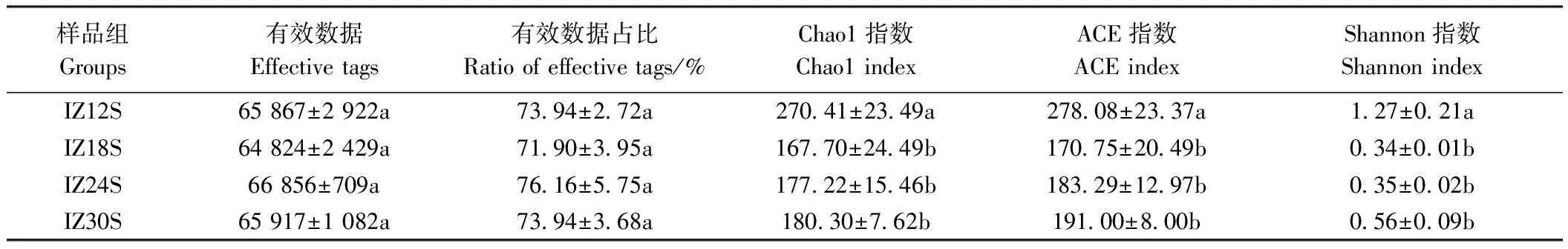
表2 各组样品获得的有效数据及Alpha多样性指数Table 2 Effective tags and Alpha diversity index obtained from each group of samples
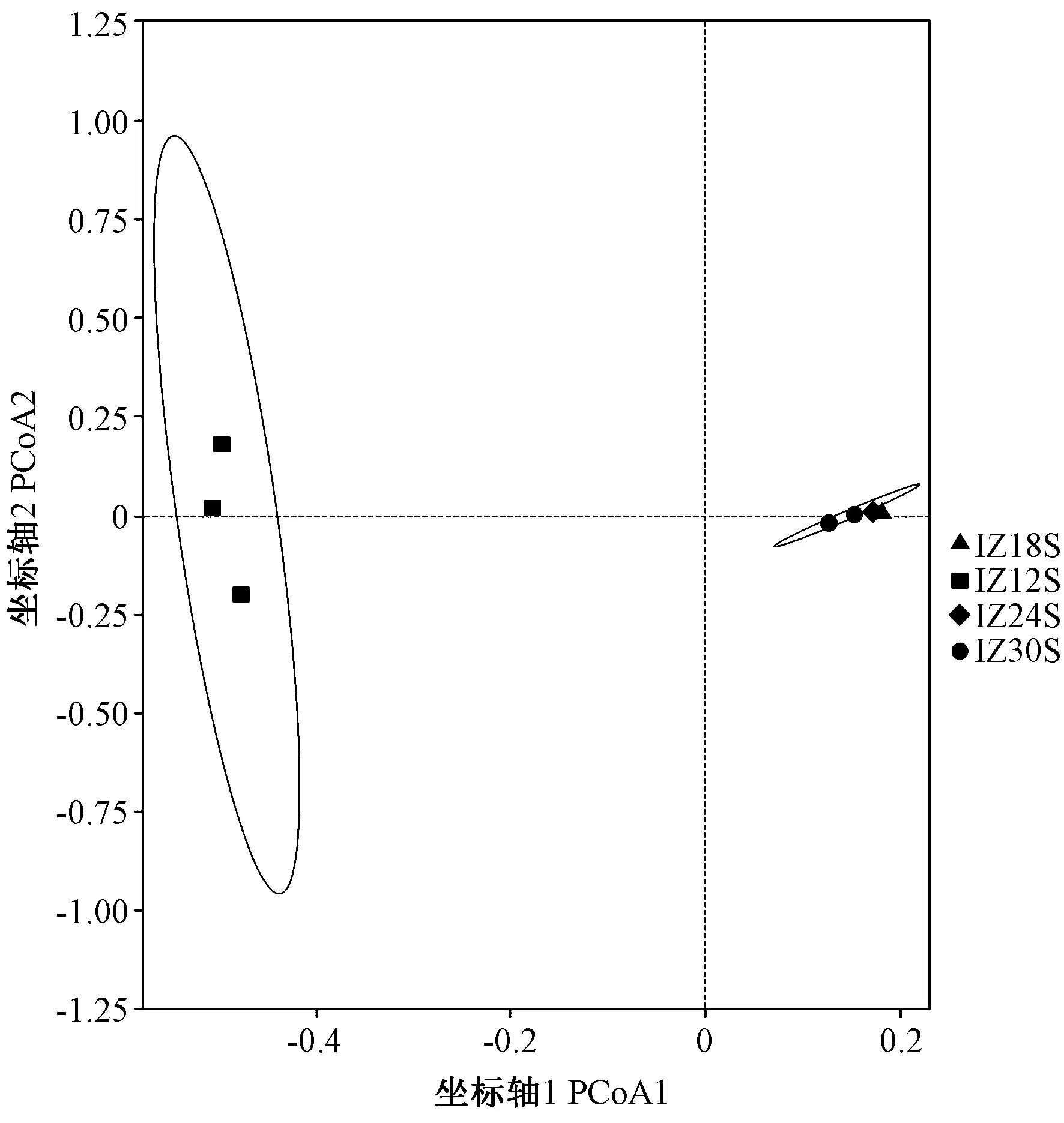
图3 基于Weighted Unifrac距离PCoA分析结果Fig.3 Analysis of PCoA based on Weighted UniFrac distance
在属水平上(图4-B),IZ12S组中相对丰度占比最多的优势菌为短波单胞菌(Brevundimonas),占比54.13%,其次是嗜盐单胞菌(Halomonas),占比36.98%。而IZ18S、IZ24S和IZ30S组因鉴定出来的是未分类的蓝细菌,所以无法进一步确认具体属水平的蓝细菌种类。
3 讨论
适宜的盐度是保证微藻正常生长代谢的前提,盐度过高或过低都会影响其生长[24-26]。同时,在微藻培养过程中,藻细胞本身代谢活动亦会造成水体盐度波动[27]。因此,本试验采用半连续培养方式以维持藻液盐度稳定,结果发现,在盐度12~24环境下,湛江等鞭金藻细胞密度和光合效率高于盐度30组。而从NPQ结果看,盐度12环境下湛江等鞭金藻通过热耗散形式消耗更多光能。综合来看,在盐度18~24环境下湛江等鞭金藻生长优于盐度12和盐度30。蔺红苹等[28]通过批次培养方式探究了湛江等鞭金藻的盐度范围,发现该藻可适应盐度范围为10~30,且最适盐度为23,与本试验结果稍有差异,推测是由藻株不同及培养方式不同导致的。
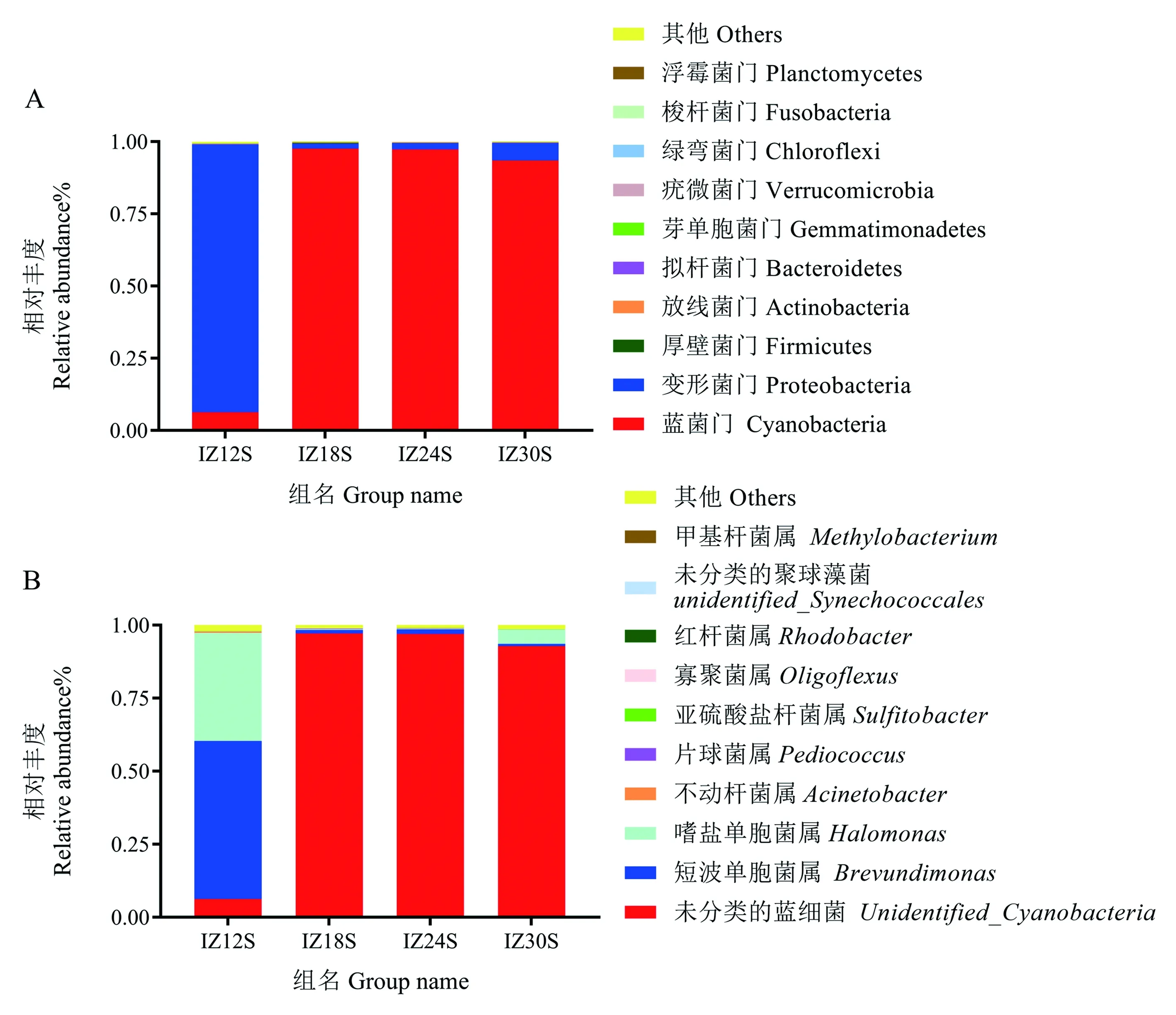
图4 样本在门水平(A)、属水平(B)上的细菌类群相对丰度柱形图Fig.4 The relative abundance of bacterial community in each sample at phylum (A) and genus (B)
一定范围内盐度的改变不仅影响微藻生长,还会影响其多种营养物质的积累。Haris等[29]研究表明,在盐度10~40范围内,盐度改变会造成球等鞭金藻蛋白质、脂肪酸和碳水化合物含量发生显著变化。在众多营养物质中,脂肪酸尤其是PUFA可提高水产动物存活率、抗氧化能力和免疫功能等,是衡量饵料微藻营养价值的主要指标[30-31]。本试验表明,中低盐度(12、18和24)下湛江等鞭金藻脂肪酸组成无显著差异,盐度30下SFA增加而PUFA降低。据Cepak等[32]报道,在0.2%~0.6% NaCl盐度范围内,随盐度增加,小粗盘藻(Trachydiscusminutus)中SFA增加而PUFA降低,与本研究结果相近。Anitha等[33]研究表明,在高于正常海水盐度下培养杜氏藻(Dunaliellasp.)会显著提高其PUFA含量,与本研究结果相悖。推测是由于不同种类微藻在各自相对高盐的环境下有着不同的脂肪酸积累方式。值得注意的是,总体上,本试验中低盐度(12、18和24)下湛江等鞭金藻细胞密度、叶绿素荧光参数和脂肪酸组成均较为接近,而盐度30下与其他三组差异显著,可见脂肪酸组成的变化是湛江等鞭金藻响应不适环境变化的方式之一。类似现象在前人研究中已有多次报道,如Pugkaew等[34]研究发现,盐度30和60下瑞典四爿藻(Tetraselmissuecica)脂肪酸组成无显著差异,且细胞生长状态均保持良好;Arora等[35]也发现,在试验设定的3种盐度(8.75、17.5和35 g·L-1NaCl)下,栅藻(Scenedesmussp.)保持了相近的生长状态和脂肪酸组成;而盐生杜氏藻(Dunaliellasalina)和普通小球藻(Chlorellavulgaris)在受到盐度胁迫后,其脂肪酸组成显著改变[36]。此外,除繁殖速度快以外,优质的营养组成也是衡量微藻饵料价值的重要标准之一。众所周知,PUFA是饵料微藻重要营养组成之一。本研究中,综合生长和脂肪酸组成,盐度18和24组是湛江等鞭金藻生长较好且PUFA占比最高的两组,故盐度18~24是该藻较为理想的培养盐度选择。
近年来,藻际菌群对微藻的影响逐渐引起研究者们的关注,但相关研究多集中在藻际菌群对微藻生长[37]、特定代谢产物生产[38]及藻菌共生体净化环境的潜力[39]等方面。而环境因子对微藻藻际菌群组成影响的研究相对较少,仅涉及温度和氮磷浓度等[17,40]。盐度对微藻藻际菌群组成影响的研究报道较少。本试验首次探索了不同盐度下湛江等鞭金藻的藻际菌群,发现盐度12下湛江等鞭金藻藻际菌群中优势菌为变形菌门,而其他三组中藻际优势菌为蓝菌门,即盐度变化会造成其藻际菌群中优势菌的剧烈变化。
前人研究已知,变形菌门是金藻中常见的藻际细菌[17,41]。本研究发现,盐度12组中的变形菌门具体到属水平上主要为短波单胞菌,而关于短波单胞菌对微藻影响的研究已有较多报道。Park等[42]从椭圆小球藻(Chlorellaellipsoidea)中分离得到短波单胞菌,两者共培养后藻和菌的生长都得到了促进。Lakatos等[43]也报道从衣藻(Chlamydomonassp.)中分离出了短波单胞菌,且共培后可促进衣藻产氢,说明短波单胞菌有益于微藻生长。另外,Kang等[44]研究表明短波单胞菌适于低盐乃至淡水环境。由此推测,在本试验所设4个盐度组中,盐度12更利于短波单胞菌生存,故该盐度下湛江等鞭金藻藻际细菌中短波单胞菌占比最大,而在另外三组中占比较少。而湛江等鞭金藻作为一种海水藻在盐度12下取得了与盐度24下相近的细胞密度,推测部分原因是短波单胞菌对该藻生长的促进作用。
蓝细菌种类繁多,有淡水菌、中度耐盐菌和嗜盐菌等[45]。湛江等鞭金藻是海水藻,长期以来与之共存的蓝细菌所偏好的盐度应接近海水盐度,而盐度12不利于这些种类的蓝细菌生存,故IZ12S组中蓝细菌最少。蓝细菌具有叶绿素a,能进行光合作用,同时存在相当一部分固氮蓝细菌能通过固氮作用将分子氮转化为植物能利用的氮素,进而促进植物生长[46]。充足的氮源同样是藻类生长的必需要素之一[11]。本研究中湛江等鞭金藻在IZ18S和IZ24S组中蓝细菌占比最高,可能是这两组藻细胞生长状况良好的原因之一。另外,有研究表明,蓝细菌在高盐环境下可产生一系列胞内相容性物质(蔗糖、海藻糖、脯氨酸等)和胞外多糖(葡萄糖、甘露糖、半乳糖等)以应对高盐环境[47-49]。因此,本试验盐度30下湛江等鞭金藻藻际菌群中蓝细菌仍有很大占比。但是IZ30S组生长状况仍不及IZ18S和IZ24S组,可见蓝细菌对藻细胞产生的积极作用尚不能抵消盐度本身给湛江等鞭金藻带来的伤害。此外,在属水平上鉴定出的蓝细菌都处于未分类状态,故本试验暂不能明确上述蓝细菌的种名,可在后续研究中进一步探索。
4 结论
本试验探索了不同盐度对湛江等鞭金藻生长、脂肪酸组成和藻际菌群组成的影响。结果表明,在试验所设4个盐度组中,最利于湛江等鞭金藻生长和PUFA积累的盐度范围为18~24。中低盐度(12、18和24)下湛江等鞭金藻的脂肪酸组成无显著变化,盐度30下细胞密度显著降低,且SFA含量升高,PUFA含量降低。盐度12下湛江等鞭金藻藻际菌群的优势菌为变形菌门短波单胞菌属,盐度18、24和30下则为蓝菌门,即盐度12和≥18对其是差异较大的生活环境,会造成藻际菌群中优势菌的剧烈变化。

