HP相关性慢性非萎缩性胃炎PG、G-17的表达及临床意义
游天丽
(广州市番禺区中心医院全科医学科 广东 广州 511400)
慢性非萎缩性胃炎是指不伴有胃黏膜萎缩,胃黏膜以淋巴和浆细胞浸润为主的胃炎,胃镜下可见到胃粘膜粗糙不平、水肿、渗出、红斑或有出血点等[1]。HP为革兰阴性菌,是导致慢性胃炎最主要病因,可使胃黏膜发生炎症、萎缩、肠化生、异型增生甚至癌变[2]。PG、PG-17主要由胃黏膜分泌,胃病的不同阶段,其水平会相应改变,是反映胃黏膜功能状态的可靠指标[3]。本研究探讨HP对慢性非萎缩性胃炎PGI、PGII、PGR及G-17表达的影响及PG、G-17在预测感染HP的诊断价值。
1 资料与方法
1.1一般资料
选取2019年6月—2021年12月番禺中心医院经胃镜诊断为慢性非萎缩性胃炎,诊断标准参考第7版内科学[1],行14C呼气试验108例患者,根据是否感染HP分为两组,HP+组(54例),年龄52.83±11.21岁,男22例,女32例,HP-组(54例),年龄50.17±11.5岁,男23例,女31例。两组的年龄、性别一般资料比较,无统计学差异(p>0.05),具有可比性。纳入标准:18岁《年龄《75岁;胃镜诊断慢性非萎缩性胃炎。排除标准:近1月服用抗酸药物;严重心肺、肝肾等疾病;有胃肠手术病史;精神异常者。入组者均已签署行胃镜同意书。
1.2方法
患者均空腹8h后抽取4ml静脉血行PGI、PGII、PGR、G-17检测,采用酶联免疫吸附法;Hp 检测采用 14C呼气试验。胃镜由经验丰富的内镜医生执行。
1.3 观察指标
对比H+与H-两组PGI、PGII、PGR及G-17表达水平。
1.4统计学分析

2 结果
2.1 两组PGⅠ、PGⅡ、PGR、G-17比较
HP+组PGI高于HP-组者,差异无统计学意义(P>0.05),前者PGII、G-17高于后者,差异有统计学意义(P<0.05);HP+组PGR低于HP-组,差异无统计学意义(P>0.05),见表1。
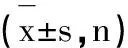
表1 两组PGⅠ、PGⅡ、PGR、G-17比较
2.2 PGII、G-17预测HP感染的价值
PGII、G17诊断感染HP的AUC分别为0.712、0.776。PGII取截断值8.85ug/L,其诊断HP感染的敏感性、特异性分别为81.8%、65.9%;G-17取截断值2.86pmol/L,其诊断HP感染的敏感性、特异性分别为83.5%、70.1%。见表2、图1。
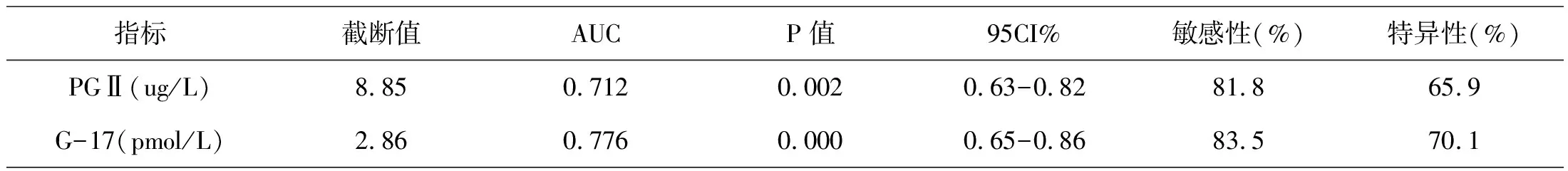
表2 PGⅡ、G-17在HP感染诊断中的价值
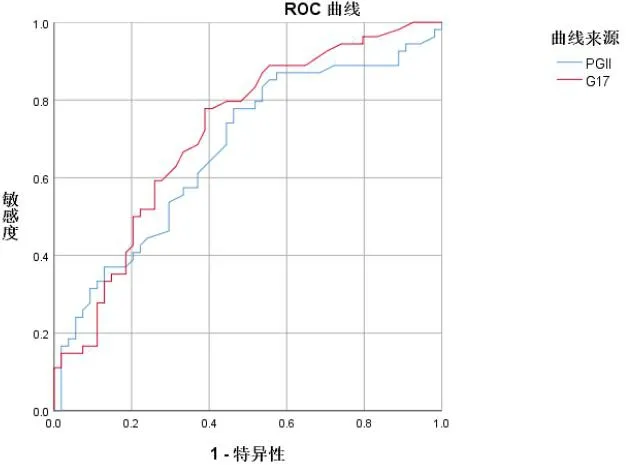
图1 PGⅡ、G-17在HP感染诊断中的ROC曲线
3 讨论
HP主要通过粪-口和口-口等途径在人群中广泛传播,全球HP的感染率约为50%。正常情况下,胃内因胃酸和消化酶的存在,不利于细菌的生存。但对无菌猪的实验表明,HP可通过产生脲酶及其功能性鞭毛定植在胃粘膜中[4]。PG分为PGI和PGII,它们分别反映了胃底黏膜和全胃黏膜的分泌功能。G-17则是反映胃窦分泌功能的敏感指标[5]。
本研究表明,在慢性非萎缩性胃炎患者中,HP感染会导致PGⅠ、PGⅡ、G-17升高,特别是PGⅡ、G-17升高更明显,PGR下降。PGⅡ、G-17对预测HP感染有重要临床价值。HP造成胃黏膜损伤的机制是通过其分解酶类、尿素产氮、细胞毒素、菌体蛋白等多种途径造成NH3增多,NH3与H+结合形成的NH4+导致胃黏膜上皮细胞损伤[6]。动物实验显示,HP主要定值在胃窦及胃体部位,引起淋巴细胞及中性粒细胞浸润聚集,促进胃炎的发生,在Hp存在局部炎症更加明显[7]。HP除了可直接刺激胃黏膜细胞分泌PG、G-17,还可通过产生的NH4+破坏胃内高酸微环境,反馈性刺激细胞大量分泌G-17;G-17又可刺激主细胞分泌胃蛋白酶原,特别是以分泌PGII为主[8]。黄妙灵[9]等发现在Hp+组胃炎中,慢性炎症反应以中度、重度为主;Hp-组则以轻、中度炎症为主;表明Hp+组慢性炎症程度较 Hp-组严重。研究人员在流行病学调查中发现,HP+较HP-胃炎患者的PGⅠ、PGⅡ、G-17升高,特别是PG II及G-17比PG I有更大的升幅,PGR则下降,根除HP后,HP+患者PGⅠ、PGⅡ、G-17水平下降,PGR升高,结果变得与HP-患者的水平相似,胃粘膜炎症减轻[10]。
综上所述,HP感染加重胃黏膜炎症,PG、G-17水平可反映胃部炎症程度。PGⅡ、G-17可作为慢性非萎缩性胃炎HP感染的辅助诊断指标。