糖耐量减低人群、2型糖尿病患者胰腺DCE-MRI定量分析与胰腺微循环的相关性研究
王 亮,张晓琴*,包智华,李 元
(1.内蒙古自治区人民医院影像医学科,内蒙古 呼和浩特 010017;2.内蒙古自治区国际蒙医医院西医内分泌科)
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种进行性胰岛β细胞功能障碍及持续性胰岛素抵抗的代谢性疾病[1]。国际糖尿病联盟2019年数据显示[2],我国2型糖尿病患病率居世界首位。胰腺微循环的稳定是胰岛β细胞生长、发育的重要前提,胰腺微循环障碍也是糖尿病发生的重要病理生理基础。DCE-MRI作为一种功能成像技术,目前在胰腺移植术后的评估、胰腺炎微循环及胰腺肿瘤的应用研究[3~5]等方面体现出重要的临床应用价值。然而,目前少见将其应用在评估T2DM和IGT人群的胰腺微循环方面。为探究T2DM发病前后胰腺微循环的变化情况,本研究利用DCE-MRI对正常成人、IGT人群和T2DM患者胰腺微循环进行定量分析,比较其参数Ktrans、Ve和Vp,旨在从T2DM的发生、发展机制方面提供一定的影像学依据。
1 材料与方法
1.1 研究对象
选取2017-08~2019-12在内蒙古自治区人民医院行胰腺DEC-MRI检查的IGT人群30例作为IGT组,男性、女性各15例;年龄45~57岁,平均年龄(51.9±4.6)岁。T2DM组30例,病程<10年15例,男性8名,女性7例;年龄51~72岁,平均年龄(61.9±8.9)岁。病程≥10年15例,男性9例,女性6例;年龄53~71岁,平均年龄(62.8±7.6)岁。选择30名健康志愿者作为正常对照组,男性、女性各15例;年龄38~52岁,平均年龄(45.8±5.5)岁。所有受试者均签署知情同意书,并由内蒙古自治区人民医院伦理委员会批准。入组标准:对照组为空腹血糖<6.1 mmol/L,餐后2 h血糖<7.8 mmol/L。依据1999年WHO制订的IGT诊断标准[6]:IGT组空腹血糖<7.0 mmol/L,并且口服75 g葡萄糖耐量试验2 h血糖≥7.8 mmol/L而<11.1 mmol/L。T2DM组:(1)糖尿病症状+任意时间血糖水平≥11.1 mmol/L;(2)空腹血糖水平≥7.0 mmol/L;(3)口服75 g葡萄糖耐量试验2 h血浆葡萄糖水平≥11.1 mmol/L,符合其中1项并排除基础血糖≥12.0 mmol/L。排除标准:(1)其他任何类型糖尿病;(2)胰腺脂肪浸润显著,或有慢性胰腺炎等病史者;(3)MRI和对比剂禁忌症者。
1.2 MRI检查及相关参数
采用3.0T MRI扫描仪(Discovery 750,GE公司生产)和体部专用线圈。常规扫描:T2WI脂肪抑制序列横轴位:TR 6667 ms,TE 81 ms,激励次数(NEX)2.0,层厚6 mm,层间距1 mm,矩阵256×192,视野(FOV)360 mm×280 mm。T1WI:TR 4.0 ms,TE 1.2 ms,层厚4 mm,矩阵256×192,FOV 360 mm×280 mm。正反相位:TR 3.8 ms,TE 2.2 ms,NEX 1.0,层厚4 mm,层间距1 mm,矩阵256×192,FOV 360 mm×280 mm。
动态增强采用横轴位T1WI-LAVA序列,扫描参数为:TR 3.3 ms,TE 1.6 ms,层厚6 mm,矩阵256×192,FOV 360 mm×280 mm。通过高压注射器于一侧肘静脉注入对比剂欧乃影(GE Healthcare Ireland生产),流率为2 mL/s,剂量0.2 mmol/kg,扫描时相共40期,单期扫描时间8 s,总用时320 s。最后静脉团注20 mL生理盐水,流率2 mL/s。
1.3 数据处理及分析
将DCE-MRI检查图像传送至工作站Omni-Kinetics软件(GE healthcare,China)进行图像后处理。由两名放射科高级医师在DCE-MRI图像中选取胰腺作为感兴趣区(RIO),每个病例需选取胰腺显示最完整层面以及上下各一层面,该区域尽可能避开脂肪浸润区、大血管等。每个病例测量3次取平均值。通过图像自动校准后,运用Extended Tofts线性模型及动脉输入函数(AIF),获取定量参数伪彩图(见图1~3)及定量参数:Ktrans、Ve、Vp。
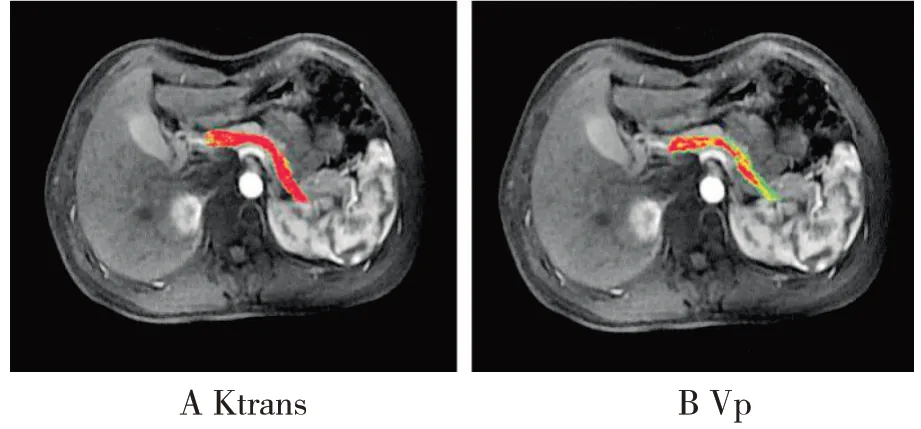
图1 正常男性,51岁,Ktrans=0.839min-1、Vp=0.085

图2 男性,55岁,IGT,Ktrans=1.126min-1、Vp=0.063
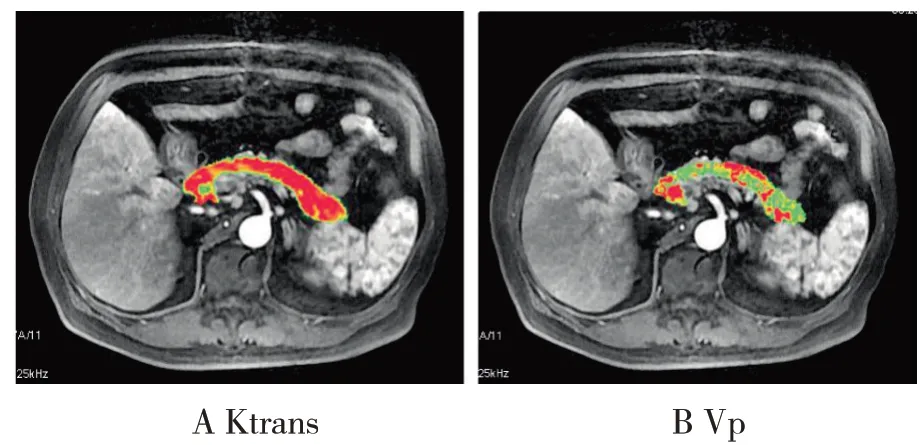
图3 男性,62岁,T2DM,Ktrans=1.245min-1、Vp=0.063
1.4 统计学方法
采用SPSS 24.0进行统计学分析。依方差齐性的不同,假设检验采用方差分析或秩和检验。病程<10年及病程≥10年T2DM患者两组资料,采用两独立样本t检验,依据方差齐性选择t或t'检验。对于差异有统计学意义的因素进行Logistic回归分析,绘制ROC曲线、计算相关参数。检验水准为α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 T2DM患者、IGT人群胰腺微循环定量参数比较
T2DM组及IGT组DCE-MRI定量参数Ktrans高于对照组、Vp低于对照组,差异有统计学意义(P<0.05);Ve值高于对照组,差异无统计学意义(P>0.05)(见表1)。
表1 T2DM、IGT组胰腺微循环定量参数比较()
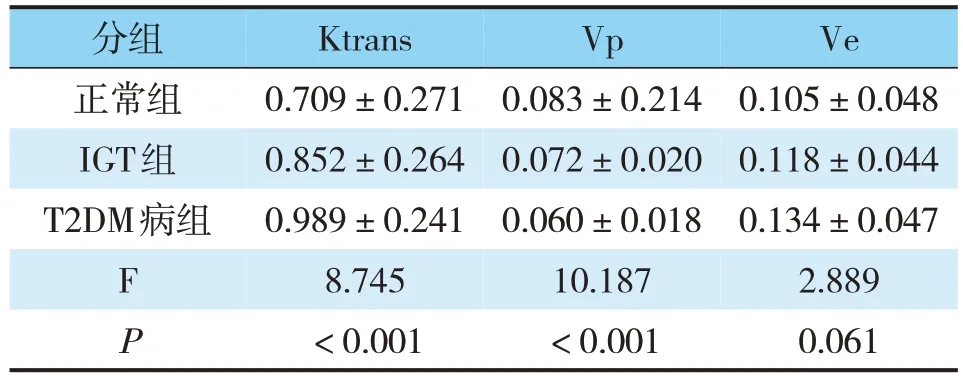
表1 T2DM、IGT组胰腺微循环定量参数比较()
分组正常组IGT组T2DM病组FP Ktrans 0.709±0.271 0.852±0.264 0.989±0.241 8.745<0.001 Vp 0.083±0.214 0.072±0.020 0.060±0.018 10.187<0.001 Ve 0.105±0.048 0.118±0.044 0.134±0.047 2.889 0.061
两组间比较,Ktrans和Vp的差异有统计学意义(P<0.05)。对两组值进一步LSD检验:Ktrans在对照组与IGT组与之间存在差异(P<0.05),在IGT组与T2DM组之间存在差异(P<0.05);Vp在对照组与IGT组之间存在差异(P<0.05),在IGT组与T2DM组之间存在差异(P<0.05)。
2.2 不同病程T2DM患者胰腺微循环定量参数比较
30例T2DM患者中,病程≥10年者的Ktrans及Ve值较病程<10年者增高,差异有统计学意义(P<0.05)。病程≥10年者的Vp值较病程<10年者降低,差异无统计学意义(P>0.05)(见表2)。
表2 不同病程糖尿病患者胰腺微循环定量参数比较()
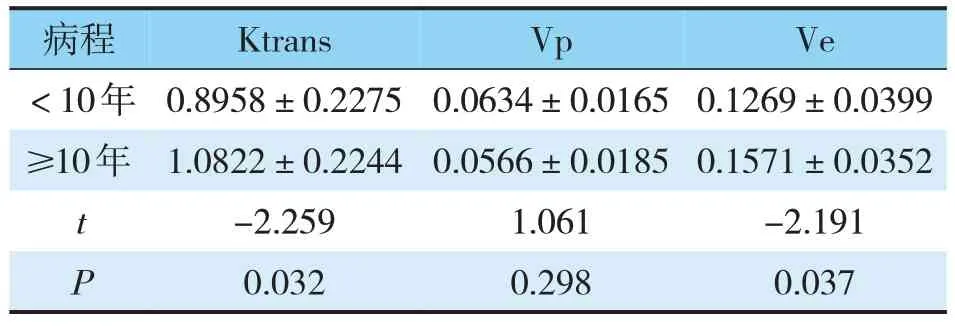
表2 不同病程糖尿病患者胰腺微循环定量参数比较()
病程<10年≥10年tP Ktrans 0.8958±0.2275 1.0822±0.2244-2.259 0.032 Vp 0.0634±0.0165 0.0566±0.0185 1.061 0.298 Ve 0.1269±0.0399 0.1571±0.0352-2.191 0.037
2.3 IGT人群微循环定量参数Logistic回归分析
将Ktrans、Vp数值进行Logistic回归分析,绘制ROC曲线(见表3)。结果显示,当Ktrans>1.133时,其对于IGT的发生预测价值最高,敏感度和特异度分别为30%、100%,ROC曲线下面积(AUC)为0.652,95%CI:0.514~0.791(P<0.05)(见图4)。
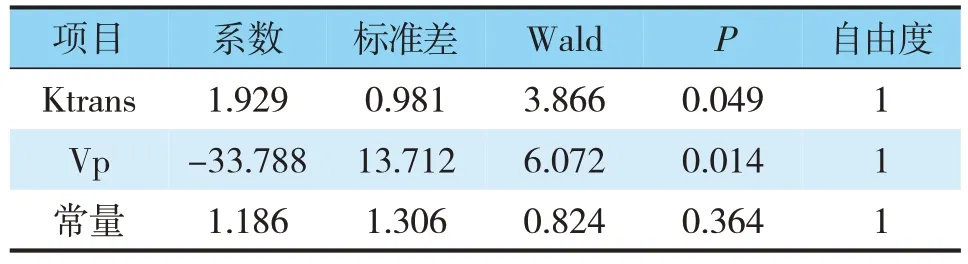
表3 DCE-MRI定量参数Ktrans和Vp回归分析
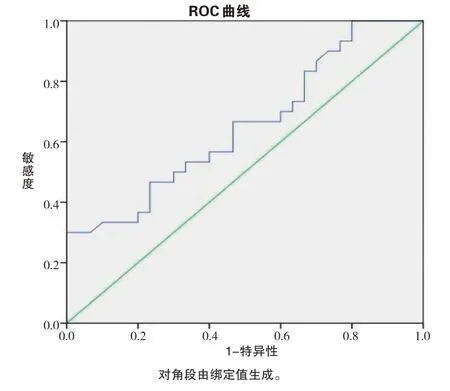
图4 胰腺DCE-MRI定量参数Ktrans预测IGT价值的评估
通过ROC曲线计算Vp值对IGT诊断临界值显示:Vp<0.098对IGT发生预测价值最高,敏感度和特异度分别为96.7%、36.7%,ROC曲线下面积(AUC)为0.682,95%CI:0.547~0.817(P<0.05)(见图5)。

图5 胰腺DCE-MRI定量参数Vp的预测IGT价值的评估
通过Logistic回归表达式:y=1.186+1.929Ktrans-33.788Vp,绘制ROC曲线(见图6)。ROC曲线下面积(AUC)为0.719,95%CI:0.591~0.847(P<0.05)。从而提示DCE-MRI定量参数Ktrans和Vp值对IGT有较好的预测及诊断价值。
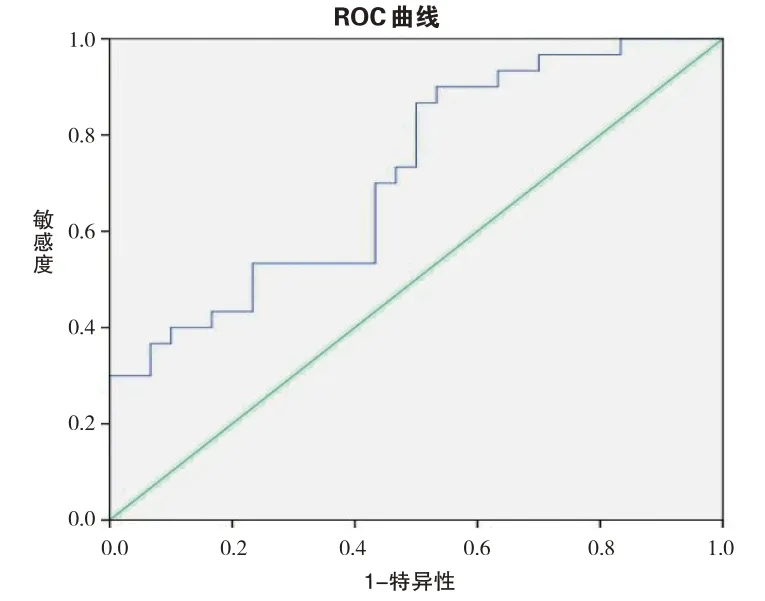
图6 胰腺DCE-MRI定量参数Ktrans、VP联合预测IGT价值的评估
3 讨论
3.1 T2DM、IGT胰腺微循环定量参数差异性分析
胰腺微循环系统的稳定可有效地维持胰岛细胞功能,且具有调控胰岛β细胞功能,继而减少血糖波动的作用[7]。当各种原因导致胰腺微循环发生障碍,会在很大程度上影响胰岛细胞分泌,胰岛素和胰高血糖素之间的平衡状态被打破,继而引起血糖升高最终发展为T2DM。因此,胰腺微循环的稳定在T2DM发生发展中起到了至关重要的作用。本研究中,反映胰腺微循环的DCE-MRI定量参数值Ktrans,T2DM组及IGT组较正常对照组增高,Vp值减低,而Ve值较正常对照组增高,与Yu等[8]研究结果基本一致。Ktrans代表对比剂从血管内渗漏到血管外细胞外间隙(extravascular extracellular space,EES)的运转常数,其反映血管内皮的通透性。由此表明,IGT人群和T2DM患者胰腺血管内皮通透性增加,血浆容积减低,这一结果也得到了以往一些国内外文献的支持。研究发现,T2DM患者随着糖化血红蛋白(glycosylated hemoglobin Al,HbA1c)浓度的增加,血管的内皮依赖性舒张功能随之下降,最终导致血管内皮不同程度的损伤[9,10]。由此推断,在T2DM发生发展中,血管内皮受损、通透性增加起到了至关重要的作用。
本研究结果显示,代表组织中血浆体积百分比的DCE-MRI定量参数Vp,T2DM组显著减低。动物模型中研究发现[11],长期高血糖状态下,胰岛的血流灌注明显减低;另外组织学研究结果发现,糖尿病大鼠的胰岛毛细血管网较对照组稀疏[12]。因此,糖尿病胰岛毛细血管网和血浆容积的减少这种情况可能也存在于人类当中。研究发现,T2DM前期即IGT阶段,胰岛就已经出现不同程度的功能障碍,胰岛微循环表现为高灌注,以代偿增加胰岛功能[13]。也由此推测,长期的胰岛高灌注状态,可能会引起胰岛微血管压力的增加,进而导致胰岛内皮细胞受损。本研究结果也表明,IGT组Ktrans值高于对照组,Vp值低于对照组,差异有统计学意义。因此可以推断,在T2DM前期即IGT阶段,胰岛内皮受损、血管通透性增加、毛细血管网以及血浆容积比减少的情况就已经出现,只是程度不同而已。因此提示临床可以尝试从改善胰岛内皮受损情况、胰腺微循环等方面采取一定的措施,从而延缓T2DM发展的进程。
3.2 不同病程T2DM患者Ktrans、Ve和Vp值差异性分析
本研究结果显示,T2DM患者病程≥10年者的Ktrans及Ve值高于病程<10年者。结果提示,尽管T2DM患者口服降糖药物或胰岛素进行治疗,胰岛内皮受损的情况并没有得到很好的改善,并且依旧可能会逐渐进展。此外T2DM患者血糖升高会激活蛋白激酶C(protein kinase C,PKC),进而导致一系列微血管病变,包括血管内皮损伤、内皮细胞通透性增加等。Ruboxistaurin(LY333531)是目前发现的唯一的蛋白激酶C-β抑制剂,在预防T2DM微血管病变中起到了良好的效果[14]。综上所述,DCE-MRI定量分析在评估和监测新药物治疗T2DM方面可能有一定的潜在价值。
3.3 IGT人群各定量参数值敏感性及特异性分析
本研究结果表明,在糖尿病前期(即IGT阶段),当Ktrans值>1.133、Vp值<0.098时,其对于诊断IGT的发生预测价值最高,特异度和敏感度也是最高的。由此提示临床,可以以此为节点,利用DCEMRI对胰岛细胞功能受损情况进行动态监测,从而采取一些有效的措施,来延缓IGT向T2DM发展的进程。
综上所述,在IGT人群、T2DM患者和正常成人之间,以DCE-MRI为基础,获得的胰腺定量参数Ktrans、Ve和Vp值具有较明显的差异性。这可以帮助我们了解T2DM、IGT阶段胰腺微循环变化情况,不仅可以评估治疗前胰岛细胞功能受损情况,而且能够动态随访治疗后胰岛细胞功能的变化。对于临床制订T2DM更合理的治疗方案、监测疗效及评估预后具有一定的指导意义。

