自身抗体水平与类风湿性关节炎患者机体炎症反应及骨关节损伤程度的相关性
李光军
湖北省襄阳市襄州区人民医院检验科 (湖北襄阳 441100)
类风湿性关节炎(rheumatoid arthritis,RA)是一种临床常见的以持续滑膜炎、全身性炎症反应和血清中可检测出多种自身抗体为特征的自身免疫性疾病,主要累及双手和双足等小关节[1]。RA 的临床表现为不可逆的骨与关节损伤,严重时甚至会出现关节和功能永久性的破坏和丧失。目前,临床尚不明确RA 的发病机制,早期诊断、早期评估关节损伤程度及尽早治疗是临床关注的重点[2]。不同于其他关节炎症性疾病,RA 的重要标志是检测出自身抗体,其中受关注较多的两类抗体为抗Sa 抗体和抗环瓜氨酸肽抗体(anti-cyclic citrullinated peptide antibody,抗CCP 抗体)。有研究指出,抗Sa 抗体和抗CCP 抗体诊断RA 的特异度高达96%以上,利于帮助对RA 患者进行早期干预,且患者自身抗体的出现早于临床症状的出现,可在临床前阶段检测到,从而延缓和减轻关节损伤,改善患者预后[3-4]。近年来,有研究发现,RA 患者中存在一种新的自身抗体——抗氨甲酰化蛋白抗体(anticarbamylated protein antibody,抗CarP 抗 体),在抗Sa 抗体、抗CCP 抗体阴性的RA 患者的血清中,该抗体也可被检测到[5]。本研究主要通过比较RA患者与健康体检者的血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体、常规实验室炎症活动指标及骨关节损伤程度相关指标水平,分析自身抗体水平与RA患者机体炎症反应及骨关节损伤程度的相关性,从而为临床早期诊断和治疗提供依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年2月至2020年12月在我院接受治疗的137例RA 患者作为试验组,患者均符合美国风湿病学会或欧洲抗风湿病联盟的分类/诊断标准[6],排除患有甲状腺和甲状旁腺疾病及其他自身免疫性疾病、合并严重肾功能损伤和感染与发热以及长期应用雄激素、雌激素、抗凝剂及其他影响骨代谢药物的患者,其中男27例,女110例;年龄18~76岁,平均(49.07±11.59)岁;体质量指数18.2~31.6 kg/m2, 平 均(23.97±3.10)kg/m2; 病程2~13年,平均(6.02±1.97)年;活动期105例,稳定期32例。另选取同期120名健康体检者作为对照组,其中男24名,女96名;年龄17~78岁,平均(50.04±13.20)岁;体质量指数17.9~32.1 kg/m2,平均(24.05±3.09)kg/m2。两组性别、年龄、体质量指数等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核通过,参与的研究对象均知情并签署知情同意书。
1.2 方法
1.2.1 自身抗体水平检测
采集两组清晨空腹肘静脉血,以3 500 r/min 离心15 min 分离血清,将其置于-80 ℃冰箱中保存,采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)法测定血清抗Sa 抗体和抗CarP 抗体水平,试剂盒购自赛默飞世尔科技(中国)有限公司;采用化学发光法测定血清抗CCP 抗体水平,应用罗氏诊断有限公司的Cobas e601电化学发光分析仪及配套试剂检测;所有操作均严格按照试剂盒说明书进行。
1.2.2 实验室炎症活动指标水平检测
应用与“1.2.1”相同的方法采集和处理两组的血液标本,取得血清,采用ELISA 法测定血清C反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白 细 胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)水平,试剂盒购自上海贝西生物技术有限公司;采用ELISA 法测定血清类风湿因子(rheumatoid factor,RF)水平,应用西门子医学诊断产品有限公司的BN Ⅱ特定蛋白分析仪及配套试剂检测;所有操作均严格按照试剂盒说明书进行。关于红细胞沉降率(erythrocyte sedimentation rate,ESR),采用抗凝全血进行检测,方法为魏式法,检测仪器为北京海富达科技有限公司生产的BD Sedi-15自动血沉仪,即静脉采血后取下针头,加血1.8 ml 与0.2 ml 抗凝剂混合,用血沉管吸取混匀血液至“0”刻度处,擦拭干净管外附着的血液,在室温中静置1 h,观察血浆高度,以红细胞下沉的毫米数报告。
1.2.3 骨关节损伤程度相关指标水平检测
应用与“1.2.1”相同的方法采集和处理两组的血液标本,取得血清,采用放射免疫法测定血清护骨素(osteoprotegerin,OPG)、基质金属蛋白酶3(matrix metalloproteinase 3,MMP3)、核因子-κB 受体活化因子配体(receptoractivatorof NFκB ligand,RANKL)水平,试剂盒购自武汉默沙克生物科技有限公司,所有操作均严格按照试剂盒说明书进行。
1.3 评价指标
比较两组血清抗Sa 抗体、抗CCP 抗体、抗CarP抗 体、CRP、TNF-α、IL-6、IL-1β、RF、ESR、OPG、MMP3、RANKL 水平,并分析血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体水平与血清CRP、TNF-α、IL-6、IL-1β、RF、ESR、OPG、MMP3、RANKL 水平的相关性。
1.4 统计学处理
采用SPSS 20.0统计软件对数据进行分析。计量资料以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验;计数资料以率表示,采用χ2检验;相关性采用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 自身抗体水平
试验组血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体水平均高于对照组,差异有统计学意义(P<0.05);试验组活动期患者血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体水平均高于稳定期患者,差异有统计学意义(P<0.05),见表1。
表1 两组血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体水平比较(±s)

表1 两组血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体水平比较(±s)
注:与对照组比较,aP<0.05;与稳定期比较,bP<0.05;抗CCP 抗体为抗环瓜氨酸肽抗体,抗CarP 抗体为抗氨甲酰化蛋白抗体
抗CarP 抗体(μg/ml)对照组 120 9.18±2.03 11.92±4.35 1.93±0.27试验组 137 73.70±21.65a 102.84±33.27a 28.62±7.24a活动期 105 113.52±21.49ab 143.41±38.54ab 47.80±12.48ab稳定期 32 57.19±16.42a 89.91±20.80a 20.52±5.69a F 1 361.319 728.511 871.491 P 0.000 0.000 0.000组别 人数 抗Sa 抗体(U/ml)抗CCP 抗体(U/ml)
2.2 实验室炎症活动指标水平
试 验 组 血 清CRP、TNF-α、IL-6、IL-1β、RF、ESR 水平均高于对照组,差异有统计学意义(P<0.05);试验组活动期患者血清CRP、TNF-α、IL-6、IL-1β、RF、ESR 水平均高于稳定期患者,差异有统计学意义(P<0.05),见表2。
表2 两组血清CRP、TNF-α、IL-6、IL-1β、RF、ESR 水平比较(±s)
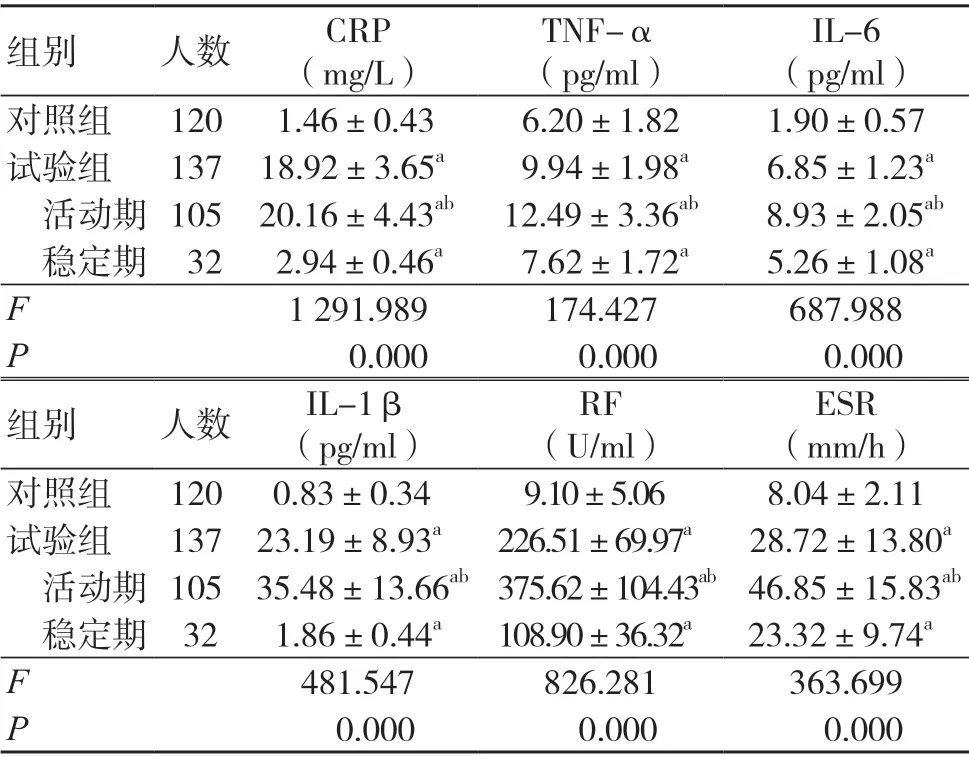
表2 两组血清CRP、TNF-α、IL-6、IL-1β、RF、ESR 水平比较(±s)
注:与对照组比较,aP<0.05;与稳定期比较,bP<0.05;CRP 为C 反应蛋白,TNF-α 为肿瘤坏死因子-α,IL-6 为白细胞介素-6,IL-1β 为白细胞介素-1β,RF 为类风湿因子,ESR为红细胞沉降率
IL-6(pg/ml)对照组 120 1.46±0.43 6.20±1.82 1.90±0.57试验组 137 18.92±3.65a 9.94±1.98a 6.85±1.23a活动期 105 20.16±4.43ab 12.49±3.36ab 8.93±2.05ab稳定期 32 2.94±0.46a 7.62±1.72a 5.26±1.08a F 1 291.989 174.427 687.988 P 0.000 0.000 0.000组别 人数 IL-1β(pg/ml)组别 人数 CRP(mg/L)TNF-α(pg/ml)ESR(mm/h)对照组 120 0.83±0.34 9.10±5.06 8.04±2.11试验组 137 23.19±8.93a 226.51±69.97a 28.72±13.80a活动期 105 35.48±13.66ab 375.62±104.43ab 46.85±15.83ab稳定期 32 1.86±0.44a 108.90±36.32a 23.32±9.74a F 481.547 826.281 363.699 P 0.000 0.000 0.000 RF(U/ml)
2.3 骨关节损伤程度相关指标水平
试验组血清OPG、MMP3、RANKL 水平均高于对照组,差异有统计学意义(P<0.05);试验组活动期患者血清MMP3、RANKL 水平均高于稳定期患者,血清OPG 水平低于稳定期患者,差异有统计学意义(P<0.05),见表3。
表3 两组血清OPG、MMP3、RANKL水平比较(±s)
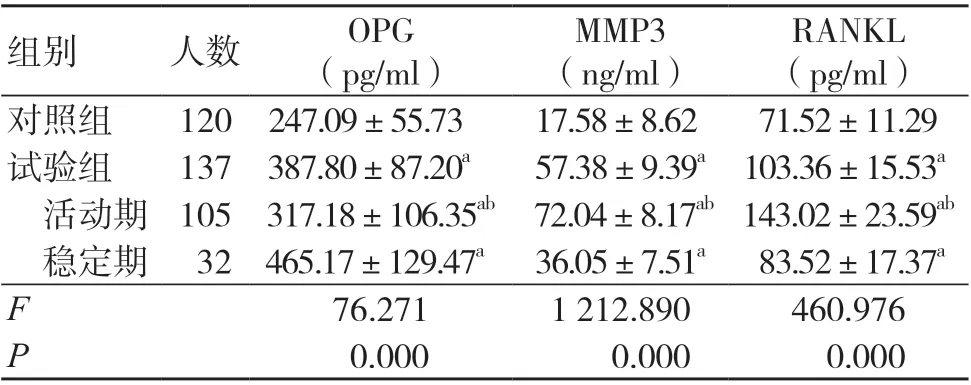
表3 两组血清OPG、MMP3、RANKL水平比较(±s)
注:与对照组比较,aP<0.05;与稳定期比较,bP<0.05;OPG 为护骨素,MMP3 为基质金属蛋白酶3,RANKL 为核因子-κB 受体活化因子配体
MMP3(ng/ml)组别 人数 OPG(pg/ml)RANKL(pg/ml)对照组 120 247.09±55.73 17.58±8.62 71.52±11.29试验组 137 387.80±87.20a 57.38±9.39a 103.36±15.53a活动期 105 317.18±106.35ab 72.04±8.17ab 143.02±23.59ab稳定期 32 465.17±129.47a 36.05±7.51a 83.52±17.37a F 76.271 1 212.890 460.976 P 0.000 0.000 0.000
2.4 相关分析
Pearson相关分析显示,RA 患者血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体水平与血清CRP、TNF-α、IL-6、IL-1β、RF、ESR、MMP3、RANKL水平均成正相关(r>0,P<0.05),与血清OPG 均成负相关(r<0,P<0.05),见表4。
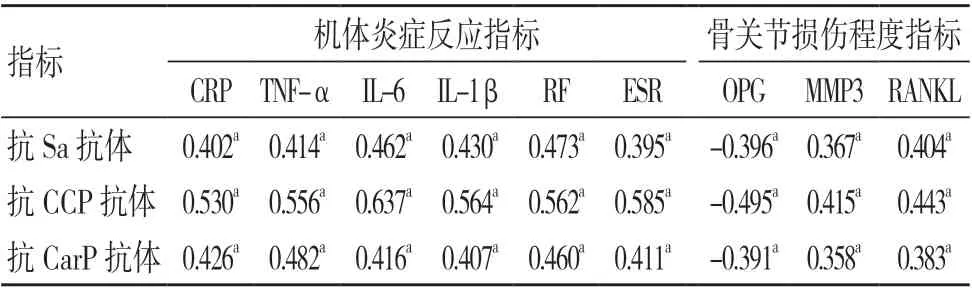
表4 自身抗体水平与机体炎症反应及骨关节损伤程度的相关性(r)
3 讨论
RA 是一种临床常见的自身免疫性疾病,其基本病理改变包括关节滑膜慢性炎症、血管翳形成、骨吸收、骨纤维化、骨破坏等,最终出现关节畸形和功能严重障碍。该病患者早期症状缺乏典型性,诊断多依靠临床表现、影像学检查和自身抗体检测,RF 相对特异度较低,影像学改变出现较晚,因此,自身抗体检测对于RA 的诊断和治疗至关重要。在临床上,很大一部分RA 患者就诊时受损关节已经出现明显的影像学改变,若未尽早发现并给予有效的治疗,病情会逐步进展,从最初的滑膜炎发展为关节不可逆转性损伤,导致患者生命质量下降,甚至终身残疾;另有一部分患者发生其他系统损伤,如肺间质纤维化。有研究指出,RA 患者的关节损伤可能在临床症状出现前即已发生,因此,通过自身抗体检测来尽早识别关节出现不可逆性损伤的患者十分重要[7]。
抗Sa 抗体是于1994年由Despres 等发现的,其诊断RA 的特异度高达95%以上。抗Sa 抗体可出现在RA 早期且提示预后不良[8]。抗CCP 抗体是于2000年由Schellekens 等发现的由19个氨基酸残基组成的肽段合成而成的抗体,以CCP 为抗原基质用化学发光法检测RA 患者血清中的抗CCP 抗体,灵敏度和特异度均较高,可达80%左右[9]。抗CCP 抗体可出现在RA 早期,且其与RA 患者关节影像学改变密切相关,可用于RA 的早期诊断和治疗。国内有学者发现,抗Sa 抗体和抗CCP 抗体均可独立作为判定RA 疾病严重度的血清学指标,且与患者关节损伤严重程度密切相关[10]。近年来,有研究发现了一种新的抗体——抗CarP 抗体,其结构与抗CCP 抗体极为相似,区别是抗CCP 抗体是由精氨酸脱亚胺酶催化精氨酸后转化为肽酰瓜氨酸而产生,属于酶促反应,而抗CarP 抗体的产生是一种化学反应,即赖氨酸在氰酸盐作用下转变为高瓜氨酸,比瓜氨酸多1个甲基,虽然两者结构极为相似,但在抗CCP 阴性的RA 患者血清中可检测到抗CarP 抗体,说明两种抗体不一定存在交叉反应[11]。目前,有关抗CarP 抗体的研究较少,对于该抗体与机体炎症反应和骨关节损伤的关系,临床尚不明确。本研究结果显示,试验组血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体水平均高于对照组(P<0.05);试验组活动期患者血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体水平均高于稳定期患者(P<0.05);提示血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体检测有助于RA 的诊断,可弥补其他手段诊断RA 的不足。
炎症反应是RA 患者核心的病理表现。CRP、TNF-α、IL-6、IL-1β、RF、ESR 均是临床常用的反映RA 患者机体炎症反应和骨破坏的指标[12]。在RA 亚临床阶段,存在于滑膜中的信号传导和效应因子即可产生并促使不断放大的级联反应式的生理病理过程启动和发展,内皮细胞、成纤维细胞、巨噬细胞、血管周围细胞、树突状细胞等多种细胞被激活并参与到炎症反应中,其中,T 淋巴细胞、滑膜成纤维细胞、破骨细胞等在RA 的骨关节破坏中发挥着关键作用。软骨和血管翳交界处大量浸润的滑膜成纤维细胞与软骨边缘骨侵蚀有关,其分泌的MMPs 直接影响骨侵蚀能力,尤其是MMP3;未受到刺激的滑膜成纤维细胞中的MMPs 呈低水平表达,但可被TNF-α、IL-1 等细胞因子介导。巨噬细胞样滑膜细胞可通过共刺激分子和抗原提呈激活T 淋巴细胞,产生促进滑膜成纤维细胞发挥骨破坏作用的TNF-α、IL-1β 等炎症因子;此外,巨噬细胞样滑膜细胞还会产生IL-6、前列腺素等其他炎症因子。在RA 炎症反应中活化的CD4+T 淋巴细胞表达的RANKL 是骨质破坏核心的效应分子;此外,T 淋巴细胞还可协同刺激B 淋巴细胞产生OPG。有研究报道,血清炎症指标及OPG、RANKL 可预测早期RA 患者之后的骨关节破坏[13]。本研究结果显示,试验组血清CRP、TNF-α、IL-6、IL-1β、RF、ESR、OPG、MMP3、RANKL 水平均高于对照组(P<0.05);试验组活动期患者血清CRP、TNF-α、IL-6、IL-1β、RF、ESR、MMP3、RANKL 水平均高于稳定期患者,血清OPG 水平低于稳定期患者(P<0.05);Pearson相关分析显示,RA 患者血清抗Sa 抗体、抗CCP 抗体、抗CarP 抗体水平与血清CRP、TNF-α、IL-6、IL-1β、RF、ESR、MMP3、RANKL水平均成正相关(r>0,P<0.05),与血清OPG 均成负相关(r<0,P<0.05);提示抗Sa 抗体、抗CCP 抗体、抗CarP 抗体可能与RA 发展有关,其血清水平可反映RA 患者机体炎症反应及骨关节损伤程度,且这些抗体的存在还可能与疾病活动度有关。需要注意的是,RA 活动期患者血清OPG 水平低于稳定期患者主要是因为在疾病活动期,IL-6、IL-17 抑制成骨细胞、骨基质细胞分泌OPG,而在疾病稳定期血清OPG 水平表达上升主要与因治疗方法诱导OPG 产生有关。
综上所述,相较于健康体检者,RA 患者的血清抗Sa 抗体、抗CCP 抗体及抗CarP 抗体水平更高,且其水平与RA 患者机体炎症反应及骨关节损伤程度相关,可作为RA 诊断、病情评估及预后判断的重要指标。

