常规超声、超微血管成像联合超声弹性成像技术对乳腺病灶良恶性的诊断效能
刘尔球 刘丽娟 邓益菁 罗劲夫 戴海霞 黄 星 徐晓红
广东医科大学附属医院超声科,广东湛江 524001
世界上每年有超过100 万的乳腺癌确诊患者,死亡人数约60 万[1-2],2020 年我国乳腺癌新发病率全球第一[3],形势严峻。乳腺癌早期表现不典型[4],易出现误诊、漏诊[5],因此手术前准确鉴别乳腺病灶良恶性,是超声医师关注的重点。影像学检查一直是诊断乳腺病灶的重点,超微血管成像(superb microvascular imaging,SMI)是在无造影剂下对微小血管成像的新技术,并根据血流的丰富程度进行精确分级[6-7]。超声弹性成像(ultrasonic elastography,UE)通过对组织挤压时导致应变分布的变化从而对乳腺病灶进行鉴别[8]。经过影像学检查判断患者的乳腺病灶情况,筛选可适用于麦默通微创旋切手术的患者,从而提高乳腺结节患者治愈率[9],其适应证包括超声可见的可疑病灶活检,有手术指征的良性病灶(病灶最大径≤3 cm)切除,新辅助治疗后的疗效判定[10]。尤其对于乳房多发微小病灶,其具有精准、微创、美观、安全等优点,临床应用日益广泛[10-12]。
在鉴别肿块良恶性时,常规超声技术误诊率较高[13]。随着UE 和SMI 技术的发展,联合运用这两种技术能根据肿块性质来鉴别肿块的良恶性。基于此,本研究全面分析乳腺病灶的常规超声征象如形态、回声、彩色多普勒血流成像(color Doppler flow imaging,CDFI)、弹性评分及SMI 等特征,同时评估SMI、弹性评分及常规超声特征在乳腺病灶诊断中的价值。
1 资料与方法
1.1 一般资料
选取2019 年8 月至2021 年6 月广东医科大学附属医院行乳腺超声检查并经病理确诊的301 例女性患者,年龄22~76 岁,平均(42.6±13.7)岁。纳入标准:①年龄>15 岁;②乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)分级为3~4 级;③患者信息及病理检查资料完整。排除标准:①合并其他系统慢性疾病;②存在语义表达不清或沟通不良。
1.2 检查方法
患者取仰卧位,暴露双侧乳腺,使用日本东芝APLIO400、APLIO500 型彩色多普勒超声诊断仪(浅表线阵14L 探头,频率5~14 MHz)进行常规超声检测,观察病灶灰阶和血流情况,利用CDFI 观察病灶血管分布走向,启用SMI 模式观察同一切面下乳腺病灶的血流变化,然后联合UE 技术对病灶良恶性进行评价,UE 技术评分采用改良5 分法弹性评分标准[14]。超声探头适度加压,观察弹性色彩指示条变化,通过病变区内蓝绿红混杂变化来观察乳腺肿物的软硬度。所有检查均由两名超声医师执行,若诊断结论不一致,再由两名高年资医师对超声图像进行分析讨论得出结论。
SMI 检查依据Adler 血流分级标准[15]对病灶的极微小血管进行评估:①病灶内血流分类无血流信号;②病灶内显示少许血流,有1~2 个点状或细棒状血管,血流信号为线型;③病灶内显示中量血流,可见3~4 个点状或1 支长度达到或超过病灶半径的血管,血流信号为树枝型;④病灶内显示大量血流,看到5 个或以上的点状或2 条长度超病灶半径的血管,血流信号为蟹足型。依据《中国抗癌协会乳腺癌诊治指南与规范(2021 年版)》分类标准[16],本研究选择BI-RADS 4B 为诊断恶性病灶截断值,对于术前评估超声报告提示乳腺BI-RADS 3~4 类患者,通过联合SMI 及UE 技术检查综合分析图像,如显示良性则实施麦默通手术切除及送病理检测。
1.3 统计学方法
采用SPSS 20.0 软件进行统计学分析,计量资料用均数±标准差()表示;计数资料用例数或百分率表示,组间比较采用χ2检验;以病理结果为金标准,观察常规超声、SMI、弹性评分乳腺病灶良恶性的诊断效能。以P <0.05 为差异有统计学意义。
2 结果
2.1 301 例患者病理结果
301 例患者中良性病变268 例,恶性病变33 例。良性病变包括纤维腺瘤及纤维腺瘤伴腺病229 例,良性叶状肿瘤5 例,肉芽肿性炎5 例,囊肿6 例,导管内乳头状瘤20 例,其他3 例;恶性病变包括原位癌8 例,浸润性癌等25 例。
2.2 良性病变与恶性病变患者常规超声特征比较
良性病变与恶性病变患者病灶形态(纵横比)、边缘、内部回声、钙化、CDFI、弹性评分及SMI 血流分类比较,差异有统计学意义(P <0.05)。见表1。相关超声图像及病理结果见图1~3。
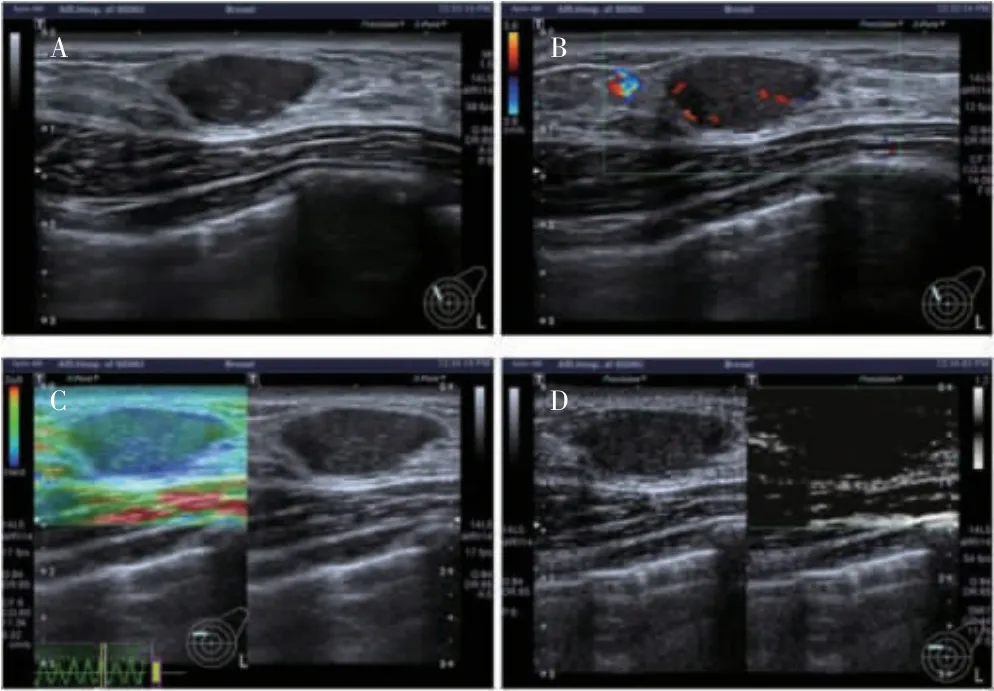
图1 纤维腺瘤超声图像
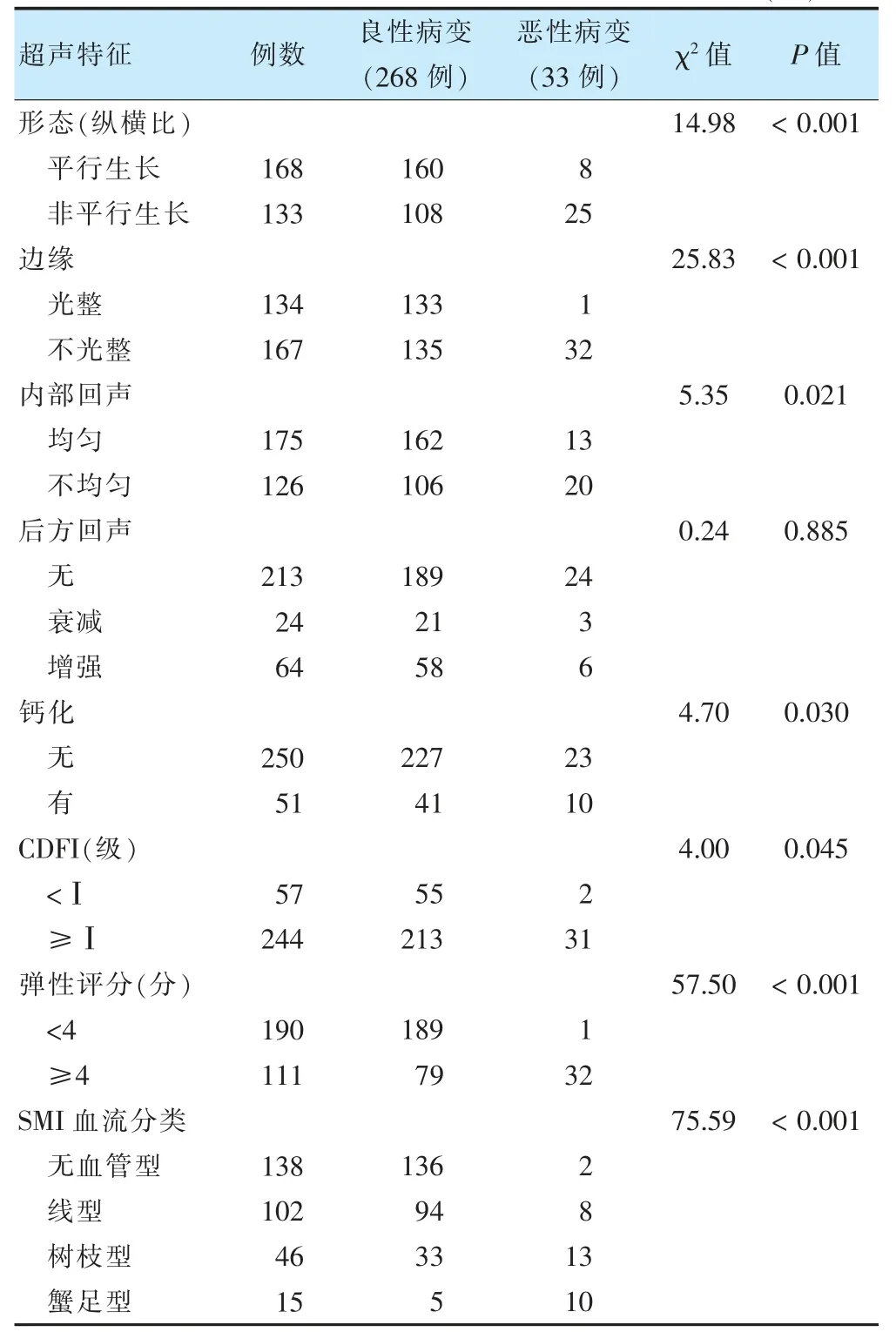
表1 良性病变与恶性病变患者常规高频超声特征比较(例)
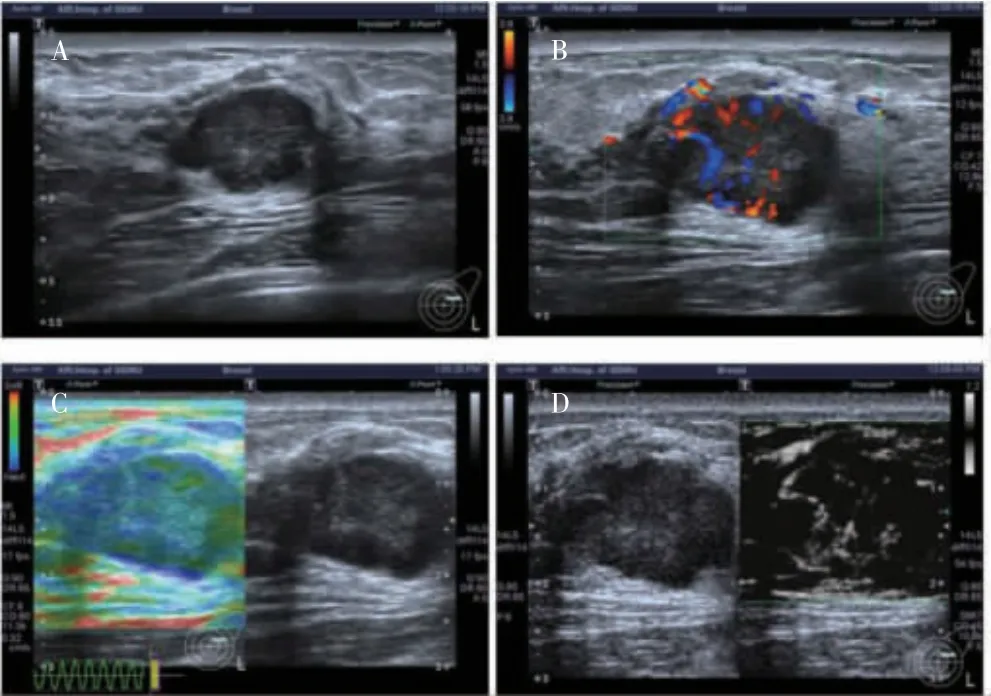
图2 浸润性导管癌超声图像
2.3 乳腺病灶超声特征的多因素logistic 回归分析
根据以往临床经验,后方回声也是鉴别乳腺恶性病灶的重要指标,故本研究选择表1 中所有的超声特征进行赋值,然后进行多因素logistic 回归分析。结果显示,病灶形态(纵横比)、边缘、弹性评分和SMI 血流分类是鉴别乳腺恶性病灶的独立影响因素(OR >1,P <0.05)。见表2。
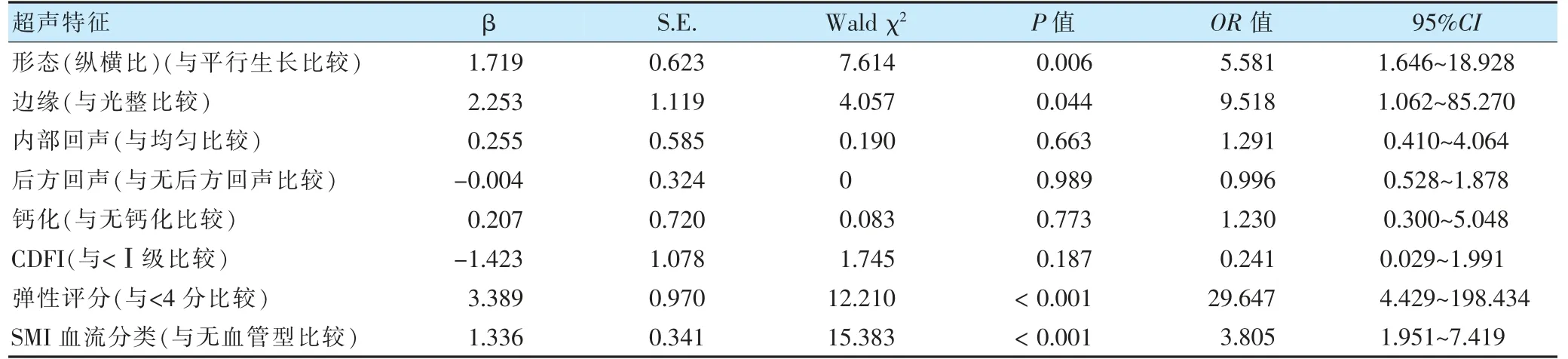
表2 乳腺病灶超声特征的多因素logistic 回归分析
2.4 乳腺病灶良恶性的诊断效能
联合检测乳腺病灶良恶性的特异度、阳性预测值及准确性最高。见表3。
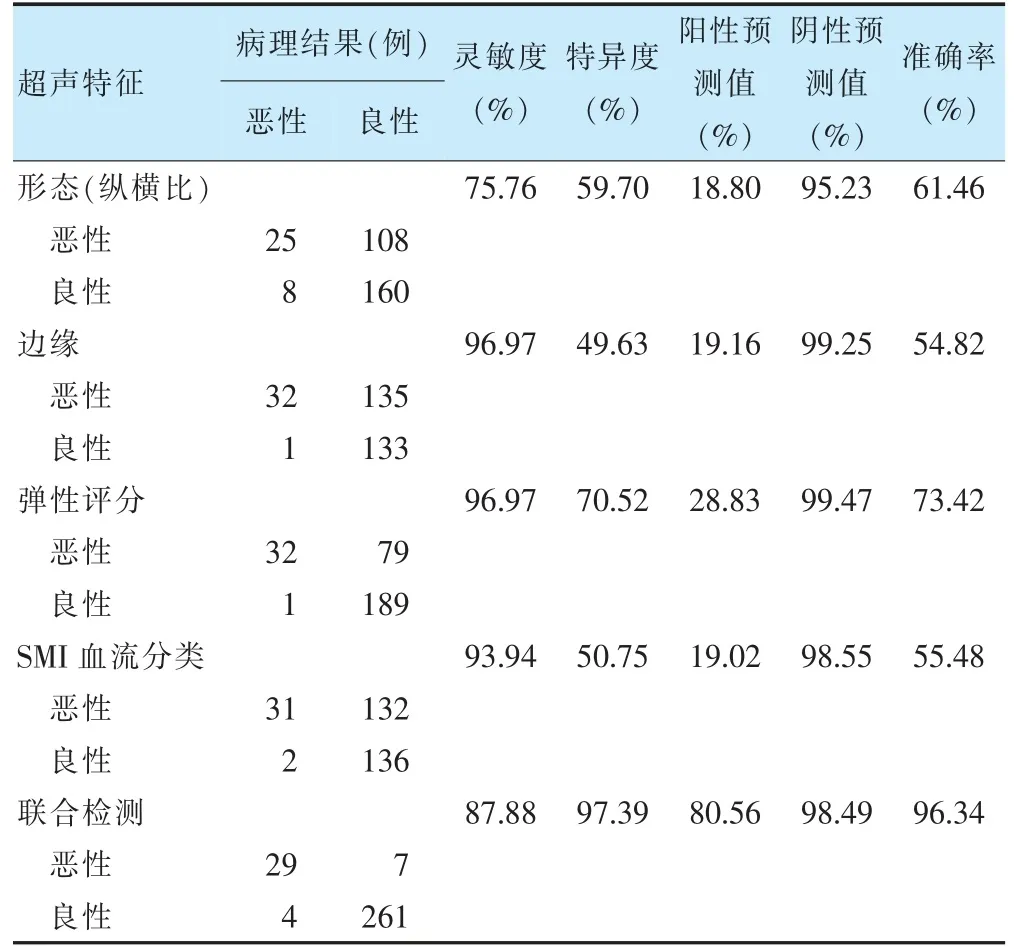
表3 乳腺病灶良恶性的诊断效能
图3 纤维腺瘤与浸润性导管癌病理结果(HE 染色,100×)
3 讨论
术前准确鉴别乳腺病灶的良恶性对于提高乳腺癌患者的早期切除率具有重要意义。但早期乳腺癌病灶在常规超声上缺乏典型的恶性征象,且不能直接提供病灶组织硬度信息,而乳腺肿瘤内血管生成对于肿瘤生长至关重要[17],常规超声无法从众多血管血流信号中鉴别出血流运动伪像,从而易造成超微小血流信息丢失导致漏诊和误诊[18],错失进行外科手术治疗的最佳机会。本研究通过常规超声、弹性评分及SMI检查,分析乳腺病灶的形态(纵横比)、边缘、后方回声、内部回声、钙化、弹性评分、CDFI、SMI 血流分类等超声特征,从常规超声特征、血管弹性、微小血流3 个方面综合分析评估其临床诊断乳腺病灶的效能,筛选可以鉴别乳腺病灶良恶性的超声特征,为评估乳腺结节患者是否适合行麦默通微创旋切手术等外科手术治疗提供准确的判断依据。
本研究结果显示,乳腺纤维瘤超声表现为形态规则,边缘光整,内部回声均匀,血流信号为少量,弹性成像以绿色为主,评分<4 分,SMI 血流分类为线型血流信号;乳腺浸润导管癌超声表现为形态不规则,边缘不光整,内部回声不均匀,弹性成像以蓝绿色交界为主,评分为4 分,SMI 血流分类为蟹足型血流信号。本研究结果显示,病灶形态(纵横比)、边缘、弹性评分和SMI 血流分类是诊断乳腺癌的独立影响因素。近年来有研究发现,形态不规则(纵横比>1)、微钙化对乳腺癌的诊断有重要价值[19],本研究结果与其类似,提示在临床应用中,形态(纵横比)及边缘是提示乳腺病灶恶性的征象之一。
乳腺肿块因其特殊的病理结构,常规超声无法准确地判断病变组织的软硬度。弹性成像的基本原理是利用探头加压导致组织发生形变,从而获得病变组织的弹性数值,相较于传统半定量弹性成像,弹性成像通过定量判断病变组织硬度使诊断结果更可信[20]。恶性乳腺肿块相对更硬,这与肿块内组织异质性密切相关。有研究发现,脂肪弹性和肿块比值受外界影响较小,重复性较好,操作便捷、能够反映病灶及周边组织的硬度[21]。本研究结果显示,恶性病灶弹性评分高于良性病灶,与Chen 等[22]研究结果相符。本研究根据病理检查结果,对弹性参数进行诊断效能分析,发现其对乳腺肿块病灶诊断准确率优于边缘和纵横比等指标,表明其具有较好的临床应用价值。但鉴别诊断乳腺病灶良恶性的弹性参数的界限值目前尚无确切标准,未来仍需更多的临床研究。
然而,仅靠判断肿块组织的软硬度仍不足以区分乳腺病灶恶性与否,还需要联合病灶内的血流信号来获取更多的参考信息。CDFI 通过入射超声与血细胞的相对运动所获得的多普勒频移来显示血流回声信号,缺点是不能区别血流杂波伪像和容易漏诊低速血流信号。而SMI 通过识别分析血流噪声所产生的特征,采用特殊算法来辨别实际的血流信息,能将运动伪像与超低速血流信息有效区分并消除、增加帧频成像,增强显示病灶中超低速血流信号[23-25]。因此,其对检测乳腺病灶血管中的超低速血流信号具有更高分辨率和灵敏度,可提高诊断效能。依据2021 年版中国抗癌协会乳腺癌诊治指南与规范分类标准[16],BI-RADS 4 类为可疑的恶性病灶,4A 类更倾向于良性病变,4B类恶性符合率为10%~50%,故本研究选择BI-RADS 4B 类为诊断恶性病灶截断值,结果显示,恶性乳腺病灶的血流信号树枝型、蟹足型者比例明显多于良性病灶,提示病灶内部血管越丰富,其恶性程度越大。原因之一可能是癌细胞可诱导产生血管内皮生长因子促进病灶内微小血管新生,而良性病灶内的新生血管少,大多表现为无血流或者线型[26]。
综上所述,联合应用可提高乳腺病灶良恶性鉴别诊断的效能,临床实际工作中应合理联合使用影像检查技术,实现优势互补以便做出准确的诊断。由于本研究为小样本量单中心的回顾性研究,未来尚需开展大样本、多中心的临床研究来验证。

