鼠李糖乳杆菌B6抗氧化活性和细胞保护作用研究
李瑞盈,张怡琳,游春苹*
1(上海海洋大学 食品学院,上海,201306) 2(光明乳业股份有限公司乳业研究院,上海乳业生物工程技术研究中心,乳业生物技术国家重点实验室,上海,200436)
氧化应激被定义为活性氧(reactive oxygen species,ROS)的生成以及抗氧化防御活性氧之间的严重失衡,导致生物分子的过度氧化损伤[1]。氧化应激是衰老和年龄相关疾病的基本原因之一[2-4]。多项研究表明,乳酸菌、双歧杆菌等具有良好的抗氧化能力,能够使抗氧化酶活性得以提高,并对氧化应激起到调节和缓解的作用。因此,具有抗氧化潜力的乳酸菌可作为食品发酵的功能性发酵剂,有望在功能食品领域发挥作用,给宿主带来健康益处[5-7]。
对于乳酸菌的抗氧化特性已经有很多学者进行过研究,李唤宇[8]利用植物乳杆菌Y44干预偶氮二异丁脒盐酸盐造成氧化损伤的人肠上皮细胞Caco-2,结果发现植物乳杆菌Y44不仅调控了一系列抗氧化酶的表达,还可激活Nrf2-Keap1-ARE信号通路,使Caco-2细胞的抗氧化活性显著增强。HOU等[9]研究发现植入乳杆菌L.plantarumJ26对H2O2诱导的Caco-2细胞超氧化物歧化酶活性的降低和谷胱甘肽过氧化物酶活性的升高具有显著的保护作用。NEMETH等[10]以H2O2处理的Caco-2细胞作为模型系统,研究炎症反应和诱导细胞死亡,研究结果发现植物乳杆菌L.plantarum2142浓缩培养上清液对H2O2介导的氧化应激存在保护作用。
益生性乳酸菌通过“脑-肠-微生物轴”改善精神健康的作用已经得到越来越多研究的证实[11],但少有利用益生菌代谢产物对于H2O2造成神经细胞氧化损伤保护作用的研究。PC12细胞作为大鼠肾上腺嗜铬细胞瘤分化的细胞株,不仅具有神经内分泌细胞的一般特征,且可传代易培养,在体外培养中表现出聚集成团和有纤维状突起等生长特征,类似于神经元,因此经常被作为神经生理和药理研究的细胞模型。此外,有学者研究了植物提取物对PC12细胞氧化损伤的保护作用,CHU等[12]发现美洲罂粟花提取物能够减轻H2O2诱导的PC12细胞的细胞毒性,缓解氧化受损细胞的氧化应激,维持细胞内ROS稳态。CLEMENTI等[13]发现红褐藻素通过调节ROS水平降低H2O2诱导的PC12细胞的细胞毒性和凋亡。OLATUNJI等[14]研究发现枸杞中的反式-N-咖啡酰胺通过减轻氧化应激,提高过氧化氢酶、SOD活力和还原型谷胱甘肽)的含量,抑制ROS生成和Ca2+内流。益生菌代谢产物用于对氧化损伤PC12细胞保护作用的研究还非常少,因此,有必要建立一套保护神经细胞抗氧化损伤的益生菌筛选和评价方法。
本文就结合了体外化学方法和细胞层面的分析,首先对实验室保藏的4株乳杆菌发酵过程中不同组分的DPPH自由基、·OH、·O2-清除能力做了比较研究,筛选出综合抗氧化能力较全面的鼠李糖乳杆菌B6,并在PC12细胞氧化损伤模型中,对丙二醛(malondialdehyde,MDA)和ROS的含量进行检测,从化学检测到细胞层面对菌株的抗氧化能力进行综合分析,旨在为开发利用该菌株保护神经细胞抗氧化用途提供参考依据。
1 材料与方法
1.1 材料与试剂
菌种:鼠李糖乳杆菌B6 (Lactobacillusrhamnosus,CGMCC 13310),鼠李糖乳杆菌KF7 (Lactobacillusrhamnosus, CGMCC 6430),副干酪乳杆菌BD5115 (Lactobacillusparacasei, CGMCC 20045),干酪乳杆菌LC2W(Lactobacilluscasei, CGMCC 0828),光明乳业研究院菌种保藏库;鼠李糖乳杆菌LGG (LactobacillusrhamnosusGG,ATCC 53103),ATCC菌种保藏中心。大鼠肾上腺嗜铬瘤细胞PC12(GE0414),江苏建诺为生物技术有限公司。
脱脂乳粉,新西兰恒天然公司;MRS肉汤培养基,德国Merck公司;DPPH、无水乙醇、邻二氮菲、FeSO4、Tris-HCl、邻苯三酚,生工生物工程(上海)股份有限公司;3% H2O2,Sigma试剂公司;胎牛血清、细胞培养基(Dulbecco’s modified eagle medium,DMEM)培养液,HyClone公司;0.25%胰酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、抗生素(青霉素-链霉素),赛默飞世尔科技公司;Cell Counting-Kit-8(CCK8试剂盒),美国Gibco公司;MDA含量检测试剂盒、ROS检测试剂盒,碧云天试剂有限公司。
培养基:10%(质量分数,下同)脱脂乳培养基(115 ℃、灭菌15 min);MRS培养基(121 ℃、灭菌15 min);DMEM完全培养基由94% DMEM培养液,5%的胎牛血清,1%抗生素(青霉素-链霉素)组成。
1.2 主要仪器与设备
MLS-3750高压蒸汽灭菌锅,三洋电机株式会社;WNB45L4恒温水浴锅,美墨尓特(上海)贸易有限公司;Spectra M5型酶标仪,美国Molecular Devices公司;A35厌氧生化培养箱,英国Don Whitley Scientific公司;SCIENTZ-IID超声细胞破碎仪,宁波新芝生物科技股份有限公司;5424R高速离心机,德国Eppendorf公司;Olympus IX71倒置显微镜,奥林巴斯(中国)有限公司;HERAce11240CO2型恒温培养箱,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 乳酸菌的培养及发酵上清液,菌体的制备
发酵上清液制备:将MRS固体培养基上活化得到的单菌落接种到MRS液体培养基或脱脂乳培养基中37 ℃培养18~24 h,将上述菌液按照3%(体积分数,下同)的接种量接种到MRS培养基或脱脂乳培养基中继续活化18~24 h,8 000 r/min 4 ℃离心15 min得到发酵上清液。
活化菌体:收集MRS发酵菌液离心得到的菌体,用PBS(pH 7.4)洗涤(10 000 r/min 4 ℃离心8 min)3次,4 ℃保存备用(菌体浓度为2.0×108CFU/mL);
热灭活菌体:用PBS(pH 7.4)洗涤菌体,将菌体重悬后置于恒温水浴锅中灭活(98 ℃, 1 h),PBS清洗沉淀3次(10 000 r/min 4 ℃,8 min)[15];
1.3.2 清除DPPH自由基实验
参考MARYAM等[16]的方法并略作修改,DPPH用无水乙醇溶解并配制为终浓度0.4 mmol/L,现用现配,待测液和DPPH乙醇溶液各取2 mL混合均匀,室温下避光反应(30 min)后,8 000 r/min室温离心10 min,测定上清液在517 nm处的吸光度,测3组平行。DPPH自由基清除率按公式(1)计算:
(1)
式中:Ai,实验组吸光度值;A0,对照组(2 mL 无菌水+2 mL DPPH乙醇溶液)吸光度值;Aj,空白组(2 mL 待测液+2 mL 无水乙醇)吸光度值。
1.3.3 清除·OH实验
参考YANG等[17]的方法并略作修改。实验组As:试管中分别依次加入PBS(1 mL,0.05 mmol/L pH 7.4),邻二氮菲(0.5 mL,6 mmol/L)、FeSO4溶液(0.5 mL,6 mmol/L)和H2O2溶液(0.5 mL,0.1%),充分混合均匀后再加入0.5 mL样品;对照组Ac:用0.5 mL 蒸馏水取代0.5 mL样品;空白组Ab:用1 mL 蒸馏水取代样品和H2O2溶液;将混合液在37 ℃水浴条件下反应1 h,利用酶标仪测定其在536 nm处的吸光值。·OH清除率按公式(2)计算:
(2)
1.3.4 清除·O2-实验
参考李颖等[18]的方法并略作修改。A样:依次加入3 mL 50 mmol/L的Tris-HCl,1 mL样品,1 mL 1.2 mmol/L的邻苯三酚;A空:将实验组中样品用蒸馏水代替;充分混匀各体系后,反应25 min(室温或25 ℃水浴),利用酶标仪测定325 nm处的吸光值。·O2-清除率按公式(3)计算:

(3)
1.3.5 B6对PC12 细胞抗氧化功能的影响实验
1.3.5.1 PC12细胞的培养
将PC12细胞复苏后,加入DMEM完全培养基(5%胎牛血清,1%青霉素-链霉素混合液),并培养在37 ℃,含有5% CO2的恒温细胞培养箱中,每隔1 d换1次液,2 d传1次代,实验所选用的PC12细胞均处于对数生长期。
1.3.5.2 H2O2诱导氧化损伤PC12 细胞模型的建立
PC12细胞以3.0×104个/mL的密度接种于96孔板,在培养24 h后,更换培养液为无血清DMEM培养基(99% DMEM培养液,1%青霉素-链霉素混合液,下同)再培养20 h;设置空白对照组(无H2O2)和H2O2终浓度分别为400、500、600、700、800 μmol/L的5个浓度梯度组,每组设6个复孔,作用20 h后,按照1.3.5.4中的CCK8法测定PC12细胞的存活率,并将细胞存活率最接近50%的H2O2浓度作为最适的造模浓度。
1.3.5.3 实验细胞分组
以3.0×104个/mL的密度将PC12细胞接种到细胞培养板中,在培养24 h后将培养液换为不含胎牛血清的DMEM培养液使细胞饥饿20 h,之后对其进行实验分组。空白对照组:添加无血清DMEM培养基再培养24 h;空白脱脂乳组:添加未发酵脱脂乳含量为15%的无血清DMEM高糖培养基,预处理4 h后,加入H2O2(终浓度500 μmol/L)继续培养20 h;模型组:添加无血清DMEM培养基培养4 h后,加入终浓度为500 μmol/L的H2O2继续培养20 h;低浓度实验组:添加鼠李糖乳杆菌B6代谢产物含量为5%的无血清DMEM培养基,预处理4 h后,加入H2O2(终浓度500 μmol/L)继续培养20 h;中浓度实验组:添加鼠李糖乳杆菌B6代谢产物含量为10%的无血清DMEM培养基,预处理4 h后,加入H2O2(终浓度500 μmol/L)继续培养20 h;高浓度实验组:添加鼠李糖乳杆菌B6代谢产物含量为15%的无血清DMEM培养基,预处理4 h后,加入H2O2(终浓度500 μmol/L)继续培养20 h;阳性对照组:配制终浓度为200 μmol/L的维生素C溶液作为阳性对照,预处理4 h后,加入H2O2(终浓度500 μmol/L)继续培养20 h。
1.3.5.4 CCK8法测定细胞存活率
根据李尽文等[19]的方法,将PC12细胞以3.0×104个/mL的密度接种于96孔板中,CO2恒温培养箱中培养24 h,之后所有组更换为无血清的DMEM培养基继续培养20 h后,除空白对照组和模型组外,实验组更换为鼠李糖乳杆菌B6代谢产物含量分别为5%、10%、15%的溶液,进行预处理(4 h);除对照组外,模型组和实验组加入终浓度为500 μmol/L的H2O2继续培养20 h。孵育结束后,分别在各组的前3个孔中加入10 μL的CCK8溶液,避光孵育2~4 h后,通过酶标仪测定450和650 nm时各孔的吸光度。细胞存活率按公式(4)计算:

(4)
式中:A,实验组的吸光度值(A450-A650);A0,对照组的吸光度值(A450-A650)。
1.3.5.5 倒置显微镜观察细胞形态
将PC12以3×104个/mL的密度接种到6孔板,按照1.3.5.4进行实验分组处理后,在倒置显微镜(×20)下观察不同组的细胞生长状态并拍照记录。
1.3.5.6 MDA和ROS含量测定
采用试剂盒测定,按照说明操作。
1.4 数据统计与分析
实验数据表示为“均值±标准偏差”的形式,利用SPSS进行单因素方差分析进行多组间的比较,显著水平设为P<0.05。
2 结果与讨论
2.1 DPPH 自由基清除率
DPPH法是检测化合物清除自由基或供氢能力以及评价食物抗氧化能力最常用的方法之一[20]。抗氧化剂对DPPH自由基的还原能力可以通过检测其在515~528 nm处吸光度的下降来评估[21]。4株乳杆菌在2.0×108CFU/mL浓度下各组分的DPPH 自由基清除率如图1所示。

图1 几株乳酸菌不同组分对DPPH自由基的清除能力Fig.1 DPPH radical scavenging ability of different lactic acid bacteria strains注:图中不同字母表示各组的差异存在统计学意义(P<0.05)(下同)
由图1可知,4株乳杆菌发酵MRS上清液,菌体均表现出较好的DPPH自由基清除能力,但其差异较大。B6、KF7和BD511的MRS发酵上清液DPPH自由基清除能力较强,分别为(63.23±1.38)%、(89.21±0.33)%、(77.26±2.30)%,高于LGG的(47.92%±0.34%),且差异具有统计学意义(P<0.05),其中鼠李糖乳杆菌KF7 发酵MRS上清液的DPPH自由基清除能力明显高于其他菌株,其次是副干酪乳杆菌BD5115、鼠李糖乳杆菌B6。4株乳杆菌的活性菌体和灭活菌体对DPPH自由基的清除能力与LGG相比均未见优势,鼠李糖乳杆菌B6灭活菌体对DPPH自由基清除能力高于其他3株菌。综合看鼠李糖乳杆菌B6的DPPH自由基清除能力相对其他3株菌较全面。实验结果表明,不同乳杆菌对DPPH的清除能力不同,发酵上清液对DPPH的清除能力均高于菌体,推测清除DPPH的活性物质主要存在于菌株的发酵上清液中[22-24]。
2.2 ·OH清除率
·OH被认为是氧化应激的主要来源。因此,抑制它们的形成或清除它们具有极其重要的生物学意义[25]。测定4株乳杆菌不同组分对·OH的清除能力进一步验证其抗氧化能力,对比结果如图2所示。
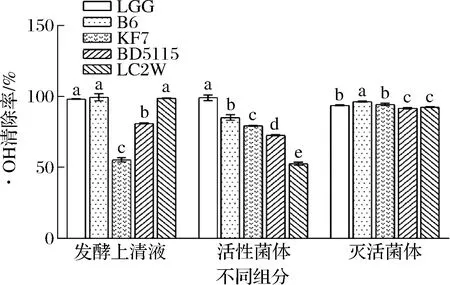
图2 几株乳酸菌不同组分对·OH的清除能力Fig.2 Hydroxyl radical scavenging ability of different lactic acid bacteria strains
由图2可知,4株乳杆菌均呈现一定的·OH清除能力,鼠李糖乳杆菌B6发酵MRS上清液对·OH清除能力最强,清除率为(99.38±2.46)%,高于LGG的(98.12±0.20)%;4株乳酸菌活性菌体的·OH清除能力均低于LGG[(99.01±1.90)%],其中鼠李糖乳杆菌B6清除率为(85.11±1.91)%,高于其他3株乳杆菌。鼠李糖乳杆菌B6灭活菌体对·OH清除率为(96.27±0.48)%,高于LGG的(93.66±0.34)%且和其他菌株差异具有统计学意义(P<0.05)。
实验结果表明,不同乳杆菌对·OH的清除能力存在一定差异,其发酵代谢产物和菌体均可对·OH的清除起到作用。综合来讲,鼠李糖乳杆菌B6发酵MRS上清液、活性菌体和灭活菌体对·OH的清除能力最强,分别为(99.38±2.46)%、(85.11±1.91)%、(96.27±0.48)%。
2.3 ·O2-清除率
·O2-作为一种信号分子,调节许多生物过程,包括细胞凋亡和衰老[26]。然而,当·O2-产生过多或抗氧化防御缺乏时,氧化应激就会发生,从而破坏重要的生物分子并改变其生理功能[27]。乳酸菌发酵MRS上清液、活性菌体和灭活菌体清除·O2-的结果如图3所示。
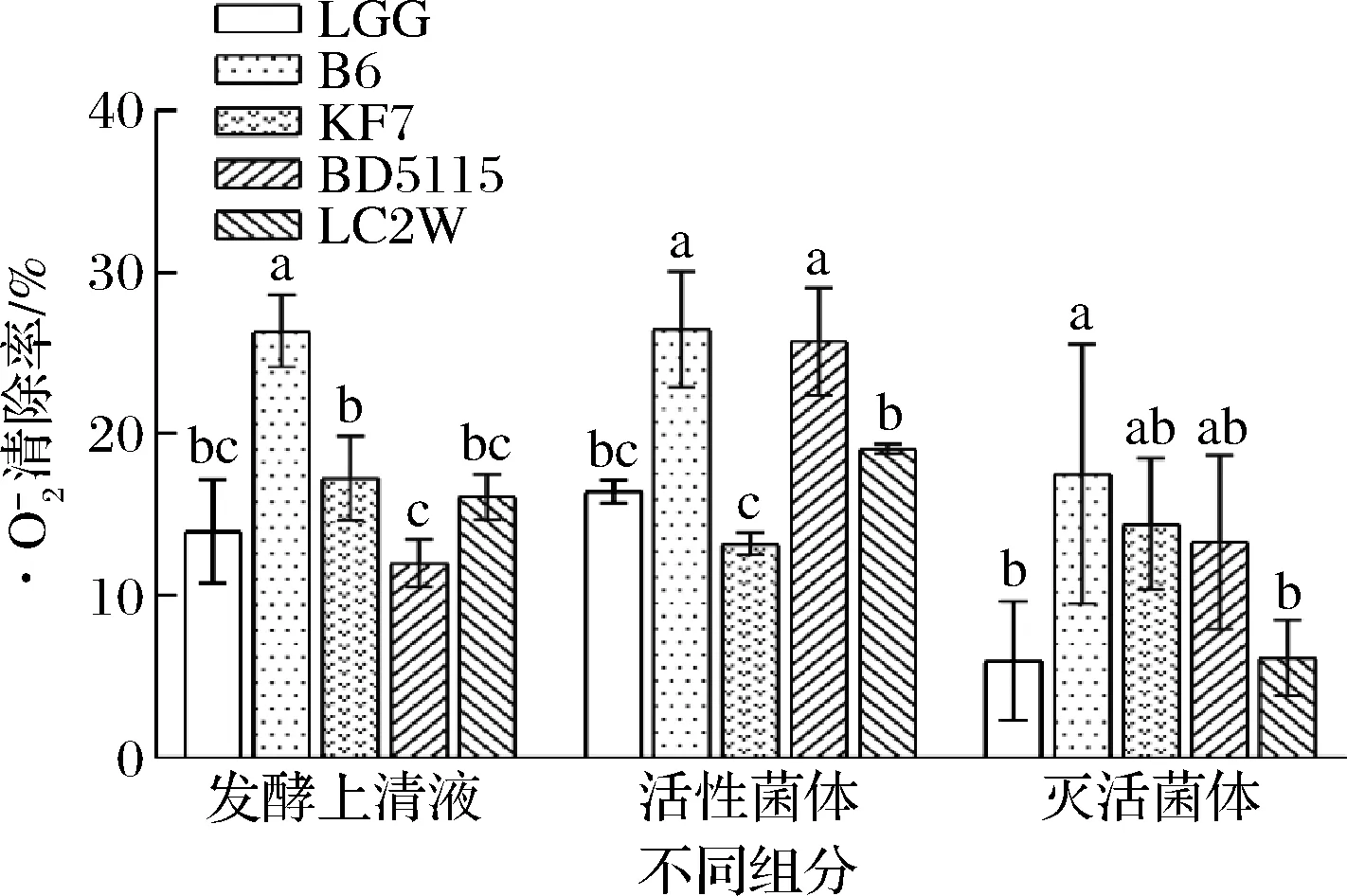
图3 几株乳酸菌不同组分对·O2-的清除能力Fig.3 Superoxide anion radical scavenging ability of different lactic acid bacteria strains
由图3可知,4株乳杆菌的MRS发酵上清液、活性菌体和灭活菌体均呈现一定的·O2-清除能力,其中鼠李糖乳杆菌B6发酵MRS上清液和灭活菌体的·O2-清除能力最强,分别为(26.35±2.21)%、(17.53±8.02)%,高于LGG[(13.97±3.19)%、(5.96±3.69)%]及其余3株乳杆菌且差异具有统计学意义(P<0.05);鼠李糖乳杆菌B6和副干酪乳杆菌BD5115活性菌体的·O2-清除能力最强,分别为(26.48±3.59)%、(25.70±3.33)%,高于LGG的(16.45±0.69)%且差异具有统计学意义(P<0.05)。
综上,鼠李糖乳杆菌B6抗氧化能力较其他3株菌更为全面,其发酵MRS上清液较菌体的抗氧化综合能力更强。
2.4 不同培养基鼠李糖乳杆菌B6发酵上清液自由基清除率
鼠李糖乳杆菌B6分别发酵MRS和脱脂乳得到发酵代谢产物,其中鼠李糖乳杆菌B6发酵脱脂乳得到的上清液对DPPH自由基和·O2-的清除率分别为(74.73±2.99)%、(34.78±2.60)%,都高于其发酵MRS上清液(表1),且差异具有统计学意义(P<0.001)。

表1 不同培养条件下鼠李糖乳杆菌B6发酵 上清液自由基清除率Table 1 Free radical scavenging rate of B6 fermentation supernatant under different culture conditions
2.5 H2O2诱导PC12细胞氧化损伤的最适浓度
PC12细胞经过不同浓度的H2O2处理,使正常的PC12细胞氧化,以得到实验所需的细胞氧化损伤模型。如图4所示,H2O2干预浓度达到500 μmol/L时,细胞的存活率达到53.51%,最接近50%。所以在建立PC12细胞氧化损伤模型时,条件为500 μmol/L的H2O2处理20 h。

图4 不同浓度H2O2处理下的PC12细胞存活率Fig.4 Survival rate of PC12 cells treated with different concentrations of H2O2
2.6 鼠李糖乳杆菌B6发酵脱脂乳代谢产物对PC12细胞形态的影响
由图5可知,对照组的PC12细胞呈现清晰的角状,是正常PC12细胞的形态;空白脱脂乳组对于细胞形态也没有造成损伤;H2O2处理组细胞不再伸展伪足而是皱缩为圆形,说明H2O2氧化损伤造成细胞形态的劣变,而随着鼠李糖乳杆菌B6发酵脱脂乳代谢产物浓度的增加,细胞形态逐渐恢复正常,且浓度越高细胞的生长状态越好,说明鼠李糖乳杆菌B6发酵脱脂乳代谢产物缓解了细胞因为H2O2造成的氧化损伤。

a-对照组;b-空白脱脂乳组;c-H2O2处理组;d-低浓度(5%) B6代谢产物干预组;e-中浓度(10%)B6代谢产物干预组; f-高浓度(15%)B6代谢产物干预组;g-阳性对照组 (200 μmol/L 维生素C)图5 鼠李糖乳杆菌B6发酵脱脂乳代谢产物对H2O2 损伤的PC12细胞形态的影响(×20)Fig.5 Effect of L.rhamnosus B6 fermented skim milk metabolites on morphology of PC12 cells damaged by H2O2(×20)
2.7 PC12细胞培养液中MDA,ROS含量的测定
由图6-a可知,空白脱脂乳组和空白对照组没有显著性差异,说明空白脱脂乳对细胞中的MDA含量没有影响。而H2O2氧化损伤模型相对于空白对照组而言,MDA的含量显著升高(P<0.05),这说明H2O2会促进细胞脂质过氧化反应,使细胞的氧化损伤加重。受损的PC12细胞经含量10%、15%的鼠李糖乳杆菌B6发酵脱脂乳代谢产物处理后,MDA含量从模型组的2.902 nmol/107cell分别降低至2.193、1.914 nmol/107cell,且与模型组差异具有统计学意义(P<0.05),15%的高剂量组作用具有优于维生素C组的趋势。进一步说明了鼠李糖乳杆菌B6发酵脱脂乳代谢产物对细胞的脂质过氧化反应有一定的改善作用。
由图6-b可知,经H2O2处理后的PC12细胞,细胞内的ROS含量显著升高,说明H2O2会促进PC12细胞内ROS的产生。空白脱脂乳不会引起细胞内ROS含量显著的变化。在经过鼠李糖乳杆菌B6发酵脱脂乳代谢产物干预后,氧化损伤的PC12细胞内ROS含量有降低趋势,15%含量的鼠李糖乳杆菌B6发酵脱脂乳代谢产物干预组与模型组差异具有统计学意义(P<0.05),且与阳性对照组水平相当,最接近空白对照组水平,这进一步表明鼠李糖乳杆菌B6发酵脱脂乳代谢产物能够一定程度上降低氧化损伤细胞内的ROS含量。

a-MDA;b-ROS图6 鼠李糖乳杆菌B6发酵脱脂乳代谢产物对H2O2 诱导的PC12细胞MDA及ROS含量的影响Fig.6 Effects of L.rhamnosus B6 fermented skim milk metabolites on MDA and ROS content in H2O2-induced PC12 cells
3 结语
研究表明,鼠李糖乳杆菌B6具有较好的抗氧化能力,其发酵MRS和脱脂乳的代谢产物均对DPPH、·OH、·O2-具有显著的清除作用。通过建立PC12细胞氧化损伤模型,观察其发酵脱脂乳代谢产物不同干预浓度对细胞形态的影响以及对细胞中MDA、ROS含量的影响,可进一步验证鼠李糖乳杆菌B6发酵脱脂乳代谢产物可以在一定程度上抑制或减少H2O2对PC12细胞造成的氧化损伤。研究结果可为鼠李糖乳杆菌B6发酵脱脂乳代谢产物作为天然抗氧化剂抑制PC12细胞的氧化损伤、保护神经提供一定的理论基础。

