外源甜菜碱对盐胁迫下千屈菜种子萌发及幼苗生长的影响
华智锐
(1商洛学院 生物医药与食品工程学院, 陕西 商洛726000; 2陕西秦岭特色生物资源产业技术研究院有限公司,陕西 商洛726000)
千屈菜(LythrumsalicariaL.),别名对叶莲、光千屈菜、型千屈菜、水枝柳、水柳,系千屈菜科千屈菜属多年生草本植物,是中医常用药,其全草均可入药,内用可治肠炎、痢疾、便血,外用于外伤出血[1]。千屈菜喜强光,耐寒性强,喜水湿,对土壤要求不高,因此千屈菜作为盐碱地重要的观赏性植物,开展其耐盐碱生理机制研究意义重大。
土壤盐碱化是阻碍全球作物生长和生产力的主要非生物限制因素,是造成世界耕地退化和土地荒漠化的主要因素之一[2]。研究表明,植物为了抵御和适应盐碱胁迫形成了一系列适应盐碱胁迫的生理生化机制,包括渗透调节、离子区域化、提高抗氧化能力、改变光合途径和调节植物激素等[3],其中渗透调节是植物适应盐碱胁迫的主要生理机制。甘氨酸甜菜碱(glycine betaine,GB),简称甜菜碱(betaine)[4],是广泛存在于植物体内的生物碱,可调节细胞渗透压,具有维持生物膜完整性的作用。研究证明,在遭受盐胁迫时,许多植物体内都会积累甜菜碱[5],但由于积累不足而作用较弱,因此人为外施GB可提高植物抗逆性[6]。周泉澄等[7]研究发现,外施GB能有效提高盐角草和毕氏海蓬子种子的萌发率和耐盐性,对于其在盐胁迫下的生长发育具有明显促进作用;李善家等[8]研究发现,甜菜碱对盐胁迫下黑果枸杞种子萌发具有显著促进作用;马婷燕等[9]研究发现,叶施GB不仅有效提高了紫花苜蓿种子及幼苗的抗盐能力,而且还能促进紫花苜蓿在盐渍环境下的生长发育;钟国辉等[10]研究发现,外源甜菜碱削弱盐胁迫下白菜叶片细胞的膜脂过氧化、膜透性和过氧化物酶(POD)活性增加的程度,延缓白菜叶片中叶绿素、可溶性蛋白含量和相对含水量以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性的下降;呼彧等[11]研究发现,适宜浓度的GB能使高温胁迫下菜豆幼苗丙二醛(MDA)含量降低,可溶性蛋白含量和保护酶活性提高。
目前关于千屈菜生理抗性方面的研究较少,且外源甜菜碱对盐胁迫下千屈菜种子萌发和幼苗生长影响的研究尚无报道。为此,本研究以千屈菜为材料,采用NaCl溶液模拟盐胁迫,设置不同质量浓度外源甜菜碱,对盐胁迫下千屈菜种子和盆栽幼苗进行处理,通过测定不同处理下千屈菜种子萌发及幼苗生长过程中的相关指标,探究外源甜菜碱缓解NaCl对千屈菜胁迫的生理机制,旨在为盐碱地区千屈菜大规模优质高产种植提供参考。
1 材料与方法
1.1 试验材料
试验所用千屈菜种子采自商洛镇安木王国家森林公园,经商洛学院王新军教授鉴定为千屈菜科千屈菜属千屈菜(LythrumsalicariaL.)的干燥成熟种子。
选择大小一致、籽粒饱满的种子进行试验;幼苗进行移栽时,选取株高为10~15 cm、生长状况基本一致的幼苗移栽至塑料花盆中,定时浇水松土,待其恢复到正常生理状态再进行后续试验处理。
1.2 试验方法
1.2.1 种子发芽盐胁迫阈值的确定 千屈菜种子用去离子水多次冲洗后,于体积分数70%乙醇溶液中浸泡30 s,然后用质量分数0.1% KMnO4溶液消毒10 min[12],再用无菌水洗涤多次。最后将种子置于无菌水中浸泡24 h,以保障种子发芽过程所需水分。
取浸泡后的种子随机分成5组,每组50粒,整齐排列在直径12 cm、垫有2层滤纸的培养皿中,用移液器分别添加质量浓度为0,2.5,5,10,15 g/L的NaCl溶液10 mL到培养皿中进行盐胁迫种子萌发预试验:25 ℃温室培养,每天补充10 mL蒸馏水防止干旱,记录发芽数,每组3次重复,7 d后以千屈菜种子发芽率(NaCl质量浓度为10和15 g/L时种子发芽率分别为50.6%和5.57%)和幼苗生物量下降到50%时的盐质量浓度得出盐胁迫阈值质量浓度为10 g/L。
1.2.2 种子发芽试验 采用纸上发芽法[13],将消毒并浸泡24 h的千屈菜种子随机分成6组,每组50粒,整齐排列在直径12 cm、垫有2层滤纸的培养皿中。其中1组用移液器添加蒸馏水20 mL,记为对照处理(CK1),另外5组先用移液器加10 g/L NaCl 10 mL,再分别加入0,1,3,5,7 g/L甜菜碱10 mL,依次记为CK2、T1、T2、T3、T4处理。然后置25 ℃温室中培养,每天加入10 mL蒸馏水,统计发芽数。每组重复3次。
1.2.3 盆栽试验 选取株高为10~15 cm、生长状况基本一致的千屈菜幼苗移栽至塑料花盆中进行盆栽处理,外源甜菜碱采用叶施的方式添加,共6个处理,每处理3盆,每盆6株。CK1处理:不添加任何药品,进行蒸馏水正常培养;CK2处理:先用10 mL 10 g/L NaCl进行浇灌,再叶面喷施10 mL蒸馏水;T1~T4处理:均先用10 mL 10 g/L NaCl进行浇灌,再分别用1,3,5,7 g/L外源甜菜碱10 mL喷洒于叶片上,隔天喷洒1次,CK1和CK2对应喷洒蒸馏水10 mL。处理7 d后随机选取千屈菜幼苗用于生长指标测定,叶片用于相关生理指标测定。
1.3 测定指标及方法
1.3.1 种子萌发指标 进行发芽试验时,需要每天记录发芽种子数,7 d时分析发芽势,10 d时统计发芽率,并分析发芽指数和活力指数。
发芽率=发芽种子数/供试总种子数×100%;
发芽势=发芽高峰期发芽种子数/供试总种子数×100%;
发芽指数(GI)=∑(Gt/Dt);
活力指数(VI)=S∑(Gt/Dt)=S×GI。
式中:Dt为发芽日数;Gt为与Dt相对应的每天发芽种子数;S为种苗生长量。
1.3.2 幼苗生长指标和生理指标测定 采用直尺测定幼苗根长(cm)和株高(cm),采用天平测定幼苗鲜质量(g/株)和干质量(g/株)。采用丙酮提取法[14]测定叶绿素含量,采用氮蓝四唑法[15]测定超氧化物歧化酶(SOD)活性,采用愈创木酚法[15]测定过氧化物酶(POD)活性,采用紫外吸收法[16]测定过氧化氢酶(CAT)活性,采用硫代巴比妥酸(TBA)检测法[14]测定丙二醛(MDA)含量,采用考马斯亮蓝法[17]测定可溶性蛋白含量。各项指标重复测定3次,取平均值。
1.4 数据处理
采用Excel 2016进行数据统计,采用SPSS statistics 22.0软件进行方差分析,采用Origin 8.0绘图。
2 结果与分析
2.1 外源甜菜碱对盐胁迫下千屈菜种子萌发的影响
由表1可知,与CK2处理相比,外源甜菜碱对盐胁迫下千屈菜种子萌发指标(发芽率、发芽势、发芽指数、活力指数)均有显著提高作用,且不同质量浓度甜菜碱处理间差异显著,随着甜菜碱质量浓度增加,盐胁迫下千屈菜种子萌发指标均呈先升高后降低的变化趋势,在甜菜碱质量浓度为5 g/L(T3处理)时,其对盐胁迫下千屈菜种子的各萌发指标均达到最大值。表明5 g/L甜菜碱对盐胁迫下千屈菜种子萌发促进作用最佳。
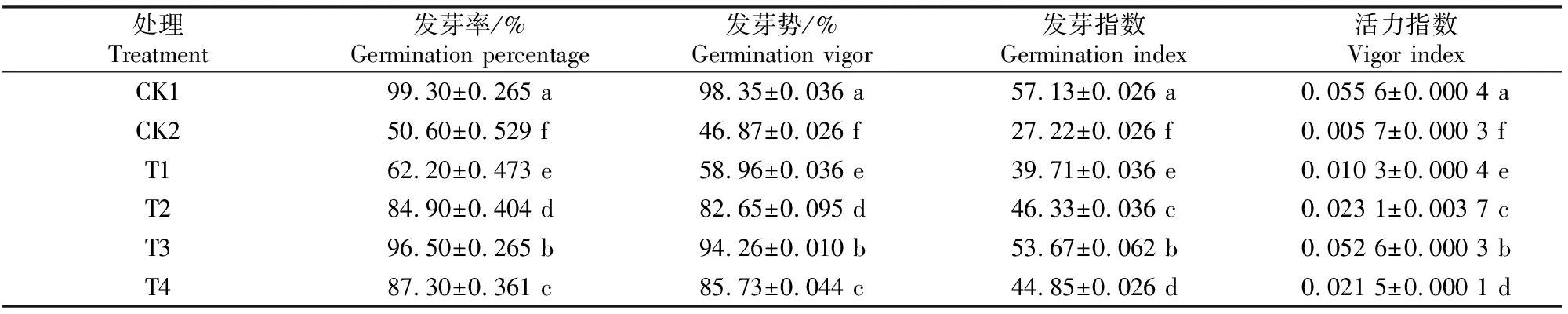
表1 外源甜菜碱对盐胁迫下千屈菜种子萌发的影响Table 1 Effects of exogenous betaine on Lythrum salicaria seed germination under salt stress
2.2 外源甜菜碱对盐胁迫下千屈菜幼苗生长的影响
由表2可知,与CK1处理相比,在盐胁迫处理(CK2)下,千屈菜幼苗的根长、株高、鲜质量和干质量均显著降低。与CK2相比,添加不同质量浓度外源甜菜碱(T1~T4处理)后,盐胁迫下千屈菜幼苗各生长指标均不同程度升高,且外源甜菜碱质量浓度为5 g/L(T3处理)时,盐胁迫下千屈菜幼苗的根长、株高、鲜质量和干质量增加幅度最大,分别增加了49.35%,22.60%,61.67%,52.01%,表明适量外源甜菜碱可以有效缓解盐胁迫对千屈菜幼苗生长的影响,且添加5 g/L甜菜碱的缓解效果最佳。

表2 外源甜菜碱对盐胁迫下千屈菜幼苗生长的影响Table 2 Effects of exogenous betaine on growth indexes of Lythrum salicaria seedlings under salt stress
2.3 外源甜菜碱对盐胁迫下千屈菜幼苗叶绿素含量的影响
由图1可知,与CK1处理相比,在10 g/L NaCl胁迫(CK2处理)下,千屈菜幼苗叶片中总叶绿素、叶绿素a、叶绿素b含量均极显著下降(P<0.01)。与CK2处理相比,添加不同质量浓度外源甜菜碱(T1~T4处理)后,盐胁迫下千屈菜幼苗的总叶绿素、叶绿素a、叶绿素b含量均有不同程度升高,其中千屈菜幼苗总叶绿素含量分别增加了73.01%,100.09%,300.73%,218.54%,叶绿素a含量分别增加了38.71%,60.28%,178.96%,129.66%,叶绿素b含量分别增加了284.17%,331.61%,820.91%,622.54%。在NaCl胁迫下,随着添加外源甜菜碱质量浓度的升高,千屈菜幼苗总叶绿素、叶绿素a、叶绿素b含量整体上均呈先上升后下降的变化趋势;与CK2处理相比,在甜菜碱质量浓度为5 g/L(T3处理)时,千屈菜幼苗总叶绿素、叶绿素a、叶绿素b含量增幅达到最大,说明添加5 g/L甜菜碱对提高盐胁迫下千屈菜幼苗叶绿素含量作用最显著。
2.4 外源甜菜碱对盐胁迫下千屈菜幼苗保护酶活性的影响
由图2可知,与CK1处理相比,在10 g/L NaCl胁迫(CK2处理)下,千屈菜幼苗POD、SOD和CAT活性均急剧变化,其中POD和SOD活性均极显著增强(P<0.01),而CAT活性极显著下降(P<0.01)。与CK2处理相比,添加不同质量浓度外源甜菜碱(T1~T4处理)均能使盐胁迫下千屈菜幼苗3种保护酶活性不同程度增强,其中POD活性分别增加43.28%,82.09%,156.72%和116.42%, SOD活性分别增加66.67%,141.67%,191.67%和108.33%,CAT活性分别增加24.38%,57.14%,99.43%和65.14%。在NaCl胁迫下,随着添加外源甜菜碱质量浓度的升高,千屈菜幼苗3种保护酶活性整体呈先上升后下降的趋势;与CK2处理相比,在甜菜碱质量浓度为5 g/L(T3处理)时,千屈菜幼苗3种保护酶活性增幅均达到最大,说明添加5 g/L甜菜碱对盐胁迫下千屈菜幼苗生长的缓解作用最显著。
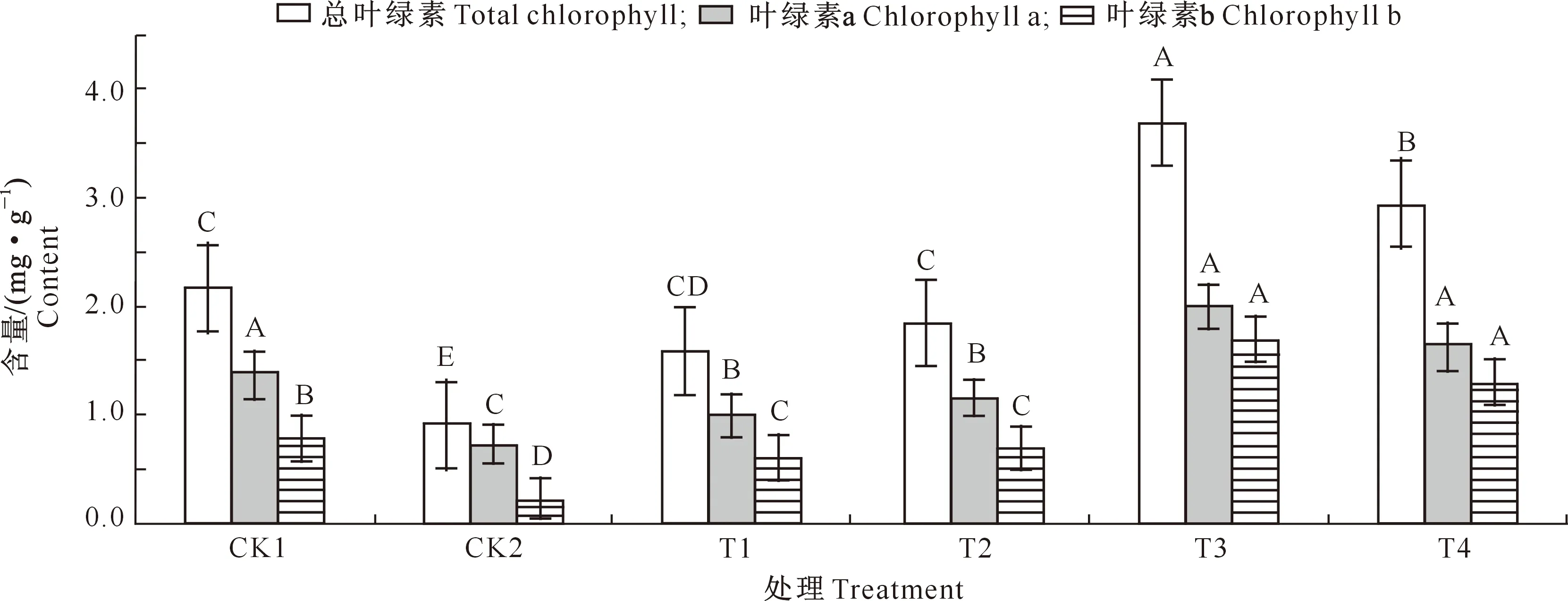
图柱上标不同大写字母表示同一指标不同处理间差异极显著。下同 Different capital letters indicate extremely significant difference among treatments.The same below

图2 外源甜菜碱对盐胁迫下千屈菜幼苗保护酶活性的影响Fig.2 Effect of GB on protective enzyme activity of Lythrum salicaria seedlings under salt stress
2.5 外源甜菜碱对盐胁迫下千屈菜幼苗MDA含量的影响
由图3可知,与CK1处理相比,在10 g/L NaCl胁迫(CK2处理)下,千屈菜幼苗MDA含量极显著增加(P<0.01)。与CK2处理相比,添加不同质量浓度外源甜菜碱(T1~T4处理)均能使千屈菜幼苗中MDA含量不同程度降低,且随着添加外源甜菜碱质量浓度的升高,千屈菜幼苗叶片中MDA含量整体上呈先下降后上升的变化趋势;T1~T4处理千屈菜幼苗中MDA含量分别较CK2处理降低了9.96%,28.66%,57.69%和31.67%,且T3处理千屈菜幼苗中MDA含量极显著低于T1、T2和T4处理。表明甜菜碱可以缓解盐胁迫对千屈菜幼苗所造成的危害作用,且添加甜菜碱质量浓度为5 g/L时效果最佳。
2.6 外源甜菜碱对盐胁迫下千屈菜幼苗可溶性蛋白含量的影响
由图4可知,与CK1处理相比,在10 g/L NaCl胁迫(CK2处理)下,千屈菜幼苗中可溶性蛋白含量极显著降低(P<0.01)。与CK2处理相比,添加不同质量浓度外源甜菜碱(T1~T4处理)均能使盐胁迫下千屈菜幼苗中可溶性蛋白含量增加,且随着添加外源甜菜碱质量浓度的升高,千屈菜幼苗叶片中可溶性蛋白含量整体上呈先上升后下降的变化趋势,其中T1~T4处理千屈菜幼苗中可溶性蛋白含量分别增加了224.76%,628.66%,530.94%和420.20%,且T2处理(甜菜碱质量浓度为3 g/L)千屈菜幼苗中可溶性蛋白含量显著高于T1、T3、T4处理,即添加甜菜碱质量浓度为3 g/L时,千屈菜幼苗叶片中可溶性蛋白含量增幅最大,说明甜菜碱可以缓解盐胁迫对千屈菜幼苗所造成的抑制作用,且在质量浓度为3 g/L时效果最显著。
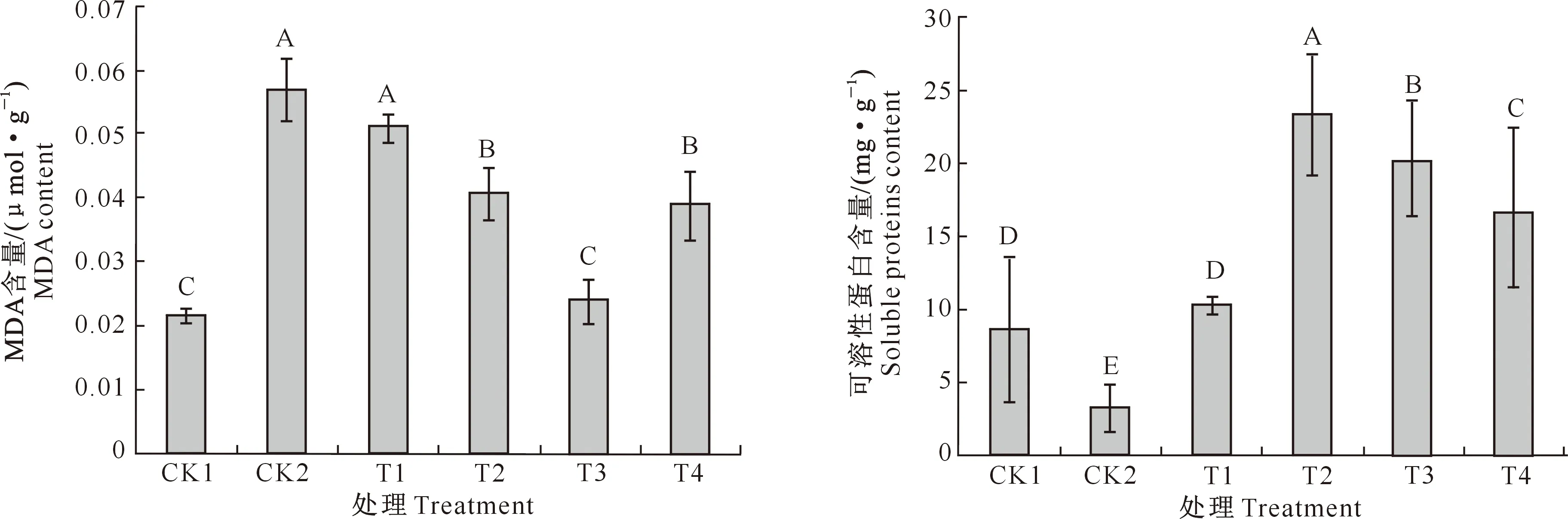
图3 外源甜菜碱对盐胁迫下千屈菜幼苗 MDA含量的影响 图4 外源甜菜碱对盐胁迫下千屈菜幼苗 可溶性蛋白含量的影响Fig.3 Effect of GB on MDA content of Lythrum salicaria seedlings under salt stress Fig.4 Effect of GB on soluble proteins content of Lythrum salicaria seedlings under salt stress
3 讨 论
3.1 外源甜菜碱对盐胁迫下千屈菜种子萌发的影响
种子萌发期是植物生活史中最重要的阶段,也是耐盐性最差的阶段。研究表明,盐胁迫下添加外源甜菜碱会明显改善向日葵[18]、番茄[19]和白三叶[20]种子的萌发情况。肖斌等[21]研究发现,盐胁迫明显降低了罗布麻和大花白麻种子的发芽率、发芽势;范春丽等[22]研究发现,外源甜菜碱能有效促进盐胁迫下石榴种子萌发。本研究发现,在NaCl胁迫下,千屈菜种子萌发指标均呈下降趋势,但在添加不同质量浓度外源甜菜碱后,其萌发指标均有所上升,且在甜菜碱质量浓度为5 g/L时千屈菜种子萌发指标达到最高,说明外源甜菜碱能有效提高千屈菜种子的抗盐胁迫能力,这与前人的研究结果相一致。
3.2 外源甜菜碱对盐胁迫下千屈菜幼苗生长的影响
盐胁迫对植物最普遍、最显著的影响就是抑制其生长,生长特性是植物对盐胁迫伤害的综合反应。研究表明,外源甜菜碱可以缓解盐胁迫对植物生长的抑制作用[23]。本研究结果表明,与CK1处理相比,盐胁迫(CK2处理)显著抑制了千屈菜幼苗的生长,这与孙焕荣等[24]对荷兰菊、千屈菜及狼尾草的研究结果一致。本研究中,添加不同质量浓度GB后盐胁迫下千屈菜幼苗的根长、株高、鲜质量和干质量与CK2处理相比均呈现出不同程度提高,且在GB质量浓度为5 g/L时,千屈菜幼苗各生长指标均达到最高,缓解效果最明显。
POD、SOD和CAT是植物抗氧化系统中的主要酶,外界逆境对植物体造成的影响程度都可以通过测定POD、SOD和CAT的活性来判定。丁能飞等[25]研究发现,大白菜经NaCl胁迫后其抗氧化酶活性急剧增加;唐露[26]研究发现,外源甜菜碱能有效提高渗透胁迫下香蕉幼苗叶片和根系中抗氧化酶活性。本研究结果表明,在10 g/L NaCl胁迫下,千屈菜幼苗POD和SOD活性均显著升高,而CAT活性下降,这可能是在短时间内处理时CAT活性受到抑制所致。但添加不同质量浓度GB后,千屈菜幼苗叶片POD、SOD和CAT活性均比CK2明显增高,这与前人的研究结果一致,说明外源甜菜碱对植物的抗氧化能力具有显著提高作用,可有效缓解盐胁迫对植物造成的抑制作用,且添加5 g/L GB效果最显著。
在盐胁迫下,植物体内会积累较多的活性氧,导致膜脂过氧化产物丙二醛(MDA)含量增加,进一步破坏质膜的结构和完整性。因此,MDA含量能在一定程度上反映植物细胞膜受损伤程度。陈锦芬等[27]研究发现,在盐胁迫下烟草MDA含量显著上升;马婷燕等[9]研究发现,外源甜菜碱能显著降低盐胁迫下紫花苜蓿幼苗中MDA含量。本研究结果表明,在NaCl胁迫时千屈菜幼苗中MDA含量显著增高,而在添加不同质量浓度外源甜菜碱后,MDA含量均有不同程度降低,这与前人的研究结论一致,且在5 g/L GB时MDA含量最低。说明外源甜菜碱能有效降低植物细胞膜的受损程度,且5 g/L GB处理效果最佳。
叶绿素是绿色植物进行光合作用的主要色素,其含量能在一定程度上反映植物的同化能力,也可作为衡量叶片受损程度的指标。郑容妹等[28]发现,盐胁迫显著降低了沿海绿竹的叶绿素含量;杨晓云等[29]发现,外源甜菜碱能有效提高盐胁迫下玉米幼苗中叶绿素含量。本研究结果表明,盐胁迫显著降低了千屈菜幼苗叶片叶绿素含量,但添加适宜质量浓度外源甜菜碱后能有效提高盐胁迫下千屈菜幼苗的叶绿素含量,这与前人研究结论一致。
可溶性蛋白是一种重要的渗透调节物质,低质量浓度NaCl胁迫可促进植物可溶性蛋白的合成以适应盐环境,但随着NaCl质量浓度的增加,当胁迫达到一定程度时,可溶性蛋白的合成受到严重抑制,含量明显下降。王国霞等[30]发现,施加外源甜菜碱显著增加了低温胁迫下油茶可溶性蛋白含量;张涛[31]发现,在盐胁迫下花楸树叶片可溶性蛋白含量先升高后降低,当盐质量浓度达到一定程度时,植物体内合成可溶性蛋白的组织或者酶类就会失活,从而使花楸树的自我调节能力受到抑制。本研究发现,对盐胁迫下千屈菜幼苗添加不同质量浓度的甜菜碱后,其可溶性蛋白含量均有不同程度增高。说明外源甜菜碱可诱导可溶性蛋白进一步合成,对植物体盐胁迫抑制有一定的缓解作用,且3 g/L GB效果最佳。
4 结 论
本研究以NaCl模拟盐胁迫条件,添加5 g/L外源甜菜碱能有效提高盐胁迫下千屈菜种子萌发和幼苗生长,促进幼苗叶片中叶绿素和可溶性蛋白(3 g/L GB时效果最佳)的形成,提高POD、SOD和CAT活性,降低MDA含量,有效缓解盐胁迫对千屈菜种子萌发和幼苗生长的抑制作用。本研究仅开展了千屈菜种子萌发及幼苗盆栽处理试验中部分生理生化指标的测定,还有待进一步开展大田生产栽培实践进行探讨。

