宁夏贺兰山东麓老龄葡萄园土壤真菌群落结构分析
潘新宇,李 茜,2, 刘松涛,何 俊,2,孙兆军,2,4
(1宁夏大学 地理科学与规划学院,宁夏 银川 750021;2教育部中阿旱区特色资源与环境治理国际合作联合实验室,宁夏 银川 750021; 3宁夏职业技术学院,宁夏 银川 750021;4宁夏(中阿)旱区资源评价与环境调控重点实验室,宁夏 银川 750021)
葡萄作为世界上主要种植果树之一,在我国的栽培历史十分悠久。葡萄树的树龄平均在60年左右,当树龄超过20~30年后,植株会陆续出现衰老现象,导致生产力下降,影响果农的收入[1]。宁夏回族自治区的葡萄种植已形成了一定的产业规模,在多年的发展下,已经成为了当地的特色优势产业[2]。由于受到社会经济效益、栽培结构的约束以及人为栽培习惯的影响,宁夏地区葡萄连作的时间、面积不断加大[3]。目前,随着葡萄种植年限的延长,当地许多老龄葡萄园陆续出现低产量、高病虫害等问题,已成为宁夏地区葡萄种植产业可持续发展的主要制约因素[4]。
真菌是土壤中的重要微生物组成,在植物多样性和生态系统生产力维护方面起着重要的作用[5]。土壤真菌与土壤环境是否有相同或不同的地理分布格局,以及是哪些驱动因素导致此类格局的出现,是当今众多学者研究的热点课题[6]。Benizri等[7]研究发现,长期种植桃树会导致土壤中的病原菌芽孢杆菌(Bacillu)含量显著增加。Weller等[8]研究指出,细菌在根际土壤间的相对丰度较非根际土壤高10~100倍;土壤养分失衡、微生物群落结构紊乱、前茬作物残留毒害等是目前普遍认同的引起葡萄种植问题的主要原因[9]。蔺君娜等[10]研究发现,葡萄的不同栽培方式会引起根际土壤真菌、细菌数量变化上的差异;史芳芳等[11]研究发现,葡萄根际土壤真菌丰度组成特征表现为子囊菌门、担子菌门真菌所占丰度最高。目前针对宁夏贺兰山东麓老龄葡萄根际与非根际土壤不同土层深度真菌群落的组成及多样性变化尚缺乏系统的研究。
土壤微生物对葡萄种植能产生生长抑制和促进作用,促进作用表现为根际土壤中的部分微生物因自身功能可以帮助植物生长代谢,抑制作用则体现在土壤病原菌对植物生长发育过程的损害以及由于连作引起的土壤微生物群落、结构改变[12]。为了深入研究宁夏贺兰山东麓老龄葡萄园土壤真菌群落组成及物种多样性,本研究对该地区种植20年的葡萄园根际与非根际土壤真菌群落进行高通量测序,分析长期种植葡萄后根际与非根际土壤真菌种群结构及多样性的变化,以期为宁夏贺兰山东麓老龄葡萄园的科学管理和可持续发展提供理论依据。
1 材料与方法
1.1 试验区概况
试验区位于宁夏回族自治区贺兰山东麓青铜峡市甘城子“宁夏西鸽酒庄葡萄种植示范基地”,地处105°55′01″ E,38°03′28″ N。为中温带大陆性气候,年均降水量为185.4 mm,试验地土壤类型为普通灰钙土[13]。试验区土壤的基本理化性质见表1。

表1 试验区土壤基本理化性质Table 1 Soil basic properties in experiment field
1.2 土壤样品采集
选取贺兰山东麓种植20年的酿酒葡萄“赤霞珠”葡萄园,在园内挑选3个植株长势相对均匀的样地(样地面积200 m×200 m,同时避开田埂和道路),每个样地按对角线法选取5株生长健壮的葡萄植株,采用抖落法[14],于2021年6月中旬分别采集0~20,20~40,40~60 cm土层植株根际土壤和非根际土壤。采集根际土壤时,先抖落葡萄根系上的大块土粒,再使用毛刷将吸附在根系上的残留土壤刷落收集,收集的5株土样混合为一个样品,3个样地3次重复,0~20,20~40,40~60 cm土层根际土壤依次记为CS20、CS40和CS60;采集非根际土壤时,选择距主根1.5 m处无葡萄根系分布且未受人为影响的区域垂直挖取,收集的5株土样混合为一个样品,3个样地3次重复,0~20,20~40,40~60 cm土层的非根际土壤依次记为NCS20、NCS40、NCS60。将采集到的土壤样本收集到灭菌的冷冻离心管置于液氮罐中带回实验室,于-80 ℃低温保存用于高通量测序[15]。
1.3 土壤真菌检测方法
根据CTAB法[16]进行土壤样品基因组DNA的提取,然后通过琼脂糖凝胶电泳检测DNA的浓度和纯度,使用无菌水将样品稀释至1 ng/μL;以所获取的基因组DNA 作为模板,使用真菌内转录区间(ITS1-ITS2)的特异性引物(ITS1F:5′-CTTGGTCATTTAGAGAAGTAA-3′;ITS2:5′-GCTG-CTGCGTTCTTCATCGATGGC-3′)进行PCR扩增[17]。使用Thermofisher公司的Ion Plus Fragment Library Kit 48 rxn建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后进行上机测序。
使用Cutadapt(V1.9.1)对读长(reads)进行低质量部分剪切、过滤、嵌合体序列比对等操作后,得到最终的有效数据(clean reads)[18-19]。使用Uparse(v7.0.1001)对所有样品全部有效数据进行聚类,以97%一致性将序列聚类成OTUs(Operational Taxonomic Units)[20],使用QIIME(v1.9.1)软件进行物种注释分析[21],确定真菌物种组成(门、纲、目、科、属)及其相对丰度等信息,进一步采用α多样性(alpha diversity)分析样品真菌群落的丰富度(Chao1、ACE)和多样性(Shannon、Simpson);采用花瓣图分析不同土样共有的OTUs;采用β多样性(beta diversity)分析样品真菌群落的结构特征(Weighted Unifrac距离),挖掘样品之间的差异[22]。PCR扩增及测序委托北京诺禾致源科技股份有限公司进行。
1.4 数据分析
使用Excel 2019软件进行数据整理,用SPSS2 6.0软件对α多样性指数进行单因素方差分析(one way ANOVA,Tukeyt-test)。
2 结果与分析
2.1 土样测序质量分析
对葡萄根际土壤与非根际土壤18个样品(每个土样3次重复)进行测序后,共获得1 483 999对读长(reads),通过筛选后得到1 442 891条有效数据,其中根际土壤获得721 321条有效数据,非根际土壤获得721 570条有效数据。以97%一致性对所有样品的有效数据进行聚类分析,共获得1 056个用于分类的OTUs。根际土壤中用于分类的真菌OTUs为911个,非根际土壤中用于分类的真菌OTUs为955个。稀释曲线是从样品中随机抽取定量数据,用来直接反映测序数据量的合理性。由图1可知,当抽取的序列数超过19 944条时曲线平缓,表明测序结果合理可靠。
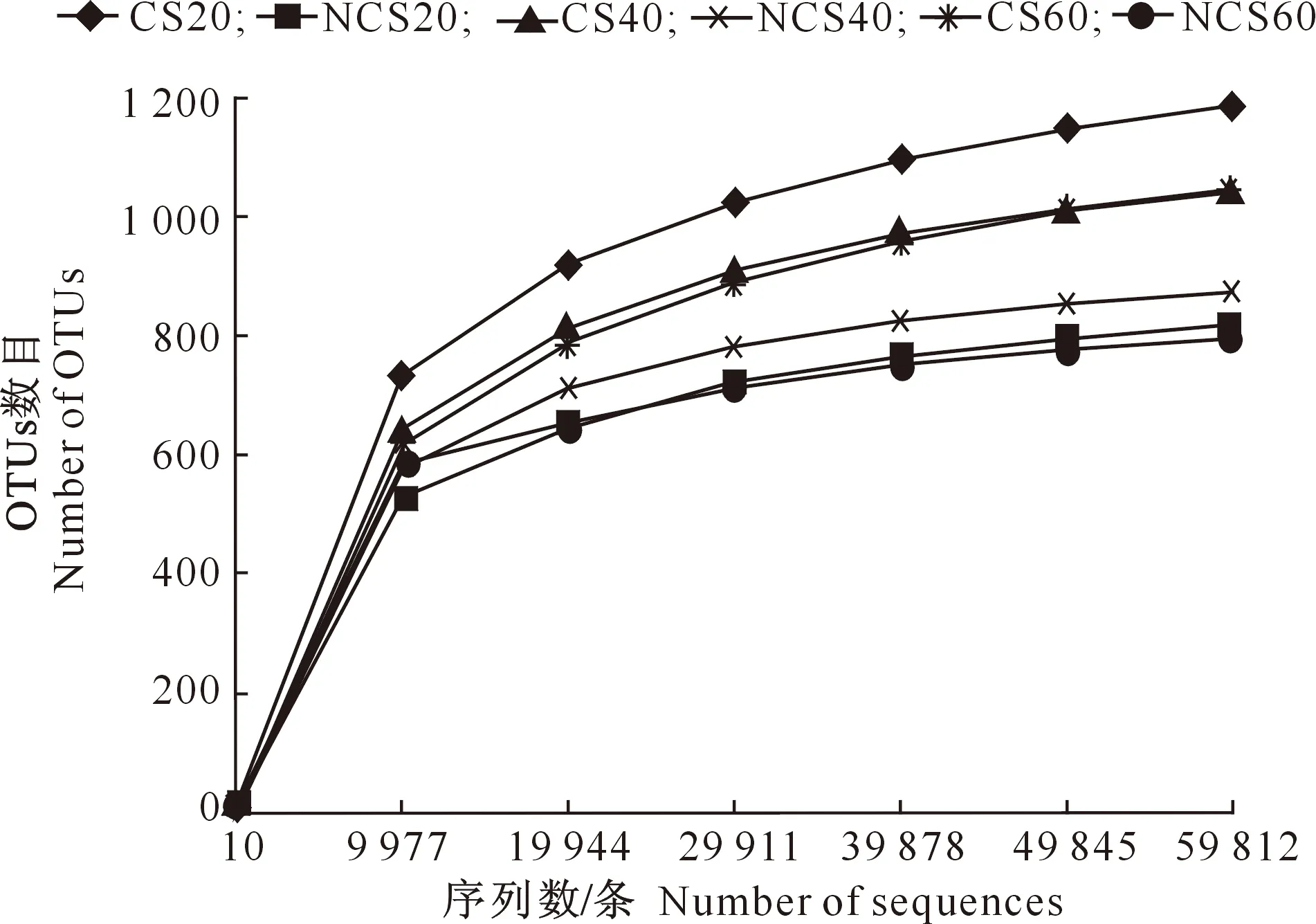
图1 贺兰山东麓老龄葡萄根际与非根际土壤真菌 OTUs数量稀释曲线Fig.1 Dilution of OTUs number of aged grape rhizosphere and non-rhizosphere soil fungi at the eastern foot of Helan Mountain
2.2 葡萄根际与非根际土壤真菌α多样性分析
贺兰山东麓老龄赤霞珠葡萄根际与非根际土壤真菌的α多样性指数如表2所示,其中Chao1、ACE指数和Shannon、Simpson指数分别为表征群落分布的丰富度指数和多样性指数。由表2可见,CS20、CS40、CS60的ACE指数平均值分别为1 296.32,1 141.76和1 161.90,而NCS20、NCS40、NCS60的ACE指数平均值分别为870.21,920.83和847.87,表明群落分布丰富度ACE指数在各垂直土层中均表现为根际土壤>非根际土壤,且根际土壤与非根际土壤间均存在显著性差异(P<0.05)。Chao1指数的变化规律与ACE指数一致。CS20、CS40、CS60的Shannon指数平均值分别为7.15,6.49和6.04,而NCS20、NCS40、NCS60的Shannon指数平均值分别为6.61,6.52和6.09,表明在0~20 cm土层中,根际土壤真菌群落多样性显著高于非根际土壤,而在20~40和40~60 cm土层中二者差异不显著。
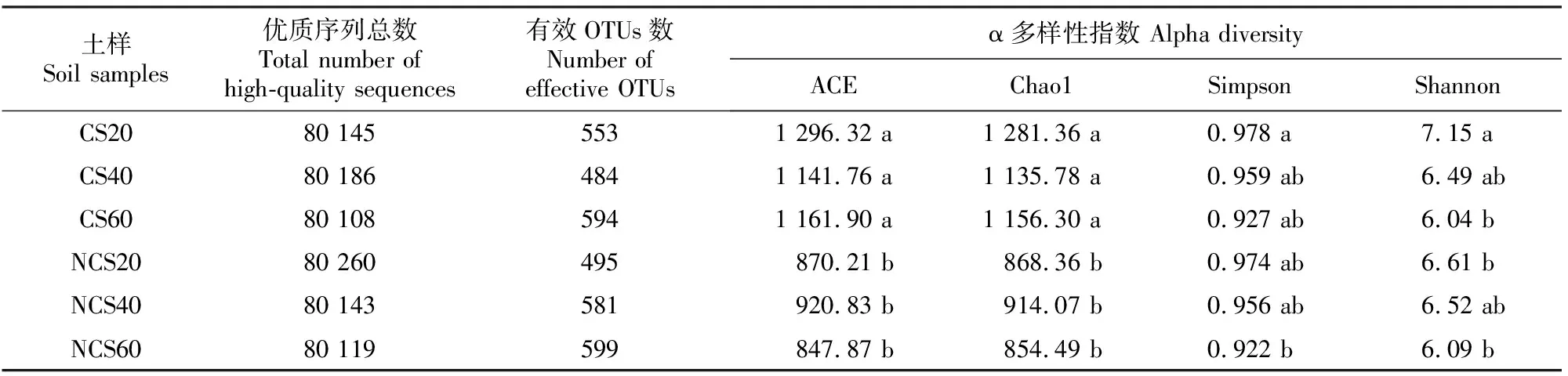
表2 贺兰山东麓老龄葡萄根际与非根际土壤0~60 cm土层真菌α多样性指数的比较Table 2 Comparison of α diversity index of aged grape rhizosphere and non-rhizosphere soils in 0-60 cm soil layers at eastern foot of Helan Mountain
花瓣图可以直接反映不同土样之间共有和特有的OTUs。贺兰山东麓老龄赤霞珠葡萄根际土壤与非根际土壤真菌OTUs花瓣图如图2所示。图2显示,经测序分析共得到1 056个OTUs,各样本间共有OTUs数量为360个。其中CS20、NCS20特有OTUs数量分别为193和135个;CS40、NCS40特有OTUs数量分别为124和221个;CS60、NCS60特有OTUs数量分别为234和239个。综合α多样性指数和OTUs花瓣图,可以发现葡萄根际土壤与非根际土壤真菌组成较为丰富,但在真菌组成结构、丰富度上存在一定差异。
2.3 葡萄根际与非根际土壤垂直土层真菌组成分析
物种组成分析可以反映样本在分类学上的群落结构[11]。物种注释分析表明,贺兰山东麓老龄赤霞珠葡萄根际与非根际土壤样本中的真菌分属17门、47纲、109目、211科、346属。图3展示了门水平上物种相对丰度排在前10位的分类结果,分别为子囊菌门(Ascomycota)、被孢霉菌门(Mortierellomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、毛霉亚菌门(Mucoromycota)、球囊菌门(Glomeromycota)、Aphelidiomycota门、Calcarisporiellomycota门、芽枝霉菌门(Blastocladiomycota)和Rozellomycota门,其中子囊菌门、被孢霉菌门和担子菌门在所有土壤样品中都属于优势菌门,其平均相对丰度分别为51.04%,5.68%,4.89%,在CS20中的相对丰度分别为44.16%,11.20%和8.37%,在NCS20中的相对丰度分别为52.28%,1.06%和5.15%,在CS40中的相对丰度分别为43.91%,11.80%和6.38%,在NCS40中的相对丰度分别为43.05%,3.38%和3.37%,在CS60中的相对丰度分别为57.52%,5.95%和3.27%,在NCS60中的相对丰度分别为65.30%,1.43%和2.82%。
对比分析根际土壤与非根际土壤可以发现,被孢霉菌门在CS20、CS40、CS60中的相对丰度分别是NCS20、NCS40、NCS60的10.57,3.49和4.16倍;担子菌门在CS20、CS40、CS60中的相对丰度分别是NCS20、NCS40、NCS60的1.63,1.89和1.16倍;子囊菌门在CS40中的相对丰度是NCS40的1.02倍,在NCS20、NCS60中的相对丰度分别是CS20、CS60的1.18和1.14倍。该结果表明,被孢霉菌门和担子菌门在根际土壤各垂直土层中均有富集,而子囊菌门仅在20~40 cm土层根际土壤(CS40)中富集。

图2 贺兰山东麓老龄葡萄根际与 非根际土壤真菌OTUs花瓣图Fig.2 OTUs petals of aged grape rhizosphere soil and non-rhizosphere soil fungi at the eastern foot of Helan Mountain

图3 贺兰山东麓老龄葡萄根际与非根际真菌门水平相对丰度的比较Fig.3 Comparison of horizontal relative abundance of phyla between rhizosphere soil and non-rhizosphere soil of aged grape at the eastern foot of Helan Mountain
由图4可以发现,在纲、目、科、属水平上,20年赤霞珠葡萄根际与非根际土壤样品真菌在群落组成和丰度上存在不同。
在纲水平上,粪壳菌纲(Sordariomycetes)是CS20、CS40、CS60中的第一优势菌种,其相对丰度分别为28.09%,26.55%和34.77%;其次是被孢霉菌纲(Mortierellomycetes),其相对丰度分别为11.20%,11.08%和5.95%;再次是锤舌菌纲(Leotiomycetes),其相对丰度分别为2.49%,9.65%和9.65%。作为子囊菌门(Ascomycota)中的第一大纲,粪壳菌纲相对丰度在葡萄根际土壤不同土层中差异较大,其在CS60中的相对丰度是CS40与CS20的1.31和1.24倍(图4-A)。
在目水平上,肉座菌目(Hypocreales)是CS20、CS40、CS60中的第一优势菌种,其相对丰度分别为25.25%,23.84%和29.23%;其次是被孢霉菌目(Mortierellales),其相对丰度分别为11.20%,11.08%和5.95%;再次是Thelebolales目,其相对丰度分别为1.90%,6.34%和5.24%(图4-B)。
在科水平上,丛赤壳菌科(Nectriaceae)是CS20、CS40、CS60中的第一优势菌种,其相对丰度分别为20.17%,20.51%和24.63%;其次是被孢霉菌科(Mortierellaceae),其相对丰度分别为11.20%,11.08%和5.94%;再次是嗜热囊菌科(Pseudeurotiaceae),其相对丰度分别为0.68%,2.23%和6.94%(图4-C)。

图4 贺兰山东麓老龄葡萄根际与非根际土壤真菌纲(A)、目(B)、科(C)和属水平(D)的相对丰度Fig.4 Relative abundance of fungi at class (A),order (B),family (C) and genus level (D) of aged grape rhizosphere soil and non-rhizosphere soil at the eastern foot of Helan Mountain
在属水平上,新丛赤壳菌属(Neonectria)是CS20、CS40、CS60中的第一优势菌种,其相对丰度分别为3.60%,9.48%和18.33%;其次是被孢霉菌属(Mortierella),其相对丰度分别为7.05%,10.35%和5.46%;再次是Dactylonectria属,其相对丰度分别为8.11%,6.82%和3.41%。其中,新丛赤壳菌属和Dactylonectria属真菌群落相对丰度在CS20、CS40、CS60间发生了明显变化。CS60中新丛赤壳菌属的相对丰度是CS40和CS20的1.93和5.09倍,Dactylonectria属在CS40和CS20的相对丰度是CS60的2.38和2.00倍(图4-D)。另外,测序分析发现,在0~20,20~40和40~60 cm土层根际土壤中,小球腔菌属(Leptosphaeria)真菌相对丰度分别为0.67%,2.22%和6.48%,可知其相对丰度在根际土壤垂直土层中呈递增趋势。
在纲水平上,NCS20、NCS40和NCS60的第一优势菌种均为粪壳菌纲,其相对丰度分别为36.32%,24.56%和37.21%;其次是散囊菌纲(Eurotiomycetes),其相对丰度分别为6.67%,4.09%和17.64%;再次是座囊菌纲(Dothideomycetes),其相对丰度分别为6.97%,8.40%和4.26%(图4-A)。
在目水平上,NCS20、NCS40和NCS60的第一优势菌种均为肉座菌目,其相对丰度分别为21.73%,11.37%和31.29%;其次为散囊菌目(Eurotiales),其相对丰度分别为6.55%,3.52%和17.30%;再次为格孢腔菌目(Pleosporales),其相对丰度分别为5.96%,7.65%和3.10%(图4-B)。
在科水平上,NCS20、NCS40和NCS60的第一优势菌种均为丛赤壳菌科,其相对丰度分别为19.45%,9.63%和29.91%;其次为曲霉菌科(Aspergillaceae),其相对丰度分别为6.53%,3.48%和16.73%(图4-C)。
在属水平上,NCS20、NCS40和NCS60的第一优势菌种均为镰刀菌属(Fusarium),其相对丰度分别为11.34%,6.91%和26.50%;其次为青霉菌属(Penicillium),其相对丰度分别为6.29%,3.12%和16.27%;再次为Zopfiella属,其相对丰度分别为3.89%,4.11%和0.30%。非根际土壤中,青霉菌属相对丰度在0~20,20~40和40~60 cm土层间发生了明显变化,其在NCS60中的相对丰度分别是NCS40和NCS20的5.21和2.59倍(图4-D)。
2.4 葡萄根际与非根际土壤水平土层真菌组成分析
由图4可知,真菌群落相对丰度不仅在垂直深度间存在差异,而且各水平土层间也存在差异。在0~20 cm土层的根际与非根际土壤之中,镰刀菌属、新丛赤壳菌属、青霉菌属、被孢霉菌属、Zopfiella属真菌的相对丰度均发生了明显改变。其中NCS20中的青霉菌属和Zopfiella属真菌的相对丰度是CS20的104.83和389.00倍,CS20中的新丛赤壳菌属和被孢霉菌属真菌的相对丰度是NCS20的60.00和6.78倍。说明在0~20 cm土层根际土壤中,青霉菌属和Zopfiella属真菌丰度急剧降低,新丛赤壳菌属和被孢霉菌属真菌明显富集。
由图4还可知,在20~40 cm土层的根际与非根际土壤中,真菌属水平的物种丰度发生了明显变化。NCS40中的青霉菌属和Zopfiella属真菌的相对丰度分别是CS40的31.20和411.00倍,CS40中的新丛赤壳菌属和被孢霉菌属真菌的相对丰度分别是NCS40的189.60和3.24倍。说明在20~40 cm土层中,青霉菌属和Zopfiella属真菌主要富集在非根际土壤中,而新丛赤壳菌属和被孢霉菌属真菌主要富集在根际土壤中。
由图4还可知,在40~60 cm土层的根际与非根际土壤中,NCS60中的青霉菌属真菌相对丰度是CS60的95.71倍;CS60中的新丛赤壳菌属和被孢霉菌属真菌相对丰度分别是NCS60的216.86和4.20 倍。此外,CS60与NCS60中的镰刀菌属、小球腔菌属和Dactylonectria属真菌相对丰度也发生了明显变化。NCS60中的镰刀菌属真菌的相对丰度是CS60的18.15倍,CS60中的小球腔菌属和Dactylonectria属真菌的相对丰度分别是NCS60的162.00和113.67倍。该结果说明,长期种植葡萄引起了同一深度根际与非根际土壤中真菌物种丰度的改变,与非根际土壤相比,根际土壤中镰刀菌属、青霉菌属、Zopfiella属真菌的相对丰度均有不同程度降低,而新丛赤壳菌属、被孢霉菌属、小球腔菌属和Dactylonectria属真菌的相对丰度均有所提高,其中小球腔菌属和Dactylonectria属真菌相对丰度在40~60 cm土层中变化最为明显。
综上可知,在老龄葡萄根际与非根际土壤之间,土壤真菌的平均相对丰度在属水平上发生了显著变化。其中,根际土壤中新丛赤壳菌属、Dactylonectria属、小球腔菌属、假裸囊球菌属真菌的平均相对丰度分别是非根际土壤的174.5,122.2,156.0和133.3倍,而非根际土壤中镰刀菌属、青霉菌属、Zopfiella属真菌的平均相对丰度分别是根际土壤的4.4,77.8和277.0倍。
2.5 葡萄根际与非根际土壤真菌β多样性分析
在β多样性研究中,常用Weighted Unifrac距离指标来衡量2个样品间的相异系数,其值越小,表示这2个样品在物种多样性方面存在的差异越小。贺兰山东麓老龄赤霞珠葡萄根际与非根际土壤Weighted Unifrac距离的比较结果见表3。

表3 贺兰山东麓老龄赤霞珠葡萄根际与非根际土壤Weighted Unifrac距离的比较Table 3 Comparison of Weighted Unifrac distance between aged grape rhizosphere soil and non-rhizosphere soil at the eastern foot of Helan Mountain
表3结果表明,种植20年葡萄根际土壤真菌物种多样性随着土层深度的增加差异逐渐变大。与非根际土壤相同深度土层相比,根际土壤CS20、CS40和CS60间的物种多样性指数(0.640,0.643,0.797)均小于1,表明根际土壤垂直方向各土层间真菌物种多样性差异更小。
3 讨论与结论
土壤微生物作为土壤生态系统中的分解者和消费者,伴随着自然界各圈层间复杂的物质能量流动过程,因此土壤微生物多样性能反映土壤的性质[23],土壤中的微生物也能在短时间内对土壤环境的变化产生大幅度反应[24]。根际土壤指植物根系范围内狭窄区域上的土壤,既是植物根系与土壤环境直接接触的狭小界面,也是与植物生长发育最为密切的外部环境[25]。土壤微生物是植物根际土壤中最为活跃的组成成分,同时也是评价土壤养分状况的指标之一。土壤中的优势真菌群落是决定某一微生物群落生态平衡的关键因素,直接影响着微生物群落的组成、群落结构和群落的演替[12];此外,根际土壤中真菌群落变化对植株影响明显,如腐生型真菌对动植物凋落物有分解作用[26],外生型真菌与植物产生共生作用[27],病原菌可使植株患病几率增加[28]。
贺兰山东麓种植20年的酿酒葡萄赤霞珠陆续表现出衰老现象,已成为当地葡萄产业可持续发展的制约因素,本研究对其根际与非根际土壤的真菌群落结构进行的高通量测序结果显示,根际土壤真菌群落分布的丰富度指数Chao1和ACE大于非根际土壤,说明在长期种植葡萄后,根际土壤真菌群落丰度在各垂直土层中均发生富集,其中0~20 cm土层表现最为明显,这与王晓雯等[29]和杨景成等[30]的研究结果相似。群落分布多样性指数Shannon和Simpson在20~60 cm土层根际与非根际土壤间差异不显著,二者仅在0~20 cm土层的根际与非根际土壤间存在显著差异,且根际土壤中真菌群落多样性大于非根际土壤,说明葡萄长期种植后引起了耕作层土壤真菌群落分布的改变,这与李坤等[31]和赵兴鸽等[32]的研究结果一致。
本研究对贺兰山东麓种植20年的赤霞珠葡萄不同垂直深度根际和非根际土壤真菌多样性的分析表明,供试土壤样本中真菌分属17门、47纲、109目、211科、346属。其中子囊菌门、被孢霉菌门和担子菌门真菌在葡萄根际与非根际土壤门水平中均为优势菌群,这与Pinto等[33]和陈伟等[34]的研究结果相似。子囊菌门真菌对环境具有较高的适应性,且多为腐生菌[35],但在本试验中,与非根际土壤相比,在0~20和40~60 cm 土层中葡萄根际土壤中的子囊菌门真菌相对丰度均出现了不同程度的降低,其中耕作层(0~20 cm)表现最为明显,下降幅度达8.12%,这可能与人为耕作、施肥及冬季覆土防冻等行为导致土壤机械结构破坏有关,最终使子囊菌门真菌的生长繁殖受到了抑制[36]。长期种植葡萄还改变了土壤真菌属水平的群落组成及结构,本研究检测到的优势真菌属分别为新丛赤壳菌属、被孢霉菌属、Dactylonectria属、小球腔菌属、假裸囊菌属、镰刀菌属、青霉菌属和Zopfiella属。其中,新丛赤壳菌属、Dactylonectria属、小球腔菌属、假裸囊菌属真菌在各土层非根际土壤中的相对丰度均较低,而在葡萄各土层根际土壤中相对丰度明显提高,CS60中的新丛赤壳菌属、小球腔菌属真菌相对丰度分别是NCS60的261.86和162.00倍,CS60中的Dactylonectria属真菌相对丰度是NCS60的113.67倍;而镰刀菌属、青霉菌属、Zopfiella属真菌的相对丰度在根际土壤中出现了不同程度的降低,这与王海英等[37]、马玉彤等[38]和刘芳[39]的研究结果相似,主要原因可能与各类菌群的最适生长环境不同有关[40]。
土壤微生物群落结构、物种丰度变化对植物病害存在关键性影响[41]。据叶清桐等[42]研究报道,常见葡萄病害的发生主要与隐球壳菌属(Cryptosphaeria)、镰刀菌属、Dactylonectria属、链格孢霉菌属(Alternaria)真菌等病原菌相关。也有研究表明,镰刀菌属真菌对葡萄霜霉病能够起到预防作用[43]。本研究分析发现,镰刀菌属真菌相对丰度在贺兰山东麓种植20年葡萄根际土壤各垂直土层中均呈下降趋势,下降幅度达3.21%~25.04%,这可能导致葡萄患霜霉病的几率增加。Dactylonectria属真菌隶属于粪壳菌纲(Sordariomycetes)、肉座菌目(Hypocreales)、赤壳菌科(Nectriaceae),Weber等[44]首先报道Dactylonectria属真菌是植株黑根病的主要致病菌,目前在16个国家均有相关报道[42]。本研究发现,Dactylonectria属真菌在研究区葡萄根际土壤各垂直土层中均已成为优势菌属,且相对丰度较非根际土壤明显提高,提高幅度可达1.37%~5.57%,表明贺兰山东麓种植20年赤霞珠葡萄的黑根病患病几率可能增大。葡萄溃疡病目前在中国国内11个省份均有报道,且丛赤壳菌科、新丛赤壳菌属真菌是引起“红地球”、“夏黑”、“赤霞珠”等葡萄品种的主要致病菌[45]。本试验结果表明,丛赤壳菌科真菌在研究区葡萄20~40 cm土层根际土壤中的相对丰度是非根际土壤的2.13倍;CS60中新丛赤壳菌属真菌的相对丰度达18.33%,是NCS60的261.86倍。
本研究结果表明,宁夏贺兰山东麓老龄葡萄园根际土壤与非根际土壤真菌多样性存在显著差异,其中,各垂直土层中根际土壤Chao1、ACE指数均显著高于非根际土壤。Weighted Unifrac距离指标分析表明,各土层根际土壤间物种多样性与非根际土壤相比差异更小,物种多样性组成结构更相似,不利于维持根际土壤真菌群落的微生态平衡。根际土壤镰刀菌属真菌相对丰度降低,Dactylonectria属和新丛赤壳菌属真菌等病原菌相对丰度提高,这种变化使葡萄植株患病风险加大,应进一步深入研究。

