血清CEA、CA19-9、CA72-4、G-17、PGⅠ、PGⅡ在胃癌中的表达及意义*
史跃燕,林 兰,顾益凤,刘红利
江苏省南通市肿瘤医院检验科,江苏南通 226000
我国每年新增胃癌病例数高达40万,死亡病例数达35万,新增病例数和死亡病例数均占全球总病例数的40%[1],但我国胃癌早期检出率不到10%[2],与韩国和日本相比,差距较大[3]。据预测,2040年中国胃癌新增病例及死亡病例将分别增加67.6%和82.4%[4]。胃癌对人类的健康构成了严重的威胁[5]。胃癌早期是指癌组织限于胃黏膜层及黏膜下层,不论其范围大小和有无淋巴结转移[6],胃癌早期患者经有效治疗后,5年生存率可达90%[7]。若病灶未及时发现和治疗,胃癌发展期患者经手术治疗后,5年生存率仅在30%左右[8]。因此有效筛查胃癌早期对预防和改善胃癌患者的预后有着十分重要的意义[9]。肿瘤标志物癌胚抗原(CEA)、糖类抗原(CA)19-9、CA72-4、胃泌素-17(G-17)、胃蛋白酶原(PG)Ⅰ、PGⅡ等因其检测简便、创伤小在胃癌早期筛查中的应用越来越广泛。但是单项肿瘤标志物检测也容易造成胃癌早期的漏诊[10],因此合理地选择联合检测项目既能提高筛查率又可以降低患者的负担,部分肿瘤标志物还可用于术后疗效监测。
1 资料与方法
1.1一般资料 选取2019年8月至2020年5月本院胃癌住院患者68例为胃癌组,其中男51例,女17例,48例进行了手术治疗;贲门+胃底部癌30例,胃窦+胃角部癌26例,胃体部癌11例,全胃癌1例。选取同期本院的胃部良性病变患者84例为良性病变组,体检健康者150例为对照组。胃部良性病变患者中胃息肉34例,胃炎32例,胃息肉伴胃炎患者15例,胃排空障碍者3例。
1.2方法 所有受试者均为清晨空腹抽取静脉血,自然凝固后离心取上清液,行实验室质量控制,质控均在控后测定结果,CEA、CA19-9、CA72-4采用电化学发光法在罗氏E601全自动化学发光免疫分析仪上测定,PGⅠ、PGⅡ和G-17在Maglimi全自动化学发光仪上测定。
1.3统计学处理 采用SPSS21.0软件进行数据处理和分析。不呈正态分布的计量资料以M(P25,P75)表示,多个独立样本比较采用Kruskal-WalisH检验,多样本两两比较采用Mann-WhitneyU检验;采用Spearman相关进行相关性分析;采用受试者工作特征(ROC)曲线评价各检测指标的诊断价值。以P<0.05为差异有统计学意义 。
2 结 果
2.1各组CEA、CA19-9、CA72-4、G-17、PGⅠ、PGⅡ水平及PGⅠ/PGⅡ(PGR)比较 G-17、PGⅡ和PGR在对照组和良性病变组间比较,差异有统计学意义(P<0.05);CEA、CA72-4、PGⅠ、PGⅡ和PGR在良性病变组和胃癌组间比较,差异有统计学意义(P<0.05);与对照组比较,胃癌组CEA、CA19-9、CA72-4、G-17、PGⅠ、PGⅡ、PGR差异均有统计学意义(P<0.05)。见表1。

表1 对照组、良性病变组和胃癌组肿瘤标志物测定结果[M(P25,P75)]
2.2CEA、CA19-9、CA72-4、G-17、PGⅠ、PGⅡ、PGR与胃癌患者临床病理特征间的关系 CA19-9水平、PGR在胃癌患者不同病变部位间比较,差异有统计学意义(P<0.05),两两比较结果表明,CA19-9在贲门+胃底部和胃窦+胃角部间比较,差异有统计学意义(P<0.05)。各肿瘤标志物水平和PGR在胃癌患者是否转移、性别和年龄间的比较,差异均无统计学意义(P>0.05)。见表2。
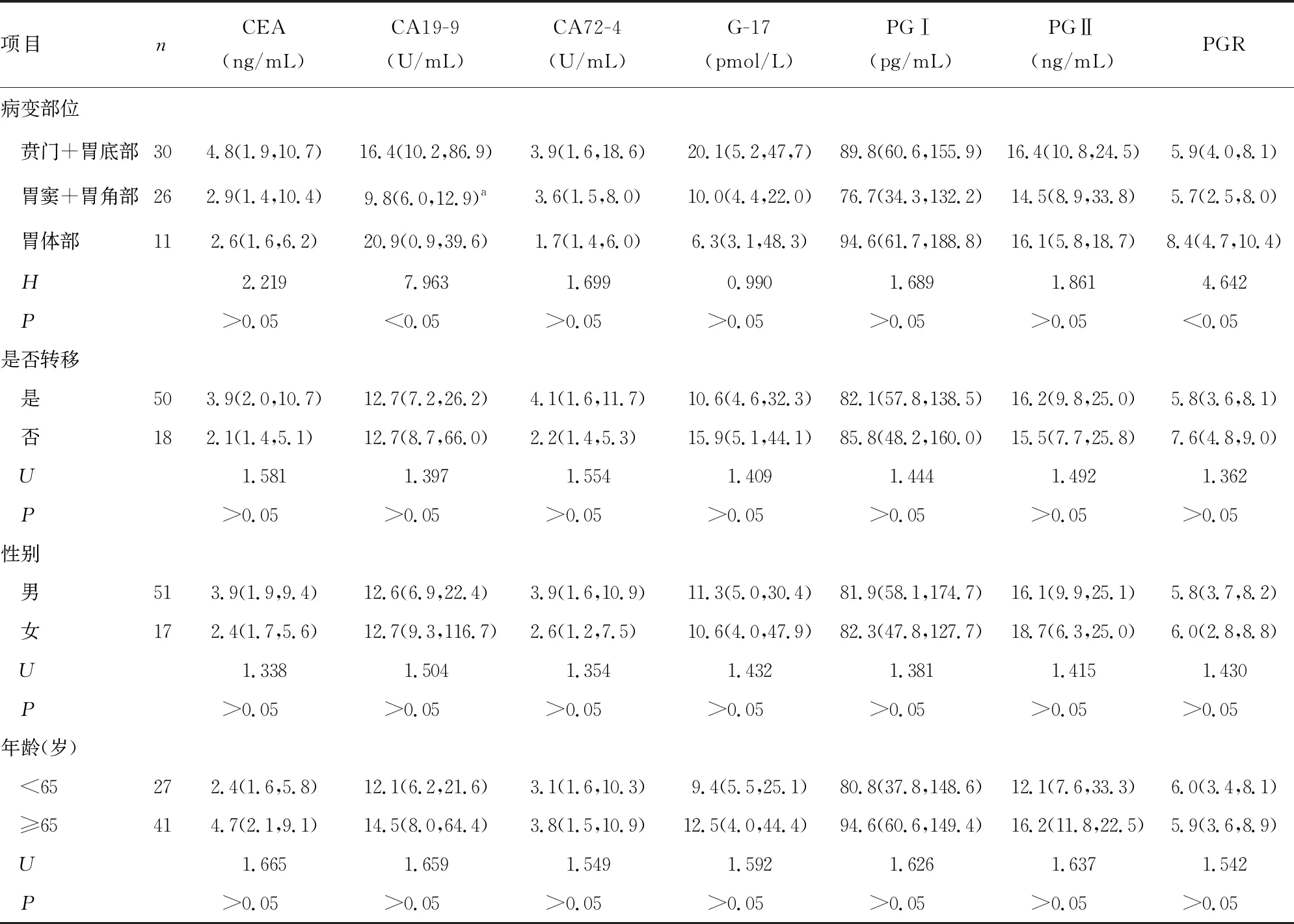
表2 CEA、CA19-9、CA72-4、G-17、PGⅠ、PGⅡ、PGR与胃癌患者临床病理特征间的关系[M(P25,P75)]
2.3Spearman相关性分析 相关性分析结果表明,CEA和CA19-9(P=0.009,r=0.316)、CEA和CA724(P=0.001,r=0.427)、PGⅠ和PGⅡ(P=0.001,r=0.616)、PGⅠ和G-17(P=0.013,r=0.299)、PGⅡ和G-17(P=0.013,r=0.299)均呈正相关,其余肿瘤标志物间无明显相关性(均P>0.05)。
2.4ROC曲线分析 PGⅡ诊断胃癌的灵敏度为63.2%,特异度为86.0%,曲线下面积(AUC)为0.725,诊断效能明显优于其他肿瘤标志物,见表3。同时选取诊断效能较高的前3种肿瘤标志物(CA19-9、PGⅠ、PGⅡ)进行联合诊断,结果发现3项指标联合诊断并无优势,PGⅠ和PGⅡ联合诊断的准确度最高,见表4。
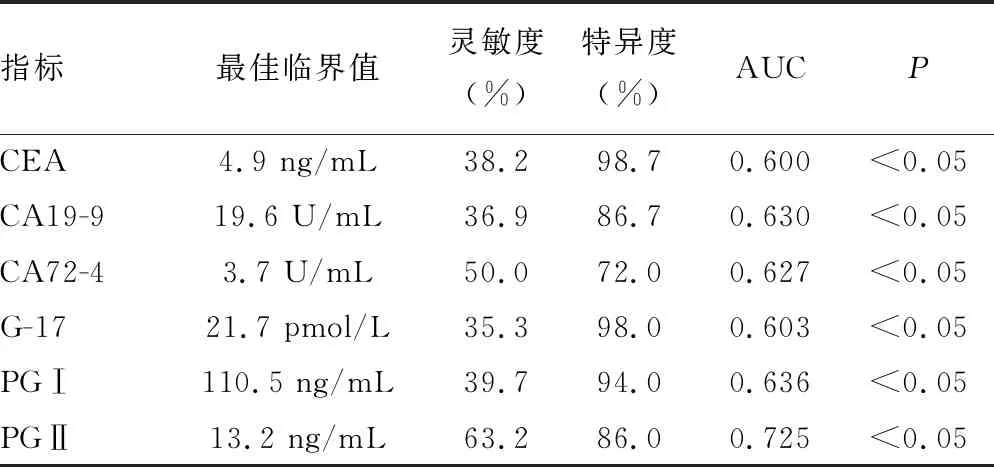
表3 各血清肿瘤标志物对胃癌的诊断价值
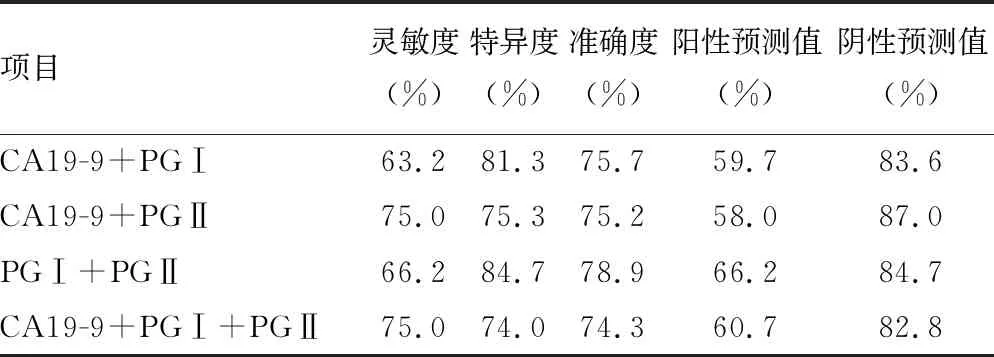
表4 CA19-9、PGⅠ、PGⅡ联合诊断对胃癌的诊断价值
2.5胃癌患者手术前后G-17和PGⅡ水平比较 68例胃癌患者中有48例进行了手术治疗,手术前后G-17水平差异有统计学意义(P=0.001),但PGⅡ水平差异无统计学意义(P=0.593),见图1。

注:A为胃癌患者手术前后G-17水平变化情况;B为胃癌患者手术前后PGⅡ水平变化情况。
3 讨 论
PG是胃蛋白酶的无活性前体,根据电泳迁移率将迁移率较快且免疫原性相近的1~5组分称为PGⅠ,组分6和7则称为PGⅡ。PGⅠ主要由胃底腺细胞分泌,因此能反映胃底腺细胞的分泌功能。而PGⅡ由胃贲门的贲门腺、胃窦部的幽门腺和近十二指肠腺产生[11],由于PGⅡ分布较为广泛,结果相对稳定,能反映全胃功能。
在本研究中PGⅠ在良性病变组和对照组间的水平差异无统计学意义(P>0.05),而PGⅡ、G-17和PGR差异均有统计学意义(P<0.05),可能由于胃癌患者早期胃黏膜分泌异常,壁细胞分泌胃酸减少,使得胃蛋白酶转化量下降,从而出现PGⅠ水平正常的假象[12]。
G-17主要由胃窦G细胞分泌,在胃肠激素中生物活性最强,能够促进多种消化液和消化酶的分泌[13],主要生理学功能是促进肠嗜铬细胞释放组胺,进一步刺激壁细胞分泌胃酸,从而有效地促进胃黏膜的生长分化。G-17通过促进缺氧诱导因子-1α的表达调控血管内皮生长因子,促进血管内皮的生成和生长,为胃癌细胞的浸润和转移提供条件[14]。南寿山等[15]研究结果表明,G-17和PG联合检测可用于胃癌早期筛查。肖佛义等[16]的研究表明胃泌素在胃癌早期进程中有重要作用。本研究结果显示,对照组G-17水平明显低于良性病变组和胃癌组,但良性病变组和胃癌组G-17水平差异无统计学意义(P>0.05),表明G-17对胃癌疗效监测有一定的临床意义。本研究结果表明,G-17水平和胃癌是否转移无关,原因可能与标本量,胃癌发病区域等因素有关。饮食状况、炎症、胃酸分泌量等都会影响G-17的分泌,因此临床应联合PG对胃癌患者进行早期筛查[11]。
ZHANG等[17]经过长期随访发现,PG异常伴幽门螺杆菌(Hp)感染的人群胃癌发生率最高(5.6%),PG异常而Hp阴性的人群胃癌发生率为4.76%,PG正常而Hp阳性的人群胃癌发生率为1.84%,与本研究中PGⅠ、PGⅡ对胃癌的诊断效率最高(AUC分别是0.636、0.725)相符合。G-17、PGⅡ和PGR在对照组和良性病变组间比较,差异有统计学意义(P<0.05),据此推断G-17和PGⅡ可能在胃部良性病变过程中便发挥作用,这两项指标水平升高的患者应采用胃镜做一步筛查。各肿瘤标志物在胃癌患者是否转移、性别和年龄间比较,差异均无统计学意义(P>0.05)。相关性分析表明PGⅠ与PGⅡ呈正相关(P=0.001,r=0.616),二者均是胃癌初筛较好的指标。
CA19-9水平在贲门+胃底部和胃窦+胃角部间比较,差异有统计学意义(P<0.05),但CEA、CA19-9、CA72-4均系广谱肿瘤标志物,尤其是CA72-4为发现较早的胃癌肿瘤标志物,在多种肿瘤中均为阳性[18],对胃癌诊断的灵敏度和特异度都无法满足胃癌早期筛查的需求。使用胃镜进行肿瘤筛查的患者依从性差,费用昂贵,难以用于大规模早期筛查。研究发现,多项指标联合检测能提高胃癌高风险人群的检出率[19-20]。在本研究中,单项检测PGⅡ对胃癌诊断效能最高,选取诊断效能较高的前3项肿瘤标志物(CA19-9、PGⅠ、PGⅡ)进行联合诊断,发现3项指标联合诊断并无优势,PGⅠ和PGⅡ联合诊断的准确度最高。
因此,上述胃癌肿瘤标志物中,PGⅡ在胃癌早期大规模筛查中的诊断价值最大,其次是PGⅠ,合理地选择联合诊断项目,可提高诊断效能。G-17可作为胃癌术后动态监测指标,由于本研究标本量不够大,还需扩大标本量作进一步研究。

