白花蛇舌草-半枝莲药对乙酸乙酯组分对胃癌SGC-7901细胞周期的影响*
刘豪杰,陈雪蕾,包萨如拉
1.鄂州市中心医院,湖北 鄂州 436000; 2.内蒙古民族大学附属医院,内蒙古 通辽 028007
胃癌是全球范围内常见的恶性肿瘤之一,虽近些年我国胃癌发病率呈逐年下降趋势,但总体发病率仍高于世界平均水平[1]。中药作为我国特有的卫生资源,具有巨大的发掘潜力,白花蛇舌草、半枝莲在临床中常作为药对进行配伍,增强清热解毒、消痈散结的作用。高宏等在重建中气抗癌汤Ⅰ号中应用白花蛇舌草-半枝莲药对观察其对胃癌术后化疗不良反应的作用发现,其可降低肿瘤术后复发率、改善患者肠道菌群[2]。乙酸乙酯可提取中药中的有效成分,是药理学研究中常用的有机溶剂和萃取剂,研究发现,白花蛇舌草-半枝莲药对乙酸乙酯组分对胃癌SGC-7901细胞增殖能力有抑制作用,在激发肿瘤细胞线粒体自噬的同时,诱导细胞线粒体凋亡[3]。肿瘤是一种细胞周期性疾病,细胞周期蛋白的异常表达,将导致细胞周期调控异常、细胞增殖失控,最终导致肿瘤的形成[4]。虽有研究证实白花蛇舌草-半枝莲药对乙酸乙酯组分可抑制胃癌SGC-7901细胞增殖,但其对于细胞周期的影响鲜有报道。本研究拟从细胞周期变化及细胞周期关键蛋白表达角度着手,深入挖掘白花蛇舌草-半枝莲药对乙酸乙酯组分对胃癌SGC-7901细胞周期的抑制作用。
1 材料
1.1 细胞人胃癌SGC-7901细胞,购自北纳创联生物科技有限公司,货号:BNCC100674。
1.2 药物与试剂白花蛇舌草(内蒙古民族大学附属医院中药房,产地:河南,货号:200620);半枝莲(内蒙古民族大学附属医院中药房,产地:浙江,货号:191022)。兔抗细胞周期蛋白D1(Cyclin D1)多克隆抗体、兔抗c-Myc多克隆抗体及β-肌动蛋白(β-actin)多克隆抗体(英国Abcam公司,货号:ab134175、ab185656、ab179467);辣根过氧化物酶标记山羊抗兔IgG(H+L)抗体(上海碧云天生物技术有限公司,货号:A0208);BCA 蛋白定量检测试剂盒(上海源叶生物科技有限公司,货号:R21250-250T);结晶紫染色液(上海紫一试剂厂,货号:100137);CCK-8试剂盒(美国AbMole公司,货号:a953268);RNase A溶液(北京索莱宝科技有限公司,货号:R1030);碘化丙啶(propidium iodide,PI)(北京中科瑞泰生物科技有限公司,货号:SP4170)。
1.3 仪器WD-9413B型凝胶成像系统(北京六一生物科技有限公司);SD Cell型转移电泳槽(美国Thermo Fisher Scientific公司);VE-180型垂直电泳装置(上海天能科技有限公司);muLISKAN-MK3型酶标仪(美国Bio-Rad公司);Waters ACQUITY型超高液相色谱仪(美国Waters公司);FYL-YS-150L型恒温箱(北京福意联医疗设备有限公司);TGL-21M型高速冷冻离心机(上海卢湘仪离心机仪器有限公司,离心半径:10 cm);CytoFLEX型流式细胞仪(美国贝克曼公司)。
2 方法
2.1 白花蛇舌草-半枝莲药对乙酸乙酯组分制备及检测白花蛇舌草-半枝莲药对乙酸乙酯组分制备方法参考文献[5],具体如下:将白花蛇舌草、半枝莲按质量比11取材后进行3次煎煮,无菌纱布过滤,获得水提物,减压浓缩得到浸膏。取适量浸膏用石油醚回流脱脂后,再以乙酸乙酯进行多次萃取,浓缩干燥后获得白花蛇舌草-半枝莲药对乙酸乙酯组分,并计算提取率。提取率=目标物质质量/原料物质质量×100%。白花蛇舌草-半枝莲药对乙酸乙酯组分检测:取白花蛇舌草-半枝莲乙酸乙酯浸膏及对羟基苯乙酮、野黄芩苷、木犀草素、芹菜素标准品,加入1 mL甲醇,充分溶解后过滤、离心,采用超高效液相色谱(ultra performance liquid chromatography,UPLC)进行分析。UPLC色谱条件:柱温 40 ℃,流动相为乙腈-0.1%甲酸水溶液,梯度洗脱(0~20 min,5%~95%乙腈;20~22 min,100%乙腈;22~25 min,100%C~5%乙腈),该部分实验由内蒙古民族大学天然产物化学及功能分子合成重点实验室完成。
2.2 SGC-7901细胞培养与分组取对数生长期胃癌SGC-7901细胞,胰蛋白酶消化后调整细胞密度为5×104mL-1,接种于96孔板,每孔100 μL,用含10%胎牛血清的培养基进行培养。将细胞分为对照组及白花蛇舌草-半枝莲药对乙酸乙酯组分低、中、高剂量组,分别予以0 mg·L-1、10 mg·L-1、30 mg·L-1、50 mg·L-1白花蛇舌草-半枝莲药对乙酸乙酯组分处理,每组设5个平行孔。5%CO2、37 ℃ 恒温培养箱中培养细胞,每天换液1次,培养48 h后取对数生长期细胞进行后续实验。
2.3 CCK-8法检测SGC-7901细胞增殖能力取对数生长期SGC-7901细胞,调整细胞浓度至5×104mL-1,接种于96孔板,每孔100 μL,5% CO2、37 ℃恒温培养箱中培养24 h后,弃去上清液,按“2.2项”所述方法对细胞进行分组及药物干预,培养12 h、24 h、48 h后每孔加入CCK-8试剂 10 μL,孵育2 h,每组设3个复孔,并设置空白孔3个。采用酶标仪在450 nm波长处检测吸光度值。
细胞增殖抑制率=(对照组OD值-实验组OD值)/(对照组OD值-空白孔OD值)×100%
2.4 平板细胞克隆形成实验按“2.2项”所述方法对细胞进行分组及药物干预,培养48 h后,将各组细胞分别制备成1.0×103L-1细胞悬液,接种于6孔板中,每孔1 mL,每组设3个复孔,5%CO2、37 ℃恒温孵育箱中培养24 h后,弃除培养液,加入不含药物的培养液进行培养,每3 d更换1次培养液,直至肉眼可见细胞集落形成。磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗6孔板后加入甲醇溶液,固定20 min,PBS清洗,加入结晶紫染色液,固定5 min,PBS清洗后用 ImageJ 统计每孔克隆形成数,计算每组细胞的克隆形成率。
克隆形成率=(克隆数/接种细胞数)×100%
2.5 流式细胞术检测SGC-7901细胞周期按“2.2项”所述方法对细胞进行分组及药物干预,培养24 h后,弃上清,使用胰酶消化细胞,离心后弃上清,加体积分数75%预冷乙醇溶液,振荡,4 ℃固定过夜。加入RNase A溶液,1 500 r·min-1离心 10 min,弃上清,室温条件下每管加30 μL PI进行染色,4 ℃避光孵育30 min,上机检测各组细胞周期的分布情况,数据用 MultiFit LT 软件进行分析。
2.6 蛋白免疫印迹检测相关蛋白的表达按“2.2项”所述方法对细胞进行分组及药物干预,培养 24 h 后,弃上清,胰蛋白酶消化细胞,离心后弃上清,加细胞裂解液裂解细胞。采用BCA蛋白浓度测定试剂盒进行蛋白定量。每组细胞样本的蛋白上样量为25 ng,采用10% SDS-PAGE进行电泳,经电转膜后封闭于脱脂牛奶中,分别加入Cyclin D1及 c-Myc 一抗(稀释比例为11 000),4 ℃封闭过夜,经TBS溶液洗膜3次后加入山羊抗兔二抗(稀释比例为1500),TBS洗膜3次后ECL显像,用凝胶图像处理系统对蛋白条带进行处理,以目的蛋白与内参蛋白β-actin的灰度值的比值表示目的蛋白的相对表达量。
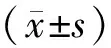
3 结果
3.1 白花蛇舌草-半枝莲药对乙酸乙酯组分制备结果白花蛇舌草-半枝莲药对提取物经乙酸乙酯萃取后提取率为0.61%。UPLC分析结果显示,白花蛇舌草-半枝莲药对乙酸乙酯提取物中含有对羟基苯乙酮、野黄芩苷、木犀草素和芹菜素4种化合物,符合白花蛇舌草-半枝莲药对乙酸乙酯组分成分。见图1。
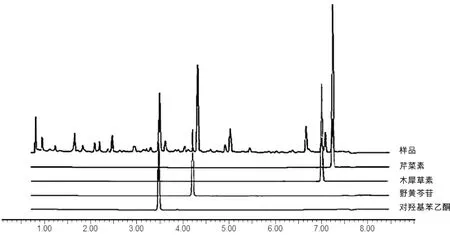
图1 白花蛇舌草-半枝莲药对乙酸乙酯组分UPLC分析图谱
3.2 白花蛇舌草-半枝莲药对乙酸乙酯组分对SGC-7901细胞增殖的影响与对照组比较,培养24 h、48 h及72 h后,白花蛇舌草-半枝莲药对乙酸乙酯组分低、中、高剂量组SGC-7901细胞的增殖抑制率均显著升高(P<0.05);与白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分中、高剂量组SGC-7901细胞的增殖抑制率显著升高(P<0.05);与白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分高剂量组 SGC-7901 细胞的增殖抑制率显著升高(P<0.05)。见图2。
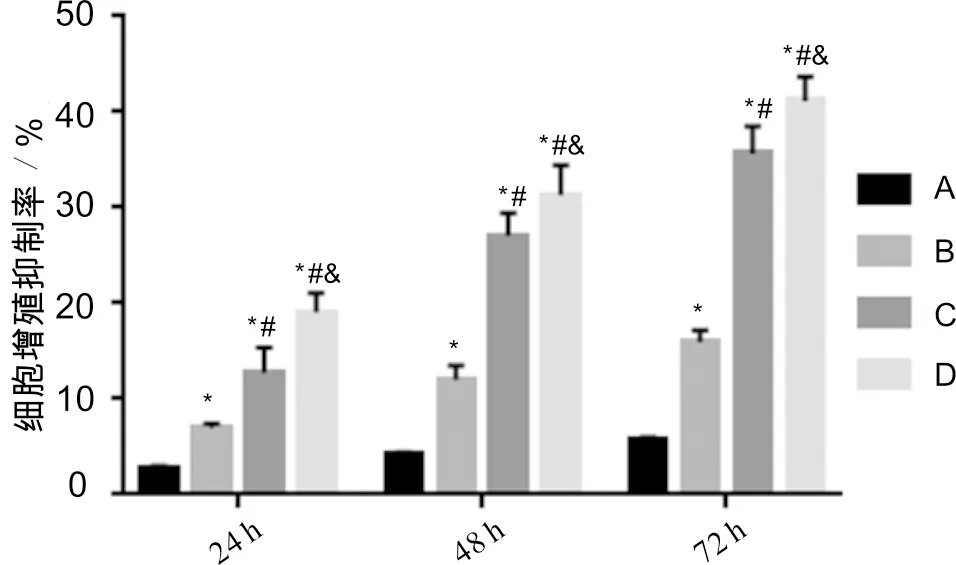
注:A:对照组;B:白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组;C:白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组;D:白花蛇舌草-半枝莲药对乙酸乙酯组分高剂量组;与对照组比较,*P<0.05;与白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组比较,#P<0.05;与白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组比较,&P<0.05图2 白花蛇舌草-半枝莲药对乙酸乙酯组分对SGC-7901细胞增殖的影响
3.3 白花蛇舌草-半枝莲药对乙酸乙酯组分对SGC-7901细胞克隆能力的影响与对照组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分低、中、高剂量组SGC-7901细胞集落形成率均显著降低(P<0.05);与白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分中、高剂量组SGC-7901细胞集落形成率均显著降低(P<0.05);与白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分高剂量组SGC-7901细胞集落形成率显著降低(P<0.05)。见图3。

注:A:对照组;B:白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组;C:白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组;D:白花蛇舌草-半枝莲药对乙酸乙酯组分高剂量组;与对照组比较,*P<0.05;与白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组比较,#P<0.05;与白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组比较,&P<0.05图3 白花蛇舌草-半枝莲药对乙酸乙酯组分对SGC-7901细胞克隆能力的影响
3.4 白花蛇舌草-半枝莲药对乙酸乙酯组分对SGC-7901细胞周期变化的影响与对照组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分低、中、高剂量组SGC-7901细胞培养24 h后,G0/G1期细胞比例显著增加(P<0.05),G2/M期细胞比例显著降低(P<0.05);与白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分中、高剂量组G0/G1期细胞比例显著增加(P<0.05),G2/M期细胞比例显著降低(P<0.05);与白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分高剂量组G0/G1期细胞比例显著增加(P<0.05),G2/M期细胞比例显著降低(P<0.05)。见图4。

注:A:对照组;B:白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组;C:白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组;D:白花蛇舌草-半枝莲药对乙酸乙酯组分高剂量组;与对照组比较,*P<0.05;与白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组比较,#P<0.05;与白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组比较,&P<0.05图4 白花蛇舌草-半枝莲药对乙酸乙酯组分对SGC-7901细胞周期分布的影响
3.5 白花蛇舌草-半枝莲药对乙酸乙酯组分对SGC-7901细胞中Cyclin D1及c-Myc蛋白表达水平的影响与对照组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分低、中、高剂量组SGC-7901细胞中Cyclin D1及c-Myc蛋白表达水平均显著降低(P<0.05);与白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分中、高剂量组SGC-7901细胞中Cyclin D1及c-Myc蛋白表达水平均显著降低(P<0.05);与白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组比较,白花蛇舌草-半枝莲药对乙酸乙酯组分高剂量组SGC-7901细胞中Cyclin D1及c-Myc蛋白表达水平显著降低(P<0.05)。见图5。
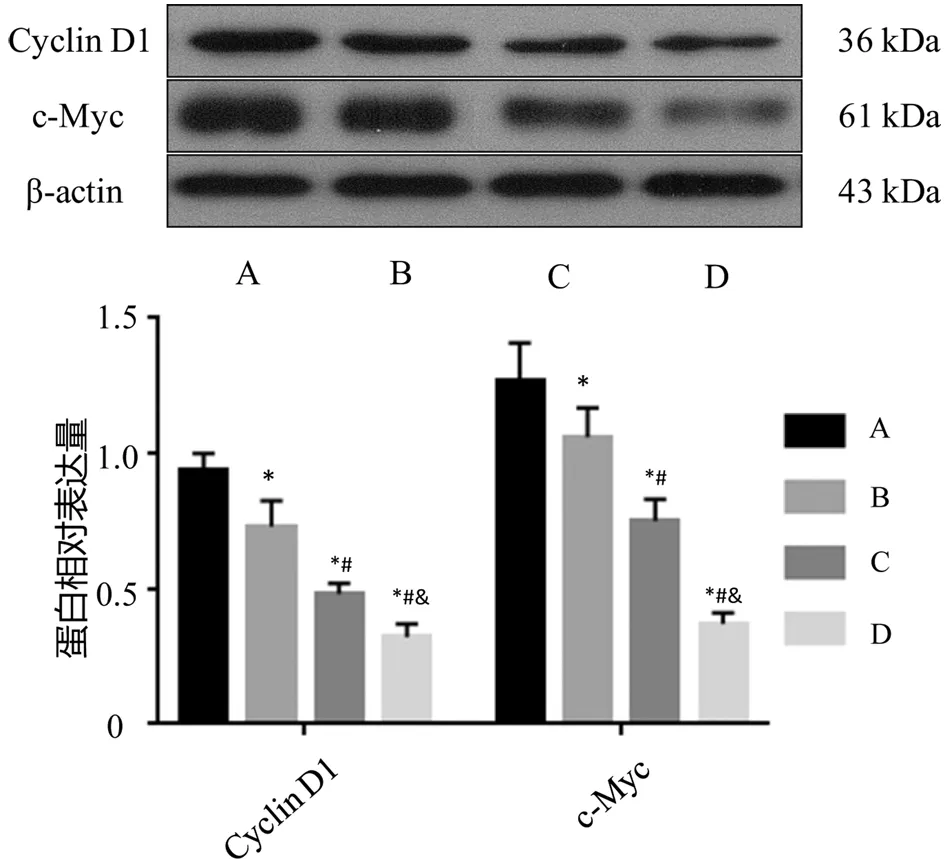
注:A:对照组;B:白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组;C:白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组;D:白花蛇舌草-半枝莲药对乙酸乙酯组分高剂量组;与对照组比较,*P<0.05;与白花蛇舌草-半枝莲药对乙酸乙酯组分低剂量组比较,#P<0.05;与白花蛇舌草-半枝莲药对乙酸乙酯组分中剂量组比较,&P<0.05图5 白花蛇舌草-半枝莲药对乙酸乙酯组分对SGC-7901细胞中Cyclin D1及c-Myc蛋白表达的影响
4 讨论
白花蛇舌草-半枝莲药对抗肿瘤作用是目前的研究热点,大量研究证实,白花蛇舌草-半枝莲药对提取物对乳腺癌、胰腺癌、子宫内膜癌及肝癌均有良好的抑制生长作用[6-9]。研究显示,白花蛇舌草-半枝莲可能通过调控胃癌细胞蛋白聚糖信号通路、磷酸肌醇-3-激酶(phosphatidylinositide 3-kinase,PI3K)/蛋白激酶 B(protein kinase B,AKT)信号通路、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、抑癌基因蛋白53(protein 53,p53)信号通路等抑制胃癌细胞生长[10],但具体的作用机制和靶点仍需通过动物实验、细胞实验甚至临床研究进行深入探讨。
本研究首先通过UPLC对所得到的提取物进行分析,鉴定后确认采用本实验所述提取方法得到的提取物为白花蛇舌草-半枝莲药对乙酸乙酯组分。利用不同含量白花蛇舌草-半枝莲药对乙酸乙酯组分培养胃癌SGC-7901细胞发现,不同含量白花蛇舌草-半枝莲药对乙酸乙酯组分(10 mg·L-1、30 mg·L-1、50 mg·L-1)培养SGC-7901细胞 24 h、48 h及72 h后,细胞增殖抑制率均显著升高,且药物剂量越高,增殖抑制率随之增高,说明白花蛇舌草-半枝莲药对乙酸乙酯组分可有效降低SGC-7901细胞增殖能力,抑制肿瘤细胞生长,且具剂量依赖性。细胞克隆形成实验结果显示,经过白花蛇舌草-半枝莲药对乙酸乙酯组分培养的SGC-7901细胞,其克隆能力明显降低,与CCK-8法检测细胞增殖抑制率趋势相同,进一步从可视角度证实该药对乙酸乙酯组分对胃癌细胞增殖抑制的有效性。
诱导肿瘤细胞凋亡及抑制肿瘤细胞增殖是目前抑制肿瘤细胞生长的主要作用机制[11-14]。肿瘤的发生发展与细胞周期的改变密切相关,越来越多的学者发现中药单体、单味中药、中药复方可将肿瘤细胞阻滞于不同细胞周期,对抑制肿瘤的发生发展具有深入研究意义[4]。细胞周期包括 G1期 (DNA 合成前期)、S期(DNA 合成期)、M期(分裂期)、G2期(DNA合成期)及G0期(休眠期)。目前研究证实,G0/G1期、S期、G2/M期是3个调控细胞周期的关键节点,肿瘤细胞阻滞在上述周期节点内,可明显抑制细胞增殖[15-17]。本研究结果显示,白花蛇舌草-半枝莲药对乙酸乙酯组分干预SGC-7901细胞 24 h 后,G0/G1期细胞比例增加,G2/M期细胞比例降低,且呈剂量依赖型,说明白花蛇舌草-半枝莲药对乙酸乙酯组分可将胃癌细胞分裂周期阻滞在G0/G1期,且能抑制DNA的合成与分裂,这可能是该药对组分降低肿瘤细胞增殖及克隆能力的原因之一。
Cyclin D1是肿瘤细胞周期最重要的调控因子之一,可与细胞周期蛋白依赖性激酶4(cyclin dependent kinase 4,CDK4)及CDK6形成蛋白复合物,使蛋白激酶磷酸化,促进细胞进入S期,对细胞增殖具有正调控作用[18-19]。另有临床研究显示,Cyclin D1在胃癌组织中呈高表达,并且其与淋巴结转移密切相关[20]。c-Myc基因是Myc癌基因家族的重要成员之一,也是常见的原癌基因之一,其可参与肿瘤细胞的增殖、迁移过程,并且对细胞的异常分化具有促进作用[21-22]。此外,c-Myc可与Cysclin启动子相结合,促进细胞周期蛋白表达上调,进而加速细胞分化[23-24]。有学者发现,降低细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)磷酸化程度,肿瘤细胞中c-Myc的表达减少,并可将肿瘤细胞阻滞在G0/G1期,降低肿瘤细胞增殖、迁移及侵袭的能力,说明抑制c-Myc表达可能是抑制肿瘤细胞生长的重要途径[25-26]。本研究发现,白花蛇舌草-半枝莲药对乙酸乙酯组分干预胃癌SGC-7901细胞后,细胞中Cyclin D1、c-Myc蛋白表达水平降低,且存在剂量依赖性,说明白花蛇舌草-半枝莲药对乙酸乙酯组分对SGC-7901细胞中Cyclin D1及c-Myc的表达具有抑制作用。
综上所述,白花蛇舌草-半枝莲药对乙酸乙酯组分可能通过下调胃癌SGC-7901细胞中Cyclin D1及c-Myc表达水平,将细胞阻滞在G0/G1期,在合成前期抑制肿瘤细胞DNA复制,进而抑制肿瘤细胞的增殖。另外本研究也有不足之处,如本研究虽对G0/G1期的关键检测蛋白Cyclin D1及c-Myc进行检测,但并未对其上下游传导信号通路进行检测,未能知晓其具体机制,有待于进一步研究加以证实。