Ag改性层状硅酸铜催化剂的草酸二甲酯加氢合成乙醇酸甲酯性能研究
薛 婧 ,武朦朦 ,宋有为 ,赵金仙 ,武建兵 ,权燕红,* ,任 军,*
(1.太原理工大学 省部共建煤基能源清洁高效利用国家重点实验室, 山西 太原 030024;2.太原理工大学 煤科学与技术教育部重点实验室, 山西 太原 030024;3.山西大学 化学化工学院, 山西 太原 030006;4.精细化学品教育部工程研究中心, 山西 太原 030006)
乙醇酸甲酯(MG)兼具醇和酯的化学性质,是一种应用广泛的化工原料。近年来,MG供不应求导致其价格持续上涨,因此,开发一条绿色可持续发展战略的生产路线势在必行[1]。MG的主要合成路线包括甲醛羰化酯化法[2]、生物酶化法[3]、草酸二甲酯加氢还原法[4]等,其中,草酸二甲酯(DMO)加氢制MG工艺具有反应条件易实现、对环境友好且原子利用率高等优点而被广泛研究[5]。
DMO加氢制MG主要采用贵金属Ru的络合物[6]、Cu[7]、Ag[8]等催化剂,其中,Cu基催化剂价格低廉且制备过程简单,其对C-O/C=O键的裂解作用高于对C-C键的裂解,具有良好的C-C键留存性,因而成为当前研究的热点[9,10]。研究者采用碳材料[11-13]和硅材料[4,14,15]作为载体负载铜催化剂,其中,硅类载体(SiO2、SBA-15、KCC-1、MCM-41等)呈弱酸性和碱性,有利于酯加氢反应[16,17];且相关文献已经证实通过对硅载体形貌和织构特性的调控可改变Cu组分的分散和化学态,进而促进铜催化剂的催化反应性能的提高[18]。层状硅酸铜以其比表面积大、传质效率高、限域效应强等优势而备受关注[15,19]。然而,MG转化为乙二醇(EG)的热力学常数比DMO转化为MG的热力学常数大两个数量级[20],即在Cu催化剂上更易发生深度加氢生成EG,产率可高达96%[21]。因此,实现DMO可控加氢对高效合成MG具有重要的意义[22,23]。
助剂改性是调控催化剂的重要手段。研究表明,引入另一种或多种元素,如Zn[24]、Ni[25,26]、Ce[14]、B[27]、La[28]、Ag[29]、In[30]和Au[31],可有效改 善Cu物种的分散度,增加Cu+的表面浓度,抑制Cu纳米颗粒的团聚烧结,明显改善催化剂的活性和稳定性[32]。究其原因,研究者主要认为,双金属催化剂之间(Au-Ag、Cu-Au和Cu-Ag)的协同作用对催化反应性能起到重要的影响,如:Wang等[31]将Au加入到铜基催化剂并应用于DMO加氢制备乙醇中,发现Cu-Au合金的形成能够稳定和提高铜基催化剂的活性并且可有效防止活性金属铜粒子发生团聚;Zhang等[33]报道,将Ag加入Cu/Al2O3后可以防止反应过程中金属铜物种的流失,维持Cu和Ag双金属催化剂中稳定的活性铜位点;Huang等[34]研究发现,在酯类加氢反应中,双金属Cu和Ag之间的相互作用不仅能够提高活性金属的分散度,而且可以保持稳定的Cu+/(Cu0+ Cu+)比例;Zhou等[35]也发现,Ag的加入既能够提高活性金属铜的分散度,还可以保证CuO物种的原位还原。由于与贵金属Au、Pd和Pt相比,Ag的价格相对低廉且电子云密度更高,因此,在酯类加氢反应中,Ag作为铜基催化剂的改性助剂而备受青睐[36]。
在DMO加氢制MG工艺中,Cu基催化剂的加氢性能依赖于铜物种的分散度和Cu+/(Cu++ Cu0)的比值[37]。Cu0能促进氢的裂解,提高DMO的转化率;Cu+能吸附和活化甲氧基和乙酰基,有利于MG的生成[34]。本研究设计了少量Ag改性层状硅酸铜催化剂,利用Cu-Ag间的强相互作用,稳定表面Cu+的含量,以期获得高选择性、高收率催化剂。采用溶胶-凝胶法制备了层状AgCu/SiO2催化剂,并考察助剂Ag含量对xAg-Cu/SiO2结构和DMO加氢制备MG催化性能的影响,从而获得助剂改性铜基催化剂的调控规律。
1 实验部分
1.1 催化剂的制备
采用溶胶-凝胶法制备Cu/SiO2催化剂。将正硅酸四乙酯(TEOS)和乙醇溶液混合,然后加入13.4 gCu(NO3)2·3H2O(TEOS、乙醇溶液和去离子水的物质的量比大约为1∶4∶11)。将混合溶液超声30 min后搅拌2 h,将其转移至玻璃瓶中并密封,然后在25 ℃下老化2 d,蓝色溶液逐渐变为蓝色果冻状胶体。将蓝色凝胶切成小块,在pH值为11的氨水中浸泡10 h。随后75 ℃下搅拌,溶剂蒸干后在100 ℃下干燥过夜。将得到的蓝色固体研磨,并用去离子水洗涤3-5次,去除残留的硝酸铜。洗净后的样品在120 ℃下烘干后,于马弗炉中焙烧5 h,焙烧温度为500 ℃。所得的催化剂前驱体在H2中还原2 h,还原温度为350 ℃。还原后的催化剂(铜载量~30%)记为Cu/SiO2。
xAg-Cu/SiO2(x= 1、3、5和8表示Ag在催化剂中的质量分数)催化剂的制备流程与Cu/SiO2催化剂制备流程相同。一定量的AgNO3与Cu(NO3)2同时引入。
1.2 催化剂的表征
采用贝士德3H-2000PS2型物理吸附仪进行BET表征。在p/p0为0-1.0时采用BET方法测定比表面积(SBET);采用p/p0= 0.99处吸附数据估算样品的孔体积;利用BJH法计算样品的孔径分布。测试前将样品在200 ℃真空条件下预处理3 h后在-196 ℃下进行N2吸附-脱附实验。
采用赛默飞Nicolet iS5型红外光谱仪测定样品的红外吸收光谱(FT-IR)。将样品与100 mg左右的KBr混合研磨后压片测试,扫描4000-400 cm-1,速率为0.6329 cm/s。
采用日本理学D/max 2500型X射线衍射仪表征样品的物相组成。以Cu靶为辐射源(λ= 0.154 nm),5°-85°扫描,扫描速率为8(°)/min。
程序升温还原采用天津先权公司TP-5080型化学吸附仪进行测试。将50 mg新鲜样品装入测试管中,用适量石英棉进行封装。在Ar气氛下300 ℃预处理30 min,待其冷却后通入H2/Ar混合气,升温至900 ℃,采用TCD检测器记录信号。
采用天津先权公司TP-5080型化学吸附仪测定铜的分散度和比表面积。将50 mg样品装入测试管中,用石英棉封装后通入H2/Ar混合气,升温至300 ℃预还原30 min,此过程的H2消耗量为X。待降温至室温,通入N2O-Ar的混合气进行吸附。再次降温至室温,采用程序升温的方法对样品进行H2-TPR测试,此时的H2消耗量记为Y。铜的分散度(DCu)计算公式如下:

采用日本电子光学公司JOEL JEM-2100 F型显微镜观察样品的微观结构。催化剂充分研磨后在乙醇中超声分散,静置,取上层清液滴在铜网上。待乙醇完全挥发后,观察其微观形貌结构等特性。
采用日本Hitachi公司生产的SU8010场发射扫描电子显微镜测试样品的表面微观形貌。测试电压为2.0-3.0 kV,放大倍数为10000-100000。
采用AXIS ULTRA DLD型X射线光电子能谱仪进行XPS表征。激发源为AlKα (hv=1486.6 eV)X射线,分辨率为0.05 eV,真空度为10-8Pa。电子结合能采用C 1s峰(284.6 eV)进行校正,并采用XPS PEAK软件进行分峰拟合分析。
1.3 催化剂性能评价
催化剂的DMO选择性加氢性能评价在实验室自组装的高温固定床微反应装置上进行。利用石英棉将已经混合均匀的0.3 g催化剂和适量石英砂封装在反应管中部。草酸二甲酯甲醇混合溶液(DMO含量为~15%)通过美国Series Ⅲ恒流型微量进样泵(流量为0.03 mL/min),然后经过预热炉加热汽化,与H2混合进入反应管中,在200 ℃,2 MPa,H2/DMO=100 (mol ratio)下进行反应。产物冷凝后收集液体产物,采用中科惠分GC-7820型气相色谱进行定量分析。毛细管柱(DB-WAX,30 m×0.320 mm×0.5 μm)和氢火焰离子化检测器(FID)进行产物分离检测。通过内标法对产物组成进行定量,并计算反应过程中催化剂上DMO的转化率(xDMO)、MG的选择性(sMG)及MG的收率(wMG),内标物为正丁醇。具体计算公式如下所示:
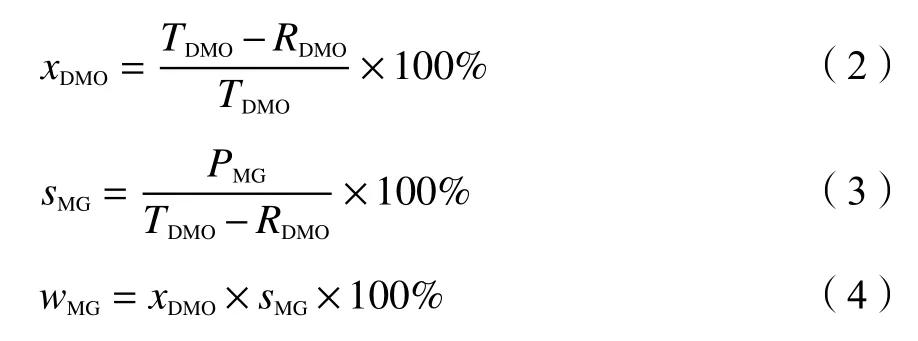
式中,TDMO为DMO的初始量;RDMO为反应后DMO剩余量;PMG为产物中MG的量。
2 结果与讨论
2.1 催化剂的表征
2.1.1 XRD分析
还原后Ag/SiO2、Cu/SiO2和xAg-Cu/SiO2的XRD谱图如图1所示,2θ= 21.5°处的峰归属于无定型SiO2的衍射峰。催化剂在2θ= 36.6°和61.9°处的弱宽峰归属于Cu2O的(111)和(220)晶面(JCPDS no.05-0667),而在2θ= 43.3°、50.2°和74.2°归属于Cu0的(111)、(200)和(220)晶 面(JCPDS no.65-9743),这表明Cu2+物种已成功被还原为Cu2O和Cu0物 种。Ag/SiO2和xAg-Cu/SiO2催 化 剂 中 均 没有观察到Ag的相关衍射峰,可能是由于催化剂中Ag助剂含量较低或分散度较高。

图1 还原后Ag/SiO2、Cu/SiO2和xAg-Cu/SiO2的XRD谱图Figure 1 XRD patterns of Ag/SiO2, Cu/SiO2 and xAg-Cu/SiO2(x =1, 3, 5 and 8) after reduction
2.1.2 BET分析
图2(a)为Cu/SiO2和xAg-Cu/SiO2的N2吸附-脱附曲线。根据IUPAC分类,所有样品均呈现IV型等温线,有明显回滞环,表明样品中存在介孔结构。Cu/SiO2催化剂在p/p0较低时,等温线上升较快,说明有微孔结构存在。加入Ag后,p/p0值较低时,等温线上升台阶几乎消失,表明Ag的引入使催化剂中微孔消失。从孔径分布(图2(b))中可以看出,加入Ag后催化剂介孔孔径明显变大。文献表明,孔径增大有利于DMO分子扩散进入催化剂孔道,与活性位点充分接触,并且有利于产物MG分子的脱附及扩散,从而提高初步加氢产物MG的选择性[38]。此外,所有催化剂均出现了2.0–3.0 nm的层状硅酸铜典型孔道,表明Ag的引入并没有破坏层状硅酸铜的结构[39]。
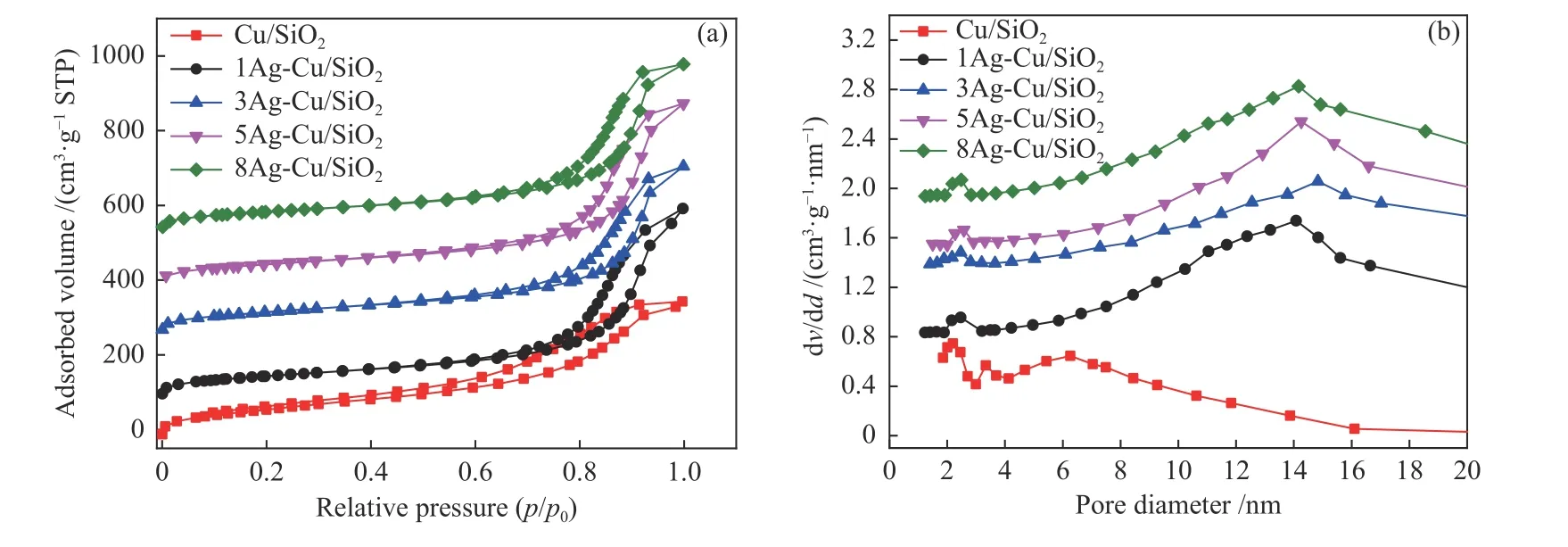
图2 焙烧后Cu/SiO2和xAg-Cu/SiO2的N2吸附-脱附曲线(a)和孔径分布(b)Figure 2 N2 adsorption-desorption isotherms (a) and pore size distribution curves(b) of Cu/SiO2 and xAg-Cu/SiO2 (x =1, 3, 5 and 8) after calcination
从表1可以看出,Cu/SiO2催化剂有较大的比表面积和较小的平均孔径。Ag加入后,xAg-Cu/SiO2的比表面积和孔径发生明显变化。当Ag加入量小于5%时,随着Ag含量的增加,催化剂的比表面积由235 m2/g减小至222 m2/g,平均孔径呈增加趋势,总孔体积相较于不加Ag均有提高。采用ICP表征测试了还原后催化剂中Cu和Ag的实际含量。与制备过程中的理论含量相比,Cu与Ag的实际负载量略低,这可能是因为催化剂制备过程中两种金属离子发生微量流失。事实上,Ag与Cu在催化剂制备过程中与载体的链接方式完全不一样,Ag不能与硅形成层状硅酸盐。催化剂制备过程中,当加入氨水浸泡时,[Ag(NH3)2]+只是像接枝一样形成接枝Ag+[40]。洗涤过程中,一部分银络合物被洗掉。这就是为何Cu的实际载量接近理论载量,而Ag的实际载量却比理论载量低的多。

表1 催化剂的物理化学和织构性质Table 1 Physicochemical and textural properties of catalysts
2.1.3 FT-IR分析
图3(a)为焙烧后催化剂的红外光吸收光谱。800和1110 cm-1处的吸收峰分别归属于非晶态SiO2中Si-O-Si的对称伸缩振动和非对称伸缩振动。670 cm-1处弱的δOH带和1040 cm-1处的νSiO肩峰同时存在表明样品中层状硅酸铜的存在[41,42],其中,670 cm-1处的吸收峰归属于层状硅酸铜中-OH的振动峰δOH,1040 cm-1处的吸收峰归属于层状硅酸铜中Si-O键的振动峰νSiO。通过对样品在670 cm-1处的δOH谱带强度和800 cm-1处νSiO谱带强度的对比,即I670/I800[42],可以定性计算样品中层状硅酸铜的相对含量。如图3(b)所示,5Ag-Cu/SiO2的I670/I800最大,表明其层状硅酸铜的相对含量最高。因此,作者认为在催化剂前驱体中加入适量的Ag可以增加层状硅酸铜的相对含量。
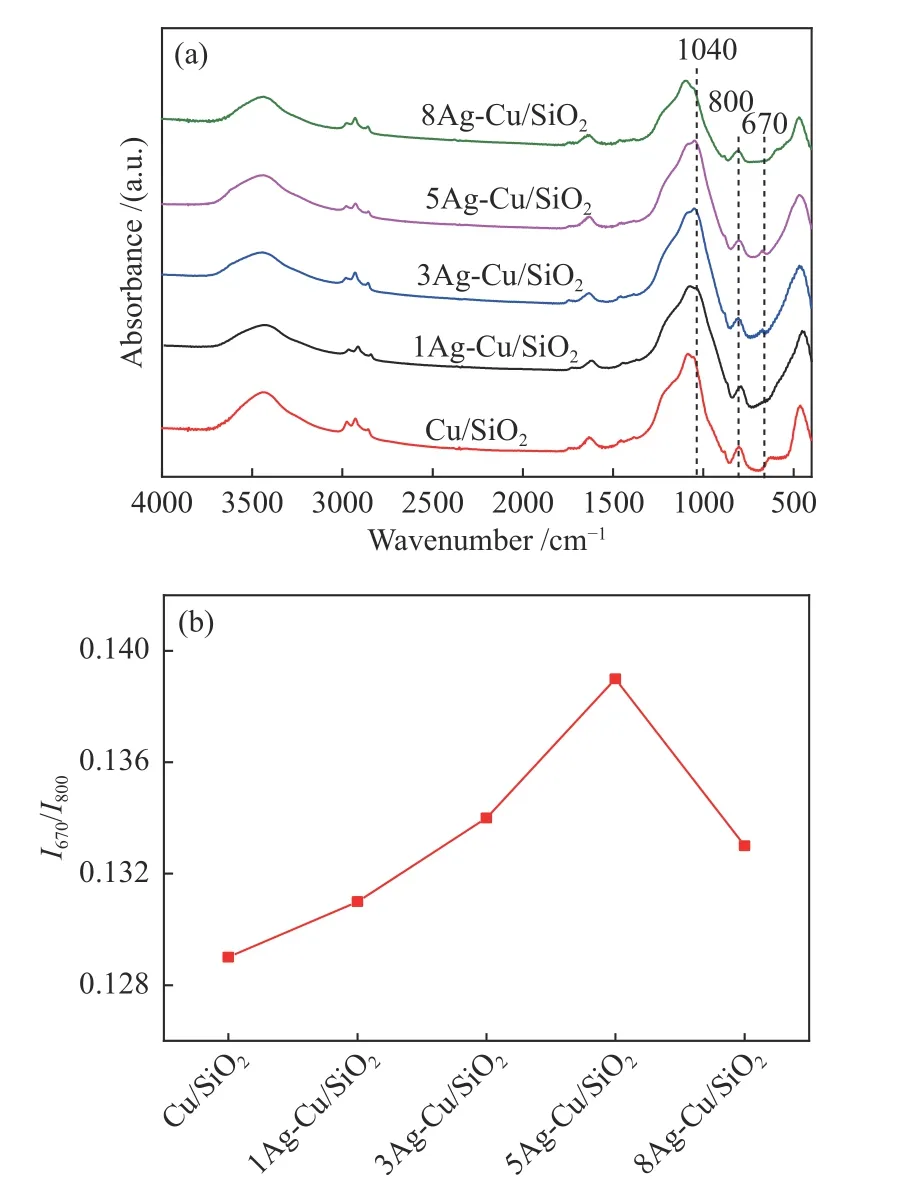
图3 焙烧后Cu/SiO2和xAg-Cu/SiO2的FT-IR谱图(a)和I670/I800(b)Figure 3 FT-IR spectra of Cu/SiO2 and xAg-Cu/SiO2 (x =1, 3,5 and 8) after calcination (a) and I670/I800 (b)
2.1.4 TEM、SEM和TEM-EDX分析
图4(A)-(E)为还原后Cu/SiO2和xAg-Cu/SiO2催化剂的TEM图像,内嵌图为不同催化剂铜物种的粒径分布。如图所示,Cu/SiO2的铜物种平均粒径为5.14 nm。随着Ag的引入,Cu颗粒尺寸明显变小,xAg-Cu/SiO2的平均粒径分别为2.42、2.30、1.95和2.74 nm。当Ag的加入量为5%时,催化剂的金属粒径最小,活性物种的分散度最高。H2-N2O滴定表征结果如表1所示,与Cu/SiO2催化剂相比,随着Ag的加入,铜物种的分散度明显提高。其中,5Ag-Cu/SiO2催化剂中铜物种分散度最高为27.2%,此结果与TEM分析结果一致。这一变化趋势表明,银助剂与活性组分铜之间产生的相互作用力可有效抑制团聚现象的发生[43]。催化剂还原后的SEM照片如图4(a)-(e)所示,Cu/SiO2和xAg-Cu/SiO2催化剂均可观察到明显的层状结构。
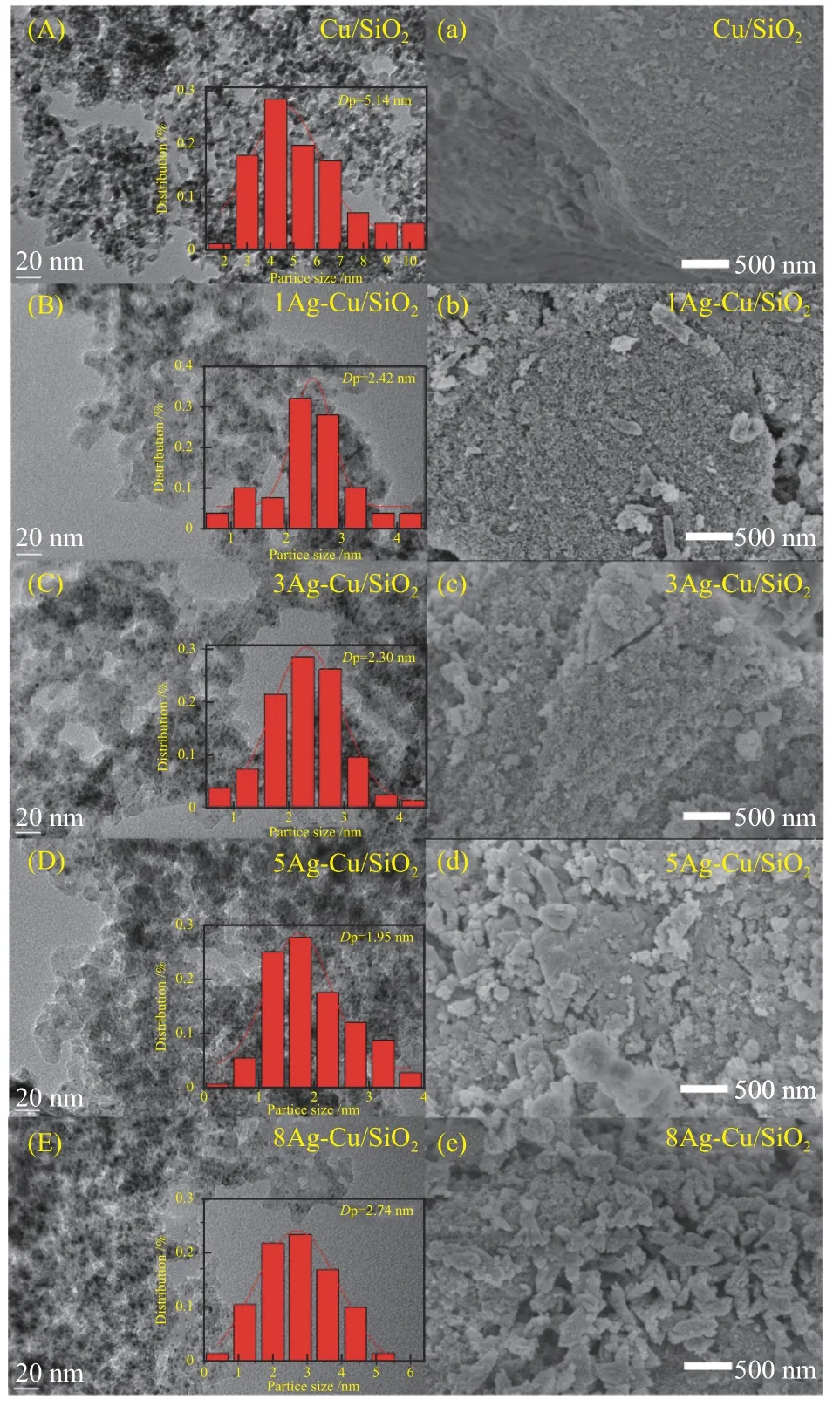
图4 还原后Cu/SiO2和xAg-Cu/SiO2的TEM照片(A)-(E)和SEM照片(a)-(e)Figure 4 TEM images (A)-(E) and SEM images (a)-(e) of Cu/SiO2 and xAg-Cu/SiO2 ( x =1,3,5 and 8)
图5为还原后5Ag-Cu/SiO2催化剂的EDX图像。由图5可以看出,样品5Ag-Cu/SiO2表面金属Cu和Ag分散均匀。这一结果表明,两种金属物种之间、金属物种与载体之间密切接触,这种接触不仅可以增强金属-载体的相互作用,同时也可以增强Cu和Ag之间的相互作用力。

图5 还原后5Ag-Cu/SiO2的TEM-EDX照片Figure 5 TEM-EDX images of 5Ag-Cu/SiO2 after reduction
2.1.5 H2-TPR分析
图6为催化剂的H2-TPR谱图。Cu/SiO2催化剂在260 ℃时出现一个对称的还原峰。研究表明,Cu/SiO2上的高分散态CuO的还原温度为250 ℃[44],而Chen等[41]报道了Cu-O-Si结构和层状硅酸铜结构中Cu2+还原为Cu+的温度在247 ℃左右,与高分散CuO还原为Cu0的还原峰高度重叠。因此,Cu/SiO2催化剂中的还原峰属于层状硅酸铜中铜物种还原为Cu+和高分散态CuO还原为Cu0的共同还原峰。随着Ag含量的增加,还原峰的位置逐渐向低温方向移动,是因为Ag的引入使活性铜物种颗粒尺寸减小,分散度增加[43],与TEM和H2-N2O表征吻合。

图6 焙烧后Cu/SiO2和xAg-Cu/SiO2的H2-TPR谱图Figure 6 H2-TPR profiles of Cu/SiO2 and xAg-Cu/SiO2( x =1,3, 5 and 8) after calcination
2.1.6 XPS分析
Cu/SiO2和xAg-Cu/SiO2催化剂的Cu 2pXPS谱图如图7(a)所示,其中,952.3和932.4 eV处的峰分别归属于Cu 2p1/2和Cu 2p3/2的特征峰。Cu/SiO2分别于935.1和943–945 eV出现了一个肩峰和卫星峰,表明还原后的Cu/SiO2催化剂存在Cu2+物种。Ag加入后,肩峰和卫星峰消失,表明在催化剂还原过程中Cu2+物种已经完全被还原为低价态的铜物种。此外,加入Ag后,Cu 2p3/2特征峰的峰位向高结合能方向移动,表明Cu和Ag之间发生了电子传递。
图7(b)为催化剂的Cu LMM谱图,对其进行高斯拟合,位于912.3和916.2 eV处的特征峰分别归属于Cu+和Cu0物种,其相对含量结果列于表2中。可以看出,随着Ag含量的增加,Cu+/(Cu0+Cu+)比例呈火山型曲线,当Ag的负载量为5%时,Cu+相对含量达到最大值(66.3%);进一步提高Ag含量,Cu+相对含量减少。此外,随着Ag的加入,铜的特征峰向高结合能处偏移,这表明电子从Cu转移到Ag,铜表面电子密度降低[43]。Liu等[37]通过DFT在Cu(111)表面布置银团簇,发现两种金属之间的相互作用可以降低Cu表面能。Huang等[34]也证明了Ag的引入会改变催化剂的电子结构,这是由于金属粒子的表面等离子体共振带所导致。综上所述可以推断,Ag与Cu之间的相互作用促进了Cu+的生成,稳定Cu+和Cu0的比例,改善了Cu的分散。
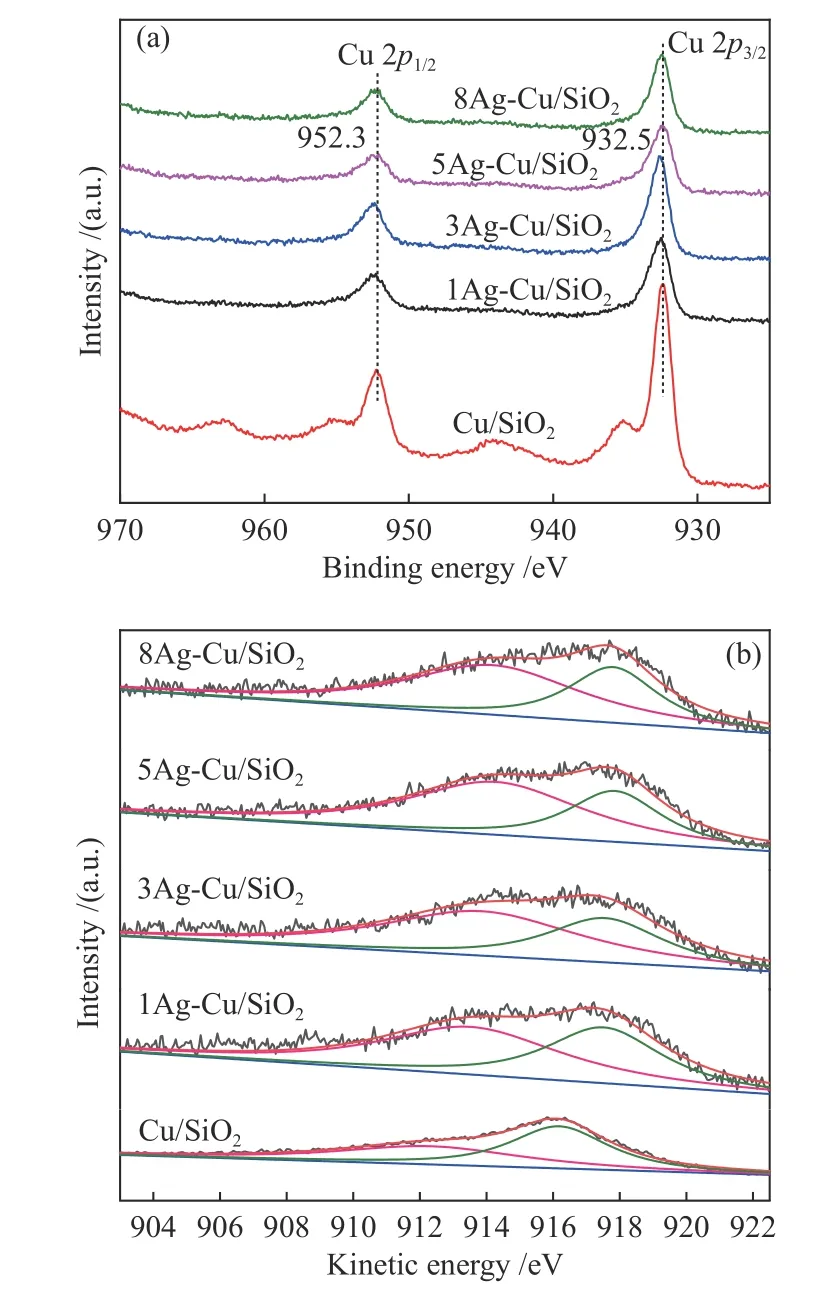
图7 Cu/SiO2和xAg-Cu/SiO2的(a)Cu 2p XPS和(b)Cu LMM谱图Figure 7 (a) Cu 2p XPS spectra and (b) Cu LMM spectra of Cu/SiO2 and xAg-Cu/SiO2

表2 还原后不同焙烧温度催化剂表面铜物种占比Table 2 Percentage of copper species on the surface of catalysts at different calcination temperatures after activation
为了进一步研究Ag物种的状态,进行了Ag 3dXPS表征,如图8所示。Ag/SiO2催化剂的Ag 3dXPS光谱显示两个峰,分别位于368.3和374.1 eV处,为Ag 3d5/2和Ag 3d3/2的典型特征峰。随着Ag含量的增加,Ag 3d特征峰信号逐渐增强。与Ag/SiO2催化剂相比,Ag-Cu/SiO2中Ag 3d的特征峰均向低结合能处偏移,表明Ag表面电子密度升高,有利于低价态铜的形成。因此,作者推测电子转移发生在Cu和Ag物种之间,从而使一部分Ag与Cu形成合金[34]。据报道,Ag物种作为负电子位点在还原性气氛作用下稳定Cu+[29]。
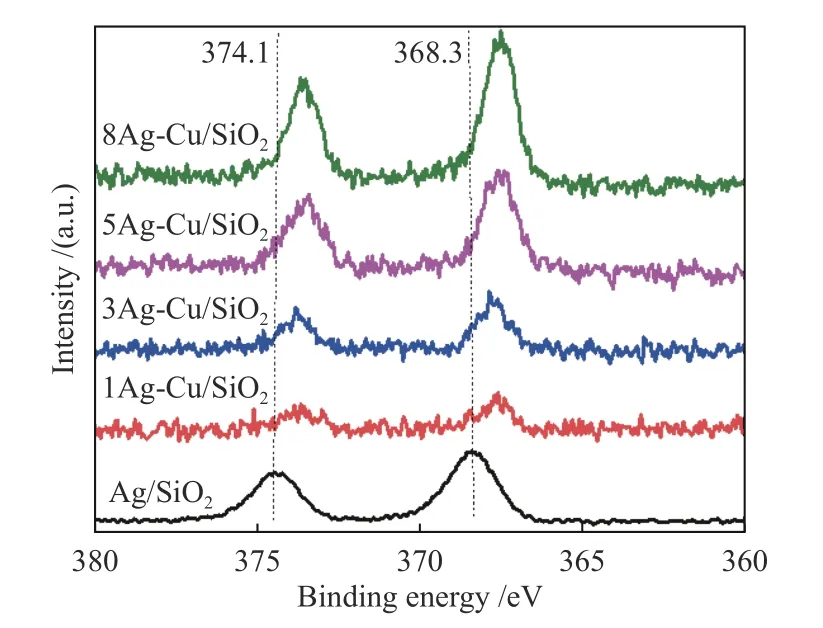
图8 Ag/SiO2和xAg-Cu/SiO2的Ag 3d XPS 谱图Figure 8 (a) Ag 3d XPS spectra of Ag/SiO2 and xAg-Cu/SiO2(x =1,3,5 and 8)
2.2 催化剂的活性评价
为探究Ag助剂对Cu基催化剂催化活性的影响,对Ag/SiO2、Cu/SiO2和xAg-Cu/SiO2催化剂的DMO加氢性能进行活性评价,结果如图9所示。与Cu/SiO2相比,xAg-Cu/SiO2的DMO转化率虽略有降低,但MG选择性及收率显著提高。且随着Ag含量的增加MG收率表现出先增加后减小的变化规律,其中,5Ag-Cu/SiO2的MG收率最高可达60.0%,相较于Cu/SiO2催化剂提高了20%。Ag/SiO2催化剂表现出极低的DMO转化率,但是MG选择性高达77%,表明Ag基催化剂具有优异的MG选择性[45]。因此,5Ag-Cu/SiO2的MG收率显著提高可以归因于:一方面,Ag自身对MG具有较高的选择性;另一方面,Cu基催化剂的加氢性能依赖于铜物种的分散度和Cu+/(Cu++Cu0)的比值[37]。Cu0能促进氢的裂解,Cu+能吸附和活化甲氧基和乙酰基[34]。TEM和XPS结果 表明,Cu-Ag间 形 成的 相互作用力提高了xAg-Cu/SiO2中铜物种的分散度(表1)和Cu+/(Cu++Cu0)的比例(表2)。此外,将少量Ag作为助剂加入Cu/SiO2中可以促进催化剂孔道的增大,有利于反应过程中MG分子转移,进而提高了MG的选择性。

图9 催化剂的反应活性评价Figure 9 Catalytic performance of catalysts at different calcination temperatures after activation
对Cu/SiO2和5Ag-Cu/SiO2进行长达100 h的活性评价。如图10所示,Cu/SiO2反应60 h后,DMO转化率和MG选择性开始下降,86 h后DMO转化率下降了30%,MG选择性下降了20%。5Ag-Cu/SiO2催化剂反应进行到80 h时加氢性能开始下降,86 h后DMO转化率下降了12%,MG选择性只下降了6%。对比发现,Ag的加入可显著提升催化剂的稳定性。5Ag-Cu/SiO2高稳定性可能归因于Ag的加入增强了Cu与载体之间的相互作用力,抑制了Cu颗粒在反应过程中的团聚[43],并保持了催化剂表面稳定的Cu+/(Cu++Cu0)比值[5,46]。
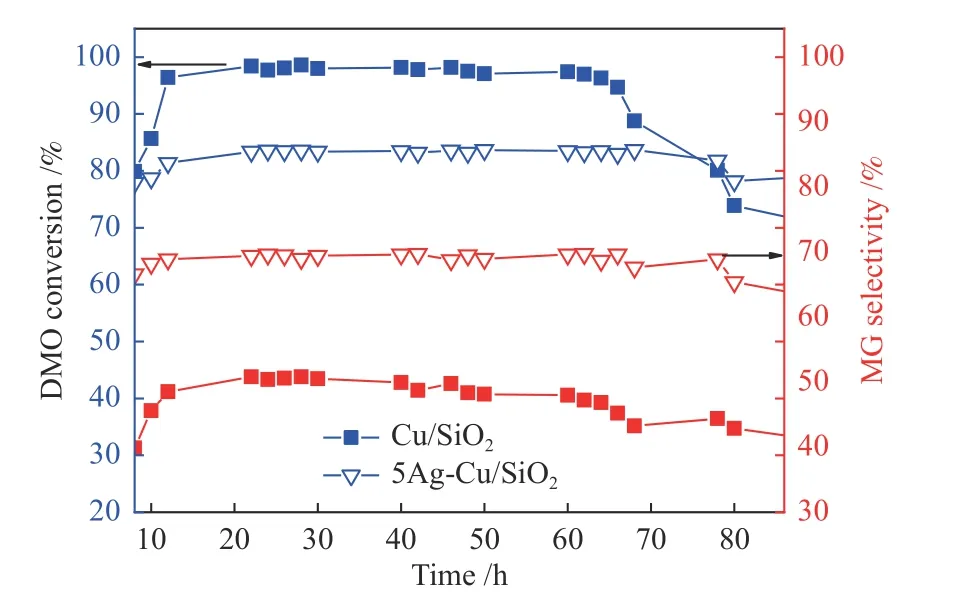
图10 催化剂稳定性评价Figure 10 Catalyst stability of catalysts at different calcination temperatures after activation
3 结 论
高分散的活性铜物种和高比例的Cu+/(Cu++Cu0)是影响催化剂活性和稳定性的主要因素。随着Ag加入量的提高,MG收率呈现出火山型曲线。当Ag的负载量为5%时,催化剂样品活性最佳,此时DMO转化率为83%,MG选择性为72.2%。Cu与Ag之间的相互作用力有效提高活性金属Cu物种的分散度及催化剂表面Cu+的含量,显著提高了催化剂的MG选择性。此外,适量Ag的加入有利于稳定催化剂表面Cu+/(Cu++Cu0)比值,其中,5Ag-Cu/SiO2催化剂在80 h的长期评价中能够保持稳定的催化活性。

