榆林煤水蒸气气化条件下钾的迁移行为研究
韦 兵 ,陈 倩 ,王伟成 ,张万祥 ,陶睿旻 ,窦艺帆 ,王兴军,*
(1.华东理工大学 资源与环境工程学院, 上海 200237;2.上海市煤气化工程技术研究中心, 上海 200237)
煤催化气化技术因其低温操作和动力学优势广泛受到研究者关注[1,2]。在煤催化气化工艺中,碱金属、碱土金属以及第Ⅷ族过渡金属的盐类是煤气化常见的催化剂。钾系催化剂因其价格低廉、催化活性好而受到广泛关注。另外,钾催化剂的引入可以有效降低反应温度[3]、提高反应速率、促进碳-水气化反应和甲烷化反应的进行、并提高目的产物的收率[4],这使得钾催化剂成为煤催化气化实验研究中最常见的催化剂[5]。
在前人的研究中表明,钾会与煤或煤焦中的炭微晶结构及煤灰中的矿物质产生相互作用并发生迁移行为,最终形成挥发性钾、气化残渣中的水溶性钾及不溶性钾。尽管在热解阶段,钾会在煤或煤焦表面重新分布[6]并形成CnK的团簇[7], 但Wigmans等[8,9]提出热解阶段形成的CnK团簇会抑制碱金属的挥发。因此,钾的挥发在气化阶段发生且被认为与催化的机理相关;被普遍接受的如Saber等[10]提出的关于C-O-K两种中间体循环的催化机理,如(1)-(3)所示;Kopyscinski等[11]提出在800 ℃以上时C-O-K中间体中的钾会挥发到气相中;Huhn等[12]在研究焦炭和碳酸钾的反应时,在反应器的冷凝段发现了挥发的钾。此外,气氛与制焦方式对钾的挥发存在一定的影响,如Feng等[13]发现水蒸气下钾的挥发量大于二氧化碳,且样品在热解前负载钾的气化比热解后负载钾的气化,挥发量高5%-27%。在气化末段,残留的钾与煤灰中矿物质之间反应形成不溶于水且无催化活性的钾铝硅酸盐导致钾催化剂的失活[14],研究人员通常对这一阶段的残渣进行水洗的方式回收钾催化剂,如陈杰等[15]发现,通过水洗的方法回收催化剂通常可将70%-80%的钾催化剂回收;Yuan等[16]发现,回收的钾与初次负载的钾具有相同的催化活性。

所以,钾的迁移行为是研究煤催化气化的一个重要方向。此外,虽然钾的挥发行为已经在不同的实验中均被发现,但大部分研究人员在研究催化气化时回避钾的挥发,如果考虑钾催化剂的挥发,会导致难以准确定量催化剂负载量,进而导致催化气化的研究困难[17]。因此,本研究将气化过程中钾的挥发行为纳入研究范围,对榆林煤水蒸气气化条件下钾迁移行为进行探究,考察气化过程中钾的挥发行为、气化残渣中的水溶性钾及不溶性钾的量。
1 实验部分
1.1 原料准备
以50-110 μm的榆林煤(ZA)为原料,负载10%碳酸钾,用研钵充分研磨混合后放入105 ℃鼓风干燥箱烘干24 h,标记为ZA-K;采用100 mL的稀盐酸(15.5%)、氢氟酸(40%)、浓盐酸(37.5%)对20 g的榆林煤在水浴温度80 ℃下洗涤40 min脱灰,对酸洗脱灰后的榆林煤(ZA-TH)重复上述负载碳酸钾的步骤,标记为ZA-THK;ZA和ZATH的工业分析及元素分析如表1所示,由表1可知,酸洗使榆林煤中的灰分含量由10.96%降低到1.44%。另外,参考表2所示的榆林煤(ZA)灰成分分析结果,采用四种主要氧化物(SiO2、Al2O3、CaO、Fe2O3)以相同质量分数配比模拟灰(SYA),负载与SYA等质量的碳酸钾标记为SYA-K,SYA的化学组成如表3所示。

表1 ZA和ZA-TH的工业分析及元素分析Table 1 Proximate and ultimate analyses of ZA and ZA-TH

表2 ZA的灰成分分析Table 2 Ash composition of ZA

表3 SYA的化学组成Table 3 Chemical composition of SYA
1.2 实验条件及样品处理
采用如图1所示的固定床实验装置进行样品的热解、气化实验。热解是将100 mg样品装载在如图1所示坩埚中,在150 mL/min氮气气氛下以20 ℃/min的升温速率升至指定温度,恒温10 min后冷却取出;气化是将100 mg样品装载在如图1所示坩埚中,以20 ℃/min左右的升温速率升至指定温度,恒温10 min后打开水蒸气泵的开关,在水蒸气速率20 mL/min下反应1.5 h后冷却至室温,对坩埚里的残渣采用水洗和消解的方法处理。残渣水洗和消解的操作如下:用多管漩涡混匀仪(上海沪西仪器分析厂,HT-200)水洗30 min,水洗后用离心机进行固液分离(7000 r/min),水洗实验重复五次,剩余的残渣添加3 mL HNO3、1 mL HF用微波消解仪(上海屹尧公司,EXCEL)在225 ℃,3.5 MPa下保持30 min进行消解,以消解后的液体无固体残留为消解完成的标志,水洗、消解得到的液体样品收集待测。
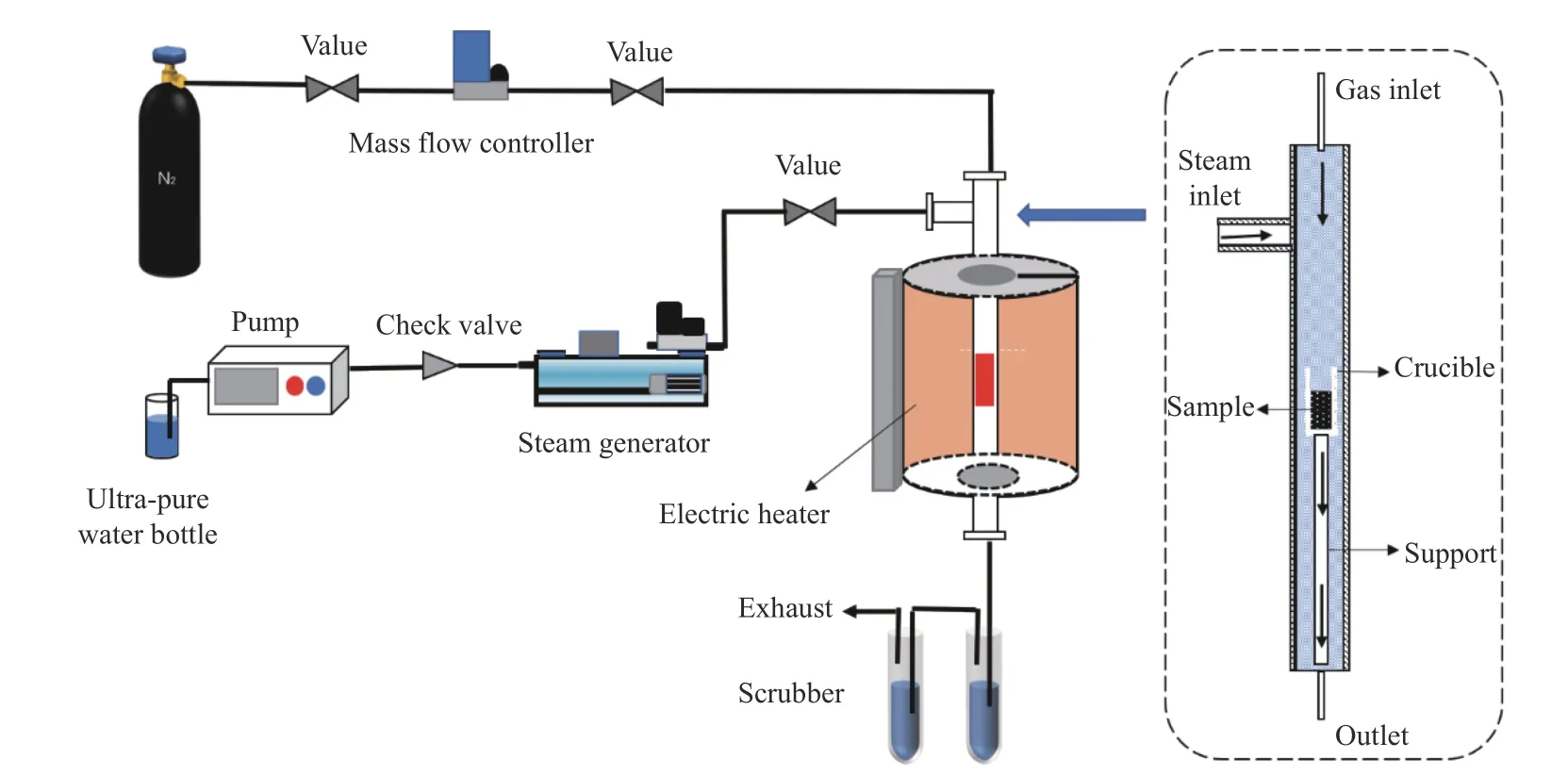
图1 实验流程示意图Figure 1 Experimental flow diagram
1.3 样品表征
1.3.1 钾含量的分析
采用原子吸收光谱(Analytik jena, nov AA350)分析水洗、消解得到的液体样品中的钾含量,钾的标准曲线质量浓度范围为0-7 mg/L,线性度R2≥ 0.995,液体样品取四次均值,样品中钾质量M及回收效率η的计算方法如式(4)-(8)所示。
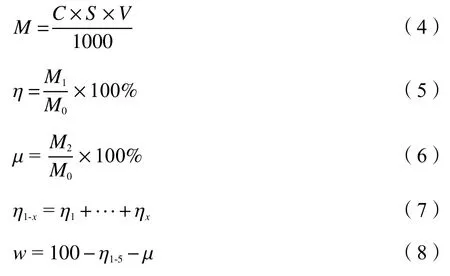
式中,M1、M2为待测样品中钾的质量(mg);C为样品中钾的质量浓度(mg/L),通过原子吸收光谱测量得出;S为样品的稀释倍数;V为样品的体积(mL),M0为反应前样品中钾的质量(mg),η和μ分别为可溶性钾回收效率和不溶性钾回收效率(%);x为水洗的次数(x= 1、2、3、4、5);η1-x为1、2、···、x次水洗的可溶性钾回收效率之和(%);w为钾的挥发量(%)。
1.3.2 炭微晶结构分析
使用拉曼光谱仪(Thermo Scientific DXR)对热解后样品的炭微晶结构进行分析,谱图3500-100 cm-1,配备455 nm波长的He-Ne激光器和50倍光学显微镜。以2 cm-1分辨率,扫描范围内10次叠加。为防止样品均一性带来的误差,对每个样品随机采集5-8个点。拉曼分峰的详细方法以及峰位置等详细信息按照Li等[18]的方法,使用Origin 9.8软件将1800-800 cm-1的拉曼光谱谱图反卷积为10个高斯峰。
1.3.3 物相组成分析
通过X射线衍射法(XRD,PAN-alytical X’Pert Powder)对样品气化反应后残渣的物相组成进行分析,样品在2θ= 10°-80° 采集信号,XRD辐射源为Cu靶,扫描电流为40 mA,扫描电压为40 kV,扫描精度为0.01°。
1.3.4 官能团分析
采用傅里叶红外光谱分析仪(Thermo Scientific Nicolet,iS50)分析ZA和ZA-TH中的官能团,谱图4000-400 cm-1,以4 cm-1的分辨率叠加32次。溴化钾和样品比例为100∶1,每次称取约30 mg的混合样品使用压片机进行压片,扣除背景时采用相同质量的溴化钾,为保证压片厚度相同,每次压片设置相同的时间和压力(8 min,2 MPa)。傅里叶红外光谱的吸收峰分析参照Ye等[19]的研究结果,分峰拟合参照Xie等[20,21]的研究结果。红外结构参数ƒa、I、DOC、A(CH2)/A(CH3)以及‘C’分别表示芳碳率、芳香基团和脂肪基团的相对丰度、芳香聚合度、脂肪链的长度及煤中大分子结构上桥键的饱和度以及C=O与C=C官能团的比值变化[22],其计算方法如下式(9)-(15)所示。

2 结果与讨论
2.1 样品官能团的变化
ZA和ZA-TH样品的红外光谱谱图以及不同官能团的吸收峰如图2所示。由图2可以看出,ZA中1100-1000 cm-1的Si-O和Si-O-Si的 吸 收峰明显,而ZA-TH中几乎没有Si-O和Si-O-Si的吸收峰,表明酸洗除去了ZA中的SiO2。除此之外,ZA和ZA-TH中存在的吸收峰几乎没有差别。
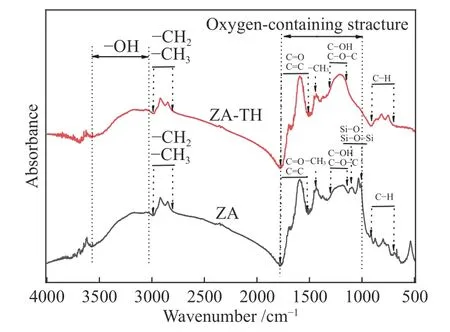
图2 ZA和ZA-TH的傅里叶红外光谱谱图Figure 2 FT-IR spectra of sample ZA and ZA-TH
对ZA和ZA-TH脱灰后的红外谱图进行分峰处理,以ZA-TH为例,分峰结果和拟合峰参数如图3和表4所示。其中,900-700 cm-1为芳香族的伸缩振动、1800-1000 cm-1为含氧官能团的的伸缩振动、3000-2800 cm-1为脂肪族的伸缩振动、3600-3000 cm-1为羟基结构的伸缩振动。
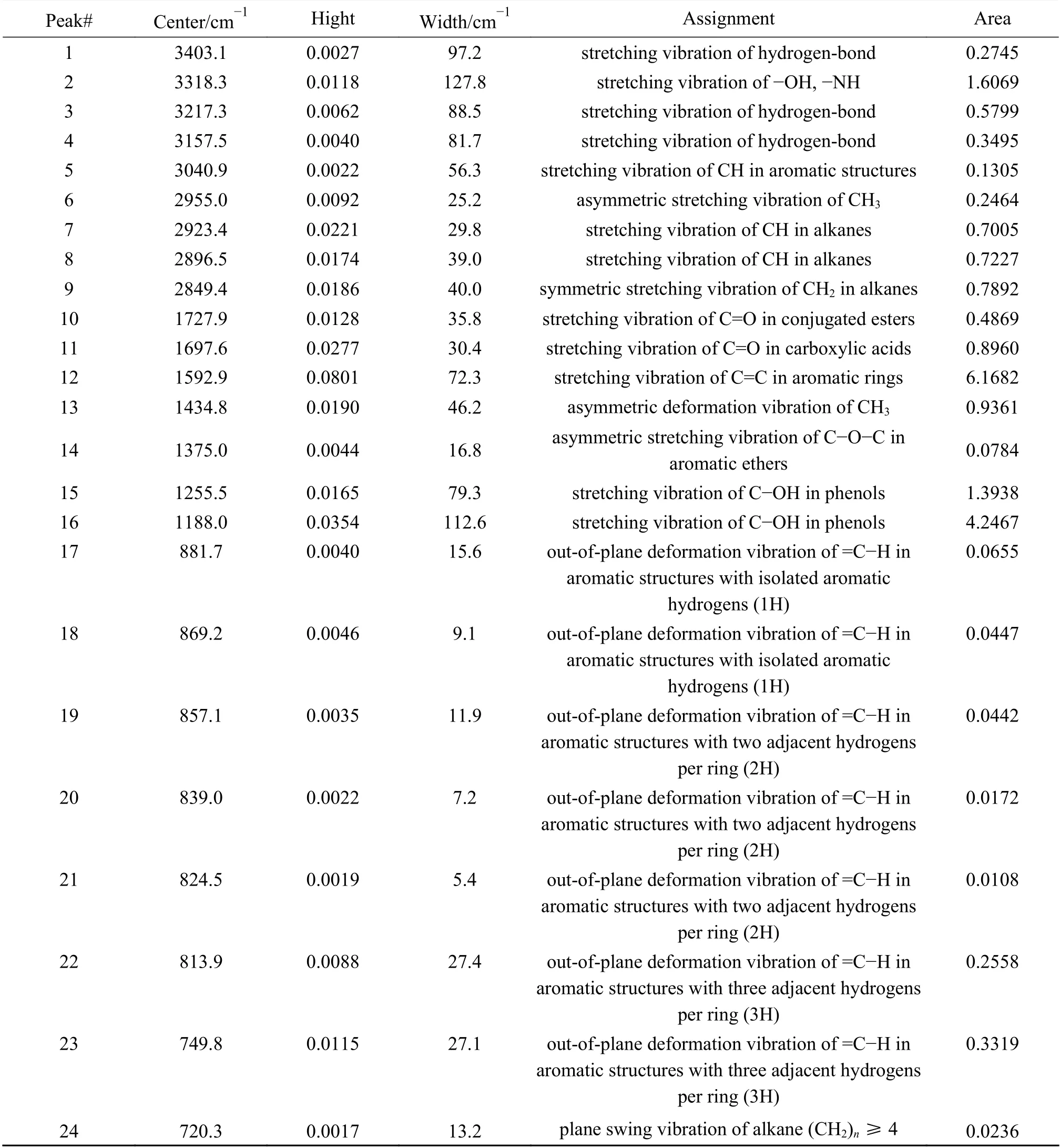
表4 ZA-TH的红外光谱拟合峰参数Table 4 Infrared spectrum fitting peak parameters of ZA-TH

图3 ZA-TH的红外拟合谱图Figure 3 Curve-fitting FT-IR spectrum of ZA-TH
ZA和ZA-TH的红外结构参数如表5所示。由表5可知,酸洗没有对ZA的芳碳率(ƒa)产生影响;但会造成长链脂肪烃的断裂,支化程度降低,脂肪链端部的-CH3数量增多,使ZA中的A(CH2)/A(CH3)的值由4.612降低到2.843;虽然长链脂肪烃的断裂使ZA中脂肪基团的相对丰度上升,但是ZA的芳香基团和脂肪基团的相对丰度(I)却由0.235增加到0.323;这主要由于酸洗导致ZA中的芳香基团增量大于脂肪基团增量;C=O与C=C官能团的比值(‘C’)由0.202降低到0.183,说明酸洗导致煤中C=O官能团的减少[23];芳香聚合度(DOC)由0.146降低到0.128,表明酸洗后样品的芳香聚合度降低,酸洗对煤中的芳香结构造成了破坏,这和王瀚姣等[24]的结论一致,盐酸-氢氟酸溶液对黄陵富油煤进行酸洗脱灰处理会降低煤样芳环缩合度。另外,I值增加也从侧面证明了这一点。

表5 ZA和ZA-TH的红外结构参数Table 5 Infrared structure parameters of ZA and ZA-TH
2.2 气化残渣中的钾
为排除榆林煤灰中的钾影响实验结果,对通过马弗炉内烧后得到的100 mg榆林煤灰进行水洗和消解实验,测得每100 mg榆林煤灰中含有可溶性钾0.044 mg、不溶性钾1.276 mg,在计算可溶性钾和不溶性钾时将减去煤灰中的钾以保证数据准确性。图4为不同温度下SYA-K与ZA-K中的水溶性钾回收效率与水洗次数的关系,图5三次水洗下可溶性钾的回收效率(η1-3)占总水溶性钾(η1-5)的百分比,图6为不同温度下SYA-K与ZAK的水溶性钾总回收效率与不溶性钾回收效率。可以得出,温度越高,水溶性钾回收效率越低;一次水洗可以回收总水溶性钾(η1-5)的64.9%-83.6%,三次水洗可以回收总水溶性钾的94.06%-98.80%,在700、750、800、850 ℃下SYA-K的水溶性钾总回收效率与ZA-K残渣的水溶性钾总回收效率的差异分别为7.55%、1.32%、1.07%、4.60%;这表明,采用氧化物模拟灰的方法与真实反应得到的水溶性钾回收效率的水平一致。

图4 不同温度下ZA-K与SYA-K的水洗次数与水溶性钾回收效率的关系Figure 4 Relationship between washing times of ZA-K,SYA-K and the yield of water-soluble potassium at different temperatures

图5 三次水洗下可溶性钾的回收效率(η1-3)占总水溶性钾(η1-5)的百分比Figure 5 Recovery efficiency of soluble potassium(η1-3) as a percentage of the total water-soluble potassium (η1-5)under three washings

图6 不同温度下ZA-K与SYA-K的水溶性钾总回收效率与不溶性钾回收效率Figure 6 Total recovery efficiency of water-soluble potassium and the recovery efficiency of insoluble potassium of ZA-K and SYA-K at different temperatures
为了进一步探究ZA-K与SYA-K总水溶性钾(η1-5)收率水平一致的原因,将SYA-K置于马弗炉中800 ℃煅烧1.5 h,记为SYA-K(Air);对800 ℃下气化1.5 h的ZA-K、SYA-K的残渣以及SYA-K(Air)进行XRD测试,结果如图7所示。由图7可知,ZA-K、SYA-K以及SYA-K(Air)的物相组成基本一致,导致ZA-K中水溶性钾收率降低的原因是钾与煤灰中的硅铝生成钾的硅铝酸盐的物相(KAlSiO4、KAlSi3O8等),这与毛燕东的研究结果一致[25];而在SYA-K以及SYA-K(Air)中也存在钾的硅铝酸盐物相,这表明高温下钾与氧化物之间的反应、钾与煤灰中矿物质之间的反应类似,且在实验条件下气氛对于可溶性钾的物相形成没有影响。根据Vargas等[26]提出的硅酸盐网络结构理论,Ca2+、Mg2+、Fe2+、Na+以及K+作为硅酸盐骨架的修饰组分、Si4+作为结构的骨架。而Al可以呈四次配位,代替部分Si4+进入络阴离子团,形成硅铝酸盐,如钾长石。另一方面,铝也可以呈六次配位存在于硅铝骨干中,起着阳离子的作用,形成铝的硅酸盐[27]。因此,尽管在气化过程中ZA-K与SYA-K、SYA-K(Air)中钾的物相不同,但是ZA-K、SYA-K以及SYA-K(Air)中的含钾物相在形成硅铝酸盐时的作用一致—为硅铝酸盐提供K+形成钾的硅铝酸盐。因此,ZA-K、SYA-K以及SYA-K(Air)的物相组成基本一致以及ZA-K与SYA-K总水溶性钾(η1-5)收率差异较小。
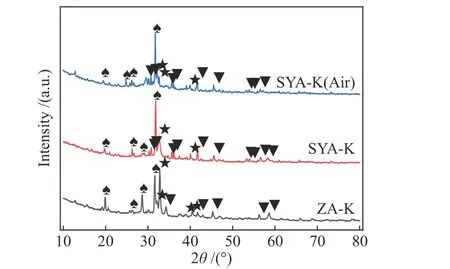
图7 800 ℃下ZA-K、SYA-K与SYA-K(Air)的XRD谱图Figure 7 XRD patterns of ZA-K, SYA-K and SYA-K(Air) at 800 °C
2.3 气化过程中挥发的钾
对ZA-K、ZA-THK、SYA-K气化后残渣中的水溶性钾和不溶性钾进行测定,以初始负载的碳酸钾为基准得到ZA-K、ZA-THK、SYA-K气化后挥发的钾,用Factsage Equlib模拟SYA-K中钾的挥发量,记为SYA-K-Factsge,结果如图8所示。由图8可知,SYA-K在700和750 ℃下钾的挥发量与模拟值一致,但800和850 ℃下SYA-K的钾挥发量小于模拟值,这是因为Factsage Equlib模拟的结果为体系达到平衡状态下的情况,而实际条件下SYA-K在800和850 ℃下的反应未达到平衡。

图8 ZA-K、ZA-THK、SYA-K反应后钾的挥发量以及SYA-K-Factsage模拟Figure 8 Volatilization of potassium in ZA-K, ZA-THK,SYA-K and after reactions and the results of SYA-K-Factsage simulation
对比ZA-K、ZA-THK以及SYA-K的实验结果表明,气化过程中以及气化反应末期(钾与煤灰之间发生的反应)钾均会发生挥发。ZA-K和ZATHK中钾的挥发量与温度呈线性关系,温度越高,钾越容易挥发。但ZA-K与ZA-THK中钾挥发量存在显著差别,在700、750、800、850 ℃下ZA-THK中的钾挥发量比ZA-K中高出10.28%、28.20%、34.13%、44.92%,ZA-THK中钾的挥发量最高可达71.18%;这表明,煤中灰分对固定钾并防止钾的挥发在气化反应后期起决定性作用。另外,对比SYA-K与ZA-K可知,在气化过程中,有5.88%-8.19%的钾因为煤焦的还原性和催化中间体C-O-K的形成而挥发[11]。
2.4 热解样品的结构变化及钾迁移机理
图9为ZA-K和ZA-THK在不同温度下热解的拉曼光谱谱图,图10为ZA-THK在600 ℃下的拉曼光谱分峰拟合。如图10所示,D峰(1300 cm-1)可以表示不少于六个芳香环的芳香结构,G峰(1590 cm-1)主要表示芳香环的伸缩振动,ID/IG与炭微晶结构尺寸La负相关[28](ID/IG=λ/La),ID/I(GR+VR+VL)表示煤中大环芳香体系(≥ 6环)与小的环芳香体系(2-8环)的比值,用于表征煤中芳香环的聚合程度,IS/IG主要表示样品中较为稳定的交联结构[13,18],ZA-K和ZA-THK在不同温度下热解的ID/IG、ID/I(GR+VR+VL)、IS/IG值如图11所示。

图9 ZA-K(a)和ZA-THK(b)在不同温度下热解的拉曼光谱谱图Figure 9 Raman spectra of ZA-K (left) and ZA-THK (right)pyrolysis at different temperatures
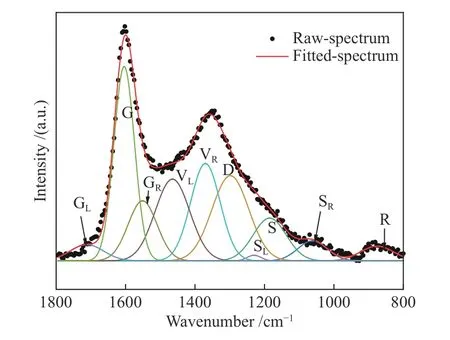
图10 ZA-THK 在600 ℃下热解的拉曼谱图分峰拟合Figure 10 Raman spectrum curve-fitting of ZA-THK pyrolysis at 600 ℃
由图11可知,随着热解温度升高,ZA-K和ZA-THK中的ID/IG和ID/I(GR+VR+VL)均呈现增大趋势,这表明样品中的微晶片层结构逐渐减小,小环芳香结构体系向大环芳香结构体系转变或优先被消耗,而Li等[29]在进行煤焦气化时也发现了小环芳香结构体系向大环芳香结构体系转变或优先被消耗的现象。值得注意的是,在低温(0、200 ℃)向高温(800 ℃)转变的过程中,ZA-K的ID/IG比ZATHK值高;ZA-K的ID/I(GR+VR+VL)值先升高至600 ℃后降低,而ZA-THK中ID/I(GR+VR+VL)的值一直呈上升趋势,且在0、400、600和800 ℃下ZA-THK的ID/I(GR+VR+VL)值均小于ZA-K,这表明ZA-THK中存在更多小环芳香体系使ZA-THK中的小环芳香体系向大环芳香体系转变的过程比ZA-K慢,这和ZA、ZA-TH的芳香聚合度参数(DOC)的结果一致。另外,在ZA-K中ID/I(GR+VR+VL)的值先升高至600 ℃后降低可能是因为在600 ℃下ZA-K中小环芳香体系已经大部分转变为大环芳香体系,随后在800 ℃的热解条件下会消耗大环芳香结构导致ID/I(GR+VR+VL)的值下降,表现为IG的减少,这和ID/IG的结果保持一致。

图11 不同热解温度下ZA-K和ZA-THK的ID/IG、IS/IG Figure 11 ID/IG, ID/ IS/IG ratio of ZA-K and ZATHK at different pyrolysis temperature
ZA-K的IS/IG在0-600 ℃保持相对稳定,而ZATHK的IS/IG在600 ℃增加后基本保持稳定;钾催化剂在热解过程中以插入芳香碳边缘和插入晶层间距中两种形式造成晶格缺陷[30]。因此,ZA-THK中更多的小环芳香体系在热解中形成的CnK团簇提供交联位点[29],使ZA-THK的小环芳香体系在600 ℃下交联,形成的交联结构在800 ℃下依旧能保持稳定。
当水蒸气进入反应体系后,由于H2O的尺寸较小[31],H2O会进入颗粒的内部并被吸附、解离为氢自由基和羟基自由基,羟基自由基会与CnK团簇反应形成C-O-K,ZA-THK中更多小环芳香体系会形成更多的CnK团簇,随着钾对煤焦的“开槽”作用[32],更多的活性位点形成C-O-K,更多的C-O-K造成更多的钾的挥发,如图12所示,这可能是ZATHK的挥发钾的量大于ZA-K的原因之一;但在反应后期,钾的挥发量取决于煤中的灰分,相比较ZA-THK,ZA-K中的煤灰会将负载的钾固定在煤灰中,这是ZA-K中的钾挥发量小于ZA-THK的主要原因。
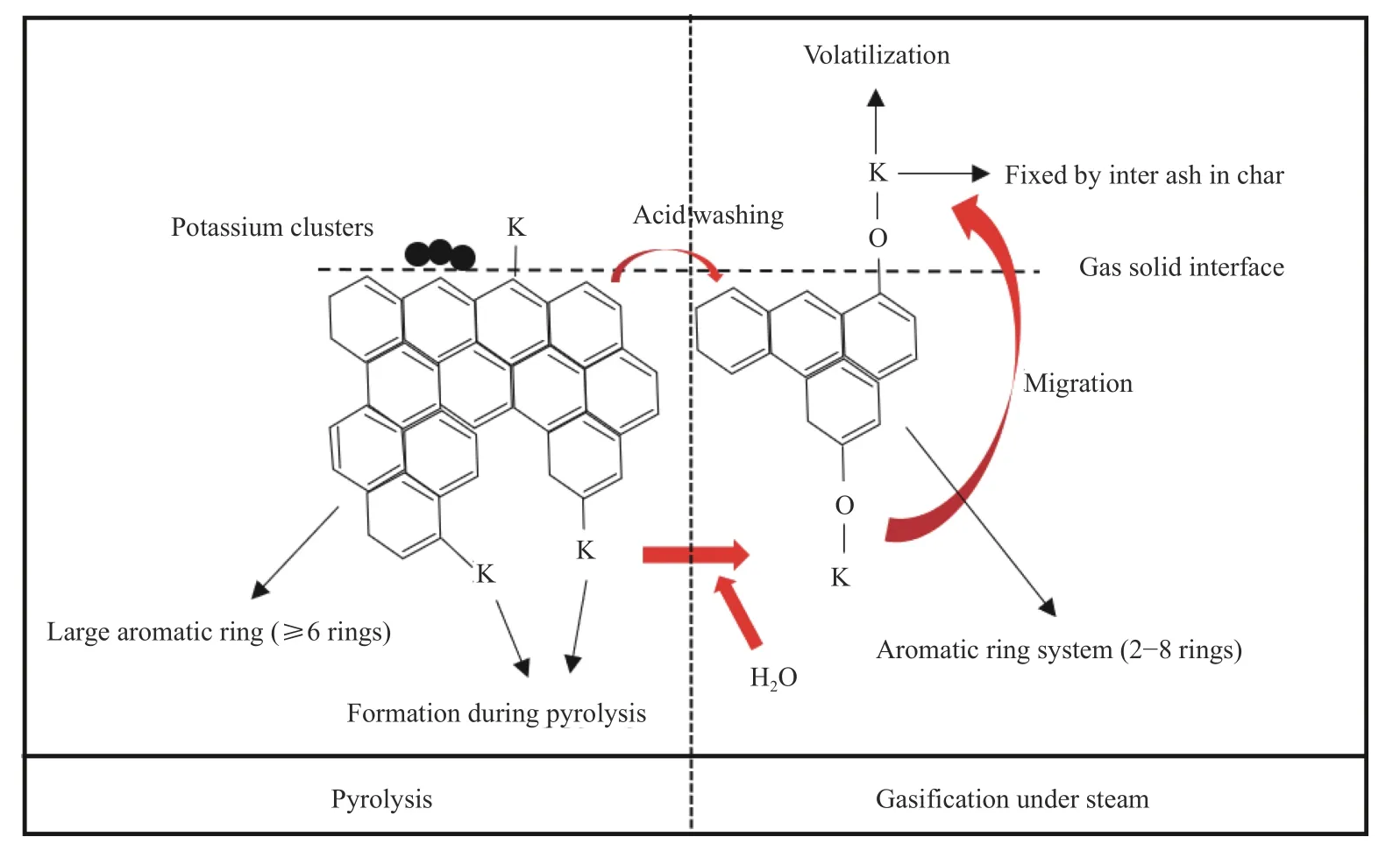
图12 煤热解和气化过程中钾迁移机理Figure 12 Potassium migration mechanism diagram during pyrolysis and gasification
3 结 论
脱灰煤比原煤中的钾在气化反应过程中更容易挥发;在700-850 ℃下,脱灰煤中的钾挥发比原煤高出10.28%-44.92%;主要原因是原煤中的灰分会将钾固定在煤灰中;另一原因是酸洗脱灰使煤的芳香聚合度降低;煤中出现更多的小环芳香结构(2-8环)。
温度越高,气化反应后残渣的水溶性钾回收效率越低、不溶性钾回收效率越高;一次水洗可以回收总水溶性钾(η1-5)的64.9%-83.6%,三次水洗可以回收总水溶性钾(η1-5)的94.06%-98.80%;不可溶性钾的生成是因为钾与煤灰中硅铝生成钾的硅铝酸盐物相。

