基于网络药理学的甘草酸二铵治疗流感机制研究
林少梅 林适峰 沈云珠 黄 刚 陈婉琼
基于网络药理学的甘草酸二铵治疗流感机制研究
林少梅1林适峰2沈云珠3黄 刚1陈婉琼1
(1.泉州医学高等专科学校,福建 泉州 362100;2.泉州市中医联合医院,福建 泉州 362100;3.福建医科大学附属第二医院,福建 泉州 362100)
目的:甘草酸二铵是临床常用的甘草酸制剂,研究从网络药理学的角度探讨甘草酸二铵治疗流感的潜在靶点和作用机制。方法:首先应用PubChem和STRING数据库获取甘草酸二铵标准靶点,接着在Genecards 数据库检索流感靶点并经Uniprot数据库校正,二者通过Venny在线工具相映射获得交集靶点,交集靶点运用STRING、Cytoscape3.7.2软件构建并分析网络拓扑参数,进一步运用R语言和DAVID平台对作用靶点进行GO功能和KEGG通路富集分析。结果:获得甘草酸二铵治疗流感的靶点23个,显著GO生物学过程115条和KEGG信号通路56条,主要涉及炎症、免疫和病毒细菌感染等。结论:甘草酸二铵可能通过多个通路作用于TNF、IL6等靶点治疗流感。
网络药理学;甘草酸二铵;流感
引言
流感是一种由流感病毒引起的急性呼吸系统传染病,流感症状不同地区发生率不同,但主要以全身症状如发热、头痛、肌肉酸痛、乏力为主,局部症状较少见,由于其具有传染性强和波及人群广的特性,一直是威胁人类生命健康的公共卫生问题[1,2]。每年全球发生重症流感病例高达300万例至500万例,在高风险人群中甚至引起死亡[3],主要防治药物有流感疫苗[4]和奥司他韦[5]等,但流感病毒变异极快,疫苗很难覆盖所有病毒[6]且疫苗接种率不高[7],药物预防变得十分困难[6],常用的抗病毒药容易引起多种不良反应[8]和耐药问题,因此亟需开发新型抗病毒药。
作为我国得天独厚的医疗资源,中医药在流感治疗中发挥了重要作用[9],甘草酸是甘草主要的活性成分,其常用制剂甘草酸二铵是临床一线抗炎保肝药[10]。近来大量研究表明甘草酸二铵可用于包括流感病毒在内的非肝炎病毒的治疗作用[11],甚至对SARS病毒[12]和SARS-CoV-2[10]也有一定作用,低剂量甘草酸二铵即可明显抑制流感病毒的复制,且呈剂量依赖性[13],但作用关键靶点和具体信号通路还不明确。
由于中药组分复杂多样、作用靶点众多、信号通路错综复杂,实验研究直接确定靶点难度大。网络药理学(network pharmacology)一词自2007年被首次提出后,便被迅速应用于众多领域研究中,运用网络药理学研究中药相关网络的报道逐年攀升,尤其是2010—2018年间的发文量更是2010年前总数的数倍,说明网络药理学在多组分、多靶点、多途径的中药干预疾病机制研究中得到了十分广泛的应用,为传统中药药理研究提供了思路和借鉴。本研究采用网络药理学的方法探讨甘草酸二铵治疗流感的关键靶点和信号通路,为药物开发和临床应用抗流感药提供新的思路。
1 资料与方法
1.1 药物靶点的获取
将甘草酸二铵的英文通用名“Diammonium Glycyrrhizinate”输入PubChem数据库(https://pubchem.ncbi.nlm.nih.gov),检索文献报道的甘草酸二铵的靶蛋白,剔除重复项后得到所有文献报道的靶标,将初步获得的靶蛋白名称输入STRING数据库(https://cn.string-db.org),把蛋白名转换成标准的基因名,建立数据集。
1.2 流感作用靶点的筛选
在Genecards数据库的关键字输入“Influenza”检索流感的治疗靶点,将得到的靶点信息剔除重复基因后输入Uniprot数据库(https://www.uniprot.org)使其标准化。
1.3 药物治疗疾病靶点预测
将疾病靶点与药物预测靶点输入Venny2.1在线平台相映射并作图,甘草酸二铵治疗流感的潜在靶点为映射得到的交集基因。
1.4 蛋白互作分析和网络构建
利用STRING数据库进行蛋白相互作用分析和PPI网络构建,在STRING数据库输入甘草酸二铵治疗流感的潜在靶点,物种选择“Homo sapiens”,置信度选择较高的0.7,得到STRING分析结果,结果通过Cytoscape3.7.2软件分析网络拓扑参数得到核心靶点并构建PPI网络图。
1.5 GO和KEGG富集分析
在DAVID数据库(https://david.ncifcrf.gov/home.jsp)导入上述Cytoscape得到的核心靶点基因进行GO功能和KEGG通路富集分析,属性设定为“Homo sapiens”,<0.05,排名前20的富集条目通过R语言进行可视化处理,结果以气泡图呈现。
2 结果
2.1 甘草酸二铵潜在作用靶点
通过PubChem数据库搜索“Diammonium Glycyrrhizinate”得到文献报道的甘草酸二铵靶点,并经STRING数据库转换共获得68个潜在靶点,详细信息见表1。

表1 甘草酸二铵作用靶点
2.2 流感潜在靶点
以“Influenza”为关键字在Genecards数据库搜索得到流感治疗靶点,进一步通过UniProt数据库校正,收集到流感相关性较高的潜在靶点共392个,部分信息见表2。
2.3 筛选药物治疗流感潜在靶点
流感疾病靶点与甘草酸二铵药物靶点在Venny2.1平台取交集得到表3,共筛选出23个共同靶基因即药物治疗流感潜在靶点,图1韦恩图展示靶点信息。
2.4 甘草酸二铵与流感靶点PPI网络构建
甘草酸二铵与流感映射得到的23个交集基因输入STRING平台进行蛋白质-蛋白质相互作用网络分析(图2a),接着通过Cytoscape3.7.2软件对STRING结果进行构图和网络拓扑参数分析,如图2b所示共包含23个节点、506条边,蛋白用节点表示,连接一个节点的线条数以度值表示,线条越多则关联度越大,颜色由红至蓝与度值呈正相关,节点越大、颜色越深,度值越大,说明靶点越重要,每条边表示蛋白之间的相互作用关系,边越粗则关系越密切。网络中度值最高的为TNF(degree=20),其次IL6(degree=19)、IL10(degree=17),其余超过节点平均度值的基因依次为IFNG、STAT1、IL4、IL5、CD4、JUN、IL17A,在PPI网络中具有重要联系作用。
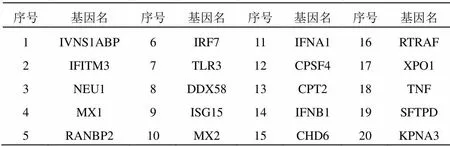
表2 流感潜在靶点部分信息
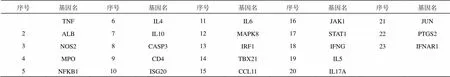
表3 药物治疗流感共同靶点
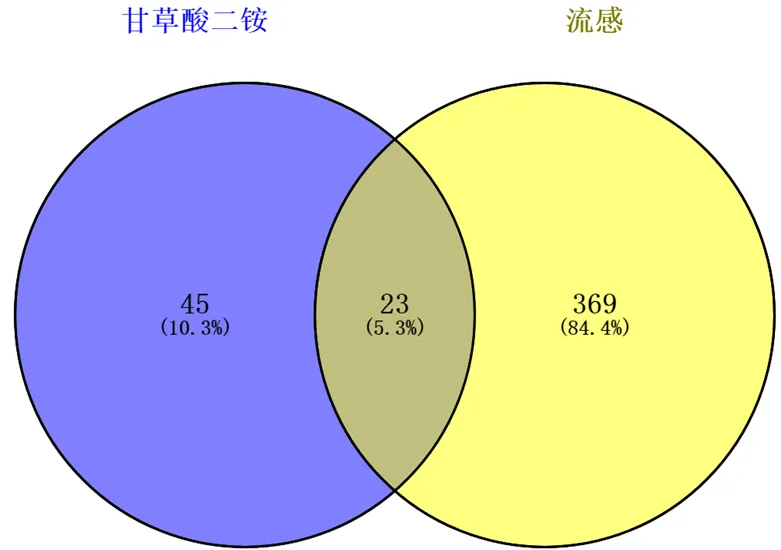
图1 药物与疾病靶点韦恩图
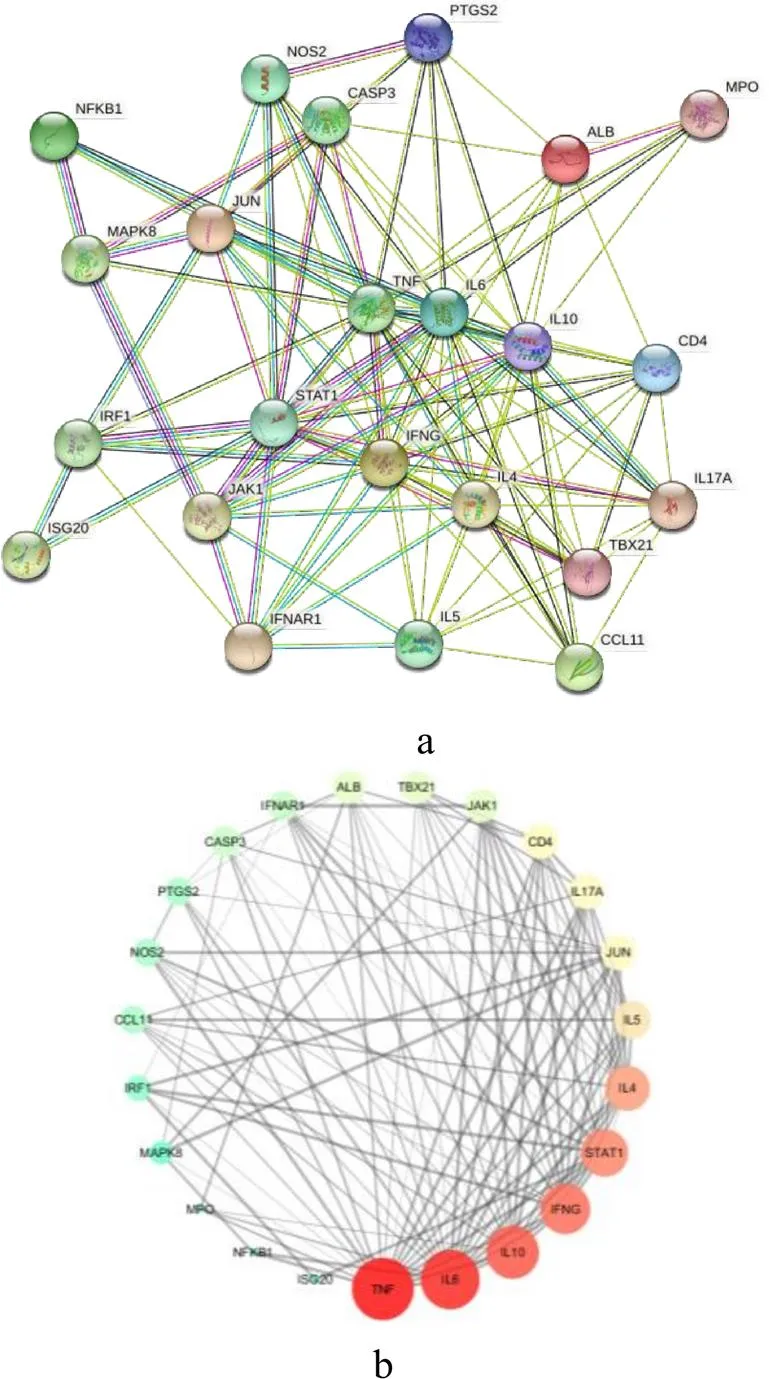
图2 甘草酸二铵与流感交集靶点的PPI网络
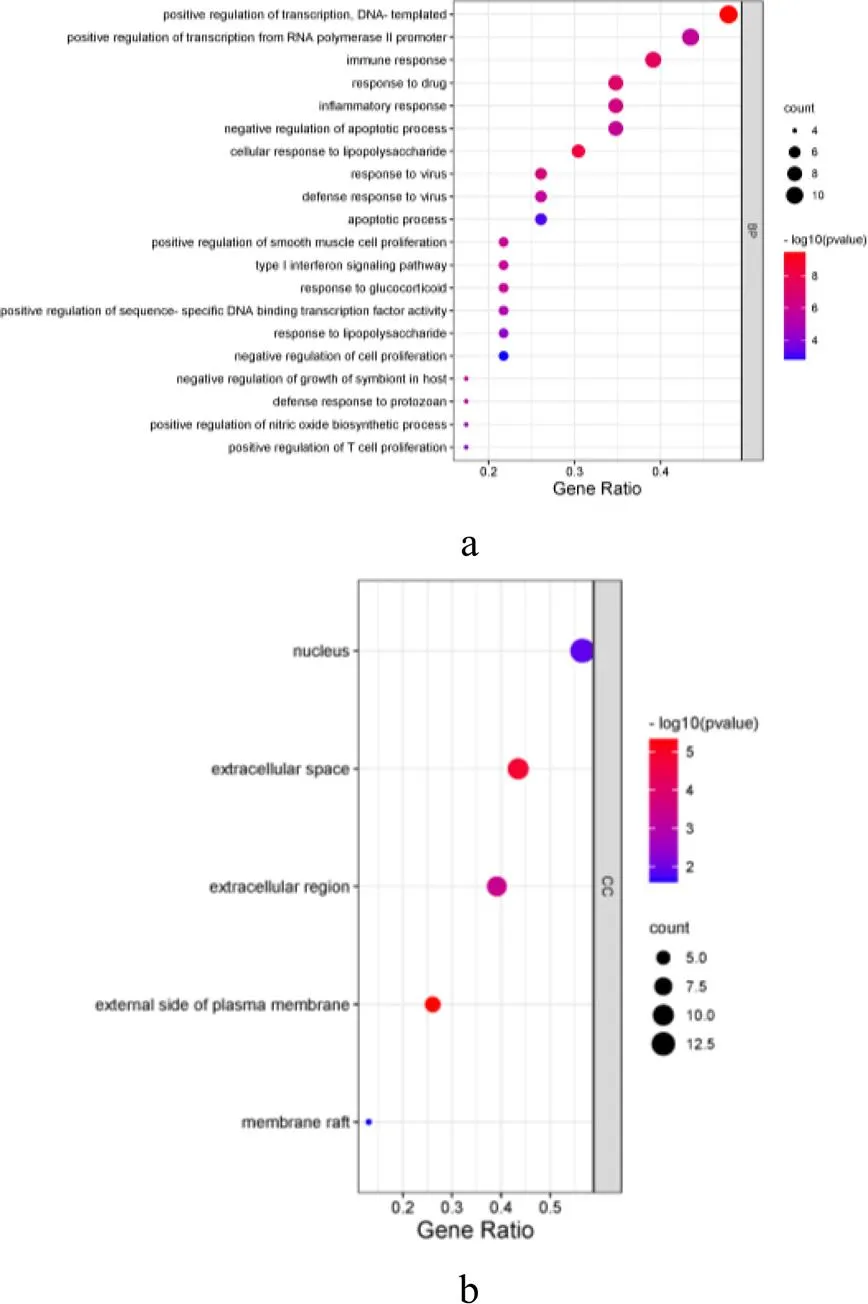
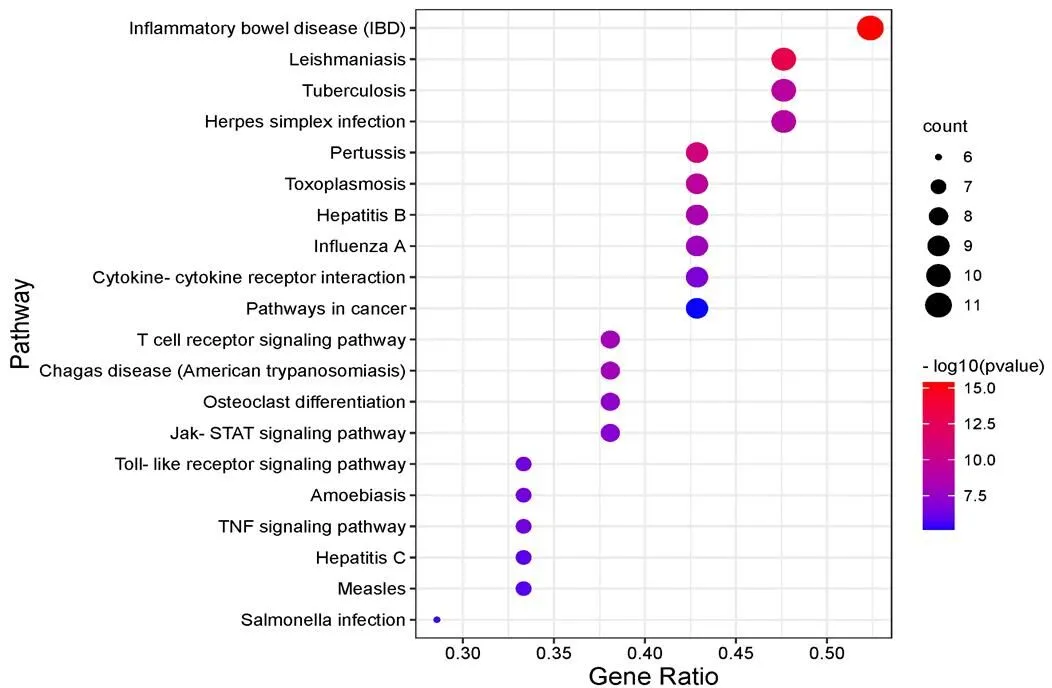
图4 KEGG通路富集的气泡图
2.5 GO功能和KEGG通路富集分析
以<0.05对核心靶点进行GO富集分析,注释结果筛选得到高显著性条目118项,其中BP(100项)、CC(5项)、MF(13项),如图3a所示,靶点主要集中在模板DNA转录正调控、RNA聚合酶II启动子转录正调控、免疫应答、炎症反应、细胞凋亡负调节、对药物的反应、脂多糖诱导的细胞反应、对病毒的反应和机体防御反应等生物过程,其中在模板DNA转录正调控、RNA聚合酶II启动子转录正调控、免疫应答等方面基因数目较多。
KEGG通路分析得到56条富集结果,基因数目>8的通路共10条,分别是炎症性肠病、利什曼病、结核病、单纯疱疹感染、百日咳、弓形虫病、乙型肝炎、甲型流感、细胞因子受体相互作用等(见图4)。
3 讨论
近年来我国流感疫情数呈增加态势,尤其是在2016-2018年处于高峰期,暴发疫情数南方地区多于北方地区,可能与南方潮湿的气候、人口密度高(高人口密度降低呼吸道免疫力)、流动性强有关[1,14]。流感病毒是流感流行季节最主要的病原体,近几年流感优势毒株为甲型H1N1、H3N2和乙型周期性更替出现,每年优势毒株不一,不断变异的抗原可能导致流感反复流行。
流感本身属于自限性疾病,可防可治可控,主要防治手段为疫苗预防和抗病毒药物治疗,接种流感疫苗仍是目前唯一最有效的预防手段[4],目前我国市面上使用的疫苗均是针对甲型H1N1、H3N2和乙型Victoria系病毒的三价疫苗,即使注射疫苗也不能保证每年流行的优势毒株都与疫苗组分相符,为了覆盖流感流行毒株的主要种类,我国加快推进四价疫苗研发,在原有三价疫苗组分上增加了乙型Yamagata系,并于2018年首次批准生产。
由于疫苗覆盖率低和研发的滞后性,想要阻断病毒复制和流感的蔓延仍需有效的抗病毒药。美国疾控中心推荐非妊娠期急性流感患者使用奥司他韦、扎那米韦等NA蛋白神经氨酸酶抑制剂。其他抗病毒药还有血凝素抑制剂、RNA依赖性RNA聚合酶抑制剂和M2离子通道蛋白抑制剂(金刚烷胺)等,临床最常用的是神经氨酸酶抑制剂,但多数患者在出现流感症状后才开始使用抗病毒药,往往已经超过控制病毒复制的最佳时间。广泛应用抗病毒药不仅治疗效果不佳还会导致大量耐药株的出现,相关耐药位点不断被发现,国内外正在寻找安全有效的抗病毒药物[15]。
中医药在经历疫情中不断发展突破,展现巨大潜力,中医辨证治疫病积累了丰富的临床经验。流感在中医学属于外感热病之瘟病、疫病[16],治疗药物莲花清瘟胶囊、清肺排毒汤和疫毒闭肺证、寒湿郁肺证、湿毒郁肺证的推荐处方皆含有中药甘草[17,18]。甘草一直是止咳祛痰、清热解毒的传统中药,主要活性成分就是甘草酸,大量研究表明甘草酸具有明显的抗病毒、抗炎、免疫调节、减少氧化应激等作用[19],对2型人副流感病毒[20]、甲型H1N1流感病毒、肝炎病毒、疱疹病毒、SARS-CoV等多种有效[11],其抗病毒作用可能与甘草酸诱导T细胞产生γ-干扰素有关[21]。甘草酸的临床制剂目前有甘草酸二铵、甘草酸单铵、复方甘草酸苷等,在治疗各类肝病中已积累较多循证医学证据[22]。其中甘草酸二铵是临床较常用的甘草酸制剂,从中药甘草活性成分提取,能够对抗乙肝病毒所产生的炎症瀑布保护肝细胞、改善肝功能[23,24],对多种原因引起的肝损伤都有防治作用,且与剂量呈正相关。对其他病毒也同样有普适性,可能与其诱导干扰素和增强免疫功能[25-27]。
本研究在通过PPI网络分析收集到甘草酸二铵治疗流感的核心靶点包括23个,主要涉及模板DNA转录正调控、RNA聚合酶II启动子转录正调控、免疫应答、对药物的反应、炎症反应、细胞凋亡负调节等生物过程,其中靶基因较多集中在模板DNA转录正调控、RNA聚合酶II启动子转录正调控、免疫应答等方面,说明甘草酸二铵治疗流感很可能与其调节免疫、转录调控、抗炎作用有关。越来越多的研究表明甘草酸能够抑制病毒的复制,付新亮报道了甘草酸二铵剂量相关性的降低感染H1N1的MDCK细胞内病毒的表达,尽管甘草酸二铵不能直接杀灭病毒和阻断病毒吸附、穿入宿主细胞过程,但能够抑制流感病毒复制后期阶段,减轻炎症反应、降低病毒复制引起的免疫损伤[13]。
机体感染病毒后启动免疫应答分泌细胞因子抗病毒,但免疫系统的过度激活可能会使免疫低下的患者发生急性肺损伤[28-31],严重者甚至出现急性呼吸窘迫综合征,专家们普遍认为肺损伤与病毒感染所致的细胞因子风暴密切相关,炎症风暴主要与病毒持续复制、T细胞介导的免疫失衡有关[32]。TNF、IL-6、IL-1等在流感病毒感染细胞的水平高于正常细胞[33],TNF是调节免疫应答、介导炎症的重要免疫防御分子,其通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子κB(nuclear factor kappa-B,NF-κB)信号通路可促进炎症反应,有研究表明甘草酸二铵可能通过影响细胞内的MAPK[34]和NF-κB[35,36]信号通道发挥抗氧化应激、改善炎症和免疫调节作用。
氧化应激时促炎细胞因子,如TNF-α、IL-1β及丝裂原等,通过IκB激酶(IKK)催化IκBα使其的两个保守的丝氨酸残基磷酸化而降解,从而活化NF-κB,活化的NF-κB转入细胞核中,引起促炎细胞因子TNF-α、IL-1β、IL-6和炎症相关蛋白诱生型一氧化氮合酶(iNOS)、环氧合酶(COX-2)等的表达增加,COX-2促进前列腺素的生成介导炎症反应。IL6是引起细胞因子风暴的关键分子之一[37],而这些细胞因子也是NF-κB的诱导剂,二者循环相互作用,并导致了炎症加剧[38]。甘草酸可减少NF-κB产生、抑制腺苷酸活化蛋白激酶(AMP-activated protein kinases,AMPK)通路和磷酸肌醇3-激酶(phosphatidylinositol 3-kinases,PI3K)/蛋白激酶B (protein kinase B,PKB)信号通路的激活,抑制IL-1β、IL-6和TNF-α的表达[39];还可减少炎症部位IL-8、iNOS的水平[40],提高抗氧化酶的活性,抑制COX-2表达降低炎症部位前列腺素水平[41],有效抑制炎症、发挥抗氧化和镇痛作用。
流感病毒感染中IL17增加提示着CD4细胞的过度激活而引起免疫失衡。CD4细胞是人体重要的免疫细胞,在IL-6的诱导下分化为Th17,分泌IL-17,参与炎症反应和自身免疫性疾病。甘草酸通过减少IL-6和IL-17的生成促进树突状细胞和巨噬细胞诱导的Th17细胞增殖和分化治疗结肠炎[42]。甘草酸还通过增加抗炎因子IL-10的表达,降低γ-干扰素、TNF-α等细胞因子的分泌,调节肠道菌群和免疫功能治疗肠部感染[43]。本研究在进行共同靶点蛋白互作分析时发现,甘草酸二铵可作用于TNF、IL6、IL10、IL17等多种细胞因子,其中TNF、IL6是最主要的潜在靶点,提示着甘草酸二铵在可能通过多重途径阻止炎症风暴、调节免疫、抗氧化应激,减轻流感病毒引起的炎症损伤。同时,甘草酸二铵可能通过IFNG调节信号传导与STAT1抑制流感病毒。
GO富集分析显示模板DNA转录正调控、RNA聚合酶II启动子转录正调控、免疫应答、炎症反应等生物过程在甘草酸二铵治疗流感中起到关键作用,说明甘草酸二铵对核酸转录调控、平衡免疫和消除炎症有一定作用。KEGG富集结果显示靶标富集的疾病通路包括与感染、免疫相关的疾病如炎症性肠病、利什曼病、结核病、弓形虫病,与流感感染源类似的单纯疱疹感染、乙型肝炎、甲型流感和与流感症状(咳嗽、肺部损伤)类似的百日咳等,提示着甘草酸二铵对病毒感染以及肺部损伤可能有用。总之,甘草酸二铵通过核酸转录正调控、增强免疫、IL17、细胞因子相互作用等多途径发挥抗炎、免疫调节作用。
4 结束语
综上所述,甘草酸二铵治疗流感是个多靶点、多途径的综合过程,主要通过阻断病毒复制、调控包括TNF、IL6、IL17在内的多种炎症因子的分泌,抑制病毒引起的细胞因子风暴,减轻炎症因子对肺组织的急性损伤,同时通过IFNG和STAT1调节免疫应答和炎症反应,多个途径阻止病毒引起的细胞因子对组织器官的损伤,促进机体康复,对流感病毒感染有巨大的临床应用前景,是今后流感疫情的潜在治疗药物。
[1] 代丽丽. 国家卫计委回应为何今年流感最凶猛[N]. 新京报,2018-1-10(6).
[2] Brown I H. The epidemiology and evolution of influenza viruses in pigs[J]. Veterinary Microbiology, 2000, 74(1/2): 29-46.
[3] Iuliano A D, Roguski K M, Chang H H, et al. Estimates of global seasonal influenza-associated respiratory mortality: A modelling study[J]. The Lancet, 2018, 391(10127): 1285-1300.
[4] Dini G, Toletone A, Sticchi L, et al. Influenza vaccination in healthcare workers: A comprehensive critical appraisal of the literature[J]. Human Vaccines and Immunotherapeutics, 2018, 14(3): 772-789.
[5] Tuna N, Karabay O, Lu Y. Comparison of efficacy and safety of oseltamivir and zanamivir in pandemic influenza treatment[J]. Indian Journal of Pharmacology, 2012, 44(6): 780-783.
[6] Li-Kim-Moy J P, Yin J K, Heron L, et al. Influenza vaccine efficacy in young children attending childcare: A randomised controlled trial[J]. Journal of Paediatrics and Child Health, 2017, 53(1): 47-54.
[7] 徐莉立,赵金华,秦颖等. 医务人员流感疫苗接种政策与现状分析[J]. 中华预防医学杂志,2019(10): 973-977.
[8] 董伟,王艳彩. 磷酸奥司他韦预防甲型H1N1流感时引起不良反应206例报道[J]. 中国临床药学杂志,2011(2): 111-113.
[9] 陈亚乔,侯林,崔清华,等. 中药抗病毒活性及作用机制研究进展[J]. 中医药导报,2017,23(22): 103-106.
[10] 甘草酸制剂肝病临床应用专家委员会. 甘草酸制剂肝病临床应用专家共识[J]. 临床肝胆病杂志,2016,32(5): 844-852.
[11] 蒲洁莹,何莉,吴思,等. 甘草属植物中三萜类化合物的抗病毒作用研究进展[J]. 病毒学报,2013,29(6): 673-679.
[12] Hoever G, Baltina L, Michaelis M, et al. Antiviral activity of glycyrrhizic acid derivatives against SARS-coronavirus[J]. Journal of Medicinal Chemistry, 2005, 48(4): 1256-1259.
[13] 付新亮,范迪,刘乙兴,等. 甘草酸二铵抗流感病毒的作用机制[J]. 中国兽医学报,2020,40(2): 330-335.
[14] 杨静,汪立杰,祝菲,等. 中国大陆地区2016—2017监测年度流感暴发疫情流行病学特征分析[J]. 中国公共卫生,2018,34(6): 67-70.
[15] 耿兴良,廖国阳. 流感病毒减毒活疫苗的研究进展[J]. 中国生物制品学杂志,2017,30(1): 103-111.
[16] 吴涛,王平,赵澄,等. 从《伤寒论》“太阳兼证”探讨胃肠型流感传变机制及治疗[J]. 中医药导报,2020,26(9): 97-100.
[17] 中华人民共和国国家卫生健康委员会,国家中医药局. 流行性感冒诊疗方案(2019年版)[J]. 中华临床感染病杂志,2019(6): 451-455.
[18] 中华人民共和国国家卫生健康委员会. 流行性感冒诊疗方案(2020年版)[J]. 传染病信息,2020,33(5): 385-390.
[19] 陈冉,王婷婷,李开铃,等. 免疫调节抗病毒中药的特性与应用[J]. 中草药,2020,51(6): 1412-1426.
[20] Sakai-Sugino K, Uematsu J, Kamada M, et al. Glycyrrhizin inhibits human parainfluenza virus type 2 replication by the inhibition of genome RNA, mRNA and protein syntheses[J]. Drug Discoveries and Therapeutics, 2017, 11(5): 246-252.
[21] 方炳虎,邱灵才,陈建新,等. 甘草主要成分抗H9N2亚型流感病毒作用研究[J]. 广东农业科学,2007(3): 66-69.
[22] 陈桂君. 甘草酸二铵治疗病毒性肝炎疗效观察[J]. 中国处方药,2018,16(11): 93-94.
[23] 李小翚,洪鸿敏,李常青,等. 甘草酸二铵对大鼠实验性肝纤维化的影响[J]. 中药材,2011,34(7): 1097-1101.
[24] Lee C H, Park S W, Kim Y S. Protective mechanism of glycyrrhizin on acute liver injury induced by carbon tetrachloride in mice[J]. Biological and Pharmaceutical Bulletin, 2007, 30(10): 1898-1904.
[25] 姚朵朵,张须龙. 流感病毒感染的模式识别及下游相关信号通路[J]. 微生物学免疫学进展,2018,46(3): 60-66.
[26] 欧强. 甘草酸二铵抗大鼠免疫性肝纤维化作用研究[J]. 中成药,2006,28(7): 1046-1047.
[27] 候长奎. 甘草酸二铵对哮喘大鼠气道炎症的影响[J]. 中国临床医药研究,2007(1): 1-3.
[28] Gu Y N, Hsu A C Y, Pang Z Q, et al. Role of the innate cytokine storm induced by the influenza A virus[J]. Viral Immunology, 2019, 32(6): 244-251.
[29] Guo X J, Thomas P G. New fronts emerge in the influenza cytokine storm[J]. Seminars in Immunopathology, 2017, 39(5): 541-550.
[30] Probert L. TNF and its receptors in the CNS: The essential, the desirable and the deleterious effects[J]. Neuroscience, 2015, 302: 2-22.
[31] Costa A G, Sadahiro A, Monteiro T A, et al. Immune response in Mansonella ozzardi infection modulated by IL-6/IL-10 axis in Amazon region of Brazil[J]. Cytokine, 2018, 104: 98-103.
[32] Durbin R K, Kotenko S V, Durbin J E. Interferon induction and function at the mucosal surface[J]. Immunological Reviews, 2013, 255(1): 25-39.
[33] 李玲,魏科,卢芳国,等. 基于TLR4-MyD88-TRAF6信号通路的麻杏石甘汤抗A型流感病毒感染小鼠所致的病毒性肺损伤研究[J]. 中草药,2017,48(8): 1591-1596.
[34] Ochi M M, Amoabediny G, Rezayat S M, et al. In vitro co-delivery evaluation of novel pegylated nano-liposomal herbal drugs of silibinin and glycyrrhizic acid(nano-phytosome) to hepatocellular, carcinoma cells[J]. Cell Journal, 2016, 18(2): 135-148.
[35] Wang J Y, Guo J S, Li H, et al. Inhibitory effect of glycyrrhizin on NF-kappaB binding activity in CCl4-plus ethanol-induced liver cirrhosis in rats[J]. Liver, 1998, 18(3): 180-185.
[36] Liang B, Guo X L, Jin J, et al. Glycyrrhizic acid inhibits apoptosis and fibrosis in carbon-tetrachloride-induced rat liver injury[J]. World Journal of Gastroenterology, 2015, 21(17): 5271-5280.
[37] Kaur S, Bansal Y, Kumar R, et al. A panoramic review of IL-6: Structure, pathophysiological roles and inhibitors[J]. Bioorganic and Medicinal Chemistry, 2020, 28(5): 115327.
[38] Karin M, Yamamoto Y, Wang Q M. The IKK NF-κBsystem: A treasure trove for drug development[J]. Nature Reviews Drug Discovery, 2004, 3(1): 17-26.
[39] Liu W, Huang S, Li Y, et al. Synergistic effect of tolfenamic acid and glycyrrhizic acid on TPA-induced skin inflammation in mice[J]. MedChemComm, 2019, 10: 1819-1827.
[40] Park J M, Park S H, Hong K S, et al. Special licorice extracts containing lowered glycyrrhizin and enhanced licochalcone a prevented helicobacter pylori-initiated, salt diet-promoted gastric tumorigenesis[J]. Helicobacter, 2014, 19: 221-236.
[41] Ojha S, Javed H, Azimullah S, et al. Glycyrrhizic acid attenuates neuroinflammation and oxidative stress in rotenone model of Parkinson's disease[J]. Neurotoxicity Research, 2016, 29: 275-287.
[42] Chen X, Fang D, Li L, et al. Glycyrrhizin ameliorates experimental colitis through attenuating interleukin-17-producing T cell responses via regulating antigen-presenting cells[J]. Immunologic Research, 2017, 65: 666-680.
[43] Xu X, Gong L, Wang B, et al. Glycyrrhizin attenuates Salmonella enterica serovar Typhimurium infection: New insights into its protective mechanism[J]. Frontiers in Immunology, 2018, 9: 2321.
Study on the Mechanism of Diammonium Glycyrrhizinate in the Treatment of Influenza Based on Network Pharmacology
Objective: Diammonium glycyrrhizinate is a commonly used glycyrrhizic acid preparation in clinic. In this study, the potential target and mechanism of diammonium glycyrrhizinate in the treatment of influenza were discussed from the perspective of network pharmacology. Methods: First, PubChem and STRING databases were used to obtain the standard target of diammonium glycyrrhizinate, and then the influenza target was retrieved in genecards database and calibrated by Uniprot database. The two were mapped by Venny online tools to obtain the intersection target. The intersection targets were constructed and analyzed by using STRING and Cytoscape3.7.2 software, and further analyzed by R language and DAVID platform for GO function and KEGG pathway enrichment of the target. Results: 23 targets of diammonium glycyrrhizinate for the treatment of influenza were obtained, including 115 significant GO biological processes and 56 KEGG signaling pathways, mainly involving inflammation, immunity and viral bacterial infection. Conclusion: Diammonium glycyrrhizinate may act on TNF, IL6 and other targets in the treatment of influenza through multiple pathways.
network pharmacology; diammonium glycyrrhizinate; influenza
R96
A
1008-1151(2022)08-0102-06
2022-05-21
林少梅(1990-),女,泉州医学高等专科学校助教,研究方向为药理学。
林适峰(1987-),男,泉州市中医联合医院主治医师,硕士,研究方向为肾脏病学相关。

