乙酰转移酶10通过介导盘状蛋白结构域受体1 mRNA的ac4C乙酰化修饰促进宫颈癌细胞的恶性行为
张 雪, 汤 华
(天津医科大学基础医学院病原生物学系, 天津 300070)
RNA的转录后修饰对其结构和功能具有重要的调控作用,目前已知的天然RNA修饰类型超过150种[4]。ac4C乙酰化修饰(N4-acetylcytidine, ac4C)是一种存在于真核及原核生物中保守的化学修饰,作为一类新发现的RNA修饰,其机制和功能受到越来越多的关注。早期研究认为,ac4C主要存在于tRNA和18 S rRNA[5]上,而近期研究显示,其亦可通过提高靶基因的mRNA稳定性和翻译效率促进其表达[6]。乙酰转移酶-10(N-acetyltransferase 10, NAT10)被认为是RNA ac4C修饰酶,是目前鉴定的一种同时具有乙酰化酶结构域和RNA结合结构域的蛋白质[7]。研究表明,NAT10介导的乙酰化修饰与胃癌[8]、获得性免疫缺陷综合征[9]等多种疾病相关。然而,NAT10是否可以通过其乙酰化修饰作用影响宫颈癌的恶性行为尚不清楚。
盘状蛋白结构域受体(discoidin domain receptors, DDRs)是一组酪氨酸激酶的亚家族,由DDR1和DDR2组成[10],DDR1是一种可被多种胶原结合并被激活的酪氨酸激酶受体,由胞外区、胞内激酶区和跨膜区三部分组成。有研究报道,DDR1在膀胱癌[11]、胃癌[12]和非小细胞肺癌[13]等多种恶性肿瘤中高度表达,可调控迁移、侵袭等多种肿瘤的生物学功能[11,12]。但是,DDR1在宫颈癌中的生物学功能及作用仍需进一步的研究探索。
本文通过数据库分析发现,NAT10在宫颈癌组织及细胞中呈高表达,并且NAT10高表达的宫颈癌病人预后较差。继而在宫颈癌细胞中过表达和敲低NAT10,检测NAT10对宫颈癌细胞恶性行为的影响。进一步研究证明NAT10乙酰化修饰DDR1 mRNA, 并提高了其表达水平,进而促进宫颈癌的恶性行为。本研究可能为NAT10介导的mRNA乙酰化修饰在宫颈癌细胞生物学功能的作用中提供新的研究思路。
1 材料与方法
1.1 细胞培养和转染
人宫颈癌细胞HeLa细胞购于美国菌种保藏中心(ATCC)细胞库并由实验室保存。HeLa细胞使用的完全培养基由6 % 胎牛血清(FBS)、100 μg/mL链霉素和100 IU/mL青霉素的RPMI 1640基础培养液配置。永生化人宫颈上皮细胞S12培养液为DMEM、F12培养液(1∶3)混合后的培养液加入5 % FBS、5 μg/mL胰岛素、8.4 ng/mL 霍乱毒素、24.3 μg/mL腺嘌呤、0.5 μg/mL氢化可的松和10 ng/mL 表皮生长因子配置而成,S12细胞为实验室前期储存。细胞均培养于含5 % CO2的37 ℃ 恒温培养箱中。细胞转染按照Lipofection 2000试剂制造商提供的操作指南进行。
1.2 质粒构建
NAT10相关质粒为实验室前期构建,并储存于实验室-20 ℃条件下。对于过表达DDR1质粒的构建,以DDR1 cDNA(SRCL03623,天津赛尔生物)为模板,扩增得到DDR1 PCR产物,并插入到BamHⅠ 和XhoⅠ 酶切位点之间,构成pcDNA3/3xFlag-DDR1(Flag-DDR1)质粒。设计并合成针对DDR1的编码发夹结构的cDNA片段,插入到pSilencer 2.1-U6 neo载体的BamHⅠ 和HindⅢ 酶切位点之间构成DDR1敲低质粒。设计并合成包含DDR1乙酰化野生型和突变型位点的互补DNA片段,其分别插入到pcDNA3/EGFP载体的BamHⅠ和EcoRⅠ位点之间,构成pcDNA3-DDR1-EGFP-ac4C-wt和pcDNA3-DDR1-EGFP-ac4C-mut EGFP报告系统质粒。引物序列见Table 1。

Table 1 Sequences of each primer
1.3 Western免疫印迹分析
将细胞接种于24孔板内,细胞转染48 h后收取蛋白质样品。弃去旧培养液,用磷酸盐缓冲液(1×PBS)清洗1~2次,加入蛋白质裂解缓冲液,获得蛋白质样品后用于SDS-PAGE,并转移至PVDF膜上,5%脱脂牛奶室温封闭2 h,再用合适比例的抗体4 ℃条件下孵育过夜:NAT10(SRP07792, 1∶300);DDR1(SRP10937, 1∶100);E-钙黏着蛋白(SRP05266, 1∶500);波形蛋白(SRP01327, 1∶1 000);HA-tag(SRPM00080, 1∶200);EGFP(SRP12235, 1∶4 000);GAPDH(SRP00849, 1∶3 000)均购于天津赛尔生物公司,Flag(1∶4 000)购于美国Sigma公司。1×TBST清洗,加入辣根过氧化物酶标记的二抗中室温孵育2 h,加入化学发光液后在暗室曝光成像。使用Image J分析数据结果。
1.4 RNA提取及实时荧光定量PCR
使用Trizon试剂提取转染后细胞的总RNA,使用HiScript®Ⅱ Reverse Transcriptase逆转录试剂盒(Invitrogen, Carlsbad, CA)将细胞总RNA逆转录为cDNA。根据制造商提供的操作说明书,使用2x Universal SYBR Green Fast qPCR Mix试剂盒(ABclonal, America)进行qPCR反应。数据采用2-ΔΔt算法处理,使用β肌动蛋白作为内参。引物序列见Table 2。

Table 2 Sequences of each primer
1.5 RNA结合蛋白免疫沉淀检测
细胞转染36 h后提取细胞的总RNA。根据试剂盒的操作说明书,使用Magna RIPTMRNA-Binding Protein Immunoprecipitation试剂盒(Millipore; America)处理细胞。结合RT-qPCR实验检测富集于Flag抗体或ac4C乙酰化抗体和抗鼠IgG抗体包被的磁珠的DDR1 mRNA的水平。数据采用2-ΔΔt算法处理,使用β肌动蛋白作为内参。引物序列见Table 3。
迎旭凌绝嶝,映泫归溆浦。钻燧断山木,掩岸墐石户。结架非丹甍,藉田资宿莽。同游息心客,暧然若可睹。清霄扬浮烟,空林响法鼓。忘怀狎鸥鲦,摄生驯兕虎。望岭眷灵鹫,延心念净土。若乘四等观,永拔三界苦。[13](卷三《登石室饭僧诗》,P1164)

Table 3 Sequences of each primer
1.6 RNA半衰期检测
将细胞接种在6孔板中,转染细胞32 h 后分别加入终浓度为5 μg/mL 的转录抑制剂放线菌素D(actinomycin-D, Act-D),处理细胞不同时间(0 h、1 h、2 h、4 h)后收集样品RNA。再提取上述细胞的总RNA进行RT-qPCR检测DDR1 mRNA水平。
1.7 MTT实验
细胞接种在24孔板中,转染24 h后消化细胞并用1 mL无血清培养液重悬细胞并计数。按照每孔6 000个/孔的HeLa 细胞(100 μL)接种在96孔板中,每一组设置5个副孔。分别在培养24 h、48 h和72 h时加入10 μL 的噻唑蓝(5 mg/mL)并培养6 h。弃去旧培养液,每孔加入100 μL 二甲基亚砜,随后避光震荡混匀5 min,立即使用酶标仪检测570 nm处的吸光度。
1.8 集落形成检测
按照每孔1 000个HeLa细胞的比例,将细胞接种在含有2 mL完全培养液的12孔板中,37 ℃、5% CO2孵箱内培养10~12 d弃去培养液,1×PBS清洗细胞,结晶紫染色5 min,用流水缓慢清洗干净结晶紫后晾干,拍照计数并统计分析。
1.9 Transwell迁移、侵袭实验
转染的细胞消化后每孔使用1 mL无血清培养液重悬计数,随后按照每孔6×104个细胞(200 μL/孔HeLa细胞)接种在含有或不含Matrigel凝胶的Transwell小室上层内,well下层每孔加入700 μL 含30%胎牛血清的1640培养液,在37 ℃、5% CO2细胞培养箱中培养48或72 h。使用固定液(甲醇:冰乙酸=3∶1)室温固定30 min,1×PBS清洗4次,结晶紫染色5 min,流水冲洗干净后晾干。用树胶封片后在显微镜下随机选取5个视野拍照。使用Image J定量分析细胞迁移或侵袭数量。
1.10 统计学方法
使用GraphPad Prism 6.0分析软件处理数据,组间数据比较采用Student′st检验分析。所有数据均重复3次。P<0.05 被认为差异具有统计学意义。
2 结果
2.1 乙酰转移酶10促进宫颈癌细胞的生长和增殖活性
通过GEO数据库(GSE9750)分析NAT10在宫颈癌组织中的表达,结果显示,与正常宫颈组织相比NAT10在宫颈癌组织中呈高表达(P<0.05)(Fig.1A)。根据TCGA数据库及Kaplan-Meier Plotter生存曲线分析(https://kmplot.com/analysis/)发现,NAT10高表达的宫颈癌病人的总生存率与NAT10低表达病人相比较低(P<0.05)(Fig.1B, C)。RT-qPCR的结果显示,NAT10在宫颈癌细胞HeLa中的表达相对于永生化人宫颈上皮细胞S12中的表达增加至(147.6% ± 12.4%)(Fig.1D)。为了探究NAT10在宫颈癌细胞中的生物学功能,本文通过Western免疫印迹及RT-qPCR验证NAT10过表达及敲低质粒的有效性,在HeLa细胞中转染NAT10过表达质粒(Flag-NAT10)使NAT10的表达水平升高约1.66倍,转染NAT10敲低质粒(shR-NAT10)使NAT10的表达水平下降至0.50倍(Fig.1E, F)。
为了研究NAT10对宫颈癌细胞生长与增殖的影响,本文通过MTT实验和集落形成实验检测NAT10对HeLa细胞的生长增殖能力的影响。MTT的结果显示,转染Flag-NAT10使HeLa细胞的生长活性增加至(164.0% ± 11.8%),敲低NAT10则使宫颈癌细胞的生长活性降低到(59.5% ± 6.5%)(Fig.1 G)。过表达NAT10增加了细胞的增殖能力约(161.0% ± 6.1%),敲低NAT10导致细胞增殖能力下降至(52.3% ± 10.0%)(Fig.1 H)。这些结果表明,NAT10在宫颈癌中高表达,并且促进宫颈癌细胞的生长活性和增殖能力。
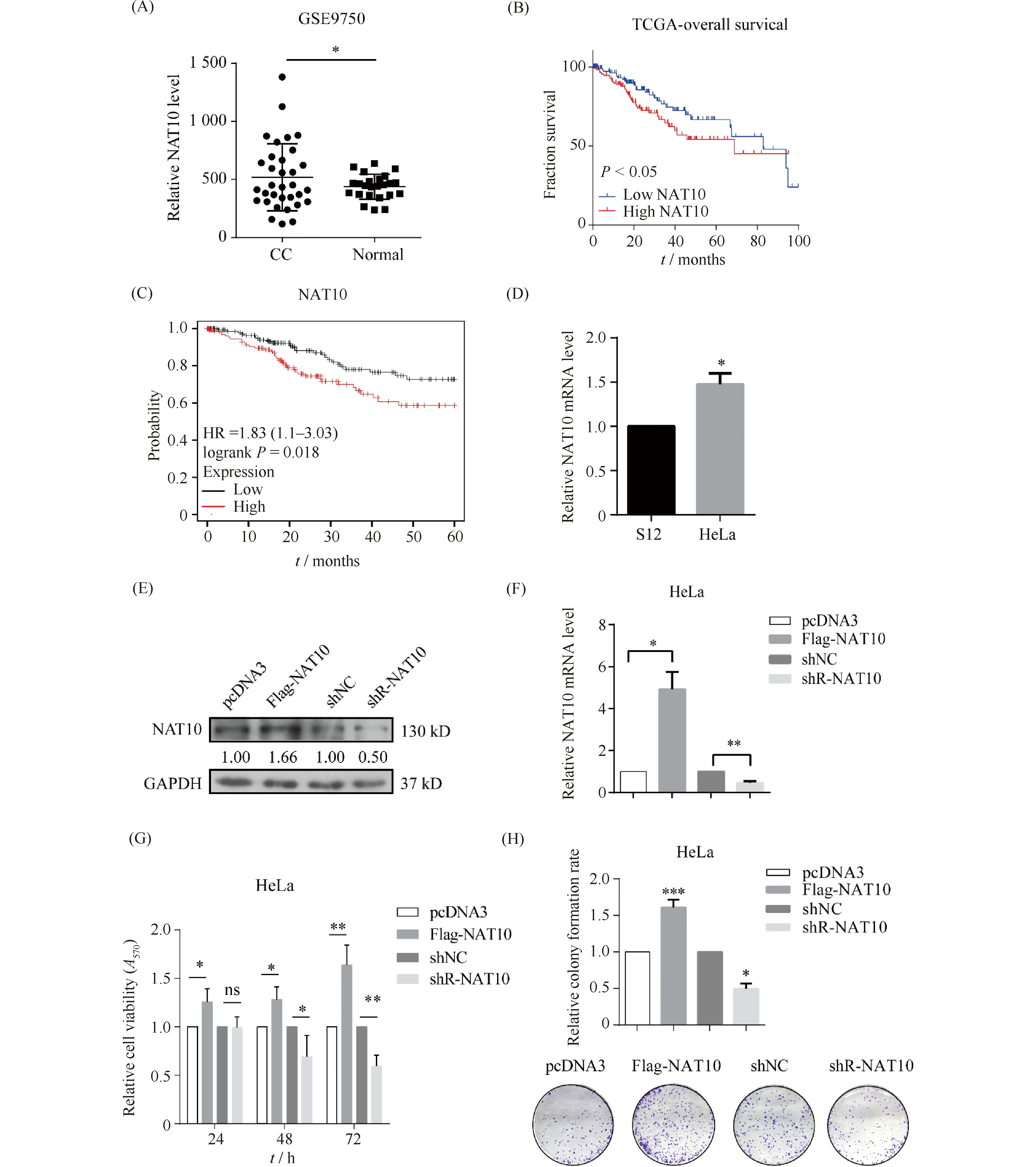
Fig.1 NAT10 enhances cervical cancer cell growth (A) The expression of NAT10 in cervical cancer and non-tumor cervical tissues from GSE9750 database containing 33 cervical cancer tissue samples and 24 normal cervical epithelial tissue samples. (B) TCGA database showed the overall survival of CC patients according to the level of NAT10. (C) Kaplan-Meier Plotter survival curve analysis showed the overall survival of CC patients. (D) RT-qPCR indicated the expression of NAT10 between HeLa cells with normal cervical cells S12. (E, F) Western blotting analysis and RT-qPCR indicated the level of NAT10 with NAT10 overexpression or knockdown in HeLa cells. (G) MTT assays showed the viability of HeLa cells after transfected with NAT10 overexpression or knockdown in HeLa cells. (H) Colony formation assays were used to detected the cell growth capacity of HeLa cells in the transfection of NAT10 overexpression or knockdown. Data were presented as means ± SD (n=3). ***P <0.001 vs. control. **P <0.01 vs. control. *P <0.05 vs. control. ns, no significance
2.2 乙酰转移酶10促进宫颈癌细胞的迁移和侵袭
为了探究NAT10对宫颈癌细胞迁移和侵袭能力的影响,Transwell迁移和侵袭实验结果显示,过表达NAT10使HeLa细胞的迁移能力增加约2.5倍,敲低NAT10,HeLa细胞的迁移能力降低至(48.3% ± 5.9%)(Fig.2A);过表达NAT10使细胞侵袭能力增加(165.7% ± 15.5%),侵袭能力降低(45.6% ± 13.8%)(Fig.2B)。越来越多的证据[14,15]表明,上皮-间充质转化(epithelial-mesenchymal transition, EMT)参与了多种肿瘤的癌变和转移。因此,本文通过Western免疫印迹检测了NAT10对上皮细胞标志物E-钙黏着蛋白和间皮细胞标志物波形蛋白表达水平的影响。结果显示,过表达NAT10使波形蛋白的表达水平升高约1.58倍;敲低NAT10,波形蛋白的表达下降至0.61倍(Fig.2C),过表达NAT10使E-钙黏着蛋白的表达水平降低至0.36倍;NAT10下调则使E-钙黏着蛋白的表达水平升高1.76倍(Fig.2D)。这些结果均表明,NAT10过表达可以增强宫颈癌细胞的迁移和侵袭能力及上皮-间充质转化进程。
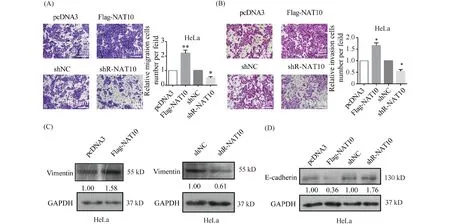
Fig.2 NAT10 promotes the migration, invasion and EMT of cervical cancer cells (A) The Transwell migration assay were performed to detected the migration ability of HeLa cells with overexpression or knockdown of NAT10. (B) The Transwell invasion assay was used to detect the invasion capacity of HeLa cells after overexpression or knockdown of NAT10. (C, D) Western blotting assay revealed the protein level of the molecular marker of EMT (C: Vimentin and D: E-cadherin) in HeLa cells with overexpression or knockdown of NAT10. Data were presented as means ± SD (n=3). **P <0.01 vs. control. *P <0.05 vs. control
2.3 乙酰转移酶10促进宫颈癌细胞中盘状蛋白结构域受体1的表达水平
为了探究NAT10调控宫颈癌细胞恶性行为的具体机制,本文借助Venny 2.1.0工具(http://bioinfogp.cnb.csic.es/tools/venny/index.html) 将TCGA数据库、GEO数据库(GSE7410)以及RNA-seq的结果[6]取交集,Venny图显示共有38个交集靶基因(Fig.3A)。随后,对这38个基因进行GO富集分析(Fig.3B),结果显示,与肿瘤细胞恶性行为相关的细胞功能主要有细胞外基质、细胞黏附及增殖调控,本文发现,DDR1涉及以上3种生物学功能,因此,选择DDR1作为接下来的研究对象。GEPIA2数据库(http://gepia.cancer-pku.cn/)[16]显示,DDR1在宫颈癌组织中的表达显著高于癌旁组织(Fig.3C)。接下来的RIP实验进一步显示过表达NAT10,富集的DDR1 mRNA的水平相比对照而言上升约4倍(Fig.3D)。Western免疫印迹结果显示,过表达NAT10后导致DDR1的蛋白质水平增加到约2倍,敲低NAT10则使DDR1的蛋白质水平降低至0.43倍(Fig.3E)。并且,RT-qPCR的结果显示敲低NAT10,使DDR1 的mRNA水平降低至(68.5% ± 4.9%);过表达NAT10则使DDR1的mRNA水平上升至(150% ± 9.8%)(Fig.3F)。这些结果表明,NAT10促进了HeLa细胞中DDR1的转录及翻译水平。
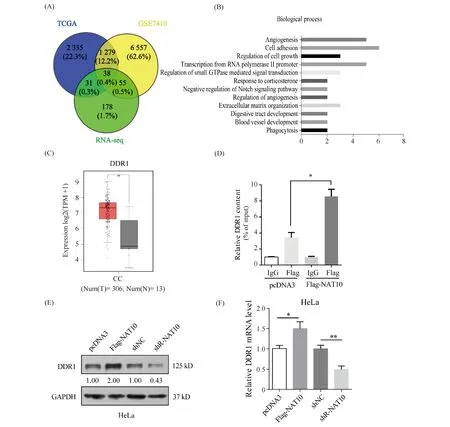
Fig.3 NAT10 upregulates DDR1 expression in HeLa cells (A) The Venny 2.1.0 was used to show a 3-set Venn diagram presented the intersection from the TCGA database, GSE7410 and RNA-seq. (B) Gene Ontology enrichment on the subset of 38 genes from (A). (C) GEPIA2 database showed the expression of DDR1 in cervical cancer and non-tumor cervical tissues. (D) RIP and RT-qPCR assays detected the level of DDR1 mRNA after HeLa cells transfected with or without NAT10 overexpression. (E) Western blotting revealed the protein expression of DDR1 in HeLa cells after transfection of NAT10 overexpression or knockdown. (F) RT-qPCR detected the mRNA level of DDR1 in HeLa cells with NAT10 overexpression or knockdown. Data were presented as means ± SD (n=3). *P <0.05 vs. control
2.4 乙酰转移酶10通过乙酰化修饰调控宫颈癌细胞中盘状蛋白结构域受体1的表达水平
为了明确NAT10对DDR1的这种调控作用是否依赖于其介导的乙酰化修饰,本文进行了RNA乙酰化免疫沉淀和RT-qPCR实验,结果发现,在过表达NAT10之后,乙酰化(ac4C)抗体富集的DDR1 mRNA的水平相比于对照组而言升高约4倍;NAT10敲低之后使DDR1 mRNA的乙酰化水平下降约9倍(Fig.4A)。本文在乙酰化预测网站PACES(http://www.rnanut.net/paces/)[17]预测了DDR1可能的乙酰化位点(Fig.4B)。结果显示,DDR1潜在的乙酰化位点位于CDS区,这与之前的研究结果[6]是一致的,同时利用EGFP报告系统构建该位点的野生型及突变型质粒(Fig.4B)。为了确定该潜在位点是否是NAT10修饰DDR1的真正乙酰化位点,本文在HeLa细胞中过表达NAT10,并与DDR1野生型位点及其突变位点质粒共转,EGFP报告系统荧光强度(Fig.4C)及Western免疫印迹(Fig.4D)结果显示,相比于空白组而言,过表达NAT10使DDR1-EGFP-ac4C-wt位点的EGFP表达增加了约1.6倍,对DDR1-EGFP-ac4C-mut的表达水平无明显影响。有文献报道,ac4C乙酰化修饰可以增加mRNA的稳定性并上调靶基因的表达[6],因此,本文检测了NAT10对DDR1 mRNA半衰期的影响。使用转录抑制剂放线菌素D处理HeLa细胞不同的时间,RNA半衰期结果表明,敲低NAT10降低了DDR1 mRNA的稳定性(P<0.05)(Fig.4E)。综上所述,NAT10可能通过对DDR1的乙酰化修饰延长其mRNA稳定性,从而促进DDR1在宫颈癌细胞中的表达。
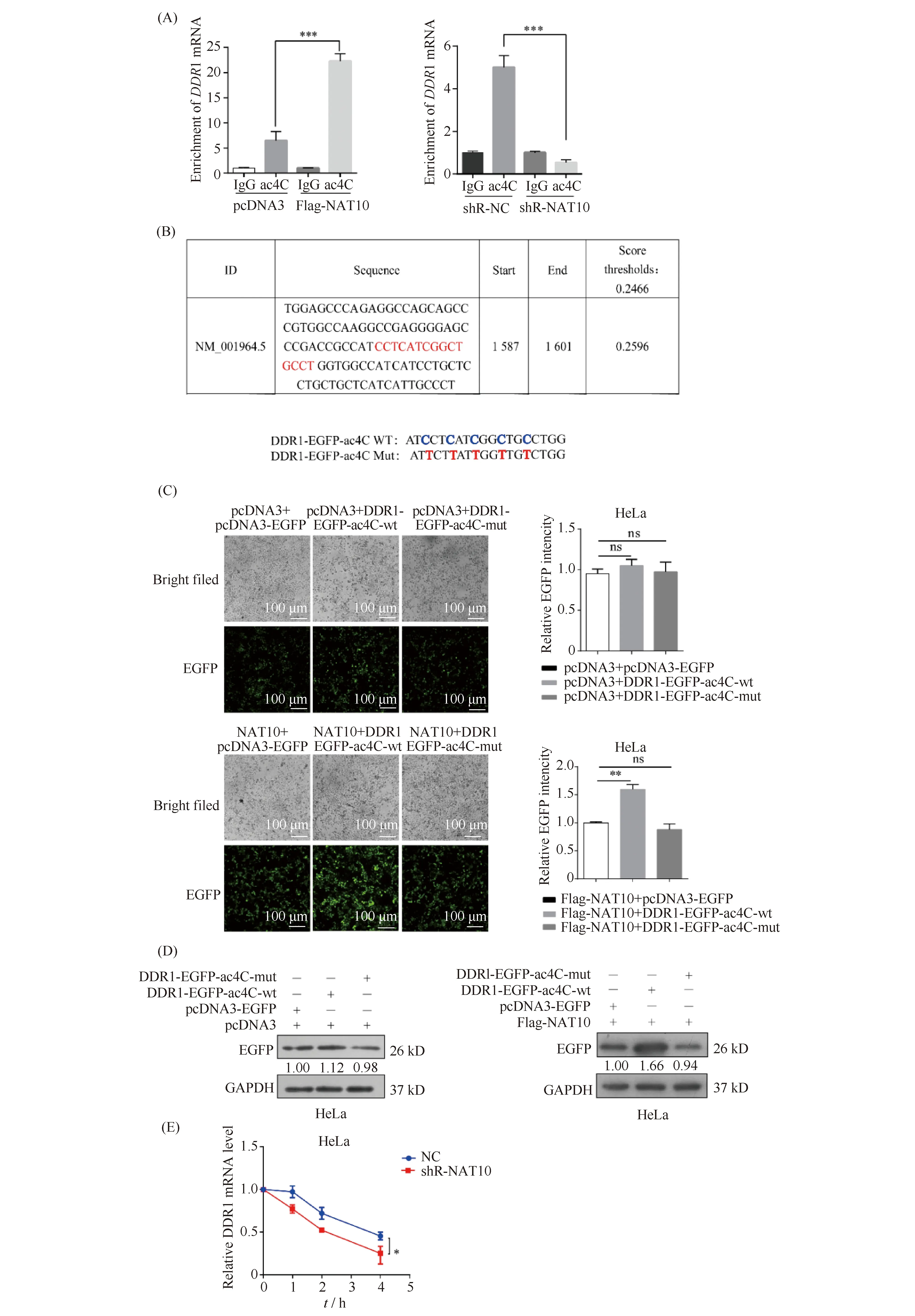
Fig.4 NAT10 promotes the expression of DDR1 in cervical cancer cells via acetylating its mRNA (A) After transfection of empty vectors or NAT10 overexpression or knockdown plasmids in HeLa cells, RNA immunoprecipitation and RT-qPCR experiments were used to detect the binding strength between the NAT10 protein and DDR1 mRNA. (B) The acetylation site prediction website PACES predicted the potential acetylation sites on DDR1 mRNA, and the map of wild-type and mutant plasmids of EGFP reporter systems at DDR1 potential acetylation site was showed. (C, D) HeLa cells were transfected with pcDNA3-EGFP, DDR1-EGFP-ac4C-wt, DDR1-EGFP-ac4C-mut and NAT10 with or without overexpression for 48 hours. The EGFP fluorescence intensity was detected by fluorescence microscope, and then prepared the protein sample to detected the protein level of EGFP in HeLa cells by Western blotting analysis. (E) RT-qPCR was used to measure the DDR1 mRNA stability of HeLa cells transfected with NAT10 knockdown after actinomycin D (5 μg/mL) treatment at the indicated periods (0, 1, 2, 4 hours). Data were presented as means ± SD (n=3). *P <0.05 vs. control. ns, no significance
2.5 盘状蛋白结构域受体1促进宫颈癌细胞的恶性行为及上皮间充质转化进程
大量研究[11, 18]表明,DDR1参与肿瘤细胞黏附、迁移与侵袭、增殖与凋亡等过程。本文通过构建DDR1过表达及敲低质粒,并通过Western免疫印迹和RT-qPCR检测DDR1的表达,结果显示,与对照组相比DDR1的表达增加了约2倍,敲低DDR1使DDR1的表达下降约0.5倍(Fig.5A)。MTT实验(Fig.5B)及集落形成实验(Fig.5C)结果表明,过表达DDR1使HeLa细胞的生长活性增加(149.5% ± 1.1%),增殖能力增加(148% ± 4.4%),敲低DDR1则导致宫颈癌细胞的生长活性和增殖能力分别降低(73.4% ± 3.9%)和(66% ± 3.8%)。为了评估DDR1在调节宫颈癌细胞迁移和侵袭中的作用,本文进行了Transwell实验。研究发现,过表达DDR1使宫颈癌细胞的迁移能力增加(173% ± 12%)(Fig.5D),使侵袭能力增加(166% ± 8.1%)(Fig.5E),敲低DDR1则导致宫颈癌细胞的迁移能力降低(43.6% ± 19%)(Fig.5D)以及侵袭能力降低(44.3% ± 6.5%)(Fig.5E)。同样,通过Western免疫印迹检测DDR1对EMT标志物E-钙黏着蛋白和波形蛋白表达水平的影响。结果显示,过表达DDR1使波形蛋白的表达水平增加了1.48倍(Fig.5F),使E-钙黏着蛋白的表达水平降低0.27倍(Fig.5G);敲低DDR1则导致波形蛋白的表达降低至0.42倍(Fig.5F),导致E-钙黏着蛋白的表达水平增加至1.64倍(Fig.5G)。这表明DDR1促进宫颈癌细胞的上皮间质转化进程,进而促进宫颈癌细胞的恶性行为。
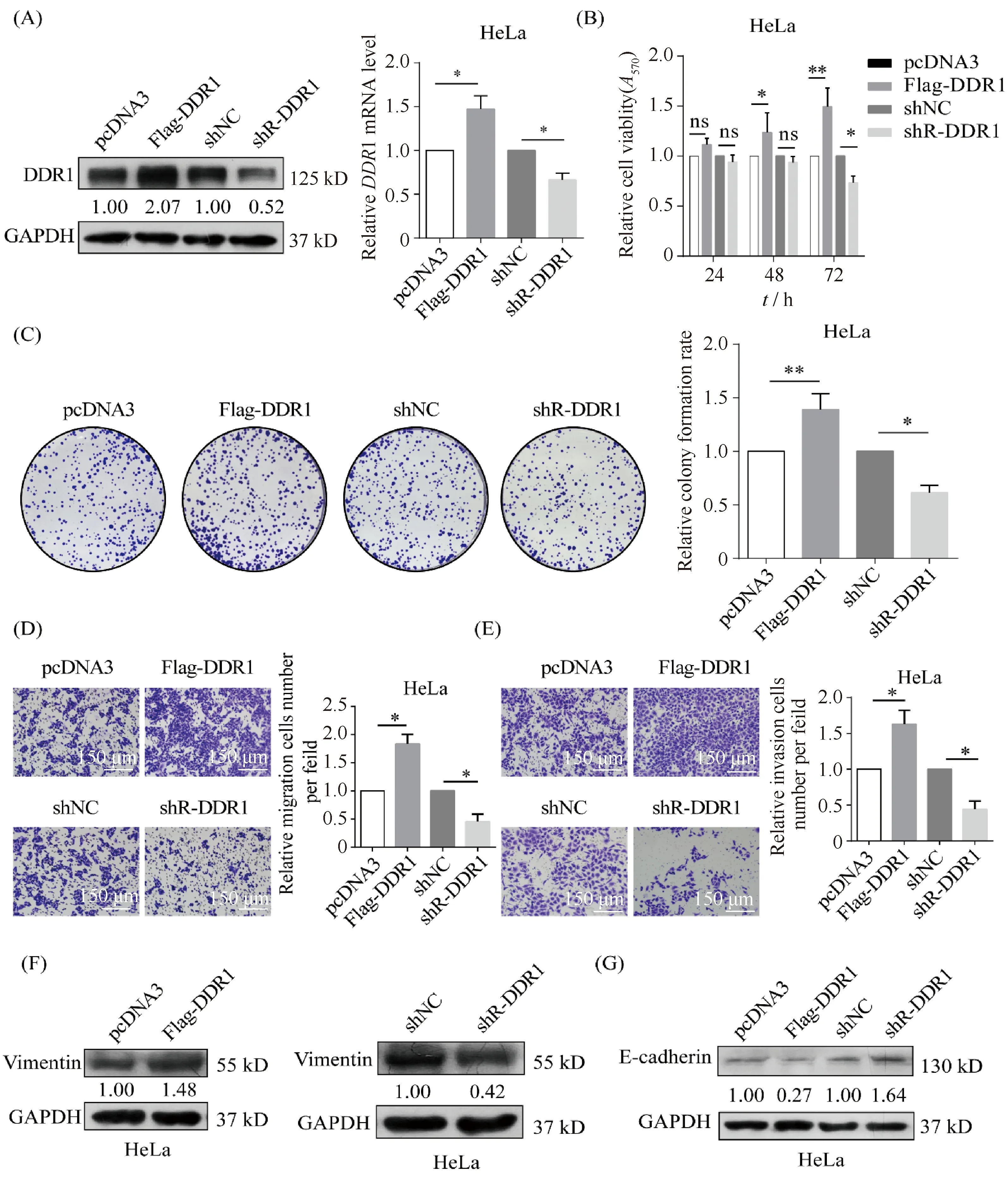
Fig.5 DDR1 promotes the malignant behavior and EMT process of cervical cancer cells (A) Western blotting assays and RT-qPCR assays showed the level of DDR1 in HeLa transfected with DDR1 overexpressed or knockdown. (B) MTT assays showed the cell viability of HeLa cells with DDR1 overexpression or knockdown. (C) Colony formation assay was used to detect the cells growth capacity of HeLa cells in the transfection of DDR1 overexpression or knockdown. (D, E) Transwell assay was used to perform the migration (D) and invasion (E) ability of HeLa cells after DDR1 overexpressed or knockdown. (F, G) Western blotting revealed the expression of molecular marker of EMT (F: Vimentin and G: E-cadherin). Data were showed as means ± SD (n=3). **P <0.01 vs. control. *P <0.05 vs. control. ns, no significance
3 讨论
宫颈癌是一种由多因素、多步骤导致的恶性疾病,涉及转录基因改变、遗传学和表观遗传学等多个复杂过程的相互作用。越来越多的证据表明,表观遗传修饰与宫颈癌的生物学发生密切相关[19],例如m6A甲基化修饰[20]、组蛋白修饰[21]和DNA甲基化[22]等。正如m6A甲基化修饰的调控[23],ac4C乙酰化修饰是在RNA乙酰基转移酶的作用下,胞嘧啶的N4位发生乙酰化的一种保守化学修饰。NAT10是一种赖氨酸乙酰转移酶,是Gcn5相关N-乙酰转移酶(Gcn5-related N-acetyltransferase, GNAT)家族中的一员[24]。近几年发现,NAT10是目前发现的一个mRNA乙酰化修饰“writer”,其介导的乙酰化修饰已被证实参与多种疾病的发生和发展。在本研究中,最先揭示了NAT10在宫颈癌组织中显著上调,并且NAT10高表达与宫颈癌病人的预后不良相关。本文的研究发现,NAT10对宫颈癌细胞HeLa细胞的迁移和侵袭能力具有促进作用。此外,本文的结果证明NAT10对宫颈癌细胞的迁移侵袭能力的影响可能与上皮-间充质转化有关。这些结果证实,NAT10在宫颈癌的发生发展过程中扮演着“促癌基因”的角色,影响宫颈癌癌细胞的多种生物学行为。
NAT10已被报道在多种疾病中发挥着重要作用。既往的研究表明,NAT10与 Hutchinson-Gilford早衰症[25,26]有关,抑制NAT10的表达水平可以恢复非经典核输入蛋白转运蛋白-1 (Transportin-1, TNPO1) 的核质比,从而改善早衰症病人的症状。NAT10通过介导P53[27]以及DNA损伤反应蛋白CW型锌指结构蛋白2(microrchidia family CW-type zinc finger 2, MORC2)[28]的组蛋白乙酰化修饰参与DNA损伤修复进程。最近,有文献报道NAT10可以催化mRNA发生乙酰化修饰,并参与多种恶性肿瘤的发生发展过程。例如,NAT10在胃癌中的表达水平显著上调,通过乙酰化修饰Ⅴ型胶原蛋白α1(collagen type Ⅴ alpha 1, COL5A1)导致其表达上调,显著促进了胃癌细胞的转移及EMT进程[8];ac4C乙酰化水平的上升也促进骨髓间充质干细胞的成骨分化,NAT10可能成为治疗骨质疏松的分子靶点[29]。这些研究表明,NAT10的异常表达在疾病中发挥着重要的作用。我们的研究证明,NAT10通过介导DDR1 mRNA的乙酰化修饰促进宫颈癌细胞的恶性行为。
盘状蛋白结构域受体被报道可以通过调节肿瘤细胞与其周围胶原基质的相互作用从而在癌症进展中发挥作用[30]。最近的研究表明,DDR1的表达水平在许多肿瘤细胞中升高,作为“传感器”在细胞的迁移和侵袭过程中发挥重要的作用[31]。此外,DDR1可以与胶原蛋白结合激活细胞内激酶,进而促进下游通路的激活,调控肿瘤的多种生物学功能。DDR1与信号转导和转录激活因子3(signal transducer and activator of transcription 3, STAT3)的正反馈激活促进肝癌的EMT进程及谷氨酰胺的代谢[32]。本文发现,DDR1在宫颈癌组织中显著上调,DDR1的过表达可以显著促进宫颈癌细胞的迁移和侵袭能力。NAT10可以通过对DDR1的位点进行乙酰化修饰促进其表达,从而可以促进宫颈癌细胞的恶性行为及EMT进程。
综上所述,我们的研究结果证明,NAT10可以对DDR1进行乙酰化修饰,并延长mRNA稳定性进而促进其表达,促进宫颈癌细胞的迁移和侵袭能力。但是,由于调控mRNA乙酰化修饰的其他蛋白质仍未知,可能存在其他的蛋白质参与该调控过程,这仍需要进一步研究进行探索。综上所述,我们的研究可能为由NAT10介导的乙酰化修饰在调控宫颈癌的生物学功能方面提供了新的分子机制。

