心房颤动射频消融术后心房食管瘘一例并文献复习
李宸 章海燕 张祖宏 申雪纯 龙明智
211166 南京医科大学研究生院(李宸、张祖宏、申雪纯);210011 南京医科大学第二附属医院心血管内科(章海燕、龙明智)
1 病例资料
患者男性,55岁,因“畏寒发热16 h”于2021年8月28日入院。患者入院前16 h无明显诱因出现畏寒发热,自测体温38.0℃,未予特殊处理,后复测体温升高至38.8℃,遂至我院急诊。测体温为39.0℃,胸部CT平扫示双肺炎症,心电图示快速型心房颤动(房颤),见图1A。予抗感染治疗,并收入心内科进一步诊治。患者既往持续性房颤病史8年,1个月前于外院行射频消融+左心耳封堵术。入院查体:体温38.5℃,脉搏99次/min,呼吸20次/min,血压117/73 mmHg。双肺呼吸音粗,可闻及少许湿性啰音。心率122次/min,心律绝对不齐,第一心音强弱不等。入院完善相关检查:白细胞计数25.46×109/L,降钙素原>100 ng/ml,凝血酶原时间31.7 s,国际标准化比值2.46,活化部分凝血活酶时间51.7 s,D-二聚体8.48 μg/ml。拟诊:肺炎、房颤、心脏射频消融术后(1个月),予抗感染、控制心室率、抗凝等治疗。入院当日18:00患者突发左侧肢体偏瘫,请神经内科急会诊。查体:左上肢近端肌力0级、远端3级,左下肢肌力1级,右侧肢体肌力5级。颅脑CT平扫示右侧顶枕交界区小灶出血,脑CTA未见明显异常。颅脑MR平扫示双侧小脑半球、额颞顶枕叶急性脑梗死,右侧顶叶小灶脑出血,脑MRA未见明显异常(图2)。遂转入神经内科进一步诊治,予抗凝、保护脑细胞、调脂稳定斑块等治疗。第2天00:50患者突发胸痛,神志模糊,心率最低降至24次/min,血压测不出;心电图:房颤,异常Q波,下壁、前间壁及前壁导联ST段抬高(图1B);心肌酶谱:肌钙蛋白I 2.3 ng/ml,肌红蛋白58.78 ng/ml,肌酸激酶同工酶49.2 ng/ml。心内科急会诊,予升压、强心、提升心率等抢救措施后,患者生命体征趋于平稳,神志清楚,复查心电图示上述导联ST段抬高幅度较前降低(图1C)。03:30患者行急诊冠状动脉造影术,但未见冠状动脉明显狭窄(图3),术后转入我院ICU进一步治疗。复查白细胞计数33.07×109/L,心电图示上述导联出现T波倒置、低平(图1D),床旁超声心动图示左室壁节段性运动异常,射血分数41%,继续予以升压、抗感染、抗凝、营养心肌、保护脑细胞等治疗。第3天多学科会诊,再次判读患者胸部CT,发现左心房气体影及食管心房之间瘘道形成(图4),结合患者射频消融手术史,考虑存在心房食管瘘可能。14:10患者心率突然降至0次/min,血压、脉氧测不出,予胸外按压,呼吸机辅助通气,肾上腺素静推等抢救措施均效果不佳,行体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)支持治疗和临时起搏器置入。20:45患者最终因抢救无效死亡。第7天患者血培养结果为韦荣球菌。
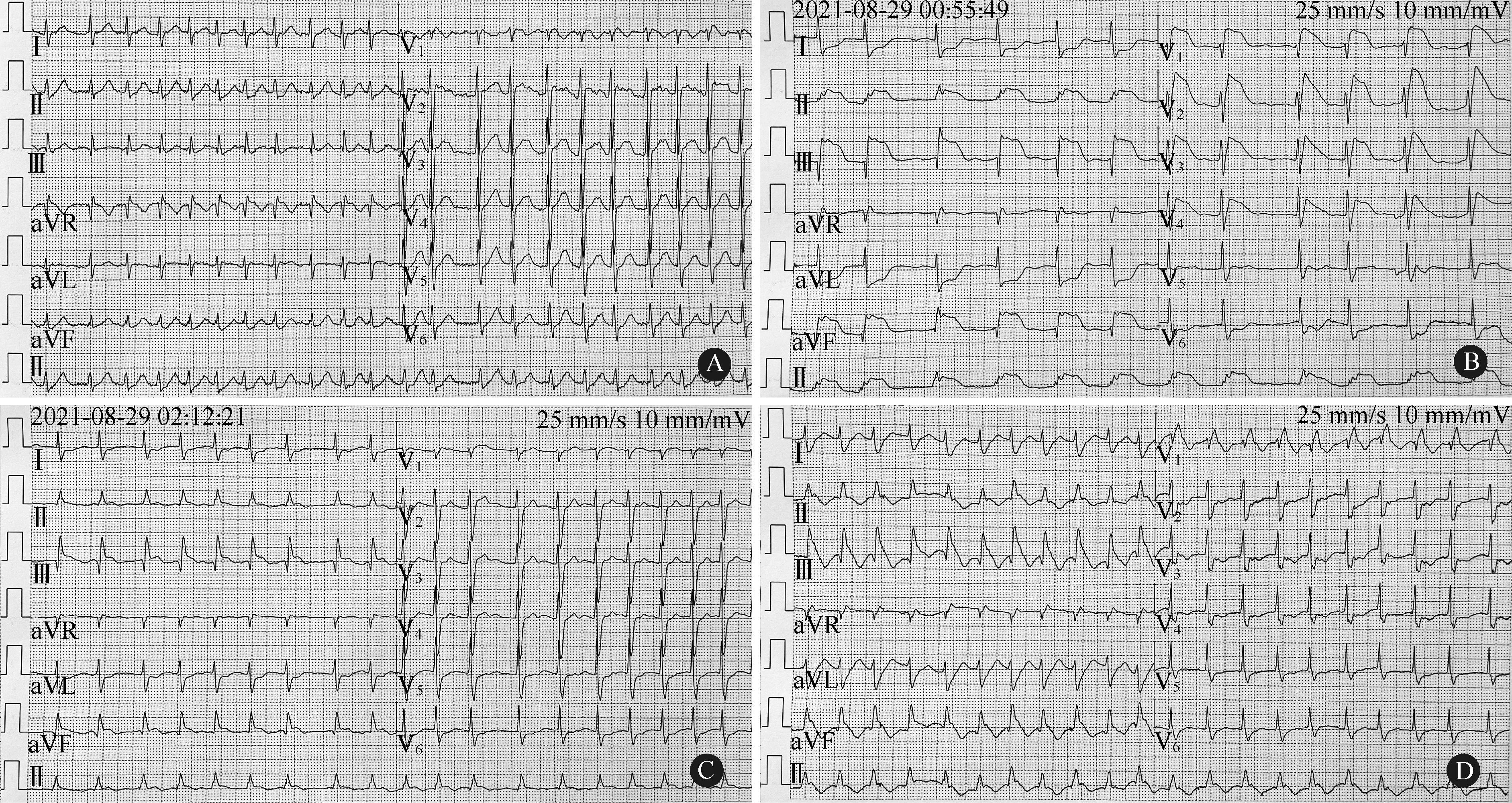
A:入院当日心电图示快速型房颤;B:突发心肌梗死时,心电图示房颤,异常Q波,下壁、前间壁及前壁导联ST段抬高;C:冠状动脉造影前,心电图示上述导联ST段抬高幅度较前降低;D:转入ICU后,心电图示上述导联出现T波倒置、低平
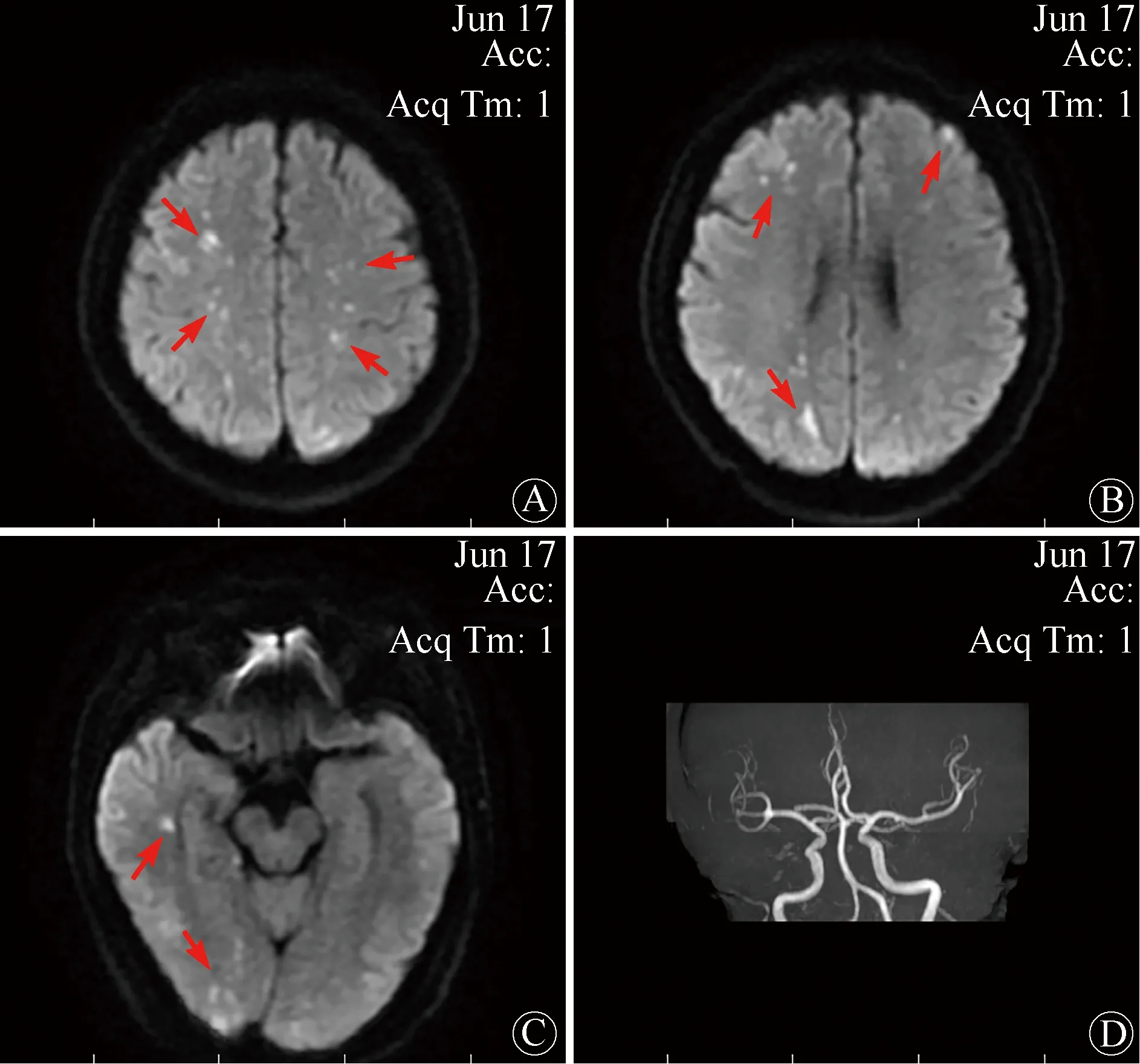
A、B、C:颅脑MR(DWI像)示多发急性脑梗死(箭头所示);D:颅脑MRA未见明显异常
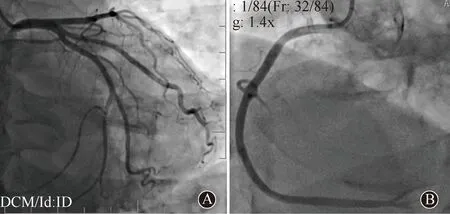
左主干、前降支、回旋支和右冠状动脉均未见明显狭窄
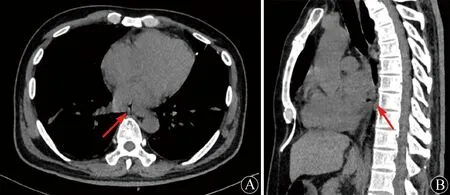
A:纵隔窗水平面可见左心房气体影(箭头所示);B:纵隔窗矢状面可见食管心房间病理性瘘道形成(箭头所示)
2 讨论
心房食管瘘(atrioesophageal fistula,AEF)是一种房颤消融术后极为罕见却足以致命的并发症,据相关文献报道,其发生率仅为0.1%~0.25%[1],但死亡率却高达80%[2-3]。一项来自中国的多中心研究显示,接受手术治疗的患者存活率为50%,而未接受手术治疗的患者无一存活[4]。AEF通常发生在术后1~6周[1],且临床表现多无特异性,患者可出现发热、胸痛、卒中、呕血、咳嗽、腹痛、吞咽困难和呼吸困难等多种症状[3, 5]。
食管和左心房的解剖位置邻近,且食管和左心房之间的脂肪层较薄,因此消融手术时产生的冷/热损伤极易破坏食管壁、食管周围微血管以及迷走神经,从而造成食管黏膜层缺血、溃疡,食管下括约肌压力降低引起胃食管反流,最终导致AEF的发生[1, 6-7]。Sarairah等[8]通过多元logistic回归分析发现,心房食管腔的距离和肥胖是导致食管热损伤的独立影响因素,这与AEF的发病机制相吻合。
实验室检查提示,AEF与感染性疾病的表现相似,通常表现为白细胞计数、C反应蛋白和降钙素原的升高以及血培养结果阳性[9]。影像学检查如胸部CT平扫可显示食管和左心房之间形成病理性瘘道,可见气体影分布于左心房;若胸部增强CT显示造影剂从左心房进入食道,则可进一步明确诊断[3, 9];颅脑MR成像多表现为散在多发的梗死灶,头颅CT则可见弥漫性气体影[10]。然而,CT的应用只能确诊65%的患者,对于25%的AEF早期患者并无异常发现,因此早期诊断仍有一定难度。
本例患者诊断为AEF,依据如下:(1)患者起病于射频消融术后1个月,符合AEF发病时间窗;(2)患者多项感染指标明显升高,血培养结果为韦荣球菌。该菌种多分布于口咽部、消化道及呼吸道,血培养中发现上述菌种,考虑与患者心房食管相通有关[11];(3)患者胸部CT示食管与左心房之间瘘道形成,且左心房内可见气体影,与AEF胸部CT表现相符;(4)患者脑梗死和心肌梗死诊断明确,但脑血管和冠状动脉均无明显狭窄,考虑可能为左心房内气体进入脑动脉和冠状动脉引起的一过性气体栓塞,进一步支持AEF诊断。
目前,AEF首选手术治疗,主要包括外科手术修补和食管覆膜支架置入。在既往治愈的案例中,大多数患者均接受了外科手术修补或食管支架置入,并辅以足量长程的抗生素治疗、良好的气道管理和营养支持[12]。Eitel等[13]认为,心包引流联合食管支架置入是切实有效的微创治疗方案。然而也有学者认为,食管镜检查可能导致发生空气栓塞的概率增加[14]。对于血流动力学不稳定的患者,ECMO治疗能够为心肺功能的恢复提供时间,但血流感染则是ECMO的相对禁忌证[10]。
本病例中,由于AEF极为罕见且临床表现缺乏特异性,相关科室医生普遍对其认识不足,因此未能及时准确判读患者胸部CT,并结合其消融手术病史在第一时间内明确诊断。并且,患者病情进展迅速,诊断明确后出现多脏器衰竭,生命体征不能维持,无法进一步耐受手术治疗。在呼吸机及各种血管活性药物使用效果不佳的情况下,予以ECMO支持治疗,但最终未能挽救患者的生命。这提示我们,各专科的医生应了解AEF,高度警惕消融术后患者发生AEF的可能,尽早明确诊断,为患者争取充足的时间以获得手术治疗的机会。
鉴于AEF的治愈率极低,因而对于此类并发症的预防至关重要。近年来,研究者在相关领域取得了一系列新的进展:(1)在术式和器械选择方面,Piccini等[15]研究发现,冷冻球囊消融术后发生AEF的风险约为0.004%,明显低于射频消融术。朱志勇等[16]研究发现,对于高龄阵发性房颤患者,冷冻球囊消融能够更加安全、有效地完成肺静脉隔离。(2)在术中辅助技术应用方面,采用可溶性造影剂显影的食管可视化技术被认为能够降低射频消融时产生的食管损伤[17],食管冷却技术也被证实可降低射频消融时食管热损伤发生的概率[18]。Grosse Meininghaus等[19]研究发现,射频消融温度超过42℃会导致食管热损伤的发生率增加,但食管温度监控技术并不能有效预防食管热损伤的发生,这可能与感知距离不固定和感知灵敏度偏低有关。(3)在术后监控与管理方面,术后质子泵抑制剂的使用能够减少胃食管反流,促进术后食管黏膜溃疡的愈合,有效预防AEF的发生[20]。另有研究表明,房颤消融术后24 h内行钆延迟增强MR成像可用于评估食管热损伤的严重程度,便于临床医生早期及时干预[21]。
综上所述,AEF是导管消融术后罕见但致命的并发症,其临床表现缺乏特异性,辅助检查诊断效能偏低,因此早期明确诊断仍有一定难度。作为临床医生,需重点关注近期导管消融术后患者是否可能出现AEF或食管损伤。手术治疗作为首选,应尽可能在患者病情恶化之前开展实施,同时做好围术期管理工作,这将有助于降低AEF患者的死亡率。
利益冲突:无

