金铁锁基于NF-κB信号通路的体外抗炎作用机制研究*
陈海丰,邓 祎,周兴悦,黄之镨△
(1.云南中医药大学,云南 昆明 650500;2.云南中医药大学附属曲靖医院,云南 曲靖 655099)
炎症是一种复杂的反应,发生在局部或全身动物器官内部,对多种内源性或外源性损伤作出反应,主要导致发红,肿胀,发热,器官疼痛和组织损伤。病原体进入血管外空间以及从破坏的组织完整性和坏死中释放细胞碎片的局部生理反应[1]。
石竹科(Caryophyllaceae)植物金铁锁(Psammosilene tunicoides W.C.Wu et C.Y.Wu),首载于《滇南本草》,“味辛,辣,性大温,有小毒,吃之令人多吐。专治面寒疼,胃气心气疼,攻疮痈排脓”。2020版《药典》中记载:“祛风除湿,散瘀止痛,解毒消肿。用于风湿痹痛,胃脘冷痛,跌打损伤,外伤出血;外治疮疖,蛇虫咬伤。”现代药理研究显示,金铁锁总皂苷能抑制佐剂性关节炎大鼠踝关节的急性炎症反应,能够明显抑制大鼠足肿胀,对佐剂性关节炎大鼠后续病变的趋势恶化有一定的抑制作用;高剂量组对大鼠醋酸扭体法实验显示出一定的镇痛作用;金铁锁总皂苷的抗炎机制:与抑制组织液中促炎细胞因子IL-1β,TNF-α的产生有关,并且存在着一定的剂量依赖性,同时能降低组织液中丙二醇的含量并双向调节大鼠血中皮质醇的水平[2-5]。
1 实验材料与仪器
1.1 实验细胞 小鼠单核-巨噬细胞RAW264.7,购于中国科学院典型培养物保藏委员会昆明细胞库,昆明细胞库(KCB)编号:KCB200603YJ。
1.2 实验药物 实验所用金铁锁购于云南绿生中草药开发有限公司,经云南中医药大学杨竹雅教授鉴定为金铁锁(Psammosilene tunicoides W.C.Wu et C.Y.Wu)的干燥根。以金铁锁干燥根粉末为原料,提取金铁锁乙醇提取物和总皂苷提取物。丝石竹皂苷元(GYP)、皂皮酸(QA)由实验室分离得到。
1.3 实验试剂 脂多糖(美国sigma公司)、DMEM培养液(美国 GIBCO公司)、胎牛血清(FBS)(美国GIBCO公司)、青链霉素双抗(美国GIBCO公司)MTS(普洛麦格(北京)北京生物技术有限公司)、一氧化氮(NO)酶联免疫试剂盒(美国R&D公司)、前列腺素-2(PGE2)酶联免疫试剂盒(美国R&D公司)、Trizol(美国Invitrogen公司)、第一链cDNA合成试剂盒(中国全式金生物科技有限公司)、TransStart Top Green qPCR SuperMix(中国全式金生物科技有限公司)、RIPA裂解液(强)(中国美仑生物公司)、PMSF(中国美仑生物公司)、BCA试剂盒(碧云天生物技术研究所)、胞浆蛋白与核蛋白分离试剂盒(美国Thermo公司)、30%丙烯酰胺(中国美仑生物公司)、1.5 mol/L Tris-HCL(pH8.8)(北京 Solarbio公司)、1 mol/L Tris-HCL(pH6.8)(北京 Solarbio公司)、10%SDS(北京Solarbio公司)、三羟甲基氨基甲烷(Tris)(中国美仑生物公司)、甘氨酸(中国美仑生物公司)、吐温-20(中国美仑生物公司)、十二烷基硫酸钠(SDS)(中国美仑生物公司)、过硫酸铵(AP)(湖北佰智昂生物化工有限公司)、化学发光液(ECL)(美国Proteintech公司)、TEMED(美国 Thermo公司)、NF-κBp65抗体、p-NF-κBp65抗体、IKK-β 抗体、p-IκBα 抗体 (美国Cell Signaling公司)、beta-actin抗体、Histone H3抗体(美国Proteintech公司)。
2 实验方法
2.1 细胞复苏与传代 提前开启水浴锅预热(37℃),在空的离心管中提前加入3 mL培养基备用。从液氮罐中取出RAW264.7细胞在水浴锅中轻轻震荡,使其在1 min中内迅速融化。吸出冻存管中的细胞加入离心管中,以800 r/min,离心5 min,弃旧培养基,将细胞重悬在5 mL完全培养基中,接种至25 cm2培养瓶中,37℃,5% CO2条件下培养。将复苏后长至80%以上处于对数生长期的RAW264.7细胞培养瓶取出放置于超净工作台,弃旧培养基,用PBS轻轻清洗细胞2次,每次2 mL,再向瓶内加入4 mL新鲜培养基使用细胞刮刀刮下细胞。收集细胞于离心管中以800 r/min,离心5 min,重悬细胞,以1∶3或1∶4的比例进行传代,培养于37℃,5% CO2条件下。
2.2 细胞冻存 将长至80%处于对数生长期的RAW264.7细胞按2.1中传代方法收集细胞,800 r/min,离心5 min后,弃旧培养基,加入一定量冻存液使每管中含有1×107/1.5 mL,转移至冻存管中,放入-80℃的程序降温盒内,24 h后取出放入液氮罐中储存。
2.3 绘制RAW264.7细胞生长曲线 取复苏后培养至第三代生长状态良好的细胞,采用细胞刮刀刮取细胞的传代方法收集细胞,制成细胞悬液。以1×105个/mL的密度将细胞接种于96孔板中,每孔100 μL,37℃,5% CO2分别培养 9 板,每孔加入 20 μL MTS,培养中孵育1 h,于490 nm波长处测定OD值,每天1次,连续9 d。以培养时间为横坐标,吸光度为纵坐标,绘制细胞生长曲线[6]。
2.4 金铁锁总皂苷及三萜类化合物对RAW264.7细胞存活率的影响 将生长良好的RAW264.7细胞使用刮刀传代,收集细胞后将细胞悬液浓度调整为1×105个/mL,接种至 96 孔板,每孔 90 μL,设置调零孔,正常组,总皂苷(TSPT)组给药浓度为40,20,10,5,2.5 μg/mL,皂皮酸(QA)组给药浓度为 32,16,8,2,0.5 μg/mL,丝石竹皂苷元(GYP)组给药浓度为32,16,8,2,0.5 μg/mL,每孔加入 10 μL,最终体积为每孔100 μL,每组设置6个复孔。24 h后,在每个孔中加入20 μL MTS,放入培养箱中孵育1 h,于酶标仪490 nm处测量各孔的吸光度A。
2.5 金铁锁总皂苷及三萜类化合物对LPS刺激后的RAW264.7细胞存活率的影响 将生长良好处于对数生长期的RAW264.7细胞收集后,重悬细胞计数调整细胞浓度为1×105个/mL接种于96孔板中,每孔90 μL,设置调零孔,正常组,模型组(以LPS刺激致炎,1 μg/mL),总皂苷(TSPT)组(10,5,2.5 μg/mL),皂皮酸(QA)组(8,2,0.5 μg/mL),丝石竹皂苷元(GYP)组(8,2,0.5 μg/mL),每组设置 6 个复孔,放置于37℃、含有5% CO2的细胞培养箱中继续培养24 h,次日弃旧培养基,给药组分别加入90 μL配置好的各组药物,空白组和模型组加入相同体积的新鲜培养基,于培养箱中孵育4 h后,空白组加入10 μL培养基,其余每孔加入 LPS 溶液 10 μL(1 μg/mL),继续培养24 h。在各孔中加入20 μL MTS,继续培养4 h,于酶标仪490 nm处测量各孔的吸光度A。
2.6 金铁锁总皂苷及三萜类化合物对一氧化氮(NO)和 PGE2水平的影响 将对数生长期的RAW264.7细胞刮下收集后,重悬计数以7×105个/mL的密度接种于6孔板中,每孔2 mL,设置正常组,模型组,总皂苷(TSPT)组(10,5,2.5 μg/mL),皂皮酸(QA)组(8,2,0.5 μg/mL),丝石竹皂苷元(GYP)组 (8,2,0.5 μg/mL),每组设置 3 个复孔,根据RAW264.7细胞的生长曲线,放置于37℃、含有5% CO2的细胞培养箱中继续培养24 h,次日弃旧培养基,给药组分别加入1 mL配置好的各组药物,正常组和模型组加入相同体积的新鲜培养基,于培养箱中孵育4 h后,正常组加入1 mL培养基,其余各孔加入LPS溶液1 mL,继续培养24 h。24 h后收集上清液用ELISA试剂盒测定NO和PGE2的水平。在各孔内加入1 mL冷PBS用细胞刮刀收集细胞至EP管中,离心后弃上清液,各管中加入1 mL Trizol试剂,混匀,放置于-80℃备用。
2.7 金铁锁总皂苷及三萜类化合物对LPS诱导的RAW264.7 细胞活化后 COX-2,iNOS,IL-6,TNF-α mRNA表达的影响
2.7.1 RNA的提取与检测 (1)取2.6项下收集的细胞,每孔加入1 mL Trizol试剂,再加入0.2 mL氯仿,剧烈震荡15 s,室温放置3 min。(2)将样品置于4℃,1 000 r/min,离心15 min,样品分为3层:底层为黄色有机相,上层为无色水相和1个中间层。RNA主要在水相中,水相体积为所用Trizol试剂的60%。(3)把水相转移到新的EP管中,用异丙醇沉淀水相中RNA。每使用1mL Trizol加入0.5 mL异丙醇,室温放置10 min。(4)样品置于4℃,1 000 r/min,离心 10 min,弃上清液。(5)每支样品加入1 mL 75%乙醇洗涤RNA沉淀,4℃,7 500 r/min,离心 5 min,弃上清液。(6)室温放置干燥,晾5~10 min,加入20~25 μL无RNasefree Water或0.5%SDS,用枪头吸打几次,55~60℃放置 10 min。(7)最后使用 120 μL RNase-free Water洗脱RNA,取1 μL RNA进行1.5%TAE琼脂糖凝胶电泳,使用紫外分光光度计检测提取的RNA的浓度和纯度。
2.7.2 反转录 (1)使用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒将1 μg总RNA反转录成cDNA。(2)轻轻混匀后离心3~5 s。(3)在PCR仪上按照下列条件进行反转录反应:①cDNA合成50℃,15 min;②终止反应85℃,5 s,处理后,放置于冰上。(4)上述样品储存于-20℃。
2.7.3 引物序列 内参(GAPDH)引物序列:
GAPDH-F 5’CTTCAACAGCAACTCCCATTC3’
GAPDH-R 5’GTAGCCATATTCATTGTCATACCAG3’
目的引物序列:
IL-6-F 5’CCCCAATTTCCAATGCTCTCCT3’
IL-6-R 5’ACGCACTAGGTTTGCCGAGTA3’
TNF-α-F 5’AGGCACTCCCCCAAAAGATG3’
TNF-α-R 5’TTTGCTACGACGTGGGCTAC3’
iNOS-F 5’GTACAAGGCTCCCTCCGATG3’
iNOS-R 5’CTCCAATCTCTGCCTATCC3’
COX-2-F 5’AGAAGGAAATGGCTGCAGAA3’
COX-2-R 5’GCTCGGCTTCCAGTATTGAG3’
2.7.4 实时荧光定量PCR检测 将每个基因在每个样品中设置三次重复试验,按下列qPCR反应体系进行检测:
(1)反应体系:
Forward Primer(10 μM)0.4 μL
Reverse Primer(10 μM)0.4 μL
2×TransStart Top Green qPCR SuperMix 10 μL
Template(cDNA) 0.4 μL
ddH2O to final volume 20 μL
(2)PCR 循环条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃30 s,进行45个循环。
最后统计5个基因(含内参)在待测样品中的Ct值,根据Ct值计算4个目的基因的相对表达量。
2.8 金铁锁总皂苷及三萜类化合物对LPS诱导RAW264.7细胞活化后NF-κB信号通路相关蛋白的影响
2.8.1 蛋白质的提取 (1)总蛋白的提取:吸去上清液,各孔加入用PBS洗1次,每孔加入100 μL细胞裂解液,冰上裂解1 min后,用细胞刮刀刮下,将细胞裂解液收集于1.5 mL EP管中,放置于冰上继续裂解30 min,4 ℃离心(12 000 r/min,5 min),取上清液,用BCA蛋白定量试剂盒测定蛋白浓度,根据各组所测的蛋白浓度用裂解液调整为同一浓度,100℃,10 min进行蛋白变性,分装后放-20℃保存,备用。(2)核蛋白、胞浆蛋白的提取:按上述方法造模给药后,将板放置于冰上每孔1 mL加入冷的PBS,轻轻刮取细胞收集于1.5 mL EP管内,500 r/min,离心3 min,使用移液器小心吸出PBS,使用Thermo ScientificTMNEPERTM试剂盒进行提取,核蛋白和胞浆蛋白用BCA试剂盒进行蛋白定量100℃,10 min进行蛋白变性,分装后放-20℃保存,备用。(3)蛋白浓度测定:按BCA试剂盒测定。绘制标准曲线,根据标准曲线及样品的体积最终计算蛋白浓度。
2.8.2 电泳、转膜 (1)电泳:浓缩胶恒压80 V约30 min,待Marker清晰分开,样品进入分离胶后,切换电压至120 V电泳50 min,待溴酚蓝跑至离板底0.5 cm左右时,停止电泳。(2)湿转法转膜:根据Marker的预染条带,用切胶刀分离所需分子量的蛋白分离胶,按照滤纸、PVDF膜、胶、滤纸的顺序依次摆放,置于转膜装置中,每层之间要确保排出所有气泡,IKKβ、NF-κBp65、p-p65、p-IκBα、β-actin 恒流 300 mA转膜1 h,Histone-3恒流300mA转膜42 min。
2.8.3 封闭、显色及成像 (1)转膜结束后,1×TBST洗膜3次,每次10 min。(2)将膜完全浸没在5%BSA封闭液中,放置于摇床上室温封闭1 h。(3)取出膜后浸没于一抗工作液中孵育,一抗工作液:用5%BSA,1×TBST稀释一抗,放置于摇床室温孵育2 h或4℃孵育过夜。(4)TBST洗膜3次,每次 10 min。(5)孵育二抗,用 5%BSA,1×TBST 稀释二抗(1∶3 000),置于摇床室温孵育 1 h。(6)TBST 洗膜 3 次,每次 10 min。(7)将膜用多功能凝胶成像系统,加入ECL化学发光液(A液∶B液=1∶1),利用Image J进行图像处理。
3 数据处理
4 实验结果与讨论
4.1 RAW264.7生长曲线的考察 经观察RAW264.7细胞9 d的生长规律,发现接种后24 h,细胞将进入一个对数生长期,从接种后的第5天开始细胞生长保持在一个平稳的状态。根据此结果确定RAW264.7细胞在接种后24 h进入对数生长期,即该时间段为干预细胞的最佳时期,可以合理的反应干预因素对细胞生长的影响。见图1。
4.2 金铁锁总皂苷及三萜类化合物对RAW264.7细胞存活率的影响 采用MTS测定法检测细胞给药后的细胞活力。结果显示,皂皮酸(QA)及丝石竹皂苷元(GYP) 给药量为 0.5,2,8 μg/mL,细胞存活率均为90%以上,而 GPY16(64.1%),GPY32(56.2%),QA16(68.2%),QA32(52.8%)随着给药量的增加存活率逐渐降低,总皂苷(TSPT)给剂量组对细胞存活率无明显影响。因此,选择皂皮酸(QA)给药量为 0.5,2,8 μg/mL,丝石竹皂苷元(GYP)给药剂量为 0.5,2,8 μg/mL,总皂苷(TSPT)给药剂量为 2.5,5,10 μg/mL 作为后续实验给药剂量。见图2。
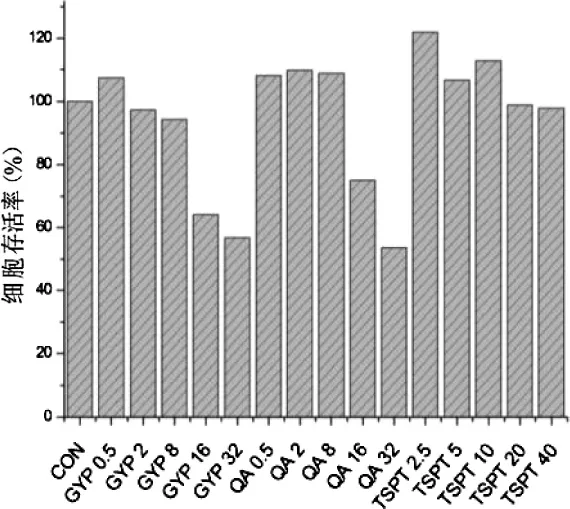
图2 金铁锁总皂苷及三萜类化合物对细胞存活率的影响
4.3 金铁锁总皂苷及三萜类化合物对LPS刺激后的RAW264.7细胞存活率的影响 实验结果表明,LPS不诱导细胞的凋亡,分别给予TSPT(10,5,2.5 μg/mL),QA(8,2,0.5 μg/mL)及 GYP(8,2,0.5 μg/mL)作用24 h后,细胞存活率均在85%以上,没有细胞毒作用,可作为后续实验浓度。见图3。
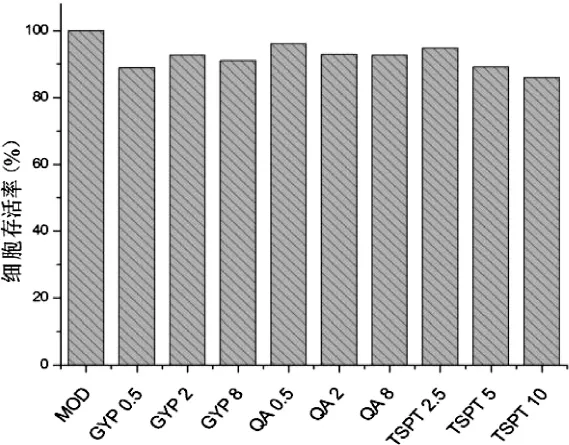
图3 金铁锁总皂苷及三萜类化合物对LPS刺激后的RAW264.7细胞存活率的影响
4.4 金铁锁总皂苷及三萜类化合物对一氧化氮(NO)和PGE2水平的影响 结果显示,LPS刺激后,RAW264.7巨噬细胞活化,与正常组(6.74±0.70),(54.18±14.13)相比模型组细胞上清液中NO(38.81±2.66),PGE2(1376.30 ±40.96) 水平明显上升(P<0.01)。给予皂皮酸(QA)及丝石竹皂苷元(GYP)组与模型组相比均可降低NO、PGE2的水平,差异有统计学意义(P<0.01),但成分之间存在一定的差异,与模型组相比,金铁锁总皂苷各剂量组及GYP 8 μg/mL对NO、PGE2水平无明显降低。见图4。
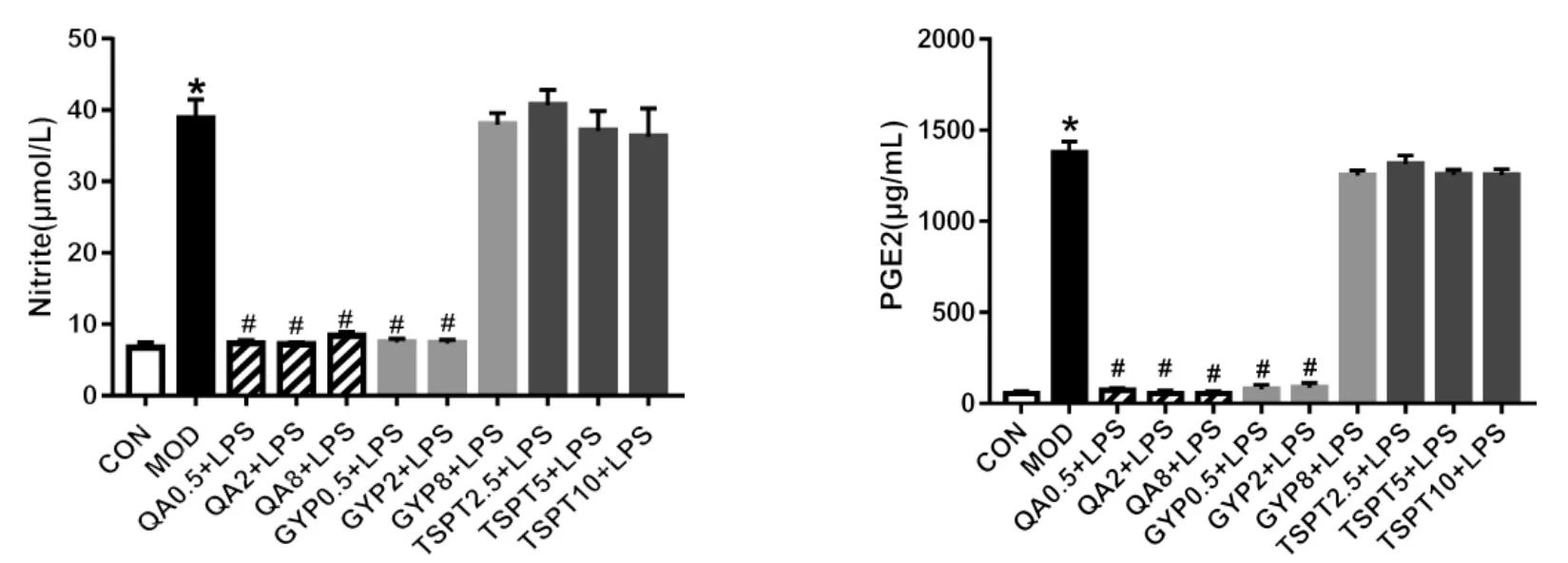
图4 金铁锁总皂苷及三萜类化合物对LPS诱导的RAW264.7细胞活化后NO、PGE2的影响
4.5 金铁锁总皂苷及三萜类化合物对LPS诱导的RAW264.7 细胞活化后 COX-2、iNOS、IL-6、TNF-α mRNA的影响 (1)iNOS扩增曲线及溶解曲线(红色箭头代表NTC)。见图5A。(2)COX-2扩增曲线及溶解曲线(红色箭头代表NTC)。见图5B。(3)IL-6扩增曲线及溶解曲线(红色箭头代表NTC)。见图5C。(4)TNF-α扩增曲线及溶解曲线(红色箭头代表NTC)。见图 5D。(5)GAPDH 扩增曲线及溶解曲线(红色箭头代表NTC)。见图5E。
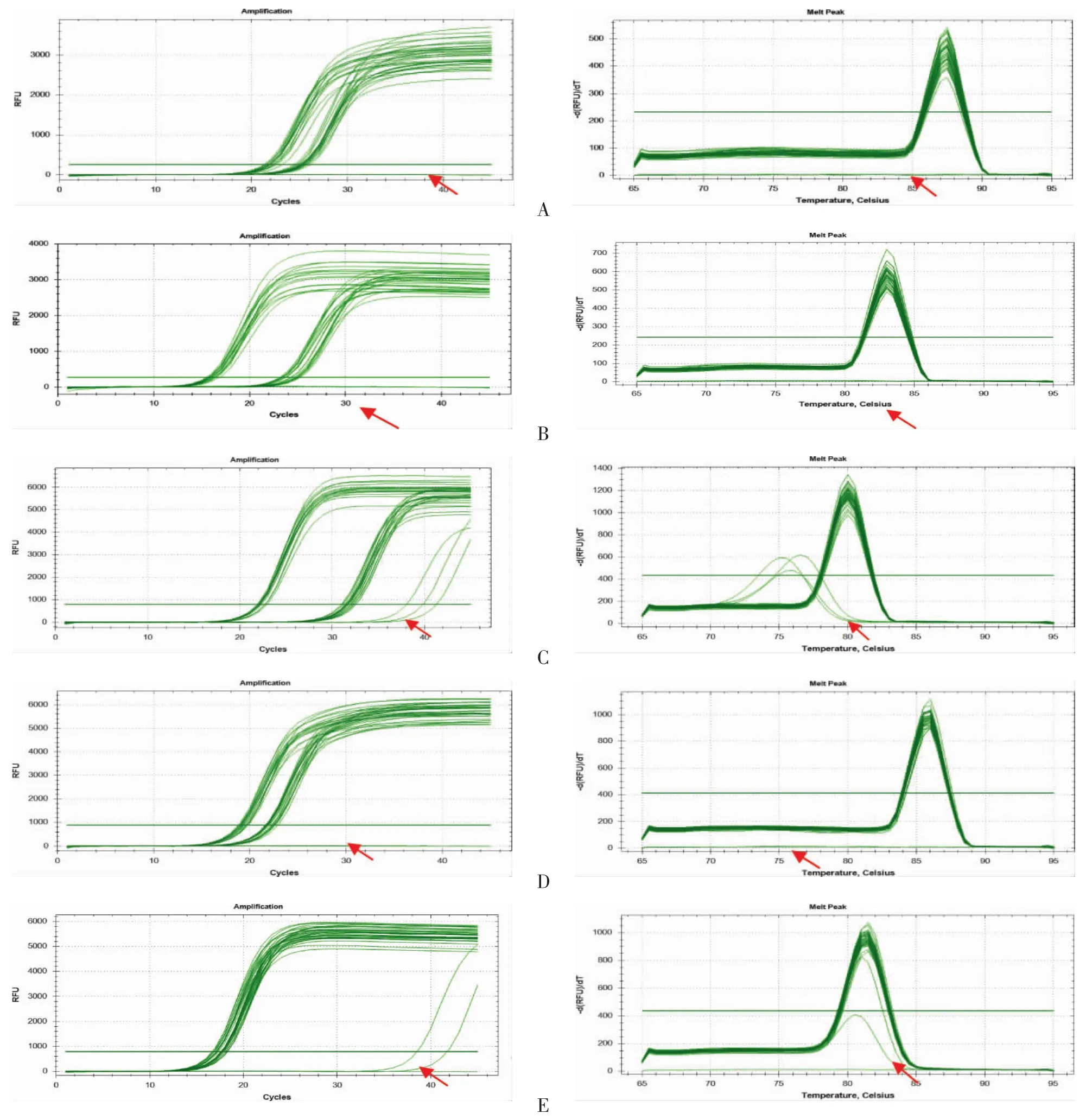
图5 金铁锁总皂苷及三萜类化合物对LPS诱导的RAW264.7细胞活化后COX-2、iNOS、IL-6、TNF-α mRNA的影响
4.6 金铁锁总皂苷及三萜类化合物对LPS诱导的RAW264.7 细胞活化后 COX-2、iNOS、IL-6、TNF-α mRNA的影响 实验结果表明,模型组(596.34±0.025)、(3.16 ± 0.32) 与正常组相比 IL-6,TNF-α mRNA的表达水平明显增加(P<0.01),给予GPY及QA后细胞内IL-6,TNF-α mRNA的表达明显降低(P<0.01),总皂苷(TSPT)组、GYP(8 μg/mL)与模型组相比无明显降低。
LPS诱导的RAW264.7细胞活化后iNOS、COX-2的表达持续增强将分别导致NO、PGE2的增加,最终导致炎症反应的发展。与正常组相比,模型组中iNOS、COX-2 mRNA 的表达明显增加(P<0.01),给予皂皮酸(QA)及丝石竹皂苷元(GYP)组与模型组相比均可降低iNOS、COX-2 mRNA的表达,而金铁锁总皂苷及GYP(8 μg/mL)与模型组相比对iNOS、COX-2 mRNA的表达无明显影响,此结果与NO、PGE2的定量结果一致。见图6。
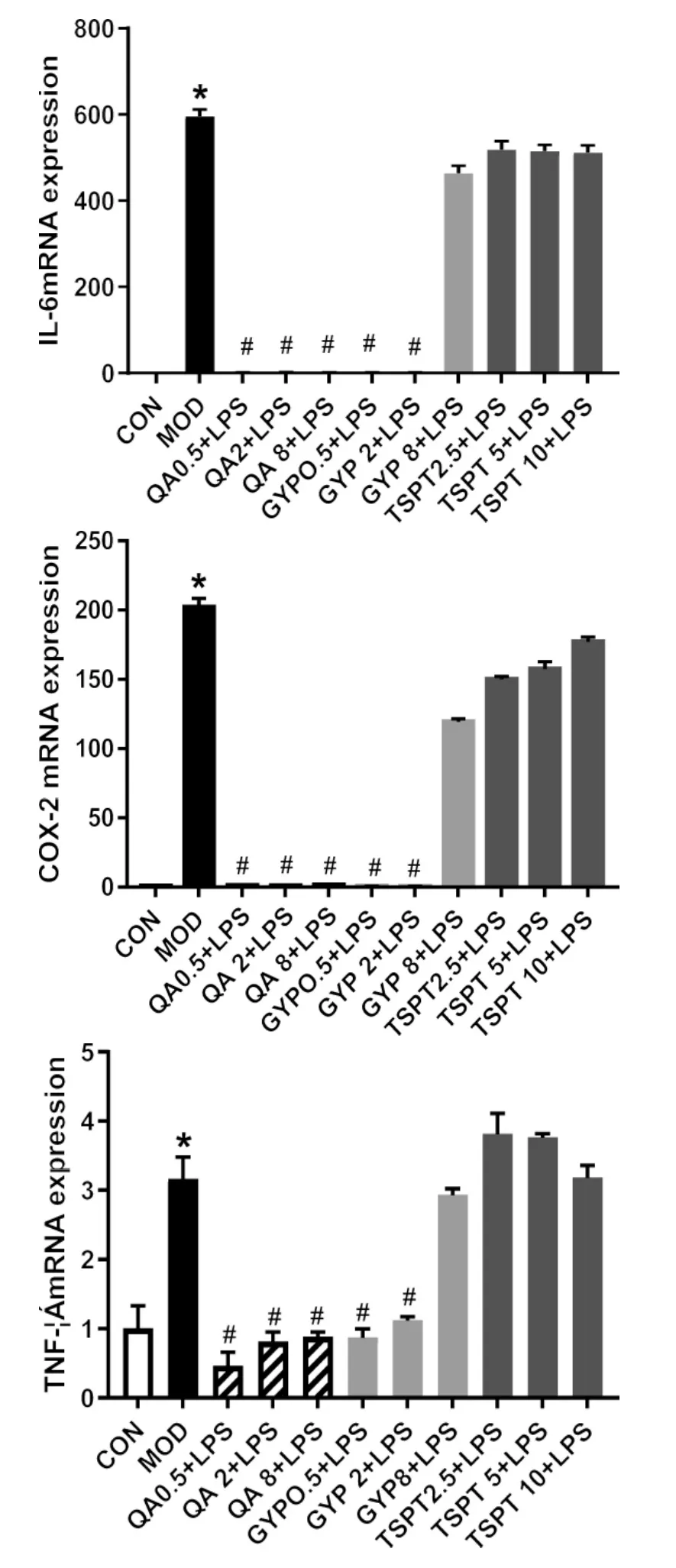
图6 总皂苷及三萜类化合物对LPS诱导的RAW264.7细胞后 IL-6、TNF-α、iNOS、COX-2的 mRNA 表达的影响
4.7 金铁锁总皂苷及三萜类化合物对LPS诱导RAW264.7细胞活化后NF-κB信号通路相关蛋白的影响
4.7.1 金铁锁总皂苷及三萜类化合物对LPS诱导RAW264.7细胞活化后IKKβ蛋白表达的影响 结果显示,LPS刺激的RAW264.7细胞活化后,胞浆中IKKβ蛋白表达降低,有向磷酸化转换的趋势,模型组与正常组相比有统计学意义(P<0.001),给予TSPT(5、10 μg/mL)、GYP(0.5、2 μg/mL)、QA 各剂量组后,IKKβ蛋白的表达量有不同程度的升高(P<0.05或P<0.01),在给予 GYP(8 μg/mL)及 TSPT(2.5 μg/mL)干预后,与模型组相比IKKβ蛋白的表达未见明显升高(P>0.05)。见图 7A。
4.7.2 金铁锁总皂苷及三萜类化合物对LPS诱导RAW264.7细胞活化后p-IκBα蛋白表达的影响 结果显示,LPS刺激的RAW264.7细胞活化后胞浆中p-IκBα蛋白表达显著升高,模型组与正常组相比,差异有统计学意义(P<0.01);给予TSPT各剂量后,与模型组相比,p-IκBα蛋白表达无明显变化,差异无统计学意义(P>0.05);而给予QA及GYP干预后,与模型组相比,蛋白IκBα的磷酸化均有明显下调,差异有统计学意义(P<0.05)。见图 7B。
4.7.3 金铁锁总皂苷及三萜类化合物对LPS诱导RAW264.7细胞活化后总蛋白p-NF-κBp65及NF-κBp65表达的影响 结果显示,LPS刺激的RAW264.7细胞活化后总蛋白中非磷酸化NF-κBp65蛋白的表达无明显变化;而磷酸化NF-κBp65蛋白的表达明显升高,模型组与正常组相比,差异有统计学意义(P<0.01);在给予本实验中所用药物各剂量后,非磷酸化NF-κBp65蛋白的表达均无明显变化,与正常组相比,差异无统计学意义(P>0.05);给予 GYP(2、8 μg/mL)、QA(2、8 μg/mL)及 TSPT(2.5、5、10 μg/mL)干预,磷酸化NF-κBp65蛋白的表达均有明显降低,与模型组相比,差异有统计学意义(P<0.05或P<0.01);而给予 GYP(0.5 μg/mL)及 QA(0.5 μg/mL)干预后,磷酸化NF-κBp65蛋白的表达有所降低,但与模型组相比,差异无统计学意义(P>0.05)。见图7C。
4.7.4 金铁锁总皂苷及三萜类化合物对LPS诱导RAW264.7细胞活化后胞浆内及核内NF-κBp65表达的影响 LPS刺激的RAW264.7细胞活化后胞浆内NF-κBp65会向核内转移,最终调节基因转录及炎症因子的释放。实验结果显示,与正常组相比,活化后的细胞胞浆内NF-κBp65蛋白表达明显降低(P<0.01);与模型组相比,给予GYP及QA的各剂量组均能明显升高胞浆内NF-κBp65蛋白的表达(P<0.01),差异有统计学意义;给予TSPT各剂量后,与模型组相比对胞浆内NF-κBp65蛋白无明显升高(P>0.05),差异无统计学意义。见图7D。
与正常组相比,活化后细胞核内NF-κBp65蛋白表达明显升高(P<0.01);在给予GYP及QA各剂量组后均能明显降低核内NF-κBp65蛋白表达,与模型组相比,差异有统计学意义(P<0.05或 P<0.01);在给予TSPT的各剂量组中,核内NF-κBp65蛋白的表达与模型组相比,无明显降低(P>0.05),差异无统计学意义。见图7E。
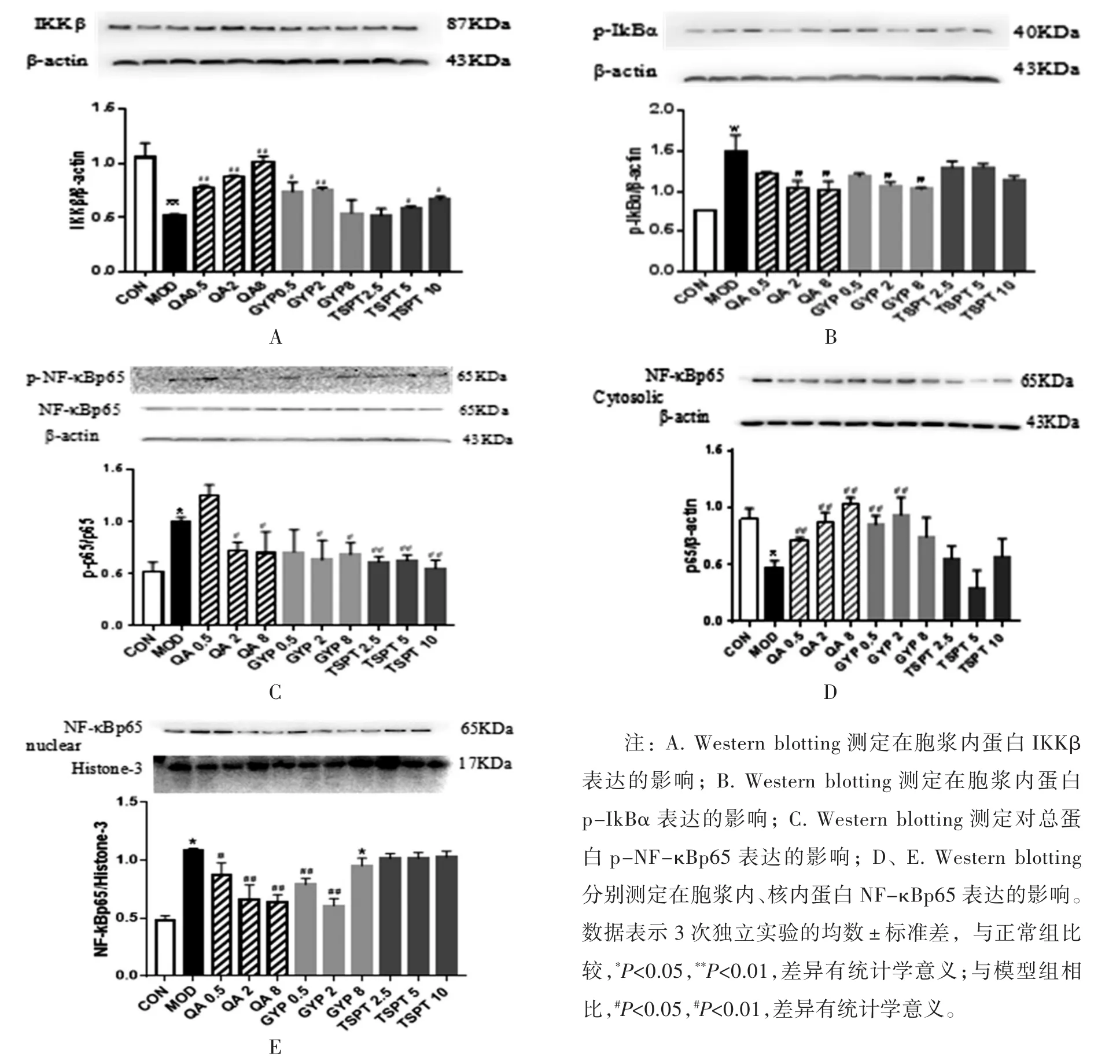
图7 金铁锁总皂苷及三萜类化合物对LPS诱导RAW264.7细胞活化后NF-κB信号通路相关蛋白的影响
5 讨论
炎症是免疫系统抵御各种外部感染的第一道防御反应,巨噬细胞作为效应细胞和调节细胞参与炎症反应的各个阶段。病原体入侵细胞时,巨噬细胞被激活释放炎症介质,如 TNF-α、IL-6、PGE2、NO 等,以抵御病原体的入侵与扩散。但过量的炎症介质得不到控制,就会对机体组织和微循环系统等造成损伤。LPS是革兰氏阴性细菌细胞壁的一种成分,容易刺激巨噬细胞分泌炎症介质,用于评价药物对炎症的反应[7]。在病理条件下,巨噬细胞的持续性激活将导致炎症介质如PGE2、NO的增加,从而导致组织损伤和血管生成[8],TNF-α的过量产生将导致白细胞(如嗜中性粒细胞)的聚集[9],IL-6主要由巨噬细胞受刺激后释放,可促进细胞吞噬功能和细胞黏附,促进细胞的分化,加速巨噬细胞的成熟等[10]。在本实验中,ELISA和qRT-PCR分析表明,金铁锁三萜类化合物不仅显著减轻了LPS诱导的RAW264.7巨噬细胞促炎症因子PGE2、NO 的释放,而且显著调节了 TNF-α、IL-6、COX-2和iNOS的mRNA表达。结果表明,金铁锁三萜类化合物可能减轻炎症的早期阶段并减少炎症介质的释放。
NF-κB通路是LPS介导巨噬细胞表达促炎基因的主要信号通路。特别是NF-κB是参与LPS引发的各种炎症反应的许多炎症基因表达。在未激活的细胞中,NF-κB 存在于细胞质中,IκB 蛋白与 NF-κB 结合并抑制NF-κB的核转移,IκB蛋白的磷酸化是NF-κB激活的关键步骤,受IκB 激酶(IKKs)调节,而IKK活性由NF-κB通路激活剂诱导。巨噬细胞受到LPS刺激活化后,IKK家族激活,促进IκB磷酸化、泛素化而降解,NF-κBp65与之解离,从细胞质向细胞核内转移,从而促使各类炎症介质的释放。研究结果表明,金铁锁三萜类化合物能够通过调节IKKβ的激活和活性,抑制IκBα的磷酸化和蛋白水解降解来显着抑制NF-κBp65核易位。同时能够明显降低COX-2和iNOS的mRNA表达,这个结果与细胞上清液ELISA测定的PGE2、NO定量结果一致。结果表明,金铁锁三萜类化合物抑制PGE2和NO与抑制抑制LPS刺激的RAW 264.7细胞中的COX-2、iNOS表达有关。

