基于磁共振加速器肺癌自适应放射治疗剂量计算精确性初探*
刘敏,廖雄飞,袁珂,黎杰,王培,姚杏红,李厨荣,谭庭强,牛刚,冯玺
610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 放射肿瘤学四川省重点实验室
2017年,荷兰乌德勒大学率先将磁共振加速器Unity应用于骨转移患者的临床治疗,证实利用磁共振影像引导进行精确放疗的可行性[1]。随后磁共振加速器Unity进入人们的视野,并且掀起了相关临床研究的热潮[2-3]。目前,在Unity上已开展了包括前列腺、直肠、膀胱、肺和肝等多个病种和部位的临床治疗[4-7]。与传统CT图像对比,MR的优点在于它的优越软组织对比度和成像无电离辐射[8-9]。自2018年开始,国内多家大型放射治疗中心相继开展Unity临床试验,2021年投入临床应用[10-12]。
另外,磁共振加速器提供两种在线自适应放射治疗模式:自适应位置(adapt to position,ATP)和自适应形状(adapt to shape,ATS)。医师可根据放疗前磁共振扫描与参考图像的配准结果,以及患者靶区的变化情况选择计划放疗模式。一般而言,在靶区形状及位置变化不大的情况下,选择ATP模式;在靶区形状及位置变化较大的情况下,选择ATS模式。ATP模式下放射治疗计划计算是基于CT影像中电子密度进行剂量计算,而ATS模式下是基于磁共振影像进行计算,然而磁共振图像由于缺乏电子密度信息不能直接在放射治疗计划系统(treatment planning system,TPS)中进行剂量计算和优化。
目前,临床应用ICRU46号报告[13]推荐的电子密度值和基于CT影像的平均电子密度[14]两种方案解决此临床问题。根据ICRU46号报告,人体中每个结构均有推荐的电子密度值,然后通过对MR影像中结构强制赋值推荐的密度信息的方式,实现MR的剂量计算。另外一种方案是磁共振加速器治疗之前,会有CT参考计划,在当前ATS流程中系统会将CT参考计划中各个结构的平均电子密度,自动赋值给MR影像中关联结构,也可以实现MR的剂量计算。但是由于赋值的是平均电子密度信息,而不是MR影像中每个点的电子密度信息,因此可能会给剂量的计算带来不确定性,特别是肺这种密度不均匀的介质。本研究拟探讨使用磁共振加速器ATS模式治疗肺癌患者时,基于MR影像进行剂量计算的精确性影响因素,检验CT平均电子密度的方法在MR上计算肺癌立体定向体部放射治疗(stereotactic body radiation therapy,SBRT)计划所导致的剂量计算偏差,评估此种方式在临床应用的可行性,为临床提供参考。
1 材料与方法
1.1 磁共振加速器系统(MR-Linac,Unity)
磁共振加速器系统(MR-Linac,Unity)是医科达(Elekta)公司与飞利浦(Philips)公司联合研发将MR与加速器有机结合的一套先进的放射治疗设备[15-16]。MR部分磁场强度1.5 T,孔径70 cm;加速器部分为7MV FFF X射线,剂量率425MU/min,80对高速多叶光栅最大射野范围22 cm×57 cm且运动方向固定(头脚方向),源轴距143.5 cm,机架为滑环结构安装在磁共振外部的轨道上,配备MV-EPID成像系统,治疗过程中采用静态调强Step and shoot模式。
1.2 一般资料
回顾性分析本院2021年6~11月已完成SBRT治疗的13例单个靶点肺癌患者影像资料,肿瘤体积7.2~96.6 cm3,5例中央型,8例周围型。将所有患者CT影像以及勾画结构信息文件通过网络传输至Unity磁共振加速器计划系统Monaco 5.40。
1.3 基于磁共振加速器肺癌自适应放射治疗流程
磁共振加速器肺癌自适应放射治疗一般分两步,即参考计划设计(图1)和患者当日治疗(图2)。在当日治疗时,如果肿瘤在MR影像和参考CT计划相比无形态变化,则进行ATP修正;如果肿瘤在MR影像和参考CT计划相比有形态变化,则进行ATS修正,ATS模式下医师在MR上在线修改或重新勾画靶区和危及器官的轮廓,物理师在MR影像中进行新的计划设计与优化。由于MR图像缺乏电子密度信息不能进行剂量优化和剂量计算,因此需要从参考计划中CT图像获取平均相对电子密度的方式来人工赋予MR图像上各危及器官电子密度,从而能够在MR图像上进行剂量计算。

图1 参考计划设计Figure 1.Design of the Reference Plan
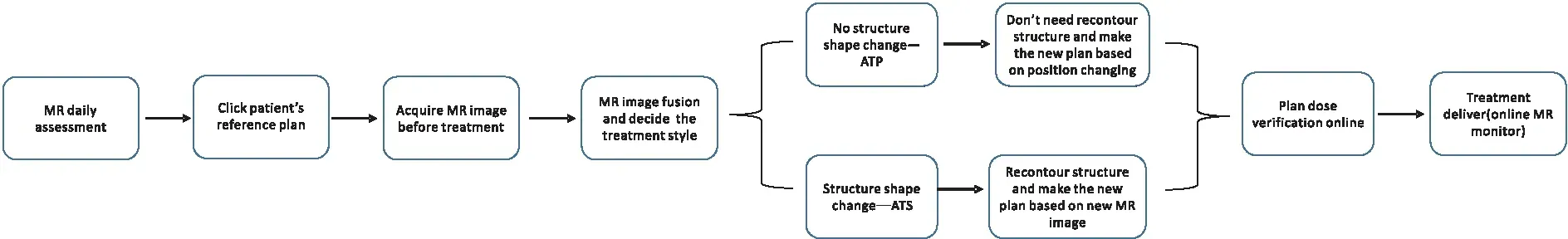
图2 患者当日治疗流程Figure 2.Process of Patients’ Daily Treatment
1.4 研究方法与计划设计、评估
基于形状修正的ATS放射治疗过程中,在线计划计算MR图像不能直接进行剂量计算和优化,TPS一般默认将CT参考计划中器官的平均密度赋予给MR上同一器官的方式在MR上进行近似的计算。本研究在TPS中先进行CT参考计划的优化设计(reference plan,RP),记录为RP组计划,然后在不改变射野的前提下,将器官的平均电子密度值手动强制赋值给器官,再重新进行剂量计算(new plan,NP),记录为NP组计划(图3),模拟在ATS流程中MR上的计算。通过统计学方法比较RP组与NP组放疗计划各参数差异。
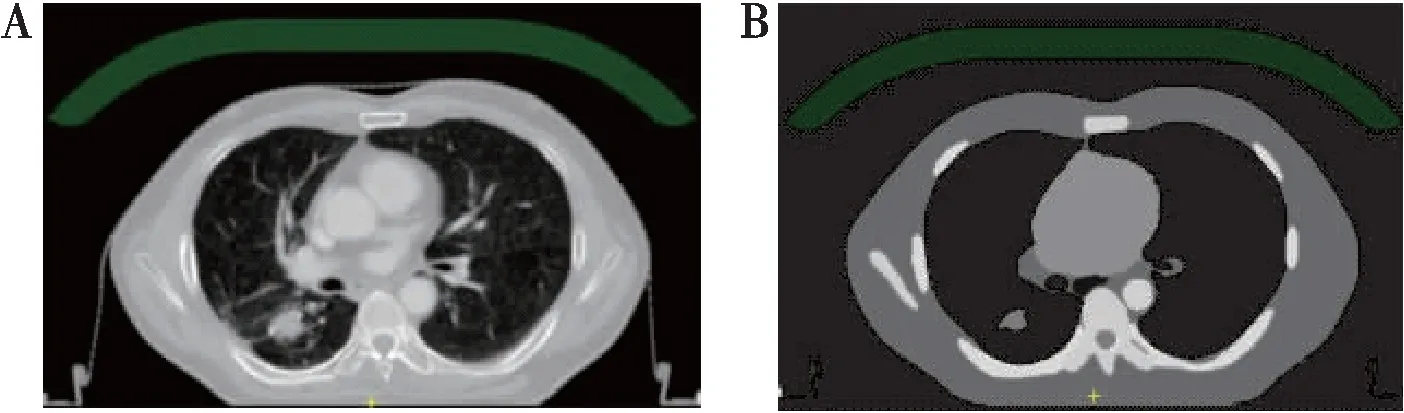
图3 CT赋值前后对比Figure 3.CT Images before and after AssignmentA.Origin CT image;B.CT image after assignment
利用核磁加速器Unity配置计划系统Monaco 5.4(Elekta AB,Stockholm,Sweden)进行计划设计,计划系统采用GPUMCD 剂量计算引擎,可以准确计算出磁场下电子的剂量分布,同时GPU硬件对计算进行加速。计划设计中采用静态调强(Step And Shoot),7MV FFF技术,计算网格为2 mm,射野布置采用计划设计中普遍接受的“就近原则”,根据靶区的具体位置,布置相应的射野,使得射线尽可能穿过较少的人体组织到达靶区。射野数目为9~11个,射野须避开治疗床两侧高密度区域(110°~135°和 239°~255°),以及在0°~30°之间避开红色核磁线圈区域,子野数目不超过120个。处方剂量50 Gy,5分次。与RP组计划相比,NP组靶区、肺、心脏、脊髓、肋骨及软组织等危及器官的相对电子密度均为该器官的平均电子密度,射野参数均不变,重新计算剂量分布生成新计划。
根据AAPM的TG101报告评价靶区与危及器官的限量[17],计划要求处方剂量80%剂量线尽可能覆盖靶区并且适形,最大剂量不超过处方剂量125%;统计的剂量学参数主要包括计划靶区(plan target volume,PTV)的适形指数(conformity index,CI)[18]、均匀性指数(homogeneity index,HI)、D2%、D98%、D90%和梯度指数(gradient index,GI)[19],患侧肺V5、V20和Dmean,脊髓D1cc,心脏Dmean,肋骨D1cc、D2cc和Dmean;Dx%表示x%体积对应的剂量;Vy表示接收Y剂量对应的体积;Dmean表示平均剂量;Dzcc表示Z立方体积对应的剂量。
CI代表处方剂量对靶区的包裹程度,定义如下:
(1)
其中VCTV,ref表示处方剂量包裹的靶区体积,VCTV表示靶区体积,Vref表示处方剂量包括的体积,CI值越大越接近1,表示靶区剂量适形度越好。
GI代表剂量的跌落程度,值越小越接近1表示剂量跌落越快,定义如下:
(2)
其中V50%ref表示50%处方剂量包裹的体积,V100%ref表示100%处方剂量包裹的体积,GI表示50%处方剂量包裹的体积与100%处方剂量包裹的体积的比值。
HI代表靶区内的均匀程度,值越小越接近1表示靶区剂量越均匀,定义如下:
(3)
其中D5%表示靶区内5%体积所对应剂量,D95%表示靶区内95%体积所对应的最小剂量,HI是两者的比值。
1.5 统计学方法
使用SPSS 25.0进行数据分析。数据经正态性检验,符合正态分布的用均数±标准差表示,采用配对t检验;不符合正态分布的采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组PTV及危及器官剂量学参数对比
RP和NP两组PTV和危及器官剂量学参数对比结果(表1)显示,PTV剂量学参数D2%、D90%、D98%、CI和GI的差异均有统计学意义(P<0.05),HI差异无统计学意义(P=0.94);危及器官包括患侧肺(V5、V20、Dmean)、脊髓(D1cc)、心脏(Dmean)和肋骨(D1cc、D2cc、Dmean)的剂量学参数差异均无统计学意义(P>0.05)。两组计划比较而言,靶区中剂量分布存在着明显差别,而对于危及器官而言剂量分布差别相对较小。
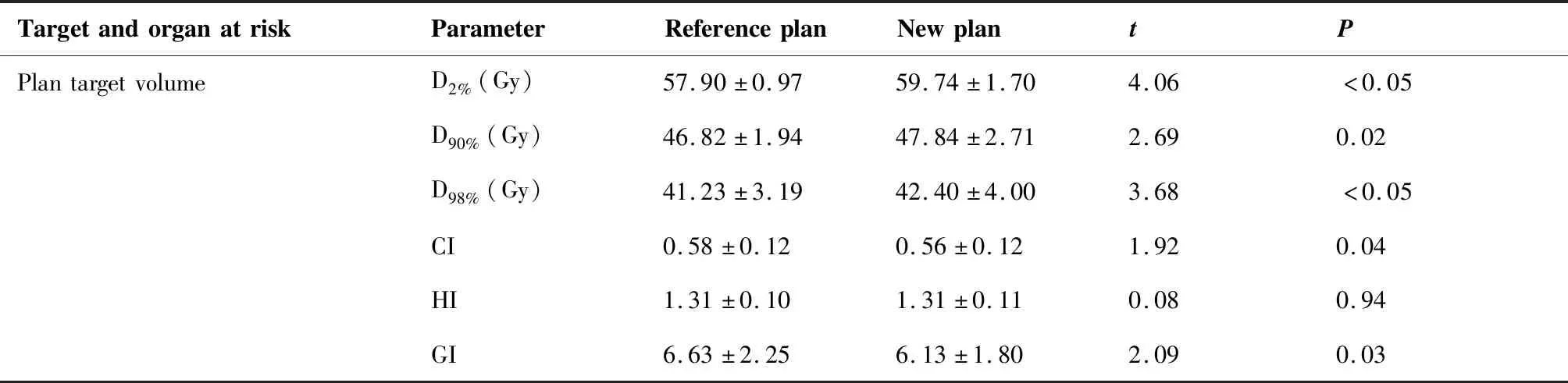
表1 RP组与NP组计划靶区和危及器官剂量学参数统计学结果Table 1. Dosimetric Parameters of Targets and Organs at Risk in the Reference Plan and the New Plan
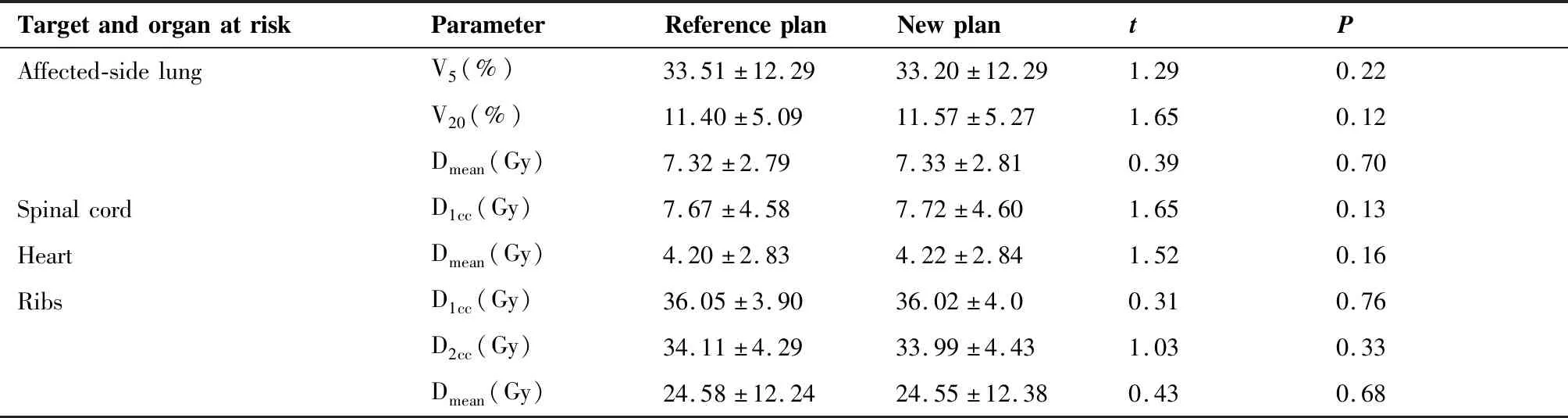
TargetandorganatriskParameterReferenceplanNewplantPAffected-sidelungV5(%)33.51±12.2933.20±12.291.290.22V20(%)11.40±5.0911.57±5.271.650.12Dmean(Gy)7.32±2.797.33±2.810.390.70SpinalcordD1cc(Gy)7.67±4.587.72±4.601.650.13HeartDmean(Gy)4.20±2.834.22±2.841.520.16RibsD1cc(Gy)36.05±3.9036.02±4.00.310.76D2cc(Gy)34.11±4.2933.99±4.431.030.33Dmean(Gy)24.58±12.2424.55±12.380.430.68
2.2 两组PTV和危及器官剂量学参数的相对偏差
以RP组计划剂量学参数作为参考,NP组PTV和危及器官剂量学参数相对偏差分别如图4和图5所示。PTV的D2%、D90%、D98%、CI、HI和GI的平均相对偏差和偏差范围分别为3.2%(-0.52%~7.42%)、2.13%(-1.16%~6.53%)、2.71%(-0.31%~6.67%)、2.57%(-8.57%~5.17%)、0.09%(-3.91%~4.80%)、5.48%(-20.35%~13.61%);危及器官患侧肺V5、V20和Dmean,脊髓D1cc,心脏Dmean,肋骨D1cc、D2cc和Dmean的平均相对偏差和偏差范围分别为0.83%(-7%~3.74%)、1.46%(-5.92%~8.49%)、0.17%(-1.66%~3.04%);0.72%(-2.43%~1.79%);0.58%(-1.07%~2.72%);0.12%(-2.43%~1.79%)、0.04%(-2.98%~1.53%)、0.33%(-2.05%~0.79%)。基于平均密度的方式进行计算,与原参考计划(RP 组)比较,所导致的靶区剂量参数的偏差要大于危及器官参数的偏差。对于靶区中剂量参数GI所导致的偏差最大达到了20.35%,而危及器官中最大偏差在于肺组织V20,其偏差最大为8.49%。

图4 靶区剂量学参数相对偏差Figure 4.Relative Deviation in Dose Parameters of Targets with Respect to the Reference Plan
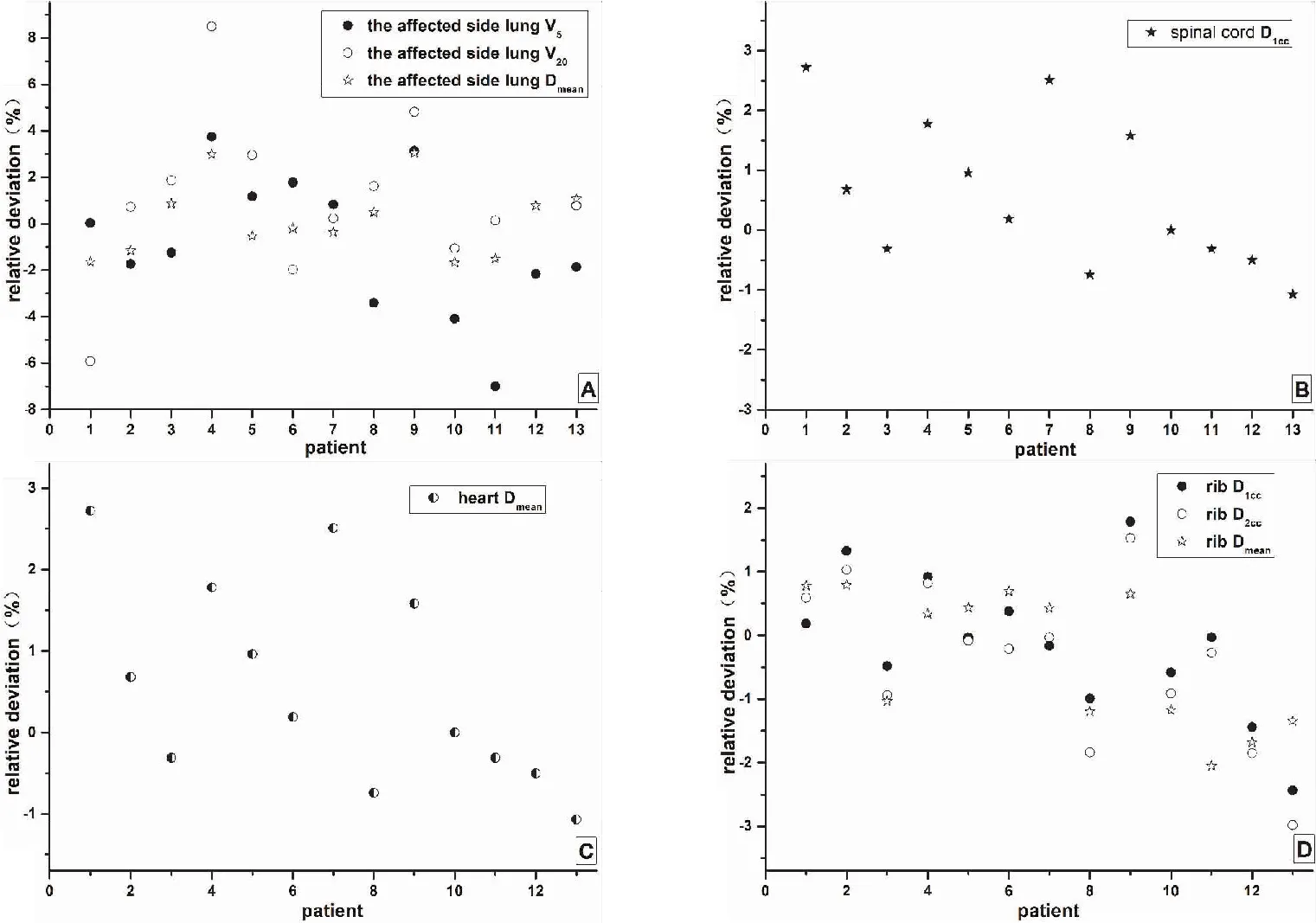
图5 危及器官剂量学参数相对偏差Figure 5.Relative Deviation from the Reference Plan in Dosimetric Parameters of Organs at Risk
3 讨 论
相对于传统加速器而言,磁共振加速器系统将1.5T诊断级磁共振成像扫描仪、7MV直线加速器结合在一起,其优势在于:1)MR具备优异的软组织对比度和功能成像能力,每次治疗前进行MR扫描,医师可以根据MR影像中肿瘤体积的变化及时调整放疗方案,真正实现对每位患者每次放疗的实时个体化,对提高肿瘤控制率及降低毒副反应具有重要的临床意义;2)对关键结构的可视化在放射治疗靶区以及危及器官的准确勾画方面具有重要意义,可更好地保护危及器官,降低并发症发生率;3)在线MR监控系统,可获取患者治疗前、治疗中、治疗后实时影像,对医师判断靶区是否脱靶,危及器官是否得到有效保护具有重要参考意义;4)由于MR无辐射,磁共振影像获取的过程中,患者不会接受多余的剂量照射。Unity(MR-Linac)是MR与加速器有机结合的产物,其1.5T的磁场与加速器的整合能提供高软组织对比度图像,可以在治疗过程中准确提供病灶位置,让图像配准更直观、更准确;同时在治疗过程中可实时进行肿瘤成像,显示靶区运动状况,进一步减小PTV的外放范围,进行更精确的运动管理;另外,成像过程中无电离辐射可以减少正常组织损伤、降低辐射致癌风险。与传统加速器治疗流程相比,Unity治疗流程差异较大[20-23],Unity是按照在线自适应放射治疗流程设计的,分为基于位置修正(ATP)和基于形态修正(ATS)的两种在线自适应放射治疗模式。ATP模式一般适用于肿瘤形态无变化情况,根据图像配准结果,修正摆位误差,由于磁共振加速器治疗床不能移动,根据需要调整多叶光栅和治疗等中心的位置来实现图像引导放射治疗,重新进行剂量生成可执行在线计划。ATS模式主要是修正靶区和危及器官的形态误差,医师在MR上修改或重新勾画靶区和危及器官的轮廓,同时将CT上对应的器官平均电子密度填充到MR图像上,并在MR图像上重新进行剂量优化和剂量计算生成可执行在线计划。
本研究利用定位CT图像,进行计划设计,然后将器官的平均电子密度值强制赋值给器官,在不改变射野的前提下,再重新进行剂量计算(NP组),模拟磁共振加速器肺癌自适应放疗ATS过程中运用平均相对电子密度替代组织器官原有电子密度的计算方式。结果显示,NP组靶区(PTV)剂量学参数D2%、D90%、D98%、CI和GI与RP组的差异均有统计学意义(P<0.05),HI差异无统计学意义(P>0.05);而两组危及器官包括患侧肺(V5、V20、Dmean)、脊髓(D1cc)、心脏(Dmean)和肋骨(D1cc、D2cc、Dmean)的剂量学参数差异均无统计学意义(P>0.05)。图4和图5结果反映出NP组危及器官除患侧肺以外,剂量偏差均在3%以内,靶区剂量学参数相对偏差最大达20.35%;患侧肺剂量学参数相对偏差最大达8.49%。偏差越大,放疗计划系统中计算剂量与患者实际受照情况差别越大,不利于患者的实际受量评估,会极大影响患者的进一步治疗。Prior等[24]应用体密度赋予MR图像进行肺癌计划剂量计算精度的研究,发现剂量误差大于5%,结果与本研究相近。国内外文献尚无应用平均相对电子密度赋予MR图像进行剂量计算精确度的相关报道,本研究结果发现在肺癌SBRT病例中应用此方法靶区剂量误差可能会超出临床允许的5%剂量偏差范围,分析原因可能是应用患侧肺平均相对电子密度时,误差偏大,在肺组织中实际存在支气管等较高密度和肺泡较低密度结构密度,应用平均值将很大程度改变组织的原有结构密度,从而造成剂量偏差。
放射治疗的过程是射线从靶区附近多个角度出发,然后向靶区集中,使得靶区获得处方受照剂量的过程,其中射束要穿过多个人体正常器官才能到达靶区。射束与经过的物质发生相互作用,实现剂量的沉积,而与物质发生相互作用的大小,取决于物质的相对电子密度。在RP组中,射束所经过的每个点的电子密度不一定相同,但是都是按照每个点的实际电子密度进行计算,而本研究在模拟Unity磁共振加速器在MR中进行计算时,不再是按照每个点的实际电子密度计算,而是按照器官的平均电子密度进行计算。
人体其他组织,例如骨、直肠、膀胱以及肝脏等组织,器官内电子密度变化一般较小,应用平均电子密度进行计算,其计算结果会相差不大,剂量偏差较小,在临床可接受的5%范围内。国内外有多项类似研究[25-29],韩胜[30]、Andreasen[8]、Prior[31]、Christiansen[20]等应用电子密度赋予MR图像进行宫颈、鼻咽、胰腺和前列腺等部位剂量计算精度的研究,结果发现剂量计算误差在临床可接受范围以内;但是对于肺组织而言,肺组织内电子密度变化较大,其中电子密度较大的支气管等结构密度可达1.1~1.2 ED,而对于肺泡等结构电子密度在0.1~0.2 ED之间,根据ICRU46号报告给出的人体肺组织平均电子密度推荐值为0.26 ED[13]。在不改变射野出束条件的前提下,如果此时按照平均电子密度重新进行剂量计算,计算结果与实际情况下CT剂量计算结果比较会出现较大偏差。由于靶区位于肺组织中间,射束从多个角度穿过肺组织,最终集中于靶区,因此对于靶区的影响最大。从本文研究结果来看靶区剂量参数CI偏差达到8.57%,而GI所导致的偏差最大达到了20.35%,远远超出了临床上能接受的范围。对于危及器管脊髓、心脏以及肋骨而言,射束大部分都没有经过肺组织就到达器官,而且脊髓、心脏以及肋骨等器官内本身电子密度变化不大,因此脊髓、心脏以及肋骨剂量偏差较小,均在3%以内。而肺组织由于本身电子密度变化较大,其剂量参数V20偏差最大达到了8.49%。
值得一提的是,在本文的研究范畴内,患者并没有实际进行治疗。文中回顾性将肺癌患者的数据导入磁共振加速器计划系统(Monaco 5.4),然后采用模拟在线MR计算的方式来进行计算,聚焦于TPS中肺癌在线MR计划运算的精确性问题。同时也排除了定位偏差、患者器官运动和形态、体积等的变化带来的干扰。
综上所述,在磁共振加速器ATS过程中肺癌SBRT计划剂量计算精确性研究中,肺肿瘤或正常肺组织上的平均相对电子密度赋值方法可能导致剂量误差>5%,因此对于在磁共振加速器进行ATS流程,在基于MR的肺癌放疗计划设计时需慎重。对肺组织进行进一步精细化勾画,更加精确确定肺组织电子密度或寻找新的计划设计方法将成为新的研究方向。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

