基于UHPLC-QTOFMS代谢组学技术的胃癌进展代谢标志物研究*
魏婷,柴顺林,朱晓亮,李汛,王燕萍
730000兰州,兰州大学第一医院 药剂科(魏婷、柴顺林、王燕萍),普外科(朱晓亮、李汛);730000兰州,兰州大学第一医院东岗院区 药剂科(魏婷、柴顺林)
胃癌是我国发病率位居第一的消化道恶性肿瘤,严重危害人类生命健康。根据国际癌症研究机构的统计数据,2020 年全世界胃癌新发病例约108.9万例,居恶性肿瘤发病人数的第5位[1]。甘肃省胃癌的发病率、死亡率明显高于全国平均水平,其中武威市凉州区、河西走廊中段张掖地区是全国上消化道癌高发区之一,对此医疗机构在省内各地开展了早癌筛查义诊活动,深入农村地区开展癌症早诊早治,并对我省不同地区人群的饮食习惯、环境和遗传因素等进行调研[2-3]。
胃癌的发生是一多因素过程,确切的致癌机制仍不明确。胃癌进展的过程通常需要四步:胃黏膜炎症(浅表性胃炎)—胃黏膜变薄萎缩(萎缩性胃炎)—异常改变(肠化生、不典型增生等早期癌症)—出现癌细胞(胃癌病灶),患者体内代谢物质发生动态变化。目前内镜结合病理学检查是胃癌明确诊断的首选方法,而传统的肿瘤标志物(CEA、CA19-9、CA72-4)用于胃癌诊断敏感性、特异性不够理想。代谢组学(Metabolomics)是一门对生物体或细胞所有低相对分子质量的代谢产物进行定量和定性分析的新技术,是目前组学领域研究的热点之一。已有研究将代谢组学方法应用于血清、血浆、尿液等样本的代谢物检测中,利用核磁共振、液相色谱-质谱联用、气相色谱-质谱联用等高灵敏度检测技术鉴定胃癌患者样本中的差异代谢物,发现具有诊断价值的特异性标志物,具有重要的临床意义[4]。但目前关于胃癌进展的相关标志物尚不明确。本研究基于我院开展的“甘肃省上消化道早癌筛查”项目,样本全部采集自甘肃省农村地区,应用超高效液相色谱-四极杆飞行时间质谱联用技术(Ultra High Performance Liquid Tandem Chromatography Quadrupole Time of Flight Mass Spectrometry,UHPLC-QTOFMS),研究甘肃农村浅表性胃炎患者和胃癌患者血浆中代谢物质的变化,旨在为胃癌进展的早期诊断和预防提供新的依据。
1 材料与方法
1.1 样本收集
本实验采集的血浆样本均来自兰州大学第一医院开展的“甘肃省上消化道早癌筛查”项目,并经医院伦理委员会审批同意(批件编号:LDYYLL2017-06)。所有受试人员均来自于甘肃农村地区,经胃镜诊断为浅表性胃炎或胃癌。纳入标准:年龄18~70岁,经胃镜诊断为浅表性胃炎或胃癌。排除标准:幽门螺杆菌感染检测阳性,近三个月内长期服用幽门螺杆菌根除药物。纳入浅表性胃炎患者30例,胃癌患者30例(其中早癌20例,进展期胃癌10例),两组受试者年龄、性别、饮食结构和生活习惯等方面的差异无统计学意义(P均>0.05),排除有服药史患者。受试者空腹采血,采用真空肝素钠无菌采血管常规收集各组受试者肘静脉血5 mL,快速恒温离心(4℃离心) ,取上层血浆样品置于EP管中,并立即冷冻于-80℃超低温保存箱中待测。
1.2 血浆样品前处理
血浆样品室温解冻,移取100 μL样品,加入400 μL提取液(甲醇∶乙腈=1∶1(V/V),含内标2 μg/mL);涡旋混匀30 s,冰水浴超声10 min;-40 ℃静置1 h;将样品4 ℃,10 000 rpm离心15 min;取上清400 μL于EP管中;真空干燥;加入200 μL 50%乙腈复溶;涡旋30 s,冰水浴超声10 min;将样品于4 ℃,13 000 rpm离心15 min;取75 μL上清液于进样瓶中上机检测;所有样品另取10 μL上清混合成QC样品上机检测。
1.3 仪器与试剂
本研究使用Agilent 1290(Agilent Technologies)超高效液相色谱仪,通过Waters ACQUITY UPLC BEH Amide(2.1 mm×100 mm,1.7 μm)液相色谱柱对目标化合物进行色谱分离。液相色谱A相为水相,含25 mmol/L乙酸铵和25 mmol/L氨水,B相为乙腈。采用梯度洗脱:0~0.5 min,95% B;0.5~7 min,95%~65% B;7~8 min,65%~40% B;8~9 min,40% B;9~9.1 min,40%~95% B;9.1~12 min,95% B。流动相流速:0.5 mL/min,柱温:25 ℃,样品盘温度:4 ℃,进样体积:正离子1 μL;负离子1 μL。
使用Triple TOF 6600高分辨质谱,通过IDA(information-dependent acquisition)模式进行高分辨质谱数据采集。在IDA这种模式下,数据采集软件(Analyst TF 1.7,AB Sciex)依据一级质谱数据和预先设定的标准,自动选择离子并采集其二级质谱数据。每个循环选取12个强度最强且大于100的离子进行二级质谱扫描,碰撞诱导解离的能量为30 eV,循环时间为0.56 s。离子源参数如下:GS1 60 psi,GS2 30 psi,CUR 35 psi,TEM 600℃,DP 60 V,ISVF 5000 V(Pos)/-4000(Neg)。甲醇、乙腈、乙酸铵、氨水、均为LC-MS级,CNW Technologies,L-2-氯苯丙氨酸(≥98%)购自上海恒柏生物科技有限公司。
1.4 质控(quality control,QC)
为了确保试验方法的稳定性,包括仪器稳定性、内标响应稳定性,制备QC样品:1.2项下处理后的所有样品另取10 μL上清混合制备成QC样品,在每5个检测样品后分别加入一个QC样品。
1.5 数据处理
使用ProteoWizard软件将质谱原始转成mzXML格式。再使用XCMS程序包做保留时间矫正、峰识别、峰提取、峰积分、峰对齐等工作,minfrac设为0.5,cutoff设为0.6。同时使用质谱数据库对峰信息进行物质鉴定。使用SIMCA软件(V15.0.2,Sartorius Stedim Data Analytics AB,Umea,Sweden)对数据进行对数转换加UV格式化处理,首先对第一主成分进行OPLS-DA建模分析,模型的质量用7折交叉验证进行检验;然后用交叉验证后得到的R2Y(模型对分类变量Y的可解释性)和Q2(模型的可预测性)对模型有效性进行评判;最后通过置换检验,随机多次改变分类变量Y的排列顺序得到不同的随机Q2值,对模型有效性做进一步的检验。VIP(variable importance in the projection)值是正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)方法中评价变量贡献最常用的指标,VIP>1的变量被认为是潜在的差异代谢物,在代谢组学数据分析中,满足这一标准的变量能够反映研究对象代谢通路变化的特征。OPLS-DA模型的质量用R2Y和Q2两个参数进行评估,其中R2Y表示模型的解释能力,Q2表示模型的预测能力[4]。通过在线数据库(Metlin、HMDB等)中检索精确相对分子质量以及可能的离子结合形式,经一级质谱和二级质谱确证差异化合物的结构,并排除非内源性物质干扰。通过差异代谢物对KEGG、PubChem等权威代谢物数据库进行映射,最后将得到的差异代谢物所在通路综合分析(包括富集分析和拓扑分析),筛选与差异代谢物相关性最高的关键通路。
2 结 果
2.1 总离子流图
所有QC样品在正离子、负离子模式下的总离子流图见图1、2。由图可知,QC样品TIC保留时间和峰面积都重叠较好,说明仪器稳定性好。
图1 所有QC样品正离子TIC图Figure 1.TIC of Metabolites in QC Samples (Positive Ion Mode)TIC:Total ion chromatogram;QC:Quality control.
图2 所有QC样品负离子TIC图Figure 2.TIC of Metabolites in QC Samples (Negative Ion Mode)TIC:Total ion chromatogram;QC:Quality control.
2.2 主成分分析(principal component analysis,PCA)、OPLS-DA分析结果
正、负离子模式下胃癌组与浅表性胃炎样本的PCA得分散点图如图3、4所示,样本基本处于95%置信区间内。由图可知,正离子模式下胃癌组与浅表性胃炎组血浆中的代谢物能明显区分,负离子模式下区分不明显。使用SIMCA软件(V15.0.2)对数据进行对数转换,对主成分进行OPLS-DA建模分析,OPLS-DA模型得分散点图如图5、6所示,模型的质量用7折交叉验证进行检验;然后用交叉验证后得到的R2Y(模型对分类变量Y的可解释性)和Q2(模型的可预测性)对模型有效性进行评判。本研究中正离子模式下R2Y=0.849,Q2=0.675,负离子模式下R2Y=0.826,Q2=0.639,说明模型拟合较好。置换检验通过随机改变分类变量Y的排列顺序,多次(次数n=200)建立对应的OPLS-DA模型以获取随机模型的R和Q值,在避免检验模型的过拟合以及评估模型的统计显著性上有重要作用。B组对A组OPLS-DA模型的置换检验结果如图7、8所示,置换检验随机模型的Q2值均小于原模型的Q2值;Q2的回归线与纵轴的截距小于零。说明原模型具有良好的稳健性,不存在过拟合现象。
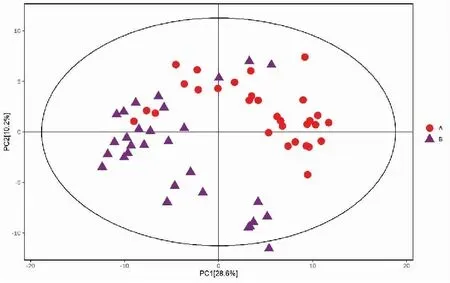
图3 正离子模式下胃癌组与浅表性胃炎组的PCA模型得分散点图Figure 3.Scatter Plot of PCA for the Gastric Cancer Group and the Superficial Gastritis Group (Positive Ion Mode)PCA:Principal component analysis.

图4 负离子模式下胃癌组与浅表性胃炎组的PCA模型得分散点图Figure 4.Scatter Plot of PCA for the Gastric Cancer Group and the Superficial Gastritis Group (Negative Ion Mode)PCA:Principal component analysis.
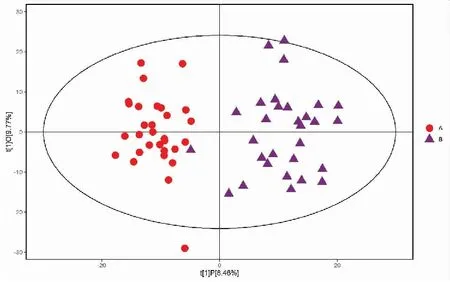
图5 正离子模式下胃癌组与浅表性胃炎组的OPLS-DA模型得分散点图Figure 5.Scatter Plot of OPLS-DA for the Gastric Cancer Group and the Superficial Gastritis Group (Positive Ion Mode)OPLS-DA:Orthogonal partial least squares discriminant analysis.
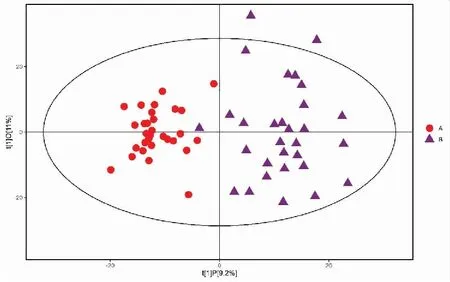
图6 负离子模式下胃癌组与浅表性胃炎组的OPLS-DA模型得分散点图Figure 6.Scatter Plot of OPLS-DA for the Gastric Cancer Group and the Superficial Gastritis Group (Negative Ion Mode)OPLS-DA:Orthogonal partial least squares discriminant analysis.
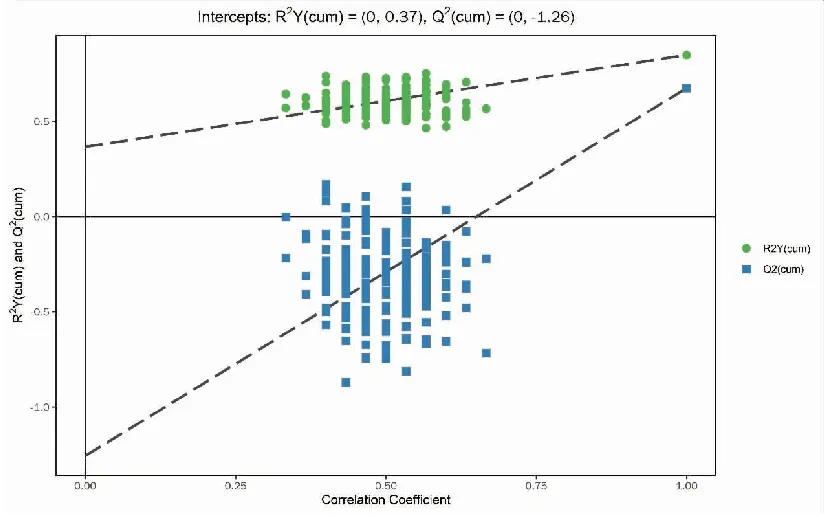
图7 正离子模式下胃癌组与浅表性胃炎组的OPLS-DA模型的置换检验结果Figure 7.Permutation Test of the OPLS-DA Model for the Gastric Cancer Group and the Superficial Gastritis Group (Positive Ion Mode)OPLS-DA:Orthogonal partial least squares discriminant analysis.
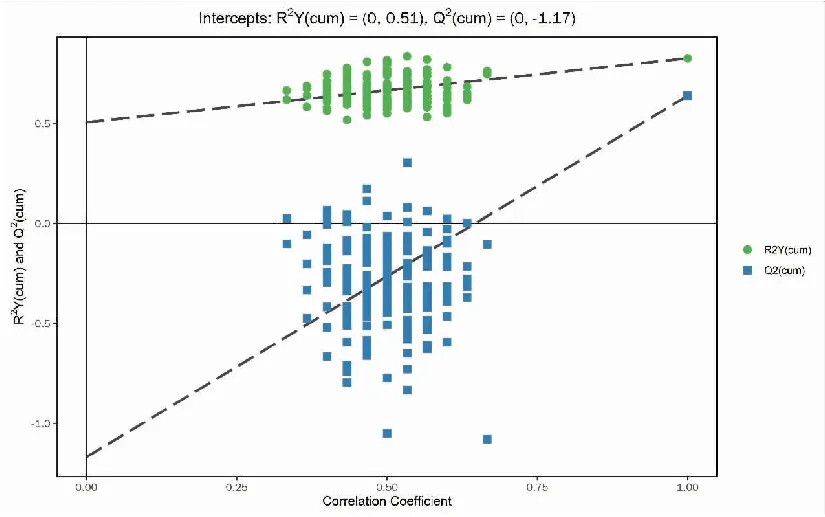
图8 负离子模式下胃癌组与浅表性胃炎组的OPLS-DA模型的置换检验结果Figure 8.Permutation Test of the OPLS-DA Model for the Gastric Cancer Group and the Superficial Gastritis Group (Negative Ion Mode)OPLS-DA:Orthogonal partial least squares discriminant analysis.
2.3 正、负离子模式下差异代谢物分析结果
卡值标准为学生t检验(Student’st-test)的P值小于0.01,同时OPLS-DA模型第一主成分的变量投影重要度VIP大于1,以VIP>1、P<0.01的变量为潜在的差异代谢物,通过在线数据库(Metlin、HMDB等)中检索精确相对分子质量以及可能的离子结合形式,经一级质谱和二级质谱确证差异化合物的结构,排除非内源性物质干扰。同时筛选倍数变化较为显著的差异代谢物,结果见表1、2。由表可知,随着浅表性胃炎向胃癌的疾病进展,正离子模式下血浆样本中白三烯、二十碳五烯酸含量显著下调,5-甲基四氢叶酸含量显著上调;负离子模式下L-半乳糖-1,4-内酯含量显著上调,n-6/n-3型多不饱和脂肪酸比例发生改变。后文根据代谢通路分析结果,结合生物学背景将所筛选代谢物代入相应的通路进行通路分析。
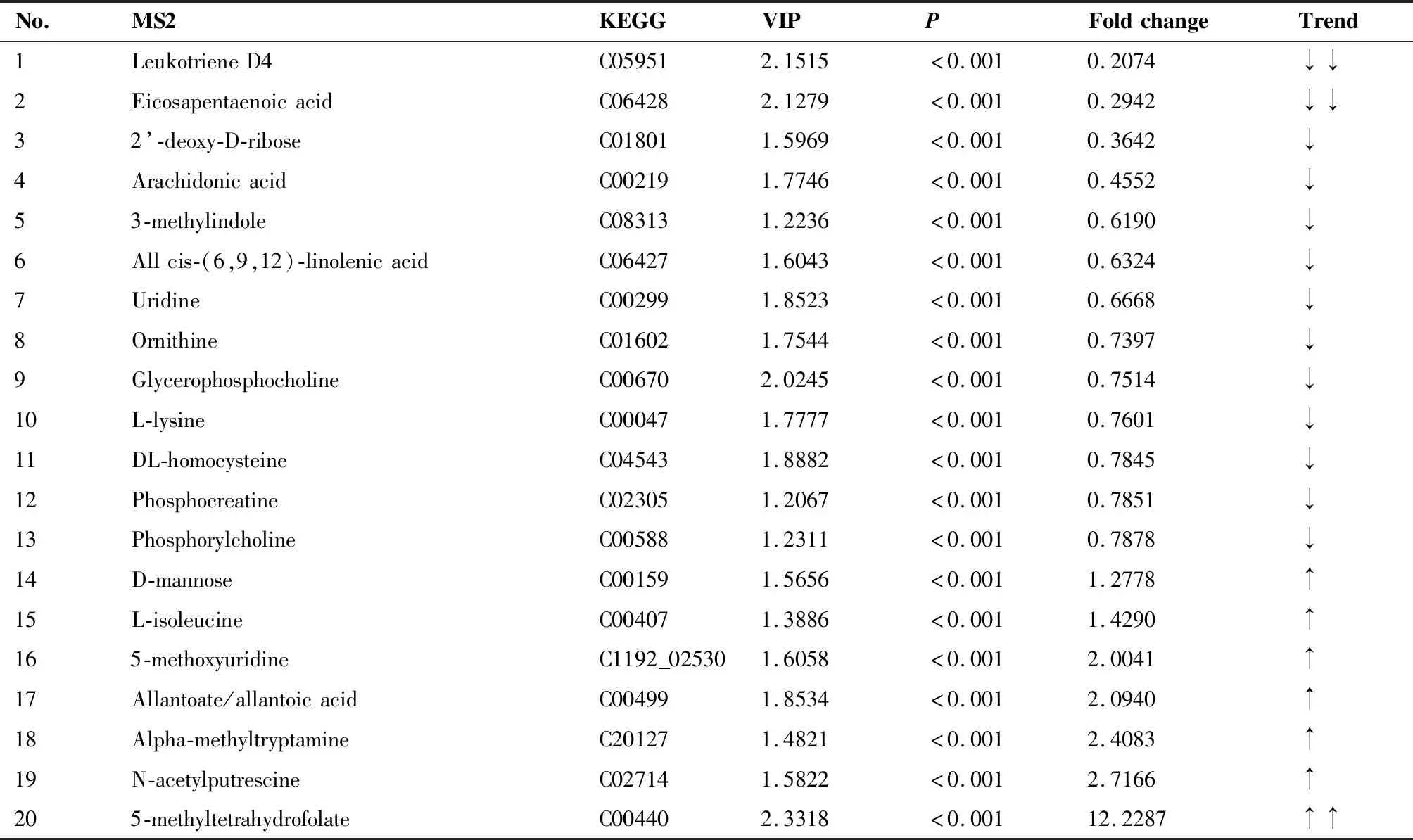
表1 正离子模式下胃癌组与浅表性胃炎组的差异代谢物Table 1. Differential Metabolites in the Gastric Cancer Group and the Superficial Gastritis Group (Positive Ion Mode)
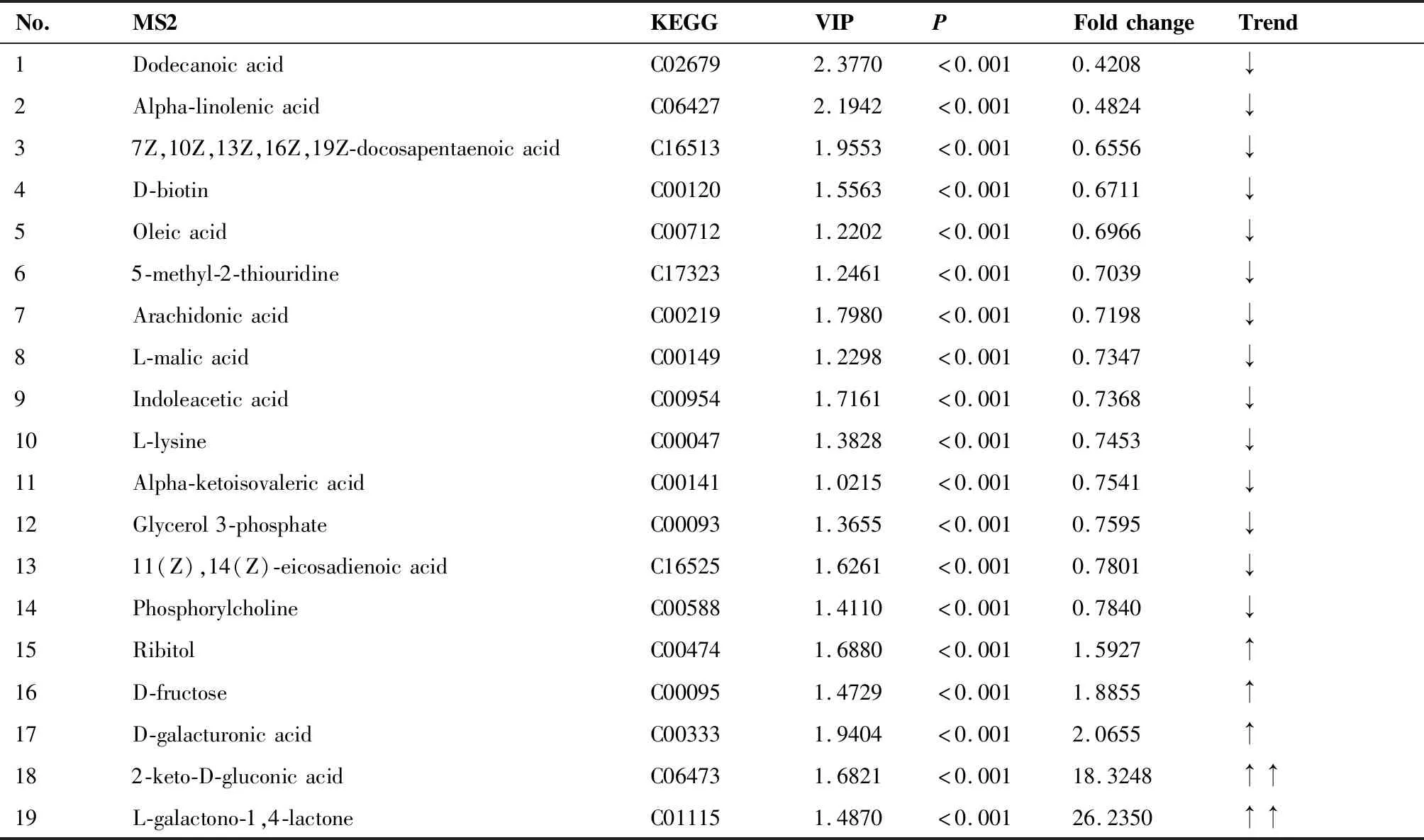
表2 负离子模式下胃癌组与浅表性胃炎组的差异代谢物Table 2. Differential metabolites in the Gastric Cancer Group and the Superficial Gastritis Group (Negative Ion Mode)
2.4 代谢通路分析
将血浆样品的差异代谢物进行代谢通路分析,分析结果以气泡图进行展示。气泡图中每一个气泡代表一个代谢通路,气泡所在横坐标和气泡大小表示该通路在拓扑分析中的影响因子大小,大小越大影响因子越大;气泡所在纵坐标和气泡颜色表示富集分析的P值[取负自然对数,即-ln(p)],颜色越深P值越小,富集程度越显著。影响因子较大或富集程度显著的代谢通路主要包括:花生四烯酸代谢、α-亚麻酸代谢、甘油磷脂代谢、精氨酸和脯氨酸的代谢、赖氨酸代谢、磷酸戊糖通路、生物素代谢、半乳糖代谢、不饱和脂肪酸生物合成等,见图9、10。
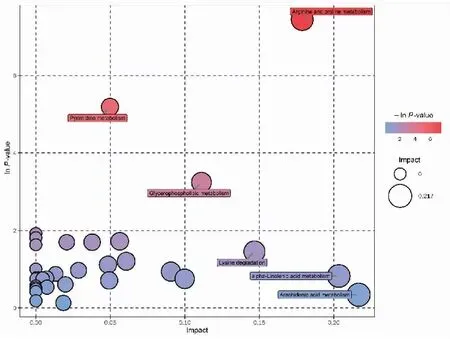
图9 正离子模式下胃癌组与浅表性胃炎组的代谢通路分析气泡图Figure 9.Metabolic Pathways in the Gastric Cancer Group and the Superficial Gastritis Group (Positive Ion Mode)
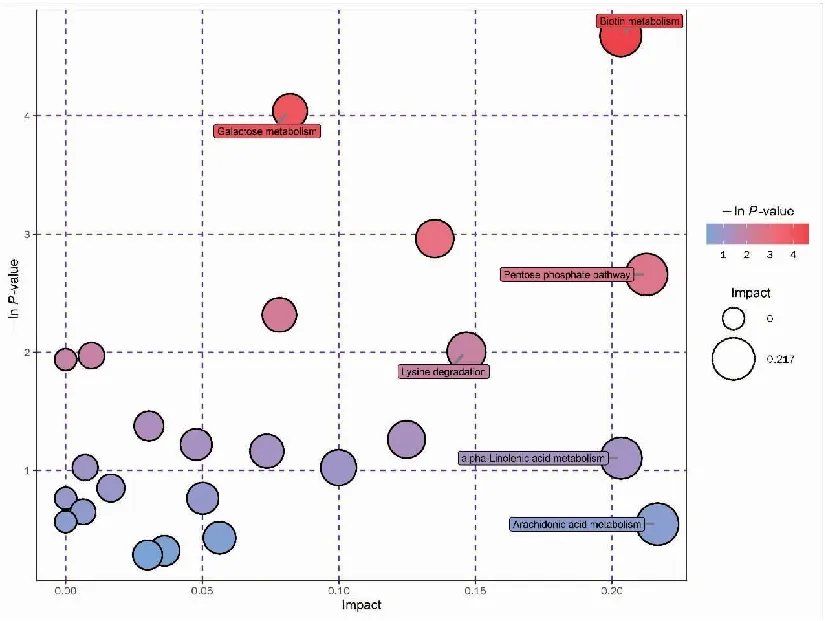
图10 负离子模式下胃癌组与浅表性胃炎组的代谢通路分析气泡图Figure 10.Metabolic Pathways in the Gastric Cancer Group and the Superficial Gastritis Group (Negative Ion Mode)
3 讨 论
本研究通过代谢组学数据结合KEGG代谢通路数据库检索发现,随着浅表性胃炎向胃癌进展,患者血浆中白三烯、花生四烯酸、二十碳五烯酸、二十二碳五烯酸、α-亚麻酸、甘油磷酰胆碱、磷酰胆碱、同型半胱氨酸、L-赖氨酸、α-酮异戊酸、亚油酸、花生四烯酸表达下调,而5-甲基四氢叶酸、半乳糖醛酸、半乳糖酸内酯、葡糖酸、尿囊酸、D-甘露糖表达上调,两组数据间差异有统计学意义。
3.1 花生四烯酸与亚麻酸代谢通路分析
长链多不饱和脂肪酸是人体必需的脂肪酸,主要包括n-3系列的二十二碳六烯酸、二十碳五烯酸(eicosapentaenoic acid,EPA)、α-亚麻酸及n-6系列的花生四烯酸(arachidonic acid,AA)、亚油酸等,很多疾病的发生都与必需脂肪酸的摄入不足或比例失调有关,亚油酸、亚麻酸也是组成细胞膜的主要成分。研究表明,n-3多不饱和脂肪酸在体内起抗炎作用,二十碳五烯酸、α-亚麻酸是人体重要的n-3脂肪酸,主要来源是鱼类及其油类产品,对心血管疾病、糖尿病、癌症、阿尔茨海默病、痴呆、抑郁等有预防作用,并对视觉和神经发育有益[5]。由它们合成的消退素和保护素是重要的抗炎活性物质,还可以干扰炎性细胞内信号传导途径来抑制炎症反应。EPA具有一定抑制肿瘤的作用,体外研究表明EPA通过细胞凋亡的方式呈剂量和时间依赖性抑制肝癌HepG 2细胞的生长增殖[6-7]。n-6多不饱和脂肪酸花生四烯酸及其代谢产物是炎症反应的重要调节因子和介质,如前列腺素、血栓素、白三烯等,介导炎性细胞间的交流和细胞内信号传递[8]。有研究发现n-6/n-3多不饱和脂肪酸的比例失调可能导致心血管疾病、肿瘤、糖尿病、自身免疫病等的发病风险提高,其饮食摄入比值一般不应高于4∶1[9-11]。n-6/n-3比例降低,乳腺癌发生率及结直肠癌患者的肿瘤细胞增殖也随之降低[12]。从本研究的差异代谢物数据(表1,2)看到,随疾病进展,正离子模式下得到的EPA与负离子模式下得到的差异代谢物AA均呈下降趋势,但EPA的变化趋势大于AA,推测随疾病向肿瘤的进展,AA/EPA升高,n-6/n-3型多不饱和脂肪酸比例的变化可能是浅表性胃炎向胃癌进展的原因。
3.2 半乳糖代谢与抗坏血酸的合成
胃癌组体内L-半乳糖-1,4-内酯显著升高,对KEGG数据库代谢通路进行上、下游通路分析后,辅因子生物合成和半乳糖代谢通路(图11)上游的相关物质浓度也显著上调,分析可能与L-半乳糖-1,4-内酯的代谢转化受阻有关。普遍认为,人体不能自身合成维生素C,只能不断从食物中获取。在植物体内,抗坏血酸主要通过L-半乳糖途径合成,L-半乳糖-1,4-内酯脱氢酶(GalLDH)又称为铁细胞色素c氧化还原酶,是一种线粒体黄素酶,是催化植物中维生素C(l-抗坏血酸)生物合成的最后一步(图12)。L-半乳糖-1,4-内酯脱氢酶(GalLDH)失活或缺乏可能导致L-抗坏血酸的生物合成减少[13-14]。
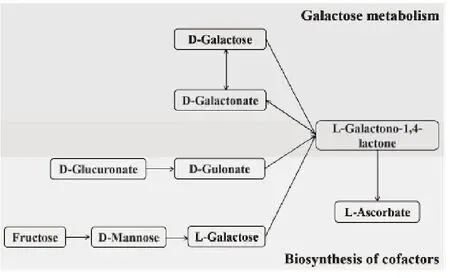
图11 抗坏血酸生物合成通路(KEGG)Figure 11. Biosynthesis Pathway of Ascorbic Acid (KEGG) KEGG:Kyoto Encyclopedia of Genes and Genomes.
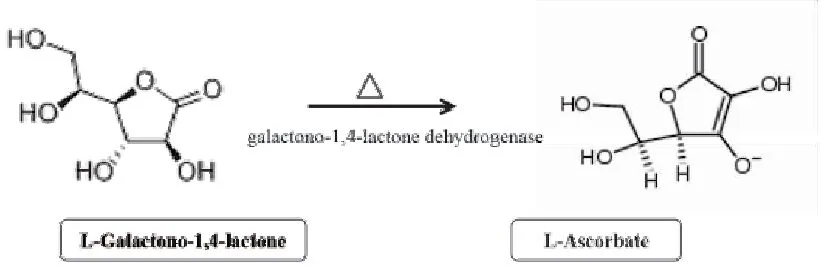
图12 L-半乳糖-1,4-内酯与抗坏血酸生物转化Figure 12.Ascorbic Acid Biosynthesis via L-Galactono-1,4-Lactone
已发表研究表明,抗坏血酸和内源性抗氧化系统可以降低患胃癌的风险[15-17]。胃癌组患者血浆中抗坏血酸水平只有健康对照组的1/5,且血浆中抗坏血酸浓度仅为胃液中的1/8,因此胃液中抗坏血酸的研究报道更为多见[18]。与浅表性胃炎者比较,胃癌、萎缩性胃炎胃液中维生素C的浓度下降。随着胃粘膜病变的加重,其浓度逐渐降低[19]。Kodama等[20]检测胃癌、慢性胃炎病人的胃液中维生素C和亚硝酸盐浓度,提示萎缩性胃炎和胃癌病人胃液中的维生素C下降,PH和亚硝酸盐水平上升。体外实验证实维生素C能通过自氧化机制产生过氧化氢促进MKN45细胞凋亡,并通过调节BCL-2基因家族表达和上调Caspase-3活性,启动线粒体细胞凋亡通路,引起肿瘤细胞生长抑制和凋亡[21]。值得一提的是,结合样本来源背景,甘肃农村地区的重要饮食习惯包括喜食腌制食物、蔬菜水果摄入不足,此为胃癌癌前病变的高危因素[22]。本文通过将软件筛选出的多个差异代谢物归入KEGG数据库进行上、下游通路分析后,发现抗坏血酸生物合成通路中的前体物质L-半乳糖-1,4-内酯在胃癌患者血浆中异常上调,提示是否抗坏血酸合成的关键步骤受阻或转化酶活性受限?有待后续实验深入研究。
3.3 其他潜在生物标志物
甘露糖、磷酰胆碱、5-甲基四氢叶酸等也在胃癌组与浅表性胃炎组间差异显著,可能为潜在的生物标志物。本课题组将进一步再针对这些人群的小分子代谢产物进行研究。
4 结 论
本研究利用代谢组学方法,基于超高效液相色谱——四极杆飞行时间质谱联用技术UHPLC-QTOFMS研究浅表性胃炎和胃癌患者血浆中代谢产物的变化,对代谢组的定性定量结果进行单变量统计分析和多元变量统计分析,在浅表性胃炎与胃癌患者的血浆中筛选出有显著差异的代谢物,结合代谢通路的分析,表明胃癌患者血浆花生四烯酸代谢、α-亚麻酸代谢、甘油磷脂代谢、精氨酸和脯氨酸的代谢、赖氨酸代谢、磷酸戊糖途径等,生物素代谢、半乳糖代谢、不饱和脂肪酸生物合成等代谢通路出现紊乱。胃癌患者血浆中二十碳五烯酸、白三烯、花生四烯酸、磷酸胆碱等内源性代谢物浓度显著下调,L-半乳糖-1,4-内酯、5-甲基四氢叶酸等浓度显著上调,可作为浅表性胃炎向胃癌进展的潜在生物标志物,为肿瘤疾病的发病机制和早期筛查提供参考。本研究同时发现,n-6/n-3型多不饱和脂肪酸比例的变化及L-半乳糖-1,4-内酯向抗坏血酸的代谢转化途径改变可能与胃癌的进展密切相关,与以往文献中报道的胃癌生物标志物存在差异[23]。结合甘肃省农村地区居民喜食腌菜、蔬菜水果摄入不足等饮食习惯,以上代谢物变化可能与生活环境、饮食特点相关联,有待在后续工作中深入研究。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

