水稻糙米率QTL检测及候选基因分析*
芦 涛, 叶涵斐, 褚晓洁, 林 晗, 王 盛,潘晨阳, 李三峰, 王跃星, 饶玉春
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.中国水稻研究所,浙江 杭州 311121)
水稻(OryzasativaL.)是世界上主要的粮食作物,加工品质作为水稻的重要品质之一,在改善水稻品质和提高水稻产量方面发挥了极为重要的作用[1].随着现代生活水平的提高,稻米品质越来越受到消费者的重视,培育出高加工品质的稻米对于农业和经济发展具有重要的作用.
水稻的糙米率受多种因素共同影响,由多个基因共同调控的数量性状,其相关分子机制复杂,并受到环境因素调控[2].目前已经有80余个水稻糙米率QTL被报道,穆平等[3]利用IRAT109/越富构建的DH群体定位到1个控制糙米率的主效QTL.刘家富等[4]以特青/云南野生稻构建了一套深入系,并定位到3个与糙米率相关的QTL,同时发现第1染色体RM449~RM3120区间内存在着1个QTL,其同时影响了水稻的糙米率和精米率.张上都等[5]通过V20B/CPSLO17构建的RILs群体在1号染色体上发现1个糙米率QTL,位于Marker641882~Marker738688,LOD值为3.267.周勇等[6]利用广陆矮4号/日本晴衍生的RILs群体定位到3个关于糙米率的QTL,其中1个位于第6染色体,2个位于第9染色体.饶玉春[7]利用DH群体检测到4个跟糙米率有关的QTL,分别在第1,8,9,10染色体上.这4个QTL当中位于第10染色体的RM271~RM304区间内的QTL位点,其LOD值高达3.95.近年来已报道许多关于水稻品质的位点:gw9.1来自于野生稻的基因组,被定位在第9号染色体上[8],而其等位基因可以增加籽粒的质量;TGW3编码1个类似糖原合酶激酶GSK3的激酶,可以负调控籽粒的长度和质量,同时也可以改变籽粒外壳当中细胞的大小和数量[9];GS2在水稻内作为转录因子发挥作用,当过量表达GS2时可以引起籽粒中细胞增大增多,进而提高产量[10].
虽然前人的研究已经发现了一部分糙米率相关QTL,但是目前并没有成功克隆出与糙米率相关的基因[11],因此,水稻糙米率具有巨大的研究价值.同时有研究表明,不同的定位群体检测到的糙米率QTL之间也具有差异,挖掘不同材料中的糙米率QTL对深入研究糙米率的遗传机制具有重要的意义.HZ具有稳产、高产、品种多等优点,Nekken是日本在20世纪90年代选育的一份粳型常规水稻品种,具有广谱亲和性与较强的亲和力,被广泛应用于亲和研究和育种利用.本研究以典型籼粳交(HZ/Nekken)构建的重组自交系群体(RILs)为材料,对水稻糙米率进行QTL定位,同时还进行了复合QTL模型分析,以期发现更多有价值的QTL位点,为培育高品质、高产的水稻品种奠定基础.
1 实验材料
本实验以Nekken为母本、HZ为父本进行杂交,以F1代通过单粒传法套袋自交,从而获得120个稳定遗传的重组自交系,组成RILs群体(见图1).
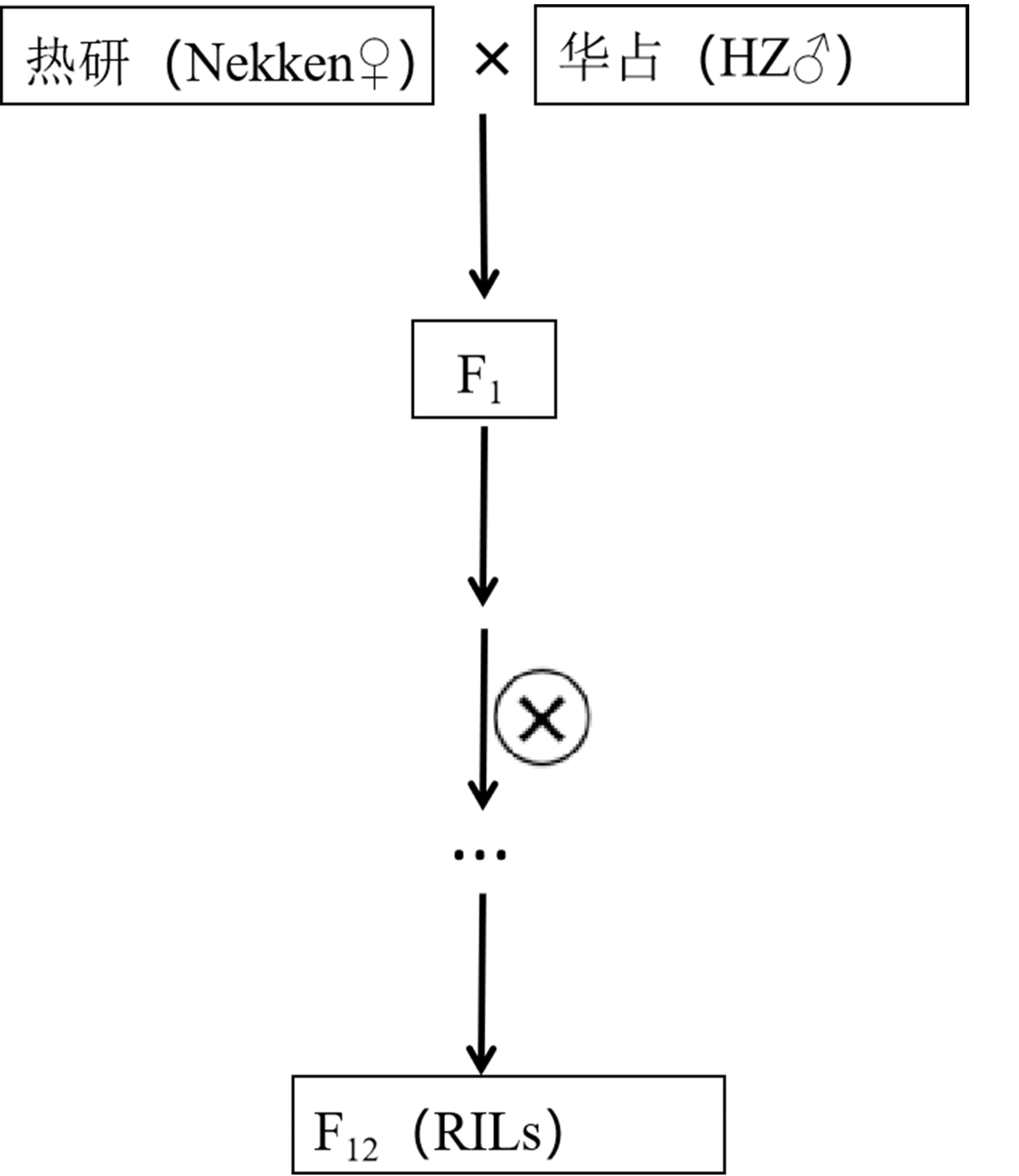
图1 亲本与RILs群体的构建原理图
2 实验方法
2.1 水稻催芽与田间管理
每个重组自交系分别取50粒种子,用70%酒精冲洗2~3次,每次2 min,再用10%次氯酸钠消毒2 min,最后用去离子水反复清洗种子10 min,洗去消毒液.随后将消毒完成的种子浸入水中2 d,2 d后用湿透的纱布包裹种子,放入37 ℃的培养箱进行催芽并保持毛巾湿润.等到种子普遍露白时,挑选长势基本相同的幼芽播种到田中.等幼芽生长1个月之后,再从每个重组自交系挑选24株生长状况相同的水稻苗进行移苗,每个株系按照4行6列移植.期间定期除草杀虫,保证水稻苗的正常生长.
2.2 糙米率数据测定
待水稻成熟后每个株系随机采收10株混合收种,脱粒后放入烘箱干燥,等到完全干燥后将种子放置储藏柜室温储藏3个月.糙米率测定方法参考《粮食、油料检验稻谷出糙率检验法》(GB/T 5495—2008)[12].每个自交系称出100 g饱满、没有病态的谷子,然后去壳,称出糙米的质量,用糙米的质量比上谷子的质量就是糙米率.
m=m1/(m2-m3)×100%.
其中:m代表糙米率(%);m1代表糙米质量(g);m2代表试样谷质量(g);m3代表脱壳谷质量(g).
2.3 遗传图谱的构建
使用CTAB法提取Nekken、HZ和120个重组自交系的DNA,对Nekken、HZ及120个重组自交系进行测序并构建测序文库,比较了从HZ和Nekken获得的RILs之间的变异位点,并用隐马尔可夫模型方法[13]确定了它们的基因型.将相同基因型的连续SNP位点集中成区块,筛选出小于100 kb的单核苷酸多态性位点.并将结果进行分类整理统计,获得4 858个分子标记,这些分子标记均匀分布在水稻的12条染色体上,构建出覆盖范围广并且密度较高的遗传图谱.
2.4 QTL定位
在实验室前期已构建的高密度SNP分子标记连锁图谱基础上,采用区间作图法,用Mapmaker/QTL1.1B软件对糙米率进行QTL定位分析,将LOD设置为2作为阈值来判断QTL存在.
2.5 糙米率相关基因表达及分析
使用总RNA提取试剂盒(RNA simple total RNA kit)提取Nekken和HZ灌浆期叶片的RNA,按照反转录试剂盒使用说明将Nekken和HZ的总RNA反转成cDNA.根据QTL的定位结果,在水稻基因组注释数据库(http://rice.plantbiology.msu.edu/)查找相关区间内可能与糙米率有关的基因,利用实时荧光定量PCR对Nekken和HZ的候选基因进行表达差异分析,引物序列见表1.定量结果采用2-△△CT方法[14]进行分析.用Excel和SPSS 21.0等软件对数据进行显著性差异分析,实验数据间的显著性差异使用T检验进行比较.P<0.05代表具有显著性差异.根据候选基因Nekken和HZ表达量差异情况,选取表达量具有显著性差异的基因利用高保真DNA聚合酶KOD-Plus-Ve.2扩增并进行测序.

表1 实时荧光定量PCR的引物序列
3 结果分析
3.1 双亲和群体的表现
对双亲及重组自交系的糙米率进行检测,发现Nekken的糙米率为84%,而HZ的糙米率为76%,Nekken的糙米率相对于HZ的糙米率要高出约8%.RILs群体的糙米率数据呈现出连续的正态分布,范围较广泛,并且存在超亲个体(见图2),符合QTL区间作图的需求.

图2 水稻重组自交系中糙米率的分布情况
3.2 QTL定位
利用该重组自交系事先构建的连锁遗传图谱进行QTL定位分析,该图谱包括4 858个标记的水稻分子标记,而且各标记均匀分布于全部水稻染色体上,完全适用于QTL区间作图的需求.本研究共检测到4个水稻糙米率相关QTL,分别位于第5,8,10,12染色体上(见表2和图3).LOD值最大的QTL位于第8染色体上遗传距离为0.48~3.69 cM的区间内,LOD值为2.78.

表2 水稻糙米率的QTL分析
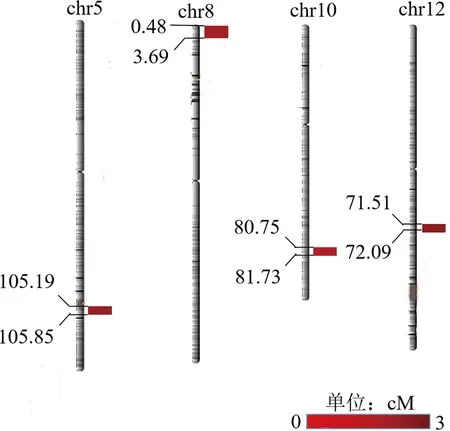
图3 水稻重组自交系糙米率的QTL定位
3.3 候选基因分析
通过对上述QTL所在区间进行候选基因分析,查阅水稻籽粒长宽比、厚度、品质相关文献,找出可能与糙米率相关的基因(见表3),并对这些基因的功能和注释信息进行了初步总结与归纳.通过qRT-PCR分析发现,LOC_Os10g35440,LOC_Os08g01450,LOC_Os05g42210在HZ和Nekken当中均有显著性差异(见图4).

表3 QTL定位区间候选基因及功能注释

图4 双亲中候选基因的表达情况
LOC_Os05g42210在Nekken当中表达量要显著高于HZ,而LOC_Os10g35440在Nekken当中表达量显著低于HZ,同时发现LOC_Os08g01450在双亲中表达量存在极显著的差异,而且该基因也位于效应最大的QTL位点内.因此,对HZ和Nekken当中LOC_Os08g01450进行测序,发现共有7处差异,且7处均为单碱基差异,分别位于第273位(HZ为G,Nekken为A),第1 042处(HZ为G,Nekken为A),第1 185处(HZ为G,Nekken为A),第1 260处(HZ为A,Nekken为G),第1 289处(HZ为T,Nekken为C),第1 411处(HZ为G,Nekken为A),第1 452位(HZ为T,Nekken为C)(见图5),其中第1处、第2处和第7处的单碱基差异没有引起氨基酸的改变,第3处、第4处、第5处和第6处的单碱基差异引起氨基酸改变,分别位于第348位(HZ为缬氨酸,Nekken为异亮氨酸),第420位(HZ为异亮氨酸,Nekken为甲硫氨酸),第430位(HZ为缬氨酸,Nekken为丙氨酸),第470位(HZ为天冬氨酸,Nekken为天冬酰胺).由此推测,HZ与Nekken间的糙米率差异有可能是由于基因LOC_Os08g01450编码的氨基酸序列的差异而造成的.

a:LOC_Os08g42750位点分析;b:位点1;c:位点2;d:位点3;e:位点4;f:位点5;g:位点6;h:位点7
4 讨 论
目前有关于水稻糙米率的研究仍处在起步阶段,本研究利用HZ/Nekken构建的RILs群体定位到4个糙米率QTL,并通过对区间内基因的分析筛选出3个候选基因,分别编码丝氨酸/苏氨酸蛋白激酶受体前体、细胞色素P450、含有五肽重复序列的蛋白质.
目前已有的研究表明,水稻糙米率受到不同基因的共同调控,LOC_Os05g42210编码1个表达丝氨酸/苏氨酸蛋白激酶受体的前体,该前体通过调控细胞周期蛋白控制水稻籽粒大小和产量,其表达量的下降可能会引起籽粒变短[18].LOC_Os08g01450编码1种酶,属于细胞色素P450家族[19].LOC_Os08g01450基因的突变可能会引起种子中糖分的积累及籽粒产量的提高,对粒长粒宽也会有一定的影响.LOC_Os10g35440编码1个三角状五肽重复蛋白[20],该蛋白在调控线粒体功能和水稻胚乳发育中发挥重要作用,其突变导致线粒体呼吸电子传递链中复合物I的组装减少,线粒体超微结构异常,同时ATP合成受阻,引起水稻营养期和生殖期生长明显减慢,成熟时米粒小且不透明,灌浆速率显著降低,千粒质量约降低36%,直链淀粉含量降低,胚乳中淀粉颗粒变小,且糊粉层细胞结构异常.
近几年,研究者通过构建不同的遗传群体对糙米率进行QTL定位并进行分析.梅德勇等[21]利用特青/IRBB的RILs群体在第6染色体短臂、第2染色体长臂、第7染色体长臂、第8染色体长臂和第10染色体长臂等共检测到8个糙米率的QTL位点,同时在第10染色体RM6100~RM3773检测到的QTL与本研究发现的qBR-3具有部分重合,而Ren等[22]利用TN1/CJ06的DH群体在第10染色体上RM258~RM1108区间内发现LOD值高达5.95的位点也与本位点非常接近,说明该位点很可能是一个稳定控制水稻糙米率的QTL位点.胡霞等[23]在第5染色体上RM161~RM3474区间发现的糙米率QTL也与本研究发现的qBR-1位点比较接近但并没有重叠,这可能是由于不同群体定位的糙米率QTL在遗传距离上存在一定的偏差,同时也说明在此附近可能存在与糙米率相关的QTL位点.除了这2个位点外,本次研究还发现了2个新的糙米率QTL位点,分别位于第8染色体RM22196~RM22277和第12染色体RM28127~RM28132的区间内.
水稻是世界重要的粮食产物之一,随着耕地面积的减少,培养出优质高产的水稻成为现在研究者的目标之一.加工品质是水稻的一个重要品质,改进水稻加工品质可以提高水稻产量,有效缓解粮食危机,保障我国的粮食安全.但是水稻加工品质的遗传是一个极其复杂的过程,不同研究方式得到的结果往往各不相同,甚至不同群体得到的结果也会有所不同.随着分子生物学的发展,分子标记育种已经逐渐应用到水稻育种的研究中,借助分子标记研究水稻加工品质将是未来研究方向之一.水稻糙米率是由多基因控制的数量性状,本研究利用HZ/Nekken构建的RILs群体得到的4个水稻糙米率QTL,为选育高糙米率的水稻品种提供一定的基础.但是QTL定位容易受到群体和材料的影响,因此,需要开展更多关于糙米率QTL的研究,进一步挖掘水稻糙米率QTL位点,寻找其中的主效基因,以加快高品质水稻的育种.

