海洋浮游植物和藻际细菌的相互作用关系及其在海洋生态系统中的重要作用
王 慧 ,蔡润林 ,甘永亮 ,陈悦蓉 ,李灵钰 ,杨小雨 ,谢建民
(1.汕头大学理学院生物系,广东 汕头 515063;2.南方海洋科学与工程广东省实验室(广州),广东 广州 511458;3.广东省海洋生物技术重点实验室,广东 汕头 515063)
海洋中的浮游植物(Phytoplankton)是水生环境中无可争辩的主要生产者,其生物量仅占全球植物的1%-2%,却贡献了全球约50%的初级生产力,与陆地植物的固碳量相当[1-2].海洋环境中的浮游植物通常包括真核的微型藻类(Microalgae)和原核的蓝细菌(Cyanobacteria).后者虽然通常被称为“蓝藻”,但其在分类学上属于原核生物中的自养细菌,在此不做论述.本文将重点关注真核生物域(Domain)的浮游微藻及原核生物域的异养细菌两种微型生物之间“跨域”的相互作用关系及其对海洋生态系统的影响.异养细菌(Heterotrophic bacteria)生物量巨大,在海洋真光层中,其生物量能够到达总生物量的四分之一[3],而异养细菌具备强大的分解能力,使其成为地球上物质循环的最重要的驱动者.浮游微藻和细菌是海洋环境“微食物环(microbial loop)”的关键组分,二者之间存在紧密的相互作用关系,这种藻菌关系在介导碳、氮、硫、磷等物质的生物地球化学循环方面发挥重要的作用.浮游植物产生的海洋初级生产力只有一部分经过经典食物链进入高营养级,大多经过浮游细菌(Bacterioplankton)参与的微食物环向上一营养级传递,据估算,浮游细菌通过微食物环使海洋中一半以上的净初级生产力再生[4].可见,浮游植物和浮游细菌是组成水生生物圈的两类最重要的生物元素,两者之间的相互作用,以及这种相互作用对二者和全球生态系统的影响已经成为近年来的研究热点[5-6].
1 硅藻和甲藻是海洋环境中重要的浮游植物
浮游植物通过光合作用将大气中的二氧化碳转化为有机化合物被海洋生物所利用,是海洋中重要的“碳库”[7],具有重要的大气和海洋环境碳循环调节功能[8-9].海洋环境中主要的浮游植物类群主要包括硅藻、甲藻、球石藻、蓝藻、绿藻和金藻,其中,硅藻、甲藻和球石藻是海洋环境中分布最广泛和生物量最多的真核种类.
硅藻(Diatoms)作为水域和陆地生态系统中最为丰富的藻类之一,有大约200 000个不同种,大小从几微米到几毫米不等,以单细胞或细胞链的形式存在[10].硅藻在全球海洋中广泛存在[11].硅藻是构成海洋食物网的基础,其通过光合作用产生的有机碳等同于全球热带雨林产有机碳的总和,约占海洋初级生产力的40%或全球初级生产力的16%[10,12].硅藻还参与海洋硅、铁和氮等物质的生物地球化学循环[10].硅藻具有硅质外壳,在硅藻衰亡时,硅质壁的重力会使它们迅速下沉,并携带着有机碳进入深海,硅藻的生命活动及硅质遗骸的归趋形成了硅-碳循环的偶联[13].因此,硅藻在驱动生物泵和促进碳、硅元素循环方面发挥着重要作用.
甲藻(Dinoflagellates)是海洋环境中另外一类重要的浮游微藻,其多样性仅次于硅藻,是海洋环境中第二大真核生物种群,占据着海洋环境的重要生态位[14].甲藻的代谢类型包括光合自养型、混合营养型和异养型三种,其中约一半的种类为光合自养型和混合营养型,这些甲藻能够进行光合作用,是海洋环境中重要的初级生产者[15].甲藻还能够参与形成珊瑚礁生态系统.甲藻(虫黄藻)—珊瑚共生体形成的珊瑚礁被誉为“海底热带雨林”,是调节海洋生态系统平衡与稳定最为基础和活跃的一部分,参与介导海洋环境中氮、硫等物质循环[16].沿岸富营养区甲藻的大量增殖,还会引起甲藻藻华,对近岸水生生态系统和生物资源造成破坏[17].有研究表明,由于甲藻更能适应全球变暖和富营养化双重压力所带来的影响,未来中国东海约70%的区域甲藻生物量将明显升高,变化最大的近岸区域,其生物量将升高60%[18].可见,甲藻在未来海洋环境中的重要生态地位将更加凸显,其对全球初级生产力的贡献也会更高.
球石藻(Coccolithophore)是一类海洋微藻,属定鞭藻门(Haptophyte)[19],其生活史特定阶段可形成碳酸钙质地的球石粒(coccolith)[20],因此而得名.球石藻是现今海洋中第三大浮游植物类群,大约有300多个不同的种类[21],最早的化石记录可以追溯到2.2亿年前的晚三叠纪,其化石材料完整地记录了该类群的形态多样性[22].赫氏球石藻(Emiliania huxleyi)作为球石藻中最受关注并被广泛研究的一种,其在全球海洋广泛分布.在赫氏球石藻发生藻华时,因脱落的大量球石粒在海面上自由漂浮,使得水面非常明亮,像一面面反射阳光的镜子,这种现象也称为“白水”[23].赫氏球石藻能够同时通过光合作用和生物矿化固定无机碳,显著影响表层海洋碳酸盐的生物地球化学循环,并将大量的碳转移到深水沉积物中[24].此外,赫氏球石藻能产生大量的具有挥发的二甲基硫醚(dimethyl sulfide),从而影响海洋云层的形成、气候调节[25-27]以及全球硫循环[28-29].
2 藻际环境—浮游植物与细菌发生紧密相互作用的微环境
藻际微环境(Phycosphere)这一概念是根际环境(Rhizosphere)的一个类比,用于描述浮游植物和细菌发生相互作用的微环境,两者有着惊人的相似之处.与植物根际类似,浮游植物会向其细胞周围海水释放由自身合成的化合物,为浮游植物和异养细菌之间的物质交流提供了一个关键界面,这种浮游植物-细菌相互作用的微环境称为藻际环境[30-31](图1).藻际环境的大小主要由浮游植物细胞的大小决定,一般认为,浮游植物细胞半径的100倍的区域可以认为是藻际环境;同时,藻际环境的大小还取决于浮游植物的生长速率、物质的渗出速率、渗出物的扩散率、以及渗出物的本底浓度[6].研究证实,在藻际环境中积累的营养物质的浓度显著超过周边海水[32],而且不同浮游植物来源的藻际环境中物质浓度和组成存在差异,于是在表层海水中就由藻际环境形成了一系列生态位(ecological niche)供细菌选择,每种生态位会有利于某些特定的细菌大量繁殖,而这些细菌会在相应的藻际环境中占据优势地位[33].在藻际环境中生活的细菌被称为藻际细菌,一些营自养生活的蓝细菌也能生活在真核藻类产生的藻际环境中,通过为宿主藻固定氮源物质形成共生关系.而这些自养蓝细菌同时又被认定为浮游植物,所以本文中对这一类细菌不做讨论,我们重点关注藻际环境中的异养细菌.
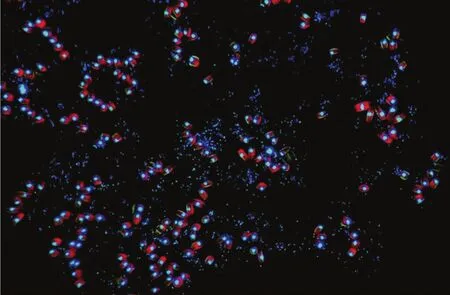
图1 荧光显微镜下浮游微藻Neodelphineis sp.PT41与其藻际细菌的紧密共生.红色为浮游微藻在紫外下的自发荧光,绿色为藻和藻际细菌DNA经4',6-diamidino-2-phenylindole(DAPI)染色后的荧光.
浮游植物和藻际细菌的种类丰富多样,它们之间存在着复杂的相互作用关系.互利共生是藻际环境中常见的相互作用关系.藻际细菌可以通过改善藻际微环境(消除过量的O2并产生CO2)以及释放无机盐、维生素、微量元素、促生长因子等物质促进微藻的生长[31].细菌在为微藻提供这些物质的同时也会获得微藻分泌的各种有机物作为回报[34-36],这些有机物包括氨基酸、参与地球硫循环的二甲基巯基丙酸内盐(dimethylsulfoniopropionate,DMSP)[37]和脂肪酸等小分子化合物,以及包括多糖[38]在内的结构复杂的大分子化合物.近年来,有研究通过稳定同位素示踪实验证明藻际细菌对微藻的促进作用[39].然而,有些藻际细菌几乎不利用微藻释放的有机物,但能促进微藻的生长,这种行为被称为偏利共生(commensalism).例如,百脉根中间根瘤菌(Mesorhizobium loti)不利用莱茵衣藻(Cylindrotheca reinhardtii)产生的碳源,而莱茵衣藻却能够利用细菌所产生的维生素B12[34].
藻际环境中,浮游植物还会与其它一些细菌存在抑制或竞争的关系.一方面,微藻能够产生化合物对自身藻际环境中的细菌进行选择[40],如一些硅藻会分泌具有抑菌作用的二十碳五烯酸(eicosapentaenoic acid,EPA),选择性抑制藻际环境中的细菌;还有很多硅藻会分泌迷迭香酸(rosmarinic acid)、杜鹃花酸(azelaic acid,又叫壬二酸)等物质,可以促进某些玫瑰杆菌类群细菌的增长,并抑制其它种类机会主义细菌的生长[41].另一方面,海洋细菌能够抑制浮游微藻的生长,甚至杀死藻细胞;海洋细菌也可以通过与微藻竞争营养物质来限制微藻的生长[31].例如,在磷限制条件下,海洋细菌凭借更高效的磷吸收能力与微藻竞争环境中的无机磷,从而使得微藻的生长受到限制[42].
细菌还可以通过絮凝的方式作用于浮游植物.“海洋雪(marine snow)”是海洋环境中有机物质凝聚成团沉降的现象.浮游植物是海洋雪的重要组成部分,尤其是在藻华期间,高浓度的藻细胞能够加速凝团的形成和沉降速率.最近的研究发现,藻际的附生细菌在浮游植物沉降过程中起着非常重要的作用,而游离细菌则对其沉降过程影响不大,这说明细菌和藻类细胞之间的接触是这些藻细胞沉降所必须的条件[43-44].笔者前期研究发现,分离自二叠纪地下海水中的Permianibacter aggregans HW001T菌株能够沉降微拟球藻Nannochloropsis oceanica IMET1,但不影响藻细胞的生长[45].进一步,对其沉降藻细胞的过程和机理研究,发现了菌株HW001T通过直接接触的方式凝集藻细胞,使90%以上的藻细胞沉降;基于此,我们提出“凝集”是与“促进”和“抑制”同等重要的细菌对于微藻的三大作用之一.
3 藻际环境中重要的细菌类群
浮游植物形成的藻际环境中存在着一些稳定的细菌类群,这些细菌被称为藻际环境的核心菌群[46-49].基于16S rRNA基因扩增子的群落结构分析,有研究发现藻际环境中最常见的细菌是黄杆菌纲(Flavobacteriia)、α-变形菌纲(α-proteobacteria,如红杆菌科Rhodobacteraceae)以及 γ-变形菌纲(γ-proteobacteria,如交替单胞菌科Alteromonadaceae)的成员,这三类细菌被称为藻际环境中的“三大菌群”[50].但由于浮游植物的种类和及其形成的藻际环境之间存在着显著差异,其藻际细菌的组成也不尽相同.相较于在纲水平的相对稳定的群落组成,在更精细的分类级别(如科或属水平)上,不同藻际环境中细菌群落的组成存在一定差异.Guannel等人对两个同属不同种的拟菱形藻Pseudo-nitzschia multiseries和Pseudo-nitzschia delicatissima藻际细菌的16S rRNA基因扩增子分析发现,两种硅藻藻际环境中的细菌类群在纲水平与“三大菌群”相一致,但是在属水平稍有不同.其中,在多列拟菱形藻P.multiseries藻际环境中的γ-变形菌纲成员主要是海神单胞菌属Neptunomonas,而在柔弱拟菱形藻P.delicatissima藻际环境中却是以交替单胞菌属Alteromonas为主[48].Teeling等人在以硅藻为主的水华前期和后期的细菌群落监测数据中发现,α-变形菌纲的玫瑰杆菌属(Roseobacter)、黄杆菌纲的极地杆菌属(Polaribacter)以及γ-变形菌纲的Reinekea这三个属的细菌在数量上存在较大的波动,但相对于其它种类细菌始终处于主导地位[33].藻际环境中物质组成的差异可以影响藻际细菌的物种多样性,塑造藻际细菌的群落结构.
目前对藻际环境中细菌类群的探究多集中在不同时期的水华样本或是少数几种微藻细胞的实验室培养体系,对藻际环境中重要细菌类群的定义也停留在纲水平阶段.为了探究在更精细的水平上是否存在相对固定的细菌类群,笔者团队通过对约10.7 Gbp藻际细菌16S rRNA基因测序数据的深度分析,研究了分离自全球海洋不同海域的110株硅藻(28个属)和86株甲藻(26个属)的藻际细菌组成.结果发现:在纲水平上,α-变形菌纲、黄杆菌纲和γ-变形菌纲细菌为主要菌群,这与传统藻际“三大菌群”的观点一致;在科水平上,玫瑰杆菌科和黄杆菌科细菌占绝对主导地位,交替单胞菌科、海洋螺菌科(Oceanospirillaceae)以及Crocinitomicaceae的细菌位居其后;在属水平,玫瑰杆菌科中的Marivita和γ-变形菌纲中的Marinobacter两个属的细菌在196株微藻样本中的分布频率及相对丰度处于优势地位,可以被认为是藻际环境的核心细菌.数据还显示,硅藻和甲藻的藻际环境中又有其各自独特的菌群,其中,海洋螺菌科中的Neptuniibacter和黄杆菌科中的Polaribacter是硅藻藻际的优势细菌属,而α-变形菌纲中的Roseibium、β-变形菌纲中的Limnobacter、拟杆菌门中的Balneola是甲藻藻际的优势细菌属.这一最新研究结果,明晰了藻际细菌更精细分类级别的群落组成,确定了藻际的核心菌群,为后续的藻菌相互作用关系研究奠定了基础.
4 藻际环境中藻菌之间的物质交流
在藻际环境中,浮游植物和细菌发生着紧密的相互关系,如前所述的共生、寄生、竞争、絮凝沉降等.物质的交换,包括营养物质、信号物质、遗传物质,是这些相互作用发生的重要“桥梁”.
4.1 营养物质交换
浮游植物可以为细菌提供营养物质,包括碳水化合物(淀粉、纤维素等)、含硫有机物(DMSP、二羟基丙磺酸盐(DHPS)等)和含氮物质(牛磺酸、色氨基酸等),以供细菌利用并促进其生长;而细菌则为藻类提供微量元素、激素及螯合剂等,以促进藻类的生长.有研究表明,硅藻为亚硫酸杆菌(Sulfitobacter)提供了含硫有机化合物——牛磺酸和DMSP,以作为对细菌所产生的铵盐的交换[6].硅藻还分泌氨基酸——色氨酸,色氨酸被细菌转化为生长素——吲哚乙酸(IAA),然后从细菌中转移回硅藻,促进细胞分裂,增加碳产量.这种互利互惠的相互交换关系在海洋中随处可见[51-52].
维生素B12是合成甲硫氨酸的重要组分,是微藻生长中的必不可少的微量元素,但是大部分的微藻不能自己合成,因此需要依靠外源的维生素B12来提供自身生长[53].许多细菌能合成维生素B12并提供给微藻,以维持藻类生长.例如,玫瑰杆菌R.pomeroyi产生维生素B12,以换取硅藻T.pseudonana分泌的糖类衍生物、有机氮化合物以及有机硫化合物——DHPS,由于DHPS的分解代谢仅限于几种有限的海洋细菌类群,因此它的分泌表明硅藻对特定的细菌有优先选择.铁(Fe)是大多数微藻进行细胞呼吸、光合作用及硝酸盐利用等过程所需的重要微量元素,但是由于铁在海洋环境中的溶解度极低,使铁成为浮游植物生长的限制因子[54].许多海洋细菌,包括海杆菌属(Marinobacter),可通过分泌一些对铁极具亲和力的小有机分子——铁载体,来减轻铁的限制[55].
4.2 信号物质的交流
信号物质在细菌的群体感应、趋化性等过程中起到重要作用,浮游植物和藻际细菌能够通过信号响应来影响彼此的生长[6].赫氏球石藻Emiliania huxleyi与玫瑰杆菌类群细菌Phaeobacter inhibins存在共生关系,由藻类分泌的二甲基巯基丙酸和氨基酸等物质被玫瑰杆菌利用[56],并生成促进或保护藻类生长的物质,如维生素、生长激素和TDA抗生素等[57-58].但当藻细胞进入衰老期后,会释放苯丙烷类化合物,如香豆酸或芥子酸,Phaeobacter inhibins能够识别这些信号物质,产生溶藻活性天然产物,包括roseobacticides和roseochelin等,杀灭藻细胞[59].然而,小球藻Chlorella pyrenoidosa能产生一种特异结合群体感应系统蛋白的小分子——叶黄素(lutein),从而抑制细菌形成生物膜[60].
一些细菌在生长的过程中向环境释放自诱导物质(auto inducers,AIs)作为信号分子,如N-酰基-高丝氨酸内酯(AHLs)、寡肽(AIPs)、呋喃酮类化合物等来调控其luxR操纵子表达,从而使细菌完成群体行为以协调细菌与宿主或者环境的关系[61-63].藻际细菌分泌的吲哚-3-乙酸作为信号物质能够通过调控宿主藻的基因表达影响藻细胞的生理生化活动:第一,吲哚-3-乙酸可以上调藻细胞光合作用中三个关键基因的表达(psbB、LHCA4和LHCF4),从而提高藻的生物量;第二,吲哚-3-乙酸也能增加藻细胞细胞周期相关蛋白的表达(如:Cyclin 2和Cyclin 8),从而促进藻的分裂;第三,吲哚-3-乙酸还能促进藻细胞cdo基因(编码半胱氨酸双加氧酶)的表达,从而上调藻细胞牛磺酸合成途径[64].藻际玫瑰杆菌类群细菌可以产生植物激素吲哚-3-乙酸并促进藻细胞分裂及二者共生,但是高浓度的吲哚-3-乙酸也会加速藻细胞衰老和死亡[51,65].
4.3 基因交流及协同进化
藻际细菌之间、微藻和藻际细菌之间以及藻际环境和外界环境之间还存在着频繁的基因交流.这些基因交流以及经过藻际环境的选择压力而保留下来的自发突变共同赋予了微藻和藻际细菌新的适应性表型,从而推动了藻际细菌之间、微藻和藻际细菌之间的协同进化.
一方面,微藻和细菌在长期的共生过程中,通过协同进化,共同适应环境变化.藻类和细菌从进化的早期阶段就已经共存了.大量文献表明蓝细菌、藻类、异养细菌和原生生物之间的相互作用均存在内共生现象[66-70].在藻菌共生系统中存在系统发育的一致性,具有协同进化的趋势.硅藻布氏双尾藻(Ditylum brightwellii)基因组有部分来源于细菌的基因,如有机碳和氮利用(木聚糖酶、葡聚糖酶、酰胺水解酶等)相关基因、尿素循环(氨基甲酰转移酶、氨基甲酸激酶、鸟氨酸环化脱氨酶)相关基因以及与细胞壁硅化相关的多胺代谢(脱羧酶、甲基转移酶)相关基因,这些基因编码的产物为硅藻提供新的物质代谢的能力,证明了两者之间在共生过程中存在着基因的交流[71].随后的研究也发现,甲藻和硅藻中存在广泛的水平基因转移、复制和演替,如藻类从细菌基因中获得参与光合作用相关的捕光蛋白和光敏色素基因[72],一些微藻也会丢失维生素B12合成相关基因,而通过藻际细菌获得维生素B12供生长所需[53].为了定植于某些特定的藻际环境,一些藻际细菌可以从外界获得抵御某种环境压力的功能基因.研究发现玫瑰杆菌类群的一个进化支从外界获得了抗氧化压力相关的基因,使得它们可以定植于活性氧(reactive oxygen species,ROS)水平高同时营养物质浓度高的藻际环境[73],相反,Feng等人发现玫瑰杆菌类群的某些细菌可以精简掉自身基因组上与浮游植物共生相关的基因,如浮游植物衍生的代谢物利用、维生素B12合成相关基因,从而脱离藻际环境[74].
另一方面,藻际特殊的环境也驱动着藻际细菌的进化.不同浮游植物分泌的营养物质不同,其产生的藻际环境也不同,这些不同的藻际环境就会驱动藻际细菌的分化.Luo等人在探索玫瑰杆菌类群的进化历程时还发现,玫瑰杆菌类群细菌的第一次基因组扩展事件与2.5亿年前海洋甲藻和球石藻的物种辐射(species radiation)时间是一致的[75],这可能是因为藻类的物种扩张产生了一系列营养丰富的藻际微环境,为玫瑰杆菌的祖先提供了大量新的生态栖息地.笔者团队近期的研究发现同一生境中不同硅藻(不同种、同种不同株)的藻际环境中的玫瑰杆菌类群细菌发生了不同程度的分化,其中有两个宿主藻不同的进化支,它们的16S rRNA基因序列相似度大于99%,而平均核苷酸一致性(Average Nucleotide identity,ANI)只有94.16%,在全基因组水平来说,已经可以界定这两个进化枝为不同物种.这说明不同藻际环境是一个影响藻际玫瑰杆菌类群细菌之间基因流动的有效屏障,驱动了不同藻际细菌的分化[76].
5 藻际环境中藻菌协同驱动的生态过程
浮游植物和异养细菌是海洋微食物环的重要组成部分,尽管藻菌关系发生在微尺度的藻际环境,但两者的相互作用关系协同驱动着全球生物地球化学循环,影响着全球气候变化,并对近岸生态环境产生影响.
5.1 碳、氮、磷等生源物质的生物地球化学循环
浮游植物和藻际细菌经由有机碳的产生和利用建立的共生关系在介导“微食物环”、“微型生物碳泵”的碳循环过程中起着关键作用,能够影响碳在海洋环境微界面中转化的速率(图2).浮游植物作为海洋生态系统中最主要的初级生产者,通过光合作用固定CO2并释放大量有机碳,包括颗粒有机碳(particle organic carbon,POC)和可溶性有机碳(dissolved organic carbon,DOC).藻际细菌能够高效利用宿主藻产生的有机碳,并最终决定有机碳的归宿.有机碳被藻际细菌分解吸收后,一部分经呼吸作用产生CO2及无机盐,其它被细菌固定至自身转化为细菌生物量.以CO2及无机盐形式储存的碳可被浮游微藻再次利用,形成紧密联系的微食物环.对于转化为自身生物量的碳,一部分被原生动物等捕食,进入高一级生物链;另一部分以惰性可溶性有机碳(refractory dissolved organic carbon,RDOC)形式存在,可在海洋中储存数千年,构成微型生物碳泵(microbial carbon pump,MCP)的重要环节.藻际环境中不同种类细菌对于复杂组成的DOC的利用具有底物偏好性,如藻际黄杆菌主要摄取和降解复杂多糖等高分子量的有机碳;交替单胞菌类群细菌可降解利用复杂程度较低的多糖或单糖类型有机碳;而玫瑰杆菌类群细菌则对简单氨基酸及单糖表现出较高的利用能力[77],这种有机碳的资源分配大大提高了海洋微食物网中的物质交流和能量流动效率,对碳循环具有一定正反馈作用[78].
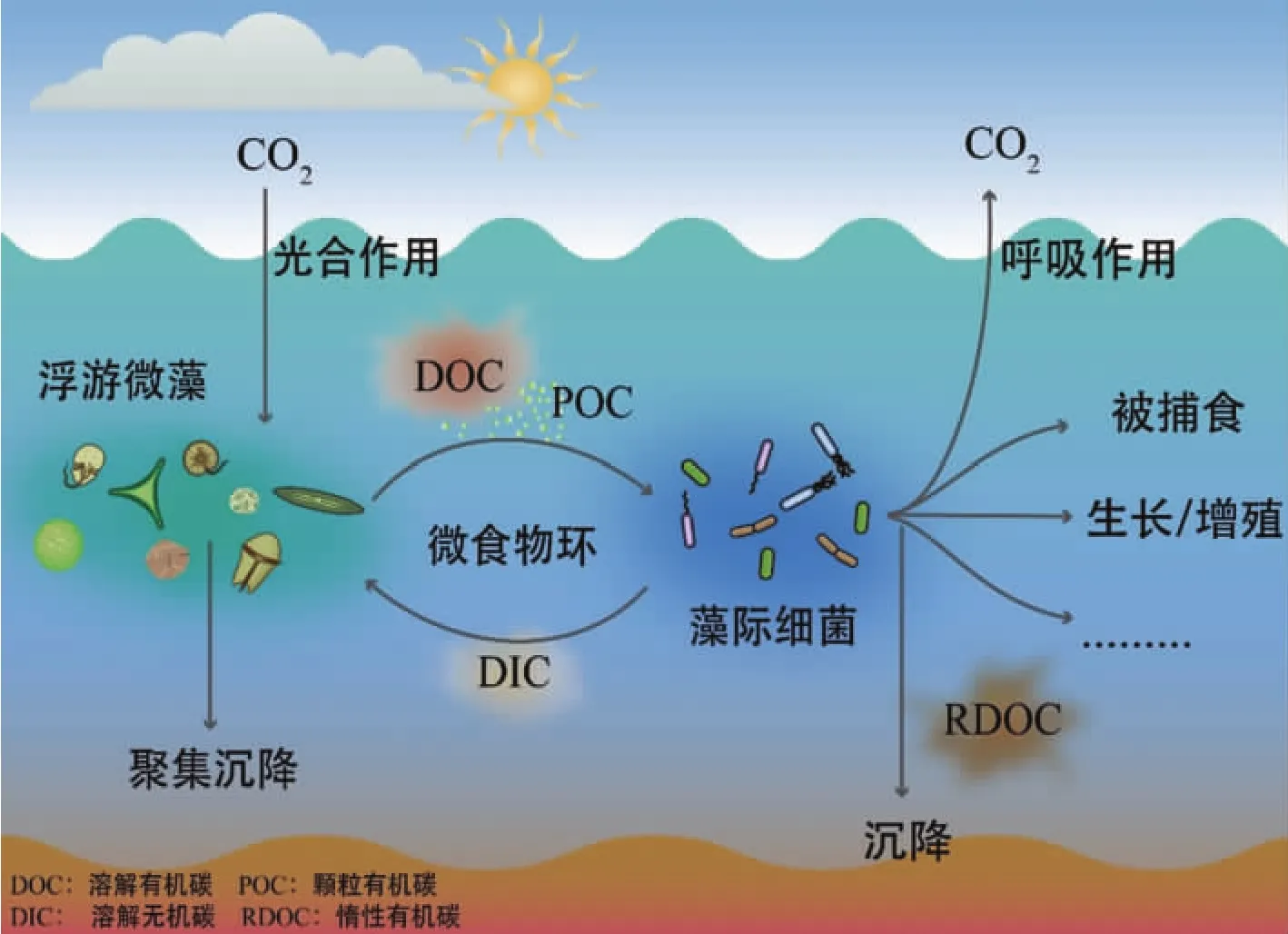
图2 浮游植物和藻际细菌协同介导的碳的生物地球化学循环过程
在藻菌的相互作用过程中,一些细菌可以使藻类发生聚集和沉降,驱动海洋生物泵对深海碳的输出效率[79].如硅藻藻际环境中经常富含具有粘性的透明胞外聚合颗粒(transparent exopolymer particles,TEP)可以使部分细菌定植于藻细胞上,促使硅藻细胞的聚集沉降,形成“海洋雪”,对上层海洋的呼吸碳量产生直接影响[44].同时,一些具有多糖降解能力的细菌反而能够增强复含多糖有机质TEP的降解速率,从而减少微藻细胞的聚集,降低向深海输出的碳量[80].
浮游植物除了能够分泌以多糖为主的DOC有机物到藻际环境中,还会释放大量的含氮磷有机底物如氨基酸、多肽、核苷酸及核苷等物质,这些物质在塑造藻际细菌群落结构以及引起特定细菌定植于藻际环境中起着重要的作用[81].在藻菌共生体系中,藻际细菌通过对可溶性有机氮(dissolved organic nitrogen,DON)及可溶性有机磷(dissolved organic phosphorus,DOP)等有机物的重新矿化为藻提供大量的营养盐.藻际细菌可促进微藻吸收氨氮的能力,且一些细菌对藻类所需硝氮的再生具有很大的贡献.当磷酸盐浓度较低时,细菌对磷酸盐的竞争影响了藻类对磷酸盐的摄入,藻类的生长因此受到限制,同时也影响了其对无机氮盐的吸收[82].因而,藻菌的协同作用关系在氮和磷耦合的生物地球化学循环中也起到重要的调节作用.
5.2 硫循环及气候变化
浮游植物能产生大量含硫化合物——DMSP,该化合物占海洋微藻光合作用固定碳的10%[83-84].DMSP既提供了细菌所需的碳、硫等营养元素[85],又可作为有效的化学引诱剂影响着细菌在藻际环境中的定植能力[86].藻际细菌对DMSP的不同代谢方式及降解的相对强度决定了DMSP最终转化为二甲基硫醚DMS(dimethylsulfide)的比例.DMS是生物硫从海洋进入大气的主要形式.在大气层中,DMS被光氧化形成气溶胶硫酸盐,这些气溶胶颗粒有形成云凝结核的能力,从而控制着太阳光的反射、散射和吸收,并直接影响着全球的辐射预算,形成了一个包含浮游植物、大气硫和气候的完整地球物理反馈通路[87].另一方面,云量的增加会导致海表温度下降和海水比重发生变化,同时促进了深层海水中营养盐向上混合,从而提高了浮游植物的生产力[88-89].不同藻际细菌对DMSP的降解能力会调节DMSP转化的方向,从而影响释放到大气中DMS的量.错综复杂的藻菌互作关系及由这些关系引起的藻际环境中有机物及信息化学物质的改变会对区域尺度上的气候调节产生重要影响.
5.3 有害藻华与“以菌抑藻”
作为海洋中无可争辩的主要生产者,浮游植物的大量增殖会给富营养的上升流区及高纬度的海岸带区域带来丰富的净初级生产力(net primary production,NPP).一方面,这些微型浮游藻类的增殖对水产养殖和渔业捕捞是有益的.另一方面,这种增殖可产生负面效应.海水中浮游藻类短时间内的大量增殖常常引起赤潮,使水产养殖、捕捞业和旅游业蒙受巨大的经济损失,并对环境和人体健康产生严重的危害[90-91].进入21世纪以来,海洋赤潮发生的频次和累计面积都有增加的趋势,尤其是近10年的赤潮频次和规模是20世纪后50年的两倍多.据《中国海洋灾害公报》报道:2013年我国沿海共发现赤潮45次,累计面积2620 km2;2014年,全海域共发现赤潮56次,累计面积达7290 km2.赤潮的爆发破坏了海洋生物的生存环境,引起海洋生态系统失衡恶化,渔业资源和海产养殖业受损,同时藻类毒素的产生严重威胁海洋生物和人类的生命安全,为此,寻找新的预防和治理赤潮的方法受到国内外海洋生物学者的高度关注[92].
赤潮的爆发与消亡,除了与原位环境中温度、光照、盐度、营养物质等理化因子有密切关系外,还与藻际环境中存在的细菌密不可分.赤潮的生消伴随着赤潮藻与海洋细菌、放线菌、病毒等微生物相互作用,这些微生物在赤潮的生消过程中扮演着重要的角色,部分海洋细菌能起到抑制赤潮藻生长的作用[93-95].而由于具有种类多、丰度高、活性物质分离纯化相对简单等特点,海洋细菌已经成为科研工作者开展“以菌治藻”的首要菌物资源目标[91].大部分杀藻细菌是通过分泌溶解性杀藻物质杀死藻细胞的,这些胞外活性物质包括胞外酶[62]、多肽(如毒素P[96])、氨基酸(如β-氰丙氨酸[97])、抗生素[98]以及色素[99]等.细菌产生的杀藻活性物质可以通过抑制藻细胞分裂繁殖和裂解藻细胞的方式来减少藻细胞数量.但是杀藻活性物质作用下藻细胞死亡机理的研究却相对较少,且没有统一的结论,部分杀藻物质对不同藻类具有选择性,可能与该物质的杀藻机理相关,阐释杀藻功能菌的杀藻机理有助于揭示杀藻活性物质的生态安全性及在赤潮治理上的应用.
笔者团队及合作者在前期系列研究中,从赤潮爆发海域原位环境分离到一株高效杀藻菌Hahella sp.KA22,能够合成具有杀藻活性的色素——灵菌红素(prodigiosin).研究表明,灵菌红素的杀藻效果具有良好的特异性,对赤潮异弯藻、球形棕囊藻和铜绿微囊藻的杀藻率均在50%以上,而对绿藻门和硅藻门的微藻,如盐生杜氏藻和三角褐指藻等没有明显的杀藻效果,因此具有很好的应用价值和开发潜力[100-102].对其杀藻机制进行研究,发现杀藻菌胁迫下藻的叶绿体光合电子传递链功能受损,ROS清除相关酶基因转录水平降低,细胞内氧化压力急剧升高,并激活后续的胁迫响应和钙离子依赖的细胞死亡调控过程,最终导致赤潮异弯藻死亡[101].
6 藻际环境蕴藏着丰富的活性物质
由于海洋生态环境的特殊性,海洋生物物种间的生存竞争十分激烈,众多海洋生物为能在严酷的环境下生存,从而代谢产生结构新颖、生物活性多样的天然产物.据统计,目前从海洋生物中共分离鉴定结构新颖或活性显著的天然产物已超过3万种[103-104],这些天然产物一直被视为药物先导化合物的重要来源.然而,由于保护生态环境的需要,一些海洋动植物如珊瑚则被禁止采集,一些用于生产药源分子的海洋生物因产量低、人工养殖困难,难以实现产业化发展.因此,寻找新的可持续发展海洋天然产物资源引起了化学家、生物学家和药理学家的极大兴趣.自2015年《Nature》发文阐明了小分子化合物在浮游藻类与共生菌之间的新型作用机制以来[51],藻菌共生体成为挖掘新颖活性天然产物的重要模式系统[105].
6.1 浮游微藻来源的活性天然产物
根据藻类形态,海藻可分为大型海藻和浮游微藻两类[106].目前,人们主要对大型海藻如褐藻、绿藻、红藻等加以综合利用,但这仅是海藻资源的一小部分.而蕴藏量巨大的微藻,是发现结构新颖且活性显著天然产物的潜在来源,值得进一步深入研究.
由于其中一些藻种可引发海洋赤潮,且能分泌毒素,是产生腹泻性贝类毒素(diarrhetic shellfish poisoning,DSP)的主要来源,因而受到全世界的广泛关注[107].尽管这些微藻代谢产物存在毒性,但却为新药设计提供了思路.冈田软海绵酸(okadaic acid,OA)是原甲藻的代表产物,不仅是DSP的主要组分,还是用于预防和治疗阿尔茨海默症的潜在药物[108].作为典型的丝氨酸/苏氨酸蛋白磷酸酶抑制剂,OA及其众多衍生物一直是研究热点.Lee等(2019)从原甲藻中鉴定了环亚胺毒素4-hydroxyprorocentrolide和prorocentrolide C,并发现化合物prorocentrolide C对肿瘤细胞HCT-116和Neuro-2a具有显著的细胞毒活性,IC50分别为2.2和5.2 μM[109].近期,我国学者从中国南海前沟藻属甲藻中发现了多个超级碳链化合物的新家族成员benthol A、gibbosols A和B等,并综合运用了波谱解析、化学降解和量子化学计算等方法成功地诠释其结构和绝对立体化学.活性测试表明benthol A具有显著的抗疟原虫活性[110],gibbosol A能够显著地促进细菌脂多糖诱导的人脐静脉内皮细胞的血管细胞黏附分子的表达,而gibbosol B却显著地抑制血管细胞黏附分子的表达[111],显示了海洋微藻是一个存在无限潜力的天然药库(图3).
6.2 藻际细菌来源的活性天然产物
许多海洋微生物因环境中营养成分的匮乏,常与含有富营养成分的海洋动植物共生以获得生存必需的营养.这种现象在海洋微生物中普遍存在并具有很高的特异性[112].海洋藻际环境中由于种类繁多的异养微生物竞争生态位,形成了结构复杂、功能多样的微生物群落.在共同生存与进化过程中,定殖微生物发展出独特的微型生境适应机制,预示着其次生代谢产物的特殊性,可能产生与宿主类似的药理活性或生态功能的天然产物,因此,藻菌共生体成为挖掘新颖活性天然产物的重要模式系统[105].
Tropodithietic acid(TDA)是由海洋玫瑰杆菌类群细菌Roseobacter产生的一种含硫的广谱性抗生素.藻际玫瑰杆菌Phaeobacter inhibins产生TDA与宿主赫氏球石藻动态共生,通过杀死有害的海洋病原菌从而保护宿主藻的健康生长[58].铜绿假单胞菌(Pseudoalteromonas tunicata)也能通过产生针对性的化合物抑制其它细菌生长,从而达到竞争优势生态位的目的.在实现这一目的的过程中,该菌产生包括抗菌蛋白、抗藻肽、抗真菌生物碱以及紫色杆菌素等多种针对性的化合物.这些化学物质共同组成细菌的化学防御手段,以使得该菌在生存环境中具有较强的竞争力[113-115].海洋微生物代谢产物的化学结构和生物活性与陆生微生物有着明显的不同,这是海洋微生物作为新药药源的重要基础.尽管目前从海洋微生物中直接获得药物的成功例子为数不多,但这一资源产生新药的巨大潜力不可忽视,因此,从藻际微生物中挖掘新颖活性天然产物,将为开发利用藻际微生物资源提供新的视角(图3).另一方面,从生态学的角度考虑,也有助于为探索微生物与宿主的关系及相互作用提供化学基础.
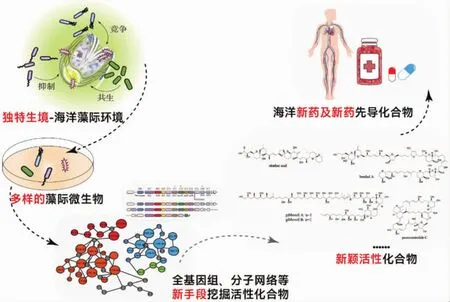
图3 海洋藻际环境是一个存在无限潜力的天然药库
7 展望
浮游植物及藻际细菌在海洋环境中的作用已经被广泛认知,且两者相互作用的藻际环境也被认为是海洋环境中物质交流和循环的热点区域.然而,尚有一系列科学问题亟待解决.
藻菌相互作用关系建立的内在机制.以往研究中,往往将浮游微藻和细菌作为互不联系的两个类群,去研究其在海洋环境中的作用,结果也显示两者的确在物质的生物地球化学循环、气候变化等过程中发挥关键作用.然而,两者的作用可能被低估.其原因之一,就是没有将两者作为一个完整的体系,放在一个“微界面”中研究.因此,笔者认为“藻-菌微界面中宿主藻和藻际细菌如何建立稳定的共生关系?在建立共生关系的过程中,何种物质起到了关键的桥梁作用?”是目前藻菌相互作用关系中的首要解决的问题.
藻菌协同驱动碳的生物地球化学循环过程及作用.藻际环境中,浮游微藻和藻际细菌如何协同介导物质的生物地球化学循环,尤其是碳循环?两者介导的碳转化对海洋总有机碳循环的贡献率有多大?在海洋碳汇中的作用如何?习近平主席提出的碳达峰与碳中和战略,不仅是全球气候治理、保护地球家园、构建人类命运共同体的重大需求,也是中国高质量发展、生态文明建设和生态环境综合治理的内在需求.全球每年排放约400亿吨的CO2中,23%被海洋吸收.海洋中浮游微藻能够固定大量的CO2合成有机碳,其中多糖形式有机碳是藻类固定的有机碳中重要的一部分;而藻际细菌则能够将这部分有机碳进一步转化,其中一部分转化为惰性有机碳储存在海洋底部,这可以大大减缓温室效应.因此,阐明“藻-菌”协同介导的碳循环过程,可以为通过“藻-菌”协同作用的方式减缓温室效应提供理论和技术支持,服务于国家的碳达峰与碳中和战略.
藻菌协同进化机制.藻际环境相较于海洋中其它生境,是一个营养丰富、信息交流频繁的特殊生境,在这独特的微环境中,宿主藻与藻际细菌如何协同进化?藻际细菌的微进化又是如何通过微进化适应藻际环境?前期研究中,笔者团队与香港中文大学罗海伟博士合作开展了藻际环境中玫瑰杆菌类群细菌种群分化和集合种群产生的研究,发现了在同一生境中不同硅藻(不同种、同种不同株)的藻际环境中的玫瑰杆菌类群细菌发生了不同程度的分化,说明藻际环境是一个影响藻际玫瑰杆菌类群细菌之间基因流动的有效屏障,对表层海水中细菌的进化过程起到重要作用.开展藻际环境中藻菌协同进化机制研究,有助于揭示海洋环境中浮游植物和细菌进化的机制,明确微生物浅时进化的过程和机理.
藻际微生物菌质资源库、基因组库和化合物库的构建.海洋微生物因独特生境,具备产生新结构活性次级代谢产物能力,已成为新药/活性物质研究开发的重要战略新资源.藻际环境中蕴藏着巨大价值的微生物资源,是发掘新型天然产物资源宝库.同时,随着基因组测序技术的飞速发展,基于基因组预测的方法为新型天然产物的发现提供了新的研究思路与开发途径.基因组数据不仅可以用来识别潜在的药物靶标,还能用于寻找先前被忽视的次级代谢产物的生物合成途径,定向发现新的天然产物药物.因此,建立一个微生物种质资源库与基因组库,并以此为基础发掘新的活性次级代谢产物,最终构建一个藻际新颖化合物库是迫切需要的.

