荷花NnXTH6基因克隆、亚细胞定位及表达分析
翟允汝,王婉茹,倪梦辉,贺丹,2,刘红利,2,张曼,2,孔德政,2,刘艺平,2
(1.河南农业大学风景园林与艺术学院,河南 郑州 450002; 2.河南省优质花卉蔬菜种苗工程研究中心,河南 郑州 450002)
木葡聚糖内转糖苷酶/水解酶(xyloglucan endotransglycosy lase/hydrolase,XTH)是一种细胞壁松弛酶[1],参与细胞壁的松弛和重构过程,对细胞壁中的半纤维素木葡聚糖具有水解、转移等多重作用,起到修饰细胞壁、调控细胞形态结构等作用。XTHs是多基因家族编码的一类酶,广泛参与植物的多项生命活动,对植物的种子萌发[2]、根茎伸长、花瓣形成、果实发育[3]及应对非生物胁迫[4-7]等过程均有所调控。自20世纪70年代,学者对不同植物体内的XTHs基因均有不同层次的广泛研究[1,3-4],有研究显示,XTHs基因广泛分布于拟南芥(Arabidopsisthaliana)不同组织器官中,对其不同部位的发育过程产生影响[8]。
开花作为高等植物繁衍后代的重要途径,吸引了众多研究者对其开展深入研究。目前,国内外已经有了一定的植物开花调控的分子研究基础[9-14],对植物的成花诱导分子机制、花发育过程有了更为深入的认识,研究角度涉及环境改变、激素处理和分子研究等多方面。较多研究表明,XTHs基因对花开放、花瓣发育等过程起到不可或缺的作用。陈驰[15]研究发现,大丽花(Dahliapinnata)中XTH基因的表达对花瓣细胞的膨大和伸展起调控作用,同时在大丽花花瓣发育后期其大量表达还可能导致花瓣松弛,从而加快细胞衰老进程。董晨等[16]研究发现,LcXTHs基因在荔枝(Litchichinensis)花穗发育中的细胞壁重构过程发挥重要作用。通过对桂花(Osmanthusfragrans)开花期的XTH基因家族进行分析发现,部分OfXTHs基因能够通过响应温度变化来参与对桂花花开放的调控[11]。此外,过表达CtXTH1基因可以显著增加红花(Carthamustinctorius)的花冠长度和花冠重量,以此来提高红花的产量[17]。
荷花(Nelumbonucifera)作为莲科莲属的多年生草本花卉,具有很高的观赏价值和经济价值,并且还具有净化水体的生态功能,因而被广泛用于园林植物观赏和生态修复中。但荷花存在花期短、花瓣易脱落萎蔫等问题,其栽培利用很大程度上受到时间和空间的限制。荷花衰老过程中的生理生化变化[18]及外源激素对荷花生长的影响[19-20]等均已有较为广泛的研究。荷花关于花发育、花期调控的研究逐渐深入至分子生物学领域,但目前的研究更多地集中在相关基因挖掘和功能验证阶段,基因调控网络尚未构建。尽管已经掌握了通过调节生长环境来实现调控荷花花期的技术,但从植物遗传育种角度出发,探明荷花花期调控的分子机制,发掘具有更高观赏价值的新品种,提高生物多样性,一直是广大研究者的目标。
本研究以荷花花瓣作为试验材料,克隆得到NnXTH6基因的编码区序列,并对荷花开花前后花瓣中的NnXTH6基因表达量进行实时荧光定量分析,探究NnXTH6基因对荷花花瓣发育和衰老的调控功能,以期为研究荷花花瓣生长和衰老的分子机制奠定理论依据。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 植物材料选取荷花重瓣品种‘晚霞’(Nelumbonucifera‘Wan xia’),采自河南省郑州市荥阳市中禾农业种植基地。试验于2021年在河南省优质花卉蔬菜种苗工程研究中心进行。选取长势一致的健康植株,在荷花花蕾出现至花瓣脱落期间分别于9:00左右采集‘晚霞’不同生长阶段的花瓣3~4片,放入盛有液氮的冰盒中带回实验室,用去离子水冲洗净并用滤纸吸干表面水分,于液氮中速冻,置于-80 ℃超低温冰箱,保存备用。根据荷花开花时期花瓣发育和衰老程度的不同,将其分为现蕾期(BU)、转色期(CC)、喧蕾期(SB)、初花期(IF)、盛花期(FF)及谢花期(FW)6个时期。
亚细胞定位观察的植物材料为本氏烟草(Nicotianatabacum),在温度25 ℃、湿度 60%、光照时长16 h 的培养箱中培养5~6周进行试验。
1.1.2 试验试剂 RNA反转录试剂盒、DNA高保真酶、pMD-18T克隆载体、DL 2000 maker均购于大连宝生物有限公司(TaKaRa);琼脂糖凝胶DNA回收试剂盒、大肠杆菌Top10感受态细胞、农杆菌GV3101感受态细胞购于北京庄盟国际生物基因科技有限公司;pCAMBIA2300-GFP表达载体由河南农业大学风景园林学院课题组提供;引物合成与测序均由生工生物工程(上海)有限公司完成。
1.2 试验方法
1.2.1 总RNA提取与cDNA合成 荷花总RNA的提取采用改良的CTAB法[21],采用超微量分光光度计测定总RNA含量并评定其质量,用质量分数为1%的琼脂糖凝胶电泳检测总RNA样品的完整性,在Alpha Imager PE型凝胶成像系统上观察其电泳条带并拍照记录。采用Prime ScriptTMRT reagent Kit with gDNA Eraser(TaKaRa,大连)反转录试剂盒合成cDNA第一条链,检测cDNA质量后储存于-20 ℃。
1.2.2 荷花NnXTH6基因克隆及阳性克隆鉴定 通过对荷花花发育转录组数据库的检索,得到NnXTH6同源序列。利用Primer 5.0设计特异引物XTH-F和XTH-R,引物序列分别为:5′-ATGGCCACAGCCACACGCAGCTTGTTA-3′和5′-TCAGATGCCGGCCAAGCATTCTGGT-3′,引物的合成由生工生物工程(上海)有限公司进行。以荷花花瓣cDNA为模板进行PCR扩增反应,反应体系为50 μL。PCR扩增体系如下:5×Primer STAR Buffer 10 μL,Primer STAR HS DNA Polymerase 0.5 μL,稀释后cDNA 2 μL,上下游引物各1 μL,dNTP 4 μL,加入ddH2O补至50 μL。扩增程序为:预变性98 ℃ 30 s;PCR反应98 ℃ 10 s,60 ℃ 5 s,72 ℃ 55 s,34 cycle;之后72 ℃延伸5 min。PCR产物用质量分数1%琼脂糖凝胶进行检测及回收。将回收产物连接至pMD-18T载体上,然后转化大肠杆菌感受态细胞,菌液PCR检测鉴定阳性单克隆后,将菌液送公司测序。
1.2.3 生物信息学分析 从转录组基因库里获得XTH目的基因序列,通过GenBank的ORF finder在线查找工具找出XTH序列的完整开放阅读框(ORF)并翻译得到其氨基酸序列;通过BLAST在线工具(BLAST: Basic Local Alignment Search Tool)搜索与NnXTH6蛋白相似度较高的蛋白序列,并使用DNAMAN 8进行多序列比对分析;利用MEGA7.0软件中的邻接法(Neighbor-joining)构建同源系统发育进化树;使用ProtParam、TMHMM Sever v 2.0、SignalP、NetPhos 3.1、SOPMA、Cell-PLoc 2.0等在线工具分析预测NnXTH6蛋白质理化性质、结构特征以及亚细胞定位情况。
1.2.4 重组表达载体构建及亚细胞定位 以测序正确的pMD18T-XTH6质粒为模板,Kpn-XTH-F、Sal-XTH-R为引物扩增带有酶切位点和同源臂的目的片段。引物序列分别为:5′-ACGGGGGACGAGCTCGGTACCATGGCCACAGCCACACGCA-GCTTGTTA-3′和5′-CTTGCTCACCATGGTGTCGA-CGATGCCGGCCAAGCATTCTGGT-3′。用Kpn I和Sal I限制性核酸内切酶处理绿色荧光蛋白载体pCAMBIA2300-GFP。扩增的目的片段以及线性化载体片段经过电泳检测后回收,进行同源重组后转化大肠杆菌感受态细胞。将成功构建的含有目的基因的融合表达载体命名为p2300-NnXTH6-GFP。
提取表达载体p2300-NnXTH6-GFP的质粒,转化根癌农杆菌GV3101感受态细胞,PCR验证阳性单克隆菌株。以pCAMBIA2300-GFP空载为对照,将空载和p2300-NnXTH6-GFP融合表达载体利用农杆菌介导的瞬时转化法导入烟草叶片细胞中,28 ℃暗处理8~14 h,后置于光照培养箱培养,3 d后叶片剪成25 mm2左右的小方块,制作临时玻片,采用激光共聚焦显微镜(A1R HD25,Nikon,Japan)观察GFP的表达情况。GFP荧光激发波长为488 nm,接收波长范围为500~560 nm。叶绿体自发荧光激发波长为633 nm,接收波长范围为650~720 nm。
1.2.5 荷花NnXTH6基因的表达分析 根据克隆获得的NnXTH6基因序列,使用Primer 5.0重新设计实时荧光定量PCR引物qXTH-F和qXTH-R,序列为:5′-GCCACACGCAGCTTGTTAAA-3′和5′-GCTGACACGCCCAAACAAAT-3′,以荷花18s-rRNA基因作为内参基因,引物序列为:5′-CCATAAACGATGCCGAC-3′和5′-CACCACCCATAGAATCAAGA-3′。按照RNA快速提取试剂盒的操作流程分别提取荷花‘晚霞’现蕾期、转色期、喧蕾期、初花期、盛花期以及谢花期花瓣的总RNA,并按照Prime ScriptTMRT reagent Kit with gDNA Eraser(TaKaRa,大连)反转录试剂盒流程合成cDNA第一链。采用SYBR Premix Ex TaqTMⅡ Kit(TaKaRa,大连)试剂盒于Applied Biosystems 7500 Fast Real-time PCR System中进行实时荧光定量PCR反应。以内参18s-rRNA表达量作为标准,用2-ΔΔCt法计算NnXTH6基因在不同发育时期花瓣的表达水平[22],并做3次生物学重复。
2 结果与分析
2.1 荷花NnXTH6 cDNA全长克隆与序列分析
以荷花‘晚霞’花瓣的cDNA为模板扩增NnXTH6基因,由图1可以看出,PCR扩增获得的基因片段约850 bp,与预期结果相符合。由图2可知,克隆所得到的基因开放阅读框片段为870 bp,编码289个氨基酸。与转录组数据库中所参照的序列相比,克隆所得到的序列存在1个碱基替换,为同义突变,表明该片段即为目的基因NnXTH6。
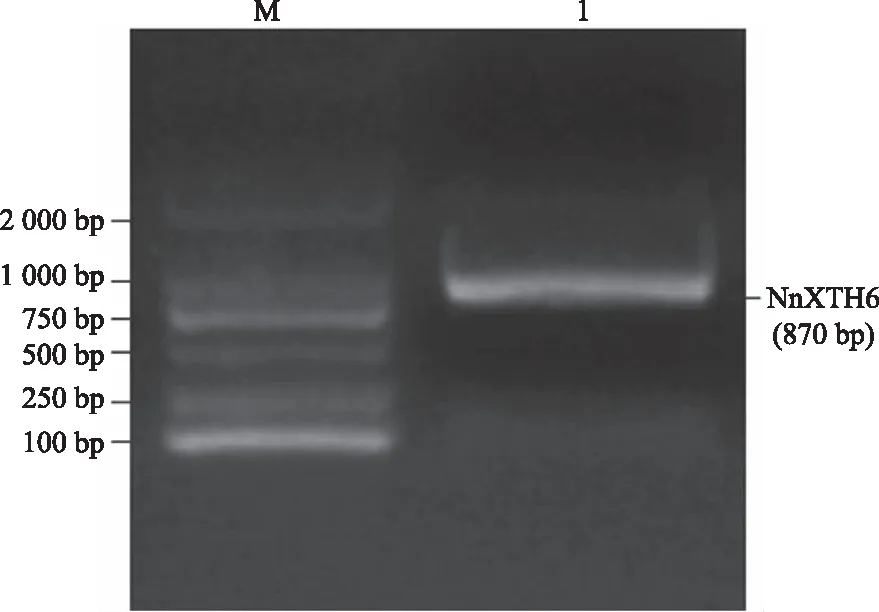
M:DNA maker;1:NnXTH6基因扩增条带。M : DNA maker; 1 : NnXTH6 gene amplification band.

方框内为GH16活性位点基序。The motif of GH16 active site in the box.
2.2 荷花NnXTH6蛋白理化性质分析
利用ProtParam在线软件对XTH6蛋白进行理化性质分析,结果显示,荷花NnXTH6蛋白由289个氨基酸组成,其中Ala(丙氨酸)含量最多,达到7.6%,不含Pyl(吡咯赖氨酸)和Sec(硒半胱氨酸)。NnXTH6蛋白质的分子式为C1 506H2 253N399O426S13,原子总数为4 597,相对分子质量为33.18 kD,等电点为6.38。蛋白不稳定系数为40.48,总正电荷残基 (Arg+Lys)数为 30,总负电荷残基(Asp+Glu)数为32,脂肪族指数为74.91,蛋白亲水性平均系数(GRAVY)为-0.329,推测NnXTH6蛋白是一个不稳定的亲水性蛋白。
2.3 荷花NnXTH6蛋白结构分析及亚细胞定位预测
NnXTH6蛋白磷酸化位点预测结果显示(图3),其氨基酸序列可能发生磷酸化的位点共有20个,丝氨酸(S)磷酸化位点8个,苏氨酸(T)磷酸化位点7个,酪氨酸(Y)磷酸位点5个。NnXTH6蛋白的跨膜结构域分析结果表明,NnXTH6蛋白存在一个跨膜结构域(图4),其跨膜结构位于N端。利用SignalP Server 4.1在线软件分析显示(图5),S-score值为0.973,C-score值为0.804,出现了2个高峰,Y-score值为0.862,S-mean值为0.918,D值在氨基酸1~25位,达到0.892。这说明该蛋白存在信号肽,且信号肽位于氨基酸1~25位,其切割位点在第25和26位氨基酸之间,推测它是一种分泌蛋白。使用NCBI中CDD保守功能区域分析结果(图6)所示,NnXTH6为LamG超家族成员,具有内转糖基酶(xyloglucan endotransglucosylase,XET)活性。SOPMA在线工具分析结果如图7显示,荷花NnXTH6蛋白的二级结构中α-螺旋占15.22%,延伸链结构占29.07%,β-折叠占5.19%,无规则卷曲占50.52%。 NnXTH6蛋白质的三级结构如图8所示。荷花NnXTH6蛋白的亚细胞定位预测结果显示,该蛋白定位于细胞质中。
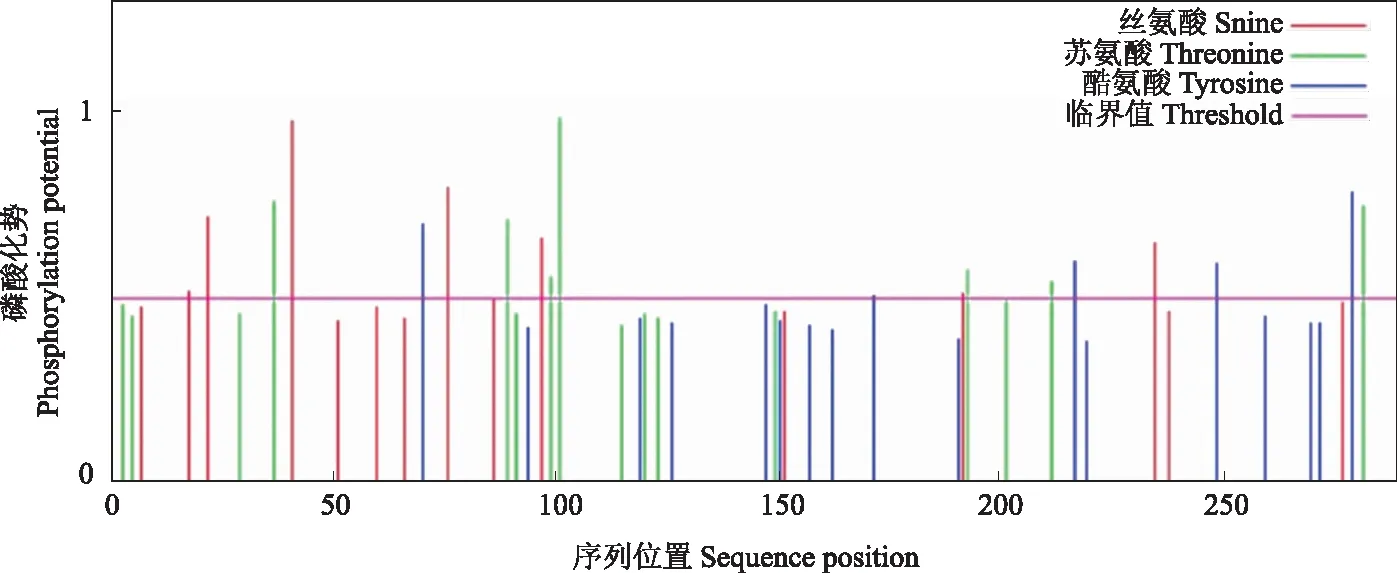
图3 荷花NnXTH6蛋白磷酸化位点预测Fig.3 Prediction of the phosphorylation site of NnXTH6 protein
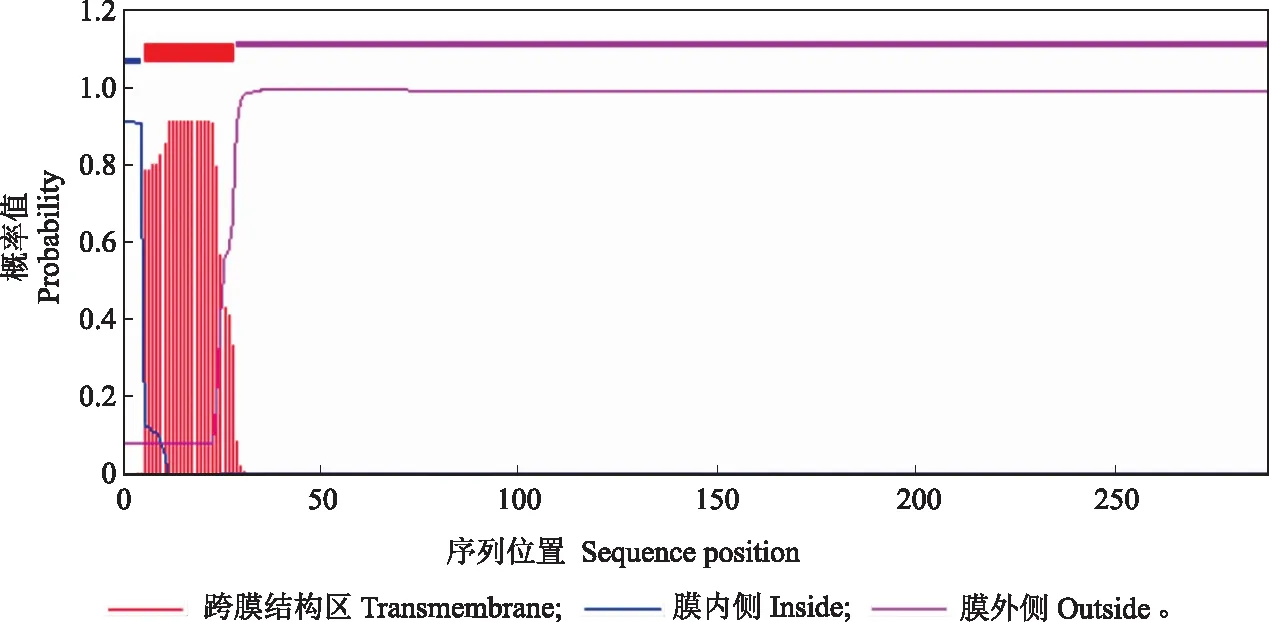
图4 荷花NnXTH6蛋白跨膜结构分析 Fig.4 Transmembrane region analysis of NnXTH6 protein
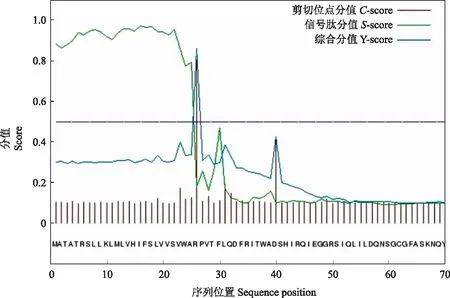
图5 荷花NnXTH6蛋白信号肽及其切割位点分析 Fig.5 Analysis of NnXTH6 protein signal peptide and its cleavage site
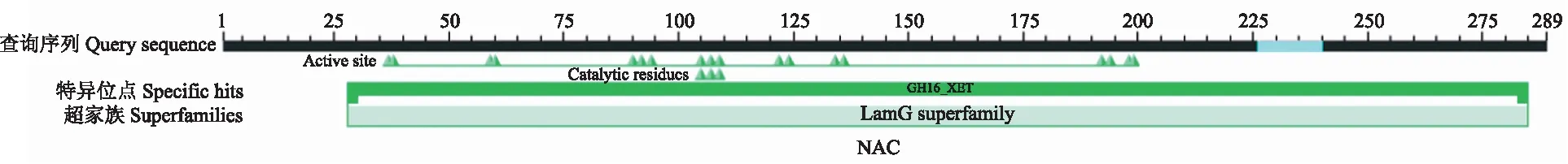
图6 荷花NnXTH6蛋白保守结构域分析Fig.6 The analysis of conserved domain for NnXTH6 protein
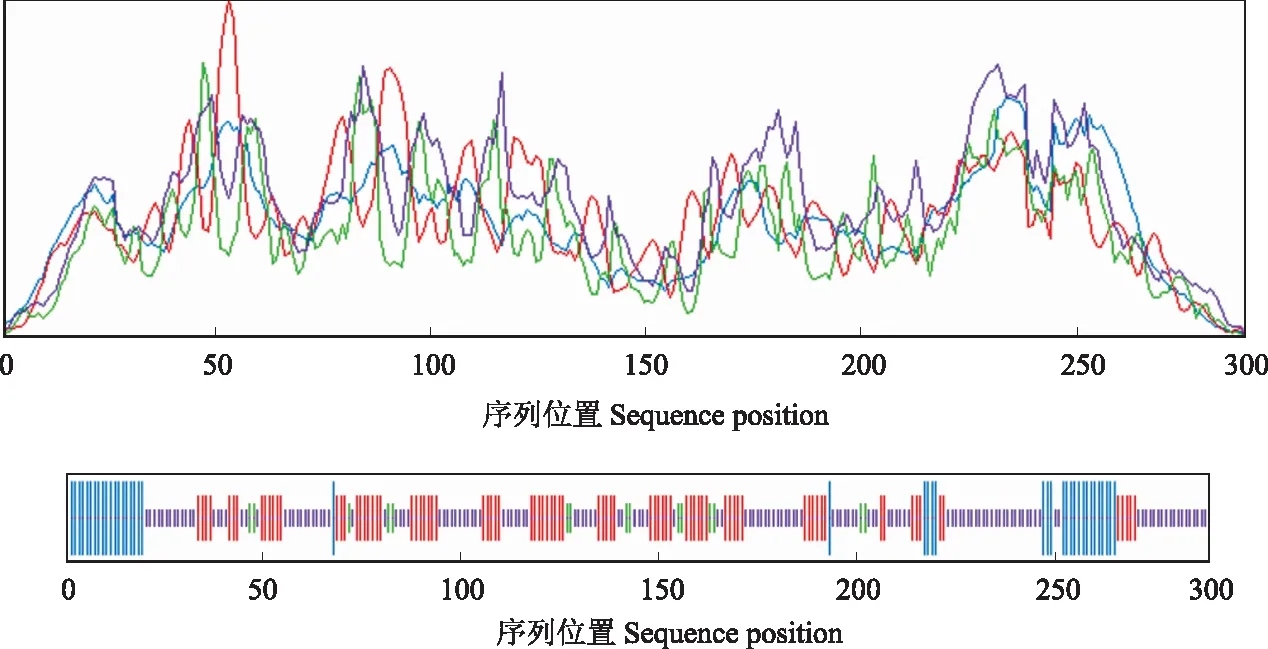
蓝色:α-螺旋;红色:延伸链;绿色:β-折叠;紫色:无规则卷曲。Blue: Alpha helix; Red: extended strand; Green: beta turn; Purple: random coil.
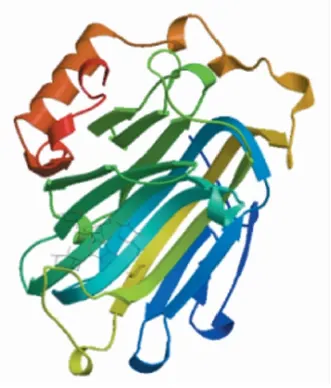
图8 荷花NnXTH6蛋白三级结构预测 Fig.8 Prediction of the tertiary structure of NnXTH6 protein
2.4 荷花NnXTH6基因同源性和系统进化分析
为验证NnXTH6基因亲缘关系,将NnXTH6基因编码的氨基酸序列提交至在线工具Blast P中,从NCBI数据库中筛选得到9个物种的11个氨基酸序列。利用DNAMAN对已注释的荷花NnXTH6蛋白和其他物种蛋白进行序列比对(图9),可以发现荷花与同属荷花(Nelumbonucifera)、沉水樟(Cinnamomummicranthum)、大丽花(Dahliapinnata)、芝麻(Sesamumindicum)、杭白菊(Chrysanthemum×morifolium)、万寿菊(Tageteserecta)、博落回(Macleayacordata)的氨基酸序列的一致性较高,分别为84.08%、83.16%、82.99%、82.70%、82.65%、82.65%和82.19%。在序列比对中发现,NnXTH6和其他同源蛋白质共同包含有介导催化活性的GH16蛋白活性位点特征基序,由此可以判断获得的序列为荷花XTH基因,命名为NnXTH6。将荷花NnXTH6蛋白序列与其他11个蛋白序列一同提交至MEGA7.0软件进行系统进化分析,结果显示,荷花NnXTH6与沉水樟(Cinnamomummicranthum)和芝麻(Sesamumindicum)同源蛋白的亲缘关系更近。
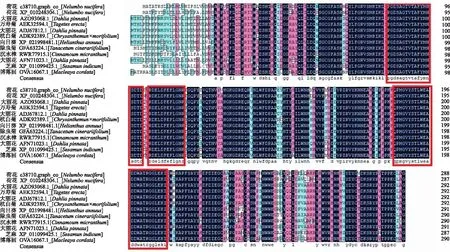
图中方框内为保守基序。图右数字为每行末尾氨基酸对应位数。The box in the figure is the conservative base order.Figure right is the number of amino acids corresponding to the end of each line.
将荷花NnXTH6与拟南芥的33个AtXTHs蛋白成员一起通过MEGA7.0 软件构建系统进化树(图10)。荷花NnXTH6蛋白与拟南芥AtXTH6/7聚在一个小组,分属于拟南芥AtXTHs分类[23]中的第Ⅰ组。研究表明,AtXTH6在拟南芥的花、茎、叶中的表达量较高,AtXTH7在花中表达量较高[8],两者均在拟南芥的叶片生长和花发育阶段高表达,调控着拟南芥的生长。因此,可以推测荷花NnXTH6基因与拟南芥AtXTH6/7基因具有相似的特性,在荷花花发育中起到调控作用。
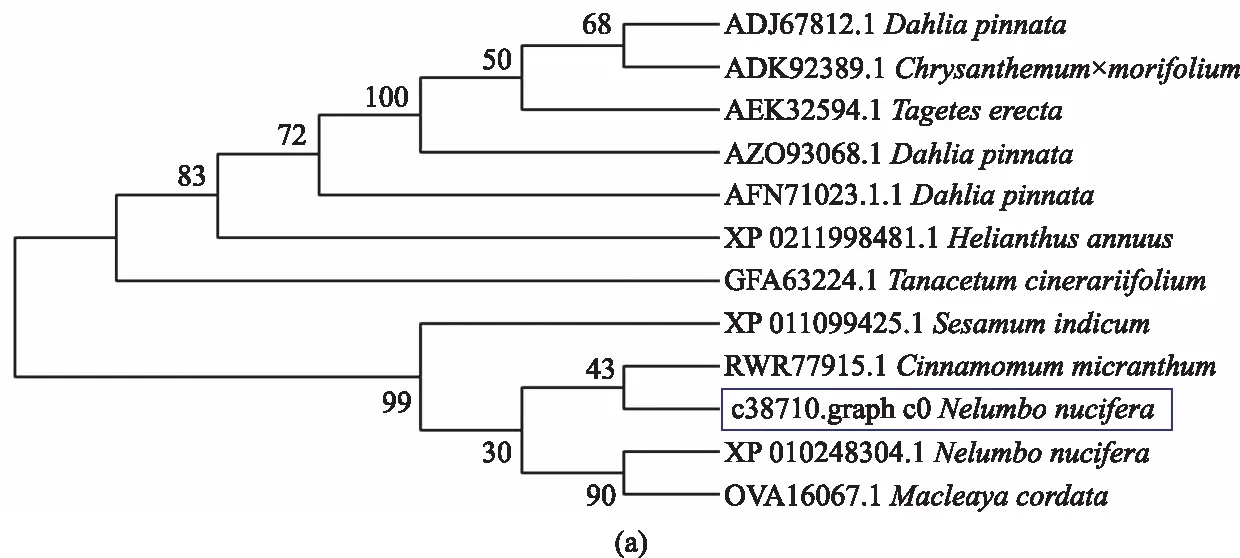
图中方框内为NnXTH6蛋白。(a)同源序列系统发育树;(b)与拟南芥XTH家族的系统发育树。The NnXTH6 protein is shown in the box.(a) Phylogenetic tree of homologous sequences; (b) Phylogenetic tree of the Arabidopsis XTH family.
2.5 荷花NnXTH6蛋白亚细胞定位
将重组表达载体p2300-NnXTH6-GFP瞬时转化至烟草叶片,用激光共聚焦显微镜观察。结果如图11显示,p2300-GFP空载的绿色荧光信号存在于细胞核和整个细胞质中,NnXTH6蛋白定位在细胞质中与预测结果一致。
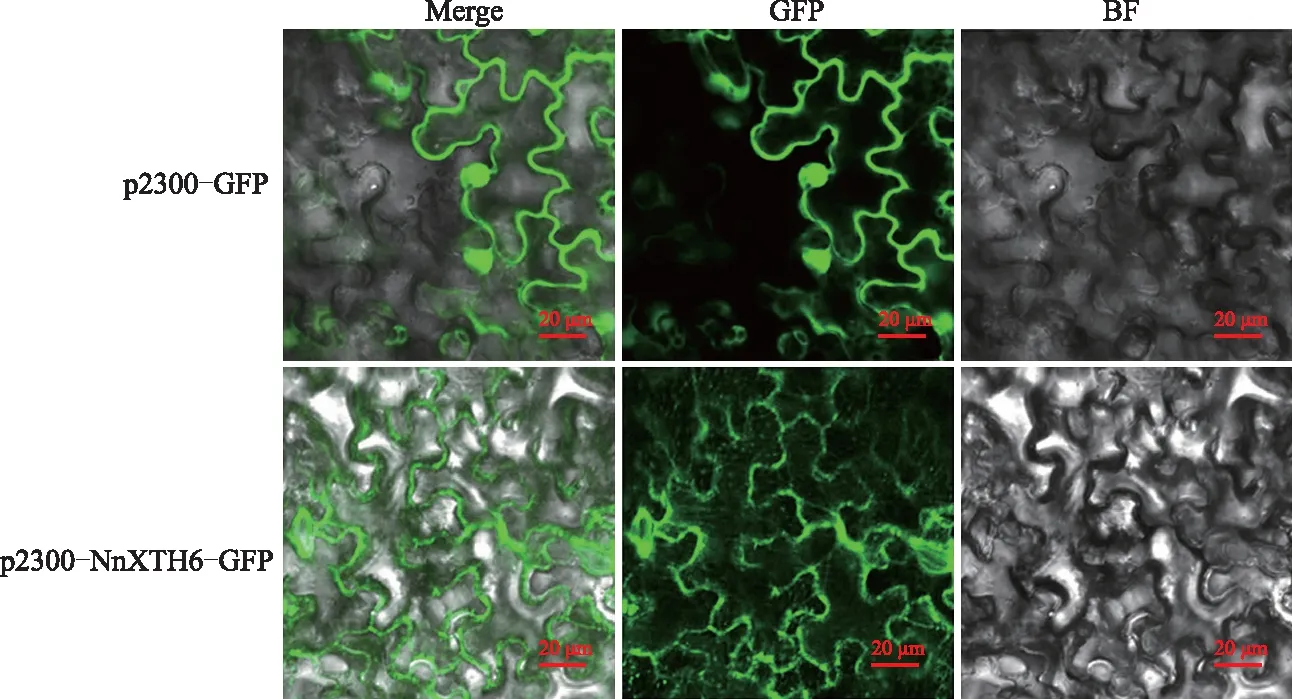
Merge:混合场;GFP:绿色荧光蛋白;BF:明场。标尺:20 μm。Merge:The fusion of green fluorescence and bright field;GFP:Green fluorescent protein;BF:Bright field.Bars: 20 μm.
2.6 荷花NnXTH6基因在不同时期荷花花瓣相对表达量分析
对荷花6个不同时期花瓣进行了组织特异性分析(图12),经荧光定量PCR分析表明,NnXTH6基因在FF时期的相对表达量最高,其次是IF时期,在CC时期的相对表达量最低。IF时期和FF时期基因的相对表达量显著高于SB、BU、CC时期,之后在FW时期显著下调,基因表达水平整体呈现先上升后下降的趋势。这说明其很大程度上参与调控了荷花的开花和衰老过程,但对开花前花色转变等过程的影响较小。
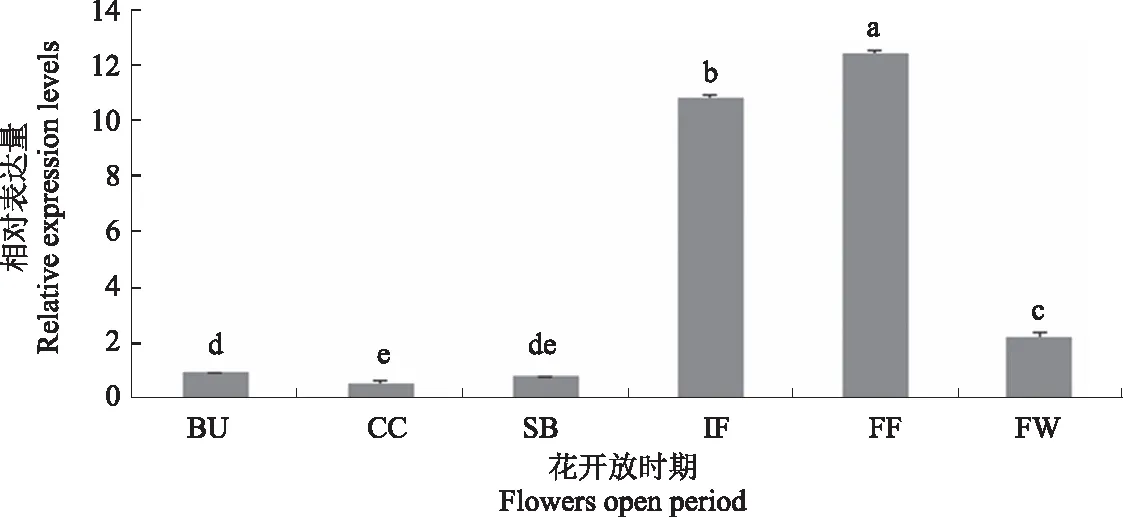
在不同时期的表达水平之间进行显著性差异比较。P<0.05(n=3)。BU:现蕾期;CC:转色期;SB:暄蕾期;IF:初花期;FF:盛花期;FW:谢花期。Significant differences were compared between expression levels across time periods.P<0.05 level(n=3).BU: Budding stage; CC: Color-changing stage; SB: Soft-bud stage; IF: Initial-flowering stage; FF:Full-flowering stage; FW: Flower-wilting stage.
3 结论与讨论
细胞壁是植物特有的细胞结构,是植物细胞形态建成的重要结构基础,对内部细胞的生长分化起到很好的支撑和保护作用。木葡聚糖内转糖苷酶/水解酶基因(XTHs)作为细胞壁结构改变的重要影响因子,其表达常常会受到多种环境信号的诱导,在植物生长发育、应对环境胁迫过程中发挥着重要的作用。研究发现,花生(Arachishypogaea)中AhXTH4/38基因在种子发育过程中表达量升高,说明AhXTHs基因参与了花生种子的发育和萌发过程[2];吕月庆[24]研究表明,拟南芥AtXTH10基因的缺失和过量表达能够在宏观和微观结构上影响拟南芥根的生长发育;CmXTH4基因沉默导致了菊花(Chrysanthemum×morifolium)花序直径以及舌状花花瓣远轴方向上的显著缩短[25];苎麻(Boehmerianivea)中的BnXTHs基因在其茎的不同发育时期、不同发育部位表现出不同或类似的表达模式,说明BnXTHs对其韧皮纤维生成过程起到重要的调控作用[26];龙晓刚[27]研究发现,MdXTHs基因能够影响苹果(Maluspumila)的果实发育进程以及储藏期的软化过程。因此,XTHs基因在不同植物中能够通过影响细胞壁的结构从而改变细胞的伸长等,调控植物根系、花瓣、茎、果实等组织器官的形态建成,影响植物的生长过程,进而对其在实际应用中的观赏价值、作物产量等应用价值产生影响。
本研究对荷花‘晚霞’品种NnXTH6基因进行了克隆,该基因全长为870 bp,编码289个氨基酸,蛋白质相对分子质量为33.18 kD。氨基酸序列比对和同源性分析显示,荷花NnXTH6基因具有XTH基因家族典型的保守结构域,与荷花、沉水樟、大丽花、芝麻和杭白菊的同源氨基酸序列的一致性较高。与其他物种的XTHs基因相比,NnXTH6基因的C端氨基酸序列表现出更高的一致性,说明该基因在进化过程中具有一定的保守性,而N端约有50个氨基酸残基存在较大差异,这可能与其功能多样有关。亚细胞定位情况显示,NnXTH6蛋白定位于细胞质中,这与XTHs蛋白在菠萝(Ananascomosus)[28]和大麦(Hordeumvulgare)[29]内的亚细胞定位结果类似,结合NnXTH6蛋白的信号肽和跨膜结构域分析,推测细胞质是NnXTH6蛋白发挥功能的主要场所。
植物在生长发育过程中细胞壁会发生重构,细胞壁的重构现象主要是通过木葡聚糖分子在不断催化下出现断裂和再连接形成的。木葡聚糖内转糖苷酶/水解酶主要对细胞壁中的半纤维素进行水解和切割等多重作用,从而调控细胞的生长发育,在植物的各种生命活动中都起到了重要的作用。申雪莹[30]研究发现,激素处理后XTH相关基因表达量的升高促进了荷花‘青玉’花瓣的开放过程,同时推测其对花瓣衰老也存在调控作用。孙悦等[31]发现,DpXTHs基因与大丽花花瓣的早期生长密切相关,同时李成忠[32]发现,PlXTHs基因还能调控芍药(Paeonialactiflora)花茎的机械强度。HARADA等[33]检测到DcXTH2和DcXTH3基因在康乃馨(Dianthuscaryophyllus)花瓣中的转录水平远高出在其他组织中的转录水平。OCHIAI等[34]在研究中发现XTH基因在洋桔梗(Eustomagrandiflorum)花瓣快速生长中起着重要作用,并且基因表达量伴随着花瓣鲜质量的增加而升高。本试验中,NnXTH6基因在荷花花瓣初花期(IF)的表达量显著上调,并且在盛花期(FF)达到最大值,在谢花期(FW)表达量显著下调。这与大丽花XTH基因在花瓣不同发育时期的表达情况[35]类似,说明NnXTH6参与荷花的花开放和衰老进程。
本研究利用RT-PCR技术从荷花中克隆得到NnXTH6基因,同源序列和系统发育分析表明,NnXTH6与拟南芥AtXTH6/7具有较高的同源性,对比与其他物种的XTHs氨基酸序列分析发现,NnXTH6与沉水樟和芝麻的XTH蛋白序列的同源性更高。荧光定量结果分析发现,荷花NnXTH6基因的表达量在6个花开放时期表现出明显差异。说明荷花NnXTH6基因的表达较大程度上影响了其自身的花开放过程,NnXTH6基因在荷花盛开和衰老过程中发挥着重要作用,为下一步荷花XTH基因的功能及荷花花发育分子机制研究提供理论依据,为荷花新品种培育、提高其园林应用价值提供科学的理论参考。

