低剂量地西他滨对免疫性血小板减少症患者来源的骨髓间充质干细胞生物学行为的影响
王昕芃,王君颖,蔡佳翌,付婉彬,钟 华
1. 上海交通大学医学院附属仁济医院血液科,上海 200127;2. 上海交通大学医学院附属仁济医院中心实验室,上海 200127
原发免疫性血小板减少症 (immune thrombocytopenia,ITP)是一种获得性自身免疫性疾病,其特征是由于血小板破坏增加和血小板生成受损导致的血小板计数减少从而出现出血、紫癜等促凝血紊乱症状,严重时可导致颅内出血等严重并发症并危害生命[1]。血小板在骨髓微环境中生成:造血干细胞从成骨细胞微环境迁移到血管微环境并最终分化为巨核细胞,随后经历增殖、分化和成熟最终产生血小板。骨髓微环境主要由非造血细胞、可溶性因子和细胞外基质蛋白组成,它们共同构成一个复杂的调控网络,可调节巨核细胞的成熟和血小板的生成。骨髓微环境中许多组分都参与调节血小板前体形成和最终血小板释放到血流中的过程[2]。间充质干细胞(mesenchymal stem cell,MSC)作为骨髓微环境中的重要组成部分,其最大特点是具有强大的免疫抑制功能。MSC 可以同时抑制T 细胞和B 细胞的增殖与活化,并降低抗原提呈细胞共刺激分子的表达,刺激调节 性T 细 胞(regulatory T cell,Treg 细 胞) 的 分化[3-5]。MSC 被认为对巨核细胞的功能具有调节作用。越来越多的证据[6-8]表明ITP中的MSC表现出增殖和功能受损,MSC缺陷在ITP的发病机制中起关键作用。我们之前的研究[9]表明,来自ITP 患者的MSC 表现出细胞凋亡增加,以及支持巨核细胞分化和血小板生成的能力不足。与此同时,有文献[10-11]报道了输注MSC 可有效改善ITP 小鼠模型的血小板水平。有临床试验[12]显示,通过静脉输注给予慢性难治性ITP患者人脐带MSC取得了较好疗效。
已有研究[13-14]表明,异常的DNA 甲基化与ITP的病因有关。甲基化缺陷导致甲基化相关基因过表达,如CD70和FOXP3(forkhead box P3),这些基因可以参与自身免疫反应,最终加速ITP 的进展。与此同时,有文献报道了DNA 甲基转移酶抑制剂可以减少MSC 衰老[13]、改善细胞迁移[15]、恢复干细胞干性[16]、 提 升 免 疫 抑 制 功 能[17]。 地 西 他 滨(decitabine,DAC)是一种有双重功能的DNA 甲基转移酶抑制剂,低剂量时表现出去甲基化作用,可引导细胞分化成熟,而高浓度的DAC 可产生细胞毒活性,导致细胞死亡。临床上,地西他滨主要应用于治疗骨髓增生异常综合征、镰状细胞贫血和β-珠蛋白生成障碍性贫血。临床研究[18]证明,低剂量地西他滨可促进ITP 患者巨核细胞的分化成熟和血小板生成,但对于低剂量地西他滨是否通过改善MSC 的功能发挥上述作用目前尚不清楚。本研究旨在研究低剂量地西他滨对ITP 患者来源的MSC 的增殖、凋亡等生物学行为的调节作用并探索其机制,为慢性ITP 临床治疗提供新的实验室理论依据。
1 材料和方法
1.1 研究对象
本研究纳入2020 年4 月—2021 年10 月上海交通大学医学院附属仁济医院血液科门诊或住院的ITP 发病期患者10 例,其中女性7 例、男性3 例,平均年龄65.7岁,中位年龄70.5岁,平均血小板计数45.7×109/L(中位数41×109/L)。患者诊断依据2009 年国际协作组制定的ITP 诊断标准[19]。所有患者在收集标本前4周内未接受任何ITP治疗。
纳入同期非ITP 患者10 例作为对照(NC)组,均为经过骨髓穿刺证实无巨核细胞成熟障碍的血液科门诊或住院患者,并且无其他累及骨髓异常的疾病;其中男性4 例、女性6 例,平均年龄57.4 岁,中位年龄62.5 岁,平均血小板计数为170×109/L(中位数170.5×109/L)。患者特征汇总见表1。标本的取得均获得了患者的知情同意。
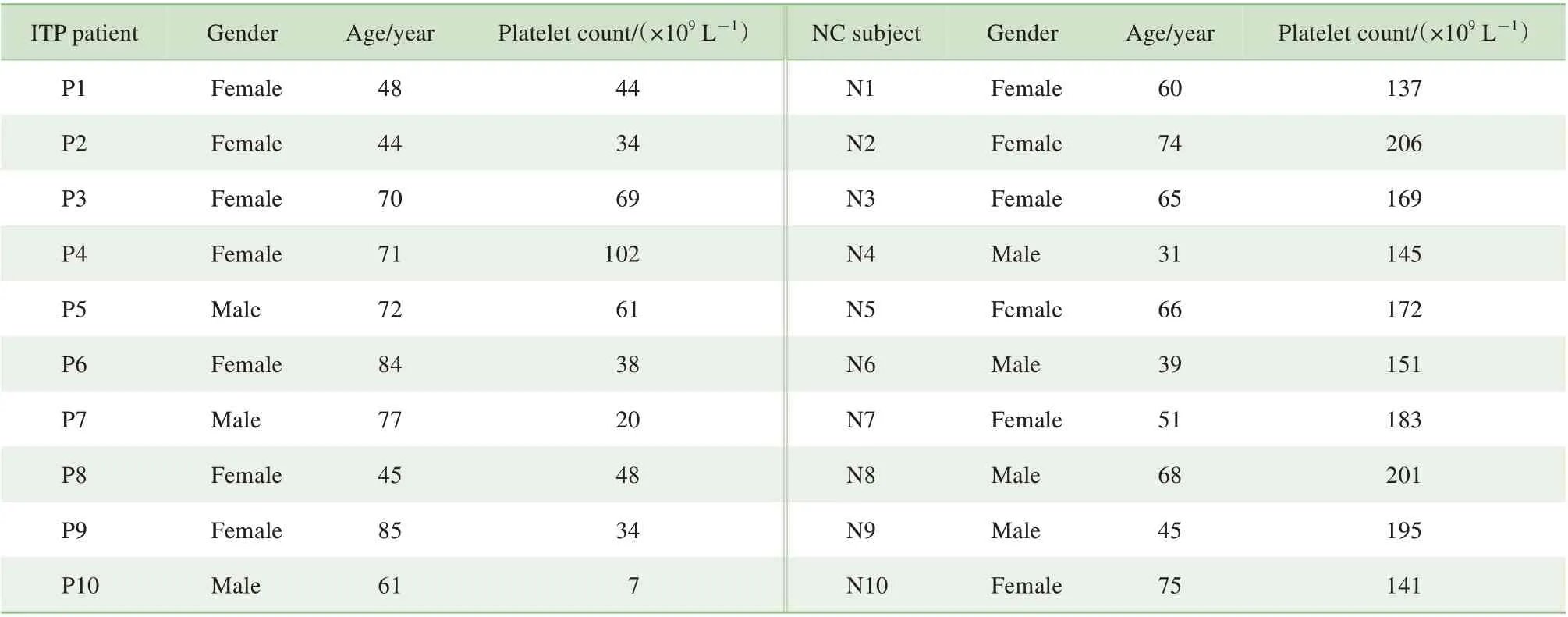
表1 纳入研究的ITP患者和对照组的临床信息Tab 1 Clinical information of the ITP patients and the normal controls enrolled in the study
1.2 主要试剂和仪器
DMEM 低糖培养液购自中国杭州吉诺生物技术有限公司,胎牛血清(FBS)购自美国赛默飞世尔科技有限公司,CCK-8 试剂盒购自东仁化学科技(日本)有限公司,人间充质干细胞分析试剂盒(human MSC analysis kit)、Annexin V-FITC/PI 细胞凋亡双染试剂盒购自美国BD 生物科学有限公司,EdU 细胞增殖检测试剂盒购自上海雅酶生物医药科技有限公司,微管荧光探针(tubulin-tracker red)、Hoechst 33258购自上海碧云天生物技术有限公司,抗促凋亡蛋白BAX 抗体(目录号5023)、 抗胱天蛋白酶3(caspase3)抗体(目录号9662)、抗cleaved-caspase3抗体(目录号9664) 购自美国Cell Signaling Technology 公司,山羊抗兔IgG 二抗(目录号ab205718)、兔抗小鼠IgG 二抗(目录号ab6728)购自美国Abcam公司。
多功能酶标仪(Synergy H1M)购自美国BioTek仪器有限公司,化学发光及双色红外荧光成像系统(Odyssey FC)购自美国Licor生物科技有限公司,流式细胞分析仪(LSRFortessa)购自美国BD 生物科学有限公司,激光共聚焦显微拍摄系统(LSM 800)购自德国蔡司集团。
1.3 实验方法
1.3.1 MSC 的分离培养及表面标志物的鉴定 取骨髓穿刺标本3~5 mL 置于EDTA 抗凝管中,加入DMEM 低糖培养基后重悬,离心,弃上清液;下层沉淀接种于细胞培养瓶,以DMEM 培养基(含10%FBS)培养,并采用差速贴壁法使MSC 黏附。第2~6代细胞用于后续实验。
骨髓MSC 鉴定:使用人间充质干细胞分析试剂盒对体外培养的骨髓MSC 进行初步表型鉴定。取分离传代的第3 代细胞,按试剂盒使用书操作,于流式细胞仪上检测。
1.3.2 荧光显微镜观察细胞形态和细胞增殖情况 将EdU 试剂加入已贴壁24 h 的MSC 培养基中培养2 h。随后用预冷PBS 洗涤2 次,并用4%多聚甲醛固定15 min。经0.1% Triton-X 透化和BCA 封闭后,按EdU细胞增殖检测试剂盒说明书操作。随后将细胞与Hoechst 33258 和微管荧光探针一起温育,洗涤封片后在荧光显微镜下观察染色的细胞。
1.3.3 CCK-8 试剂盒检测细胞增殖状况检测 将细胞浓度调至2×105/mL,每孔100µL 接种到96 孔细胞培养板上,并培养12~24 h,随后将CCK-8 试剂添加到孔中并孵育,最后在酶标仪上测定450 nm 处的吸光度值[D(450 nm)]。
1.3.4 细胞凋亡水平检测 将贴壁24 h 的MSC 细胞爬片,用预冷PBS 洗涤2 次,并用4%多聚甲醛固定15 min。加入少量Hoechst 33258 覆盖样本后室温放置3~5 min。吸除Hoechst 33258 染色液,用PBS 洗涤2~3次,每次3~5 min。封片后荧光显微镜下观察。
采用细胞凋亡双染试剂盒检测细胞凋亡水平。收集细胞重悬于结合缓冲液(binding buffer),每份样品约5×105个细胞,随后按照说明书操作,最后在流式细胞仪上检测。实验重复3次。
1.3.5 地西他滨浓度探索 根据参考文献[8,10,12]探索地西他滨的最适浓度和作用时间。将ITP 患者来源的MSC(MSC-ITP)按地西他滨的处理浓度(10、5、1、0.5 和0 μmol/L)分为5 个组。每个组设5 个孔,CCK-8 法分别记录0 h、12 h、24 h、48 h 时的吸光值。找到刺激MSC-ITP 的最佳处理浓度和处理时间。
1.3.6 Western blotting检测凋亡相关蛋白表达量 将细胞用预冷的PBS 洗涤2 次,并在冰上裂解细胞,提取蛋白。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后将蛋白转移至硝酸纤维素膜上。之后将膜在室温下用5%脱脂奶粉封闭1 h。清洗3 次,加入一抗(抗BAX 抗体、抗caspase3 抗体、抗cleaved-caspase3 抗体)孵育,β-肌动蛋白(β-actin)作为内参蛋白。清洗3 次,加入抗小鼠或抗兔的二抗孵育。使用ECL 化学发光试剂盒进行显影。所有实验进行3次,通过ImageJ软件进行定量分析,通过将每个蛋白条带的单独灰度除以β-肌动蛋白来计算归一化灰度。
1.4 统计学方法
使用Graphpad Prism 8.0 软件对各实验结果进行统计学分析。符合正态分布的定量资料采用±s表示,2 组间比较采用t检验,多组间比较采用单因素方差分析法。P<0.05 表示差异具有统计学意义。每组数据独立重复3次。
2 结果
2.1 MSC表型鉴定
采用流式细胞术分析研究体外培养的ITP 患者来源(n=5)及对照组来源(n=5)的细胞表面抗原标志物。ITP 患者及对照组细胞表面表达CD90、CD73和CD105 (图1),不表达CD34、CD11b、CD19、CD45、HLA-DR等。这些结果表明ITP患者及对照组体外培养并分离的长梭形贴壁细胞在表型上与典型的MSC一致。
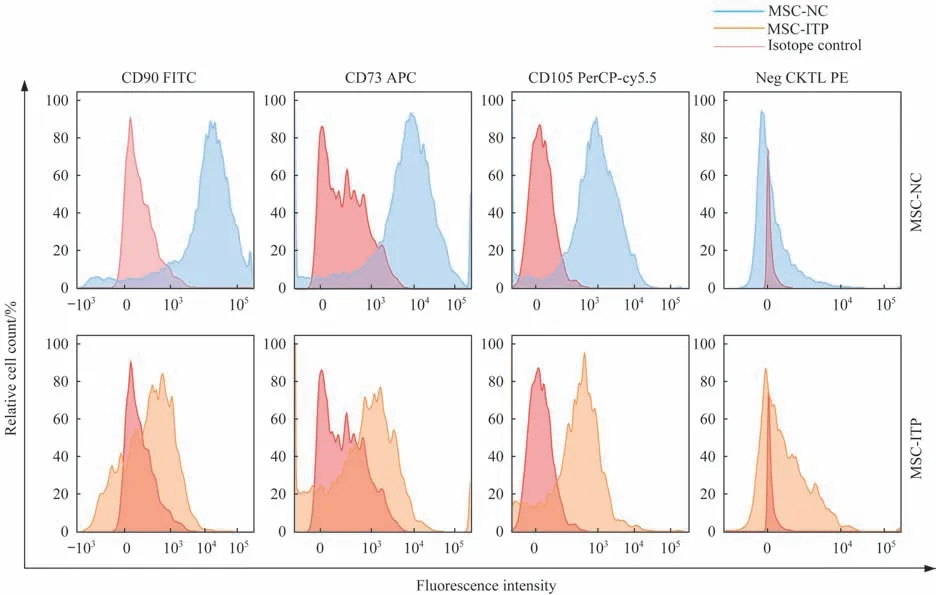
图1 流式细胞术鉴定体外培养MSC表型Fig 1 Phenotype of MSCs cultured in vitro identified by flow cytometry
2.2 ITP 患者来源MSC 细胞形态异常和细胞增殖减弱
如图2 所示,MSC-NC 在培养过程中扩增并获得纺锤形形态;相比之下,MSC-ITP 扩增速度较慢(图2A)。CCK-8 法测定显示,MSC-ITP 与对照组相比增殖能力较低(图2B)。EdU 测定也显示MSC-ITP与对照组相比增殖能力受损;微管荧光探针显示MSC-ITP 与对照组相比,细胞体积增大,形态扁平,失去长梭形形态并出现多个类似丝足的长细胞突起(图2C)。

图2 ITP患者来源MSC增殖水平和细胞形态检测Fig 2 Detection of proliferation and morphology of MSCs derived from ITP patients
2.3 ITP患者来源MSC基础凋亡增多
使用Hoechst 33258 染液对MSC 的凋亡进行形态学测定。MSC-NC 具有正常的圆形和规则的细胞核;相比之下,在MSC-ITP 中观察到较多的细胞核碎裂,呈致密浓染,这是凋亡细胞的特征(图3A)。我们使用双染凋亡试剂盒进一步评估了细胞凋亡率。MSCITP的总凋亡率(AV+PI+/−)显著高于MSC-NC,且主要以晚期凋亡(AV+PI+)为主(图3B)。
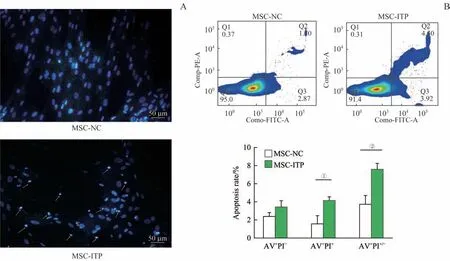
图3 ITP患者来源MSC基础凋亡水平检测Fig 3 Detection of basal apoptosis in MSCs derived from ITP patients
2.4 地西他滨增强ITP 患者来源MSC 增殖活性的最佳浓度
用CCK-8 法研究DNA 甲基转移酶抑制剂地西他滨对MSC-ITP 细胞增殖能力的提升作用。如图4 显示,地西他滨对促进MSC-ITP 的作用具有一定的浓度依赖性,其最佳作用浓度为2.5 μmol/L,最佳作用时间为24 h;与其他浓度相比,2.5 μmol/L 地西他滨处理24 h 后,培养体系中MSC-ITP 的增殖效率最高。

图4 CCK-8法测定不同剂量、不同处理时间下地西他滨对MSC-ITP增殖的影响Fig 4 Effect of decitabine on MSC-ITP proliferation under different doses and working hours detected by CCK-8 assay
2.5 地西他滨处理后ITP患者来源MSC凋亡减少
如图5A 所示,MSC-ITP 在2.5 μmol/L 地西他滨处理24 h后细胞核形态得到改善,细胞核的碎裂和凝聚减少,MSC-ITP总凋亡率显著降低(P=0.015),而MSC-NC 凋亡也减少,但差异无统计学意义(图5B)。
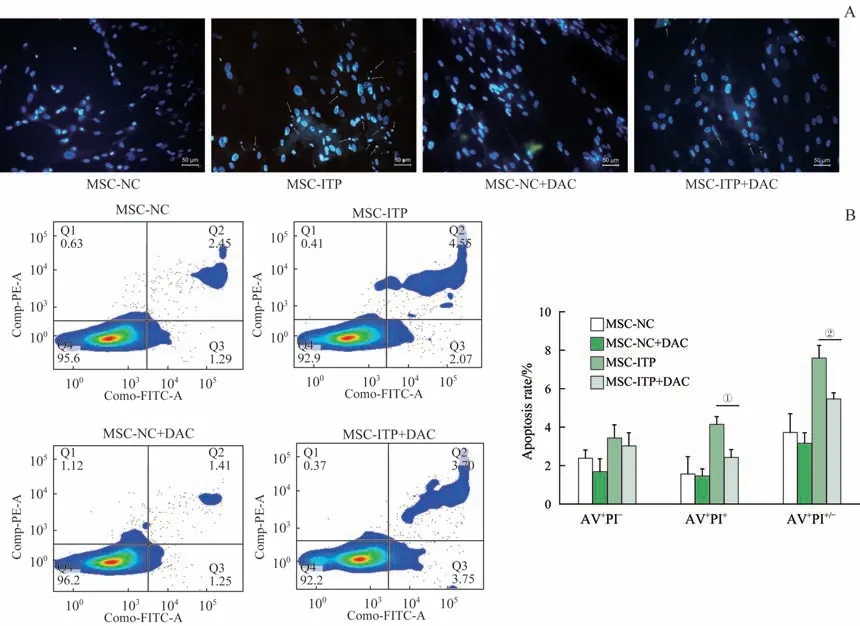
图5 2.5 μmol/L地西他滨处理24 h后MSC-ITP的凋亡检测Fig 5 Apoptosis detection of MSC-ITP after 2.5 μmol/L decitabine treatment for 24 h
2.6 地西他滨减少MSC 凋亡可能与线粒体凋亡通路有关
线粒体在细胞凋亡中发挥着关键性作用。为了研究地西他滨处理后MSC-ITP 凋亡过程中线粒体凋亡通路活化水平的变化,采用Western blotting 进行蛋白层面的研究。如图6 结果显示:MSC-ITP 凋亡相关蛋白BAX、caspase3 和cleaved-caspase3 水平均较高,用2.5 μmol/L 地西他滨处理24 h后,这些蛋白水平均显著下降(均P<0.05)。从蛋白水平证明低剂量地西他滨可以降低MSC 的凋亡水平,且这种保护作用可能与抑制线粒体凋亡通路有关。

图6 Western blotting检测凋亡相关蛋白BAX、caspase-3和cleaved-caspase3的表达量Fig 6 Expression levels of apoptosis-related proteins BAX,caspase-3 and cleaved-caspase3 detected by Western blotting
3 讨论
原发ITP 发病机制目前尚未完全阐明,免疫失耐受导致血小板破坏增加或血小板产生不足可能是患者发病的重要原因。免疫异常主要涉及体液免疫、细胞免疫2个方面[20]:体液免疫方面,表现为T细胞亚群功能异常和细胞比例失调导致B细胞异常激活,产生大量血小板表面膜糖蛋白特异性抗体,并加强了单核巨噬系统对血小板的破坏;细胞免疫方面,表现为细胞毒性T细胞的异常活化导致对正常血小板的杀伤增多,同时Treg 细胞的减少和功能受损,辅助T 细胞Th1/Th2比例失衡,Th17及Th22细胞增多等。
成骨细胞、血管周围细胞、内皮细胞、间充质细胞和各种成熟的免疫细胞等多种细胞构成了骨髓微环境[21]。血小板生成发生在骨髓微环境中,其中各个组分都会影响血小板的生成。ITP 患者的骨髓微环境异常表现包括Th1、Tc1 和Th17 细胞的过度极化以及Treg 细胞的显著减少[22]。MSC 作为骨髓微环境中重要组成部分,是十分重要的免疫抑制类细胞。很多研究[6-8]发现,慢性ITP患者来源的骨髓MSC的增殖能力受损,抑制活化T细胞增殖的能力较弱,诱导Treg细胞的能力较弱。此外,在ITP 动物模型或患者中,通过移植正常骨髓或脐带的MSC 可逆转Th1/Th2 细胞因子的失衡状态,改善血小板的生成,并减轻巨核细胞功能障碍,这表明MSC 的损伤可能与ITP 的发病机制有关[23]。
多种自身免疫性疾病存在基因组DNA 的异常甲基化,且异常甲基化与疾病的发病有关。ITP 作为一种自身免疫性疾病,同样存在DNA甲基化异常现象。研究[24]发现,ITP 患者血浆S-腺苷同型半胱氨酸浓度升高,外周血单个核细胞中DNA 甲基转移酶3A(DNA methyltransferase 3A,DNMT3A) 和DNMT3B在mRNA 水平上显著低于对照组。地西他滨是一种具有双重机制的去甲基化药物:低剂量地西他滨(<5 μmol/L)处理可以促进巨核细胞生长分化[18,25]、调节T 细胞稳态[26]、抵御MSC 衰老[16]等;大剂量地西他滨(>10 μmol/L)处理人骨髓增生异常综合征(MDS)细胞系SKM-1 后,凋亡率大于20%[27]。在急性T 淋巴细胞白血病细胞株MOLT4 细胞中,地西他滨作用呈现剂量依赖性,10 μmol/L 诱导凋亡率为43.70%,50 μmol/L诱导凋亡率为62.38%[28]。
研究表明低剂量地西他滨在免疫调节中发挥重要作用。基于GO 和KEGG 数据库的基因微阵列分析[29]发现,地西他滨上调的基因大部分富集于免疫调节通路和与免疫相关的信号转导通路。在本研究中,我们发现MSC-ITP 与对照组相比增殖能力受损,增殖速度明显缓慢;同时细胞形态改变,表现为细胞体积增大,形态扁平,失去长梭形形态,并出现多个类似丝足的长细胞突起,而这种细胞形态改变被认为是受到微环境中炎症相关介质的影响[30]。在其细胞核染色过程中我们发现与对照组相比,MSC-ITP 的细胞核碎块状致密浓染明显较多,整体细胞核大小形态也不均一,这些是凋亡的主要特征。凋亡试剂盒和流式细胞术进一步评估了细胞凋亡率,发现MSC-ITP的总凋亡率高于MSC-NC,其中主要以晚期凋亡为主。
有不同文献报道了地西他滨对于MSC 的刺激作用,然而其最佳工作浓度和工作时间不尽相同。本研究利用浓度曲线测定显示,地西他滨浓度为2.5 μmol/L且在处理24 h 后,培养体系中MSC-ITP 的增殖效率最高;而在10 μmol/L 处理时则无明显的促细胞增殖作用。利用2.5 μmol/L 地西他滨处理24 h 后,MSCITP 细胞核形态改善,细胞核的碎裂和凝聚减少。我们的结果显示,去甲基化药物可能有刺激MSC 增殖、减少MSC-ITP凋亡的作用。
细胞凋亡,也称为程序性细胞死亡,是一种细胞自主机制,依赖于通路控制的caspase 和核酸酶的激活,导致受损细胞死亡而不影响邻近细胞[31]。线粒体凋亡通路是凋亡最重要的通路。在细胞凋亡过程中,线粒体膜通透性增加,促凋亡因子释放到细胞质中,从而激活caspase家族下游蛋白caspase3,凋亡进入不可逆阶段[32]。我们的研究表明MSC-ITP 与对照组相比,凋亡通路蛋白水平更高,证明MSC-ITP 的凋亡与线粒体凋亡通路相关;而在小剂量地西他滨处理后MSC-ITP与对照组都表现出BAX降低,caspase-3和cleaved-caspase3 减少,证明MSC 凋亡被抑制,且低剂量地西他滨的这种保护作用可能与其抑制线粒体凋亡通路有关。
综上所述,本研究通过体外培养ITP 患者和对照组来源的MSC 进行生物学行为比较,证明MSC-ITP表现出增殖能力受损和细胞凋亡增多,这表明MSC可能是ITP 发病机制中的重要一环。我们证明低剂量地西他滨可能通过抑制线粒体凋亡通路来保护ITP 患者来源的MSC 免受凋亡。本研究为进一步阐明ITP的发病机制及提升相关针对性治疗的研究提供了新的体外实验理论依据。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
伦理批准和知情同意/Ethics Approval and Patient Consent
本研究涉及的所有实验均已通过上海交通大学医学院附属仁济医院伦理委员会的审核批准(文件号RA-2014-267)。所有实验过程均遵照《上海交通大学医学院附属仁济医院伦理标准/守则》的条例进行。受试对象或其亲属已经签署知情同意书。
All experimental protocols in this study were reviewed and approved by Ethics Committee of Renji Hospital, Shanghai Jiao Tong University School of Medicine (Approval Letter No. RA-2014-267), and all experimental protocols were carried out by followingGuidelines of Renji Hospital,Shanghai Jiao Tong University School of Medicine. Consent letters have been signed by the research participants or their relatives.
作者贡献/Authors'Contributions
王昕芃、蔡佳翌、王君颖、钟华参与实验设计;王昕芃、付婉彬、钟华参与论文的写作和修改。所有作者均阅读并同意最终稿件的提交。
The study was designed by WANG Xinpeng, CAI Jiayi, WANG Junying and ZHONG Hua. The manuscript was drafted and revised by WANG Xinpeng, FU Wanbing and ZHONG Hua. All the authors have read the last version of paper and consented for submission.
·Received:2022-02-11
·Accepted:2022-05-11
·Published online:2022-06-28

