TRMT61A在肝癌细胞中的功能及其机制研究
胡哲轩,张 欣,沃璐璐,李静池,王 娇,周佽想,赵 倩,2
1.上海交通大学医学院病理生理学系,细胞分化与凋亡教育部重点实验室,上海 200025;2.中国医学科学院应激与肿瘤创新单元(2019RU043),上海 200025
肝癌是一种常见的消化系统恶性肿瘤。据统计,2020 年肝癌的发病率和病死率在恶性肿瘤中分别居于世界第6 位和第3 位;尤其在男性肿瘤患者中,肝癌的病死率排名第2 位[1]。原发性肝癌有多种类型,其中肝细胞肝癌约占所有病例的90%,是最常见的一种肝癌类型[2]。肝细胞肝癌发病的危险因素多种多样,主要包括慢性乙型肝炎病毒(hepatitis B virus,HBV)或丙型肝炎病毒(hepatitis C virus,HCV)感染、长期饮酒、2型糖尿病等。近年来,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)正快速发展为肝细胞肝癌高危病因之一[3]。手术切除和肝移植一直以来是肝细胞肝癌主要的根治性治疗手段。除了常规治疗方案之外,针对早期肝癌的局部射频消融术、治疗中期肝癌的肝动脉化疗栓塞、经动脉放射栓塞等不同手段均展现出良好的治疗前景[4-5]。然而,肝细胞肝癌仍缺乏有利于前期诊断的生物学标志物,其发生和发展机制也尚未研究清楚。
N1-甲基腺苷(N1-methyladenosine,m1A)是一种转录后水平的RNA 甲基化修饰,指腺苷酸第一位N 原子甲基化修饰,最早在不同生命体的tRNA 核苷酸位点上(9、14、22、57、58)被发现。在哺乳动物中,最具有代表性和高度保守性的tRNA 修饰位点位于第9 位和第58 位核苷酸。研究发现,这2 个位点上的m1A 修饰都与tRNA 的结构稳定性和正确折叠相关[6],如在酵母中tRNA 第58 位核苷酸m1A 修饰(m1A58) 的缺失会导致携带起始密码子的tRNAMet 发生降解[7]。TRMT6/TRMT61A 复合体是负责催化真核生物tRNA 上m1A58 修饰的腺嘌呤甲基转移酶,其中TRMT61A 属于催化蛋白亚基,TRMT6 属于RNA 结合亚基[8]。越来越多的研究发现,异常的m1A 修饰与不同的病理生理过程或疾病相关。数据库分析研究结果显示,在包含肝细胞肝癌的多种消化系统肿瘤患者标本中m1A 修饰水平异常升高,提示m1A修饰可能参与不同肿瘤发生和发展过程[9-10]。然而,关于m1A修饰如何影响肝细胞肝癌的发生和发展的研究并不多。本研究以2 种肝癌细胞(Huh7细胞和HepG2细胞)作为疾病细胞模型,探究m1A 修饰甲基转移酶亚基TRMT61A对肝癌细胞功能的影响,为进一步探索m1A修饰对肝细胞肝癌发生和发展的影响,进而探索该病新的诊断、治疗方法提供参考。
1 材料与方法
1.1 细胞与试剂
肝癌细胞系HepG2 购于ATCC;Huh7 细胞系由本课题组长期保存于液氮中。CCK-8试剂盒[东仁化学科技(上海)有限公司],碘化丙啶(propidium iodide,PI)(Sigma,美国),甲基蓝(methyl blue,MB)染色液、结晶紫染液、Annexin V/PI 细胞凋亡检测试剂盒(上海碧云天生物技术有限公司),TRMT61A 抗体[爱必信(上海)生物科技有限公司],cyclin D1 抗体、cyclin E1 抗体、β-tubulin 抗体(Proteintech 公司,美国),m1A 抗体(Abcam 公司,英国),P53 抗体、PARP 抗体、cleaved caspase3 抗体、P21 抗体(CST 公司,美国),台盼蓝染液、TRIzol、Lipofectamine 2000 转染试剂(Invitrogen 公司,美国),高糖DMEM 培养基(上海源培生物科技股份有限公司),胎牛血清(fetal bovine serum,FBS)(Sigma 公司,美国),ECL 显影液(上海圣尔生物科技有限公司)。
1.2 细胞培养
人肝癌细胞系Huh7 和HepG2 细胞均培养于37 ℃、5%CO2的恒温细胞培养箱中,均采用含10%FBS 的DMEM 培养基进行培养。每日观察细胞状态与生长密度,2~3 d进行细胞传代。
1.3 生物信息学分析
使用GEPIA 生物信息学网站(http://gepia.cancer-pku.cn/)在线分析TCGA 数据库中TRMT61A在肝癌患者癌与癌旁组织中的表达情况。其中,肝癌组织样本数为369,癌旁组织样本数为50。使用该网站在线绘制高表达或低表达TRMT61A肝癌患者生存曲线。
1.4 构建稳定敲低TRMT61A 肝癌细胞系及细胞分组
设 计 并 合 成TRMT61A的2 条sgRNA (single guide RNA)引物序列,分别为1 号、2 号片段,在引物两端添加酶切位点,磷酸化引物并退火。将sgRNA 连接于酶切后的lentiCRISPRv2 载体上,分别构建质粒并测序鉴定。将含1 号、2 号片段的质粒各自与慢病毒包装质粒共转染293T 细胞,收集48 h 或72 h 病毒上清,感染目的细胞Huh7 和HepG2 肝癌细胞系。感染1 号片段病毒上清所得的细胞作为1 号敲低组(KD-1 组),感染2 号片段病毒上清所得细胞为2 号敲低组(KD-2 组),仅转染包装质粒病毒上清感染所得细胞为对照组(NC 组),用嘌呤霉素(puromycin) 进行最终筛选。使用有限稀释法在96 孔板中挑选单克隆,依次过渡到24 孔板、12 孔板和6 孔板,最后通过蛋白质印迹法(Western Blotting) 检测细胞TRMT61A 蛋白水平确定阳性克隆。
1.5 斑点印迹实验检测细胞总RNA水平m1A修饰
对照组、KD-1 组、KD-2 组细胞用TRIzol 裂解,常规提取细胞RNA,定量并稀释至1 μg/μL。取适量RNA 于65 ℃处理5 min 使其变性,滴于尼龙膜上,进行紫外自动交联。1×PBST 温和洗去膜上未结合RNA,使用5%牛奶(脱脂奶粉与1×PBST 配制) 封闭1 h。1×PBST 温和清洗,使用m1A 抗体(2 μg/mL,5%BSA 配制)室温孵育1 h。1×PBST 温和清洗3 次,5 min/次。使用抗兔二抗室温孵育1 h。1×PBST 温和清洗3 次,5 min/次。孵育显影液曝光显影。孵育甲基蓝染液20 min,染色总RNA,扫描膜成图。
1.6 CCK-8法检测细胞增殖
将对照组细胞和敲低组细胞按照1 000 个/孔种于96 孔板中,同时每组按3 000、6 000、12 000、24 000个细胞梯度种于96孔板,设置3个复孔进行培养。待细胞贴壁生长后,分别于第0、1、2、3 日在每孔培养基中加入10 μL的CCK-8试剂,孵育2 h后,检测每孔450 nm 波长处的吸光度值[D(450 nm)]。并根据标准曲线计算对应细胞数,绘制增殖曲线。
1.7 平板克隆实验
将对照组细胞和敲低组细胞按照250 个/孔种于24 孔板中。每日观察细胞状态,3~4 d 后进行细胞换液,培养10~14 d。撤去每孔培养基,PBS 清洗2 次。每孔加入预冷甲醇固定15 min,弃甲醇,加入0.01%结晶紫溶液染色1 h。染色完成后用流水清洗,晾干,显微镜下观察克隆,统计每组≥50 个细胞的细胞克隆数。
1.8 细胞周期及其相关蛋白检测
将对照组细胞和敲低组细胞用胰酶消化,离心收集,部分用于后续蛋白检测。部分加入PBS 清洗细胞,再次离心收集,加入终浓度为75%的无水乙醇混匀,−20 ℃下固定细胞过夜。细胞固定完成后,加入PBS 清洗细胞,2 000×g离心10 min,重复清洗、离心,加入5 μL 浓度为10 mg/mL 的RNA酶,37 ℃水浴30 min,室温加入PI 染料,避光孵育15 min。用流式细胞仪检测不同细胞周期的细胞占比并分析。
取前步骤所收集部分细胞沉淀,使用PBS重悬细胞,并按1∶1 加入等体积2×SDS 细胞裂解液充分裂解,105 ℃加热5 min,冰浴5 min,重复3 次,12 000×g离心5 min。所得上清液为蛋白样品,采用Western blotting 方法,使用P21 抗体、P53 抗体、cyclin D1抗体、cyclin E1抗体检测相关蛋白水平。
1.9 细胞凋亡及其相关蛋白检测
收集对照组和敲低组细胞培养基上清,用不含EDTA 的胰酶消化细胞。用收集的培养基上清终止胰酶消化,离心收集细胞,用PBS 清洗重悬细胞并计数,部分细胞用于后续蛋白检测。每组各取5 万~10 万个细胞,1 000×g离心5 min,依次加入Annexin V-FITC结合液、Annexin V 染液和PI染色液,轻轻混匀细胞,室温避光孵育10~20 min,用流式细胞仪进行检测。
蛋白样品制备如前所述,采用Western blotting 方法,使用PARP 抗体、Cleaved caspase3 抗体检测相关蛋白水平。
1.10 统计学方法
使用FlowJo 10.4 软件分析流式细胞仪检测结果。使用GraphPad Prism 8 软件进行统计学分析并绘制柱状图。定量资料用±s表示,2 组间比较采用t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 TRMT61A 在肝癌组织样本中的表达及其与预后的关系
通过生物信息学软件分析发现,在TCGA数据库中,相比于癌旁组织,TRMT61A在肝癌组织样本中高表达(图1A)。绘制患者生存曲线,结果显示TRMT61A的表达与肝癌患者的预后呈明显的负相关(图1B)。
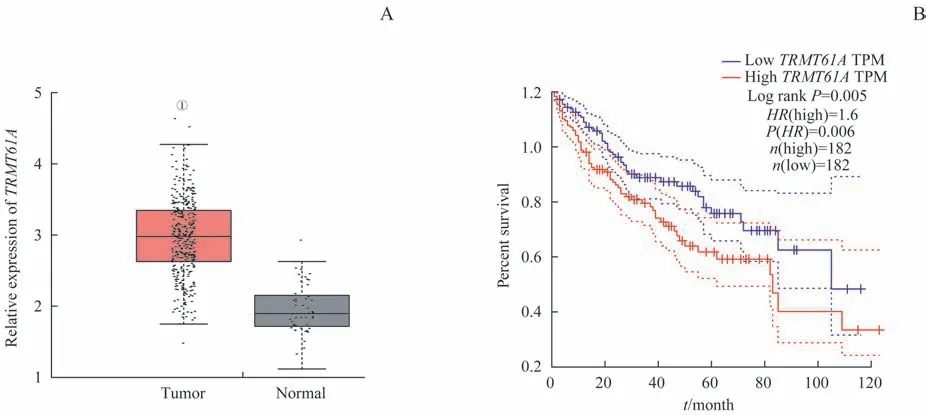
图1 TRMT61A在肝癌组织样本中的表达及其与预后的关系Fig 1 Expression of TRMT61A in hepatocellular carcinoma samples and its correlation with prognosis
2.2 稳定敲低TRMT61A肝癌细胞系的构建和验证
Western blotting 及斑点印迹实验结果显示,在Huh7 和HepG2 细胞中,相比于NC 组,KD-1 组和KD-2 组细胞的TRMT61A 蛋白水平显著下降(图2A~D),总RNA 的m1A 修饰水平也明显降低(图2E、F);相比于KD-2 组,KD-1 组细胞TRMT61A敲低效果更好,m1A 修饰水平更低。因此,采用KD-1组作为敲低组细胞进行后续功能实验。
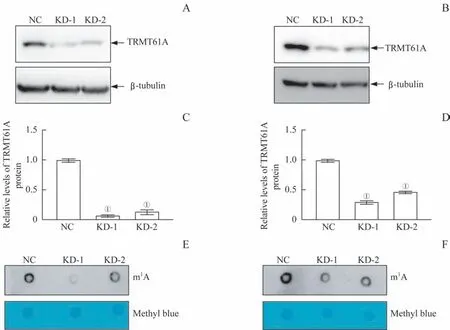
图2 稳定敲低TRMT61A肝癌细胞系Huh7和HepG2的构建和验证Fig 2 Establishment and confirmation of stably-TRMT61A-knockdown Huh7 and HepG2 cells
2.3 敲低TRMT61A对肝癌细胞增殖能力的影响
CCK-8 检测结果显示,在2 株肝癌细胞中,相比于对照组,从实验第2 日开始,敲低组细胞增殖情况明显受到抑制(图3A、B)。同样,平板克隆实验结果也显示在Huh7 和HepG2 细胞中稳定敲低TRMT61A后,克隆形成数目均显著降低,证实敲低TRMT61A可以显著抑制肝癌细胞的增殖能力(图3C~F)。

图3 敲低TRMT61A对肝癌细胞增殖功能的影响Fig 3 Effects of TRMT61A knockdown on proliferation of Huh7 and HepG2 cells
2.4 敲低TRMT61A对肝癌细胞周期的影响
流式细胞仪检测结果显示,在Huh7(图4A、B)和HepG2(图4C、D)细胞中,相比于对照组,稳定敲低TRMT61A后细胞处于G0/G1 期的比例均显著上升,其中Huh7 细胞敲低组处于S 期的细胞占比显著下降,表明细胞出现了显著的G0/G1 周期阻滞。
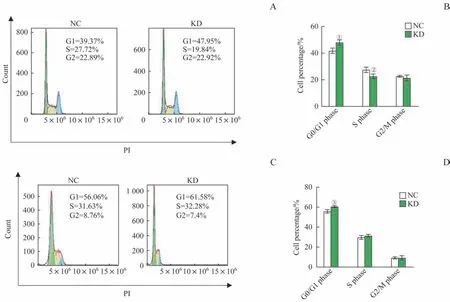
图4 敲低TRMT61A对肝癌细胞周期的影响Fig 4 Effects of TRMT61A knockdown on cell cycle of Huh7 and HepG2 cells
2.5 敲低TRMT61A对肝癌细胞调控细胞周期相关蛋白表达的影响
通过Western blotting 检测细胞周期相关蛋白水平并对结果进行灰度扫描分析发现,在Huh7 和HepG2细胞中,与对照组相比,敲低组细胞P21 蛋白水平均明显上升,cyclin D1 蛋白水平明显下降,而2 组细胞P53 和cyclin E1 蛋白水平的差异无统计学意义(图5)。

图5 敲低TRMT61A对肝癌细胞调控细胞周期相关蛋白表达的影响Fig 5 Effects of TRMT61A knockdown on cell cycle-related protein levels in Huh7 and HepG2 cells
2.6 敲低TRMT61A对肝癌细胞凋亡的影响
对Huh7 和HepG2 细胞进行Annexin V/PI 共染色后,通过流式细胞仪分析发现Huh7 细胞和HepG2 细胞中,相比于对照组,敲低组细胞中处于早期凋亡(Annexin V+/PI−,右下象限)的细胞占比和晚期凋亡(Annexin V+/PI+,右上象限)的细胞占比均升高(图6A~D)。Western blotting 结 果 表 明,在Huh7 和HepG2细胞中,相比于对照组,敲低组细胞剪切活化caspase3蛋白水平均升高(图6E~G)。
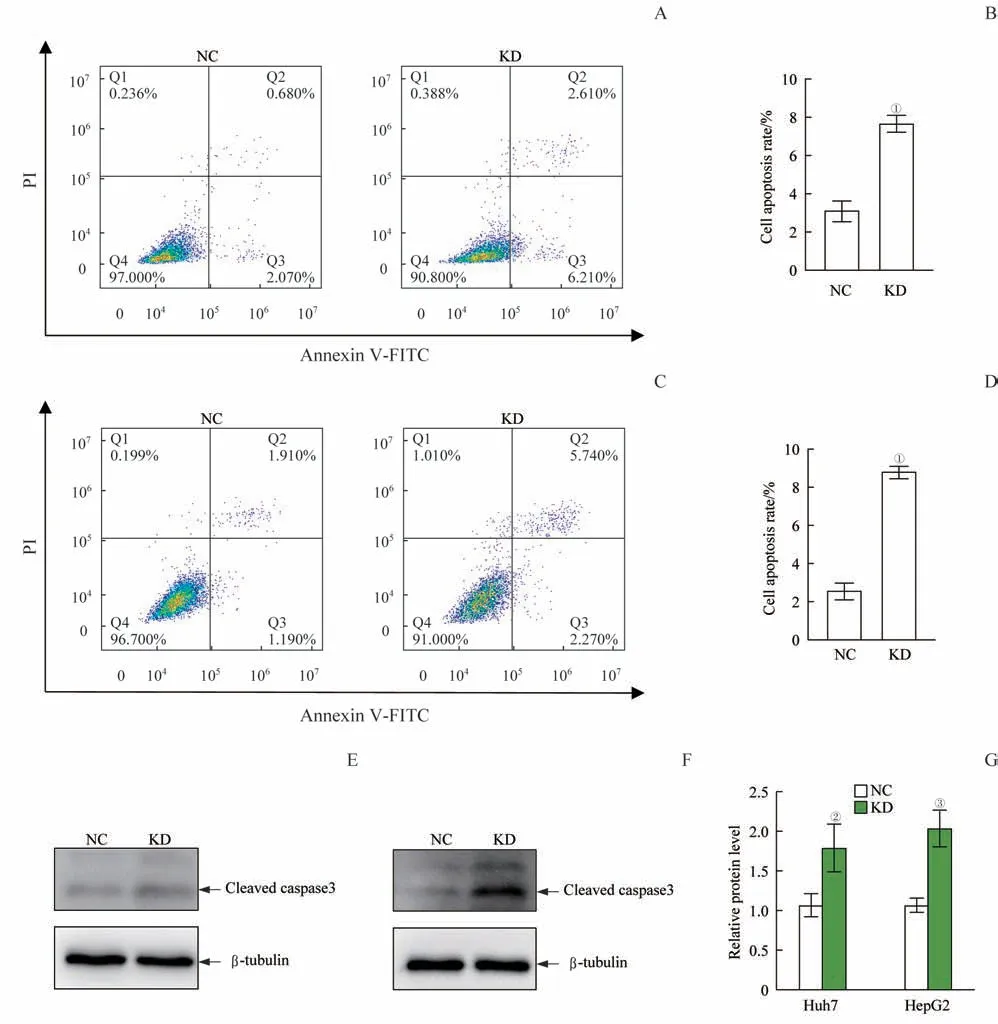
图6 敲低TRMT61A对Huh7和HepG2细胞凋亡的影响Fig 6 Effects of TRMT61A knockdown on cell apoptosis in Huh7 cells and HepG2 cells
3 讨论
肝细胞肝癌是一种恶性程度高、早期不易诊断的原发性肝脏肿瘤,近年来新辅助治疗、免疫治疗与转化治疗的临床研究为肝细胞肝癌的治疗提供了新的思路[11-12]。然而,肝细胞肝癌潜在的特定诊断标志物与治疗靶点仍然需要更深入的研究。
m1A 修饰是一种RNA 甲基化修饰,研究表明m1A 修饰可参与调控多种生命活动[13]。在tRNA 上的第58 位氮原子是高度保守且重要的m1A 修饰位点,TRMT61A 作为m1A58 甲基转移酶的催化亚基,其活性与tRNA 结构稳定性以及蛋白翻译进程有密切关系,可影响人体多种病理生理学过程[14-16]。但关于m1A 修饰在肝癌细胞功能中的作用,尚未见报道。
本研究为了探究m1A修饰在肝癌细胞功能中的作用,首先构建了稳定敲低TRMT61A的2 株肝癌细胞,即Huh7 和HepG2,验证结果发现敲低组细胞总RNA的m1A修饰水平明显下降。然后,将对照组与敲低组细胞进行细胞功能实验,探究敲低TRMT61A对肝癌细胞功能的作用及其机制。结果表明,在Huh7 和HepG2细胞中,相比于对照组,敲低组细胞增殖能力明显减弱。进一步通过检测细胞周期和相关蛋白表达发现,敲低TRMT61A后肝癌细胞P21 蛋白水平上调,cyclin D1 蛋白水平下降,细胞发生G0/G1 周期阻滞;另外,我们发现敲低TRMT61A可上调肝癌细胞内剪切活化的caspase3,并诱导肝癌细胞发生凋亡。
近年来,越来越多的研究发现异常的m1A修饰与多种肿瘤相关:TRMT61A与生殖细胞肿瘤患者预后有关[17];m1A 去甲基化酶ALKBH3的异常表达与卵巢癌和乳腺癌的侵袭[18]、尿路上皮癌的进展[19]有密切联系。这些研究结果提示m1A修饰可能在肿瘤发生和发展过程中发挥调控作用,但m1A修饰具体的作用靶点仍需要更深入的研究。除了tRNA 外,在mRNA、rRNA 上都有m1A 修饰的分布[20]。虽然m1A修饰在mRNA 上的丰度不如tRNA,但tRNA 的甲基化酶可以识别mRNA 上含有类似tRNA 模序“GUUCRA”的环状结构(T-loop-structure),进而对mRNA 进行m1A 修饰[21]。有学者发现m1A 修饰的峰值富集于5'-UTR 和以起始密码子为中心的50 nt 周围区域[22]。这些区域更倾向于形成稳定的二级结构,可能进一步影响转录本的翻译过程[23]。本研究发现在肝癌细胞中敲低TRMT61A表达后,细胞P21 和活化的caspase3 蛋白水平均升高,cyclin D1 蛋白水平有所下降,导致细胞增殖受到抑制,并发生凋亡。而m1A修饰是否直接作用于这些蛋白对应的转录本或携带特定氨基酸的tRNA 从而影响翻译进程,仍然需要更深入的探索。
综上所述,本研究发现m1A 修饰催化亚基TRMT61A表达降低可显著抑制肝癌细胞的增殖能力,上调细胞P21蛋白并下调cyclin D1蛋白,使细胞发生周期阻滞;同时,可诱导肝癌细胞发生凋亡,进一步降低肝癌细胞存活率。该结果可为肝细胞肝癌发生和发展的机制研究提供新的思路。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
作者贡献/Authors'Contributions
胡哲轩、张欣参与实验设计;胡哲轩负责论文的写作和修改;沃璐璐、李静池、王娇参与文献检索;周佽想负责研究方案核实;赵倩负责实验指导与论文审阅。所有作者均阅读并同意最终稿件的提交。
The study was designed by HU Zhexuan and ZHANG Xin . The manuscript was drafted and revised by HU Zhexuan . The document was searched by WO Lulu, LI Jingchi and WANG Jiao. The procedure was verified by ZHOU Cixiang.The research was guided by ZHAO Qian. All the authors have read the last version of paper and consented for submission.
·Received:2022-03-16
·Accepted:2022-05-25
·Published online:2022-06-28

