基于网络药理学探讨十一味参芪制剂治疗肿瘤作用机制研究
黄博威,刘启鸿,温劲羽,张慧玲,赵红佳*
(1.福建中医药大学附属人民医院,福建福州 350004;2.福建中医药大学附属第二人民医院,福建福州 350003)
流行病学资料显示,恶性肿瘤是我国病死率最高的一种疾病,严重危害着人们的生命健康[1],至今还被WTO 确定为是一种慢性消耗性疾病。肿瘤的治疗一直都是医学界极为迫切需要解决的问题,但由于肿瘤的类型较为繁多,所反映出来的病理表现与临床症状各不相同。近些年来,众多研究者通过临床试验研究发现中医药在肿瘤防治中发挥了不可小觑的作用,主要以扶正祛邪为原则,达到“正气存内,邪不可干”的效果。十一味参芪制剂是临床上治疗肿瘤常用的中成药,由人参、黄芪、天麻、菟丝子等11 味中药加工制成,具有抗癌扶正祛邪、健脾补气养血、益肾填精生髓的作用。前期通过系统评价显示,十一味参芪制剂能有效提高肿瘤患者临床疗效稳定率,改善骨髓抑制和肾功能,降低化疗的胃肠道不良反应,提高患者生活质量,治疗安全性较好[2]。但是,该制剂防治肿瘤的作用机制并未明晰。由于中药复方具有综合整体调节的作用,通过传统的单药研究难以反映出中药复方的疗效,而网络药理学正好能弥补这一不足,借助对生物网络进行分析,将药物作用靶点的网络进行整合,是一种综合研究药物作用机制的新技术[3]。因此,本研究借助网络药理学的方法,探索十一味参芪制剂干预治疗肿瘤的可能作用机制,为推动中医药的传承与发展做贡献。
1 资料与方法
1.1 筛选活性成分及靶点 通过中药系统药理学分析工具TCMSP(http://lsp.nwu.edu.cn/tcmsp.php),以人参、黄芪、天麻、当归、熟地黄、泽泻、决明子、菟丝子、枸杞子、细辛为关键词,查找这10 味药的化学成分,将口服生物利用度(OB≥30%)与类药性(DL≥0.18)作为筛选标准,对所检索到的活性成分进行分析[4]。利用BATMAN-TCM 数据库(http://bionet.ncpsb.org.cn/batman-tcm/)查找TCMSP 未收录的鹿角化学成分,由此建立十一味参芪制剂的成分数据库。利用TCMSP 和BATMAN-TCM 查找十一味参芪制剂化合物对应的靶标蛋白,将靶标蛋白通过Unitprot 数据库(http://www.Unitprot.org/)查询相应的基因ID。
1.2 肿瘤靶点获取 采用GeneCards数据库(https://www.genecards.org/)以“Cancer”作为检索词,进行相关靶基因的获取,从而构建肿瘤的靶基因库。
1.3 药物与疾病交集靶点的获取 借助Venny 2.1工具绘制十一味参芪制剂药物靶标基因与肿瘤靶点的韦恩图,并获得二者交集靶点信息,即为十一味参芪制剂治疗肿瘤的作用靶点。
1.4 可视化网络体系的构建 将交集靶点输入STRING 数据库(https://string-db.org/),设置物种为“homo sapiens”,作用阈值“>0.9”[5],绘制蛋白互作的PPI 网络图。再将得到的结果CSV 文件导入Cytoscape 3.7.2 软件进行网络拓扑分析,得到目标靶点之间的连接图,运用R 语言软件对其结果进行分析整理。同时进一步可视化地构建“药物-靶点-疾病”相互作用的网络图。
1.5 功能与通路富集分析 利用Metascape 平台对交集靶点进行GO 与KEGG 富集分析。通过GO 分析基因靶点的生物学功能,包括细胞成分、分子功能和生物过程3 个方面的作用。借助KEGG 通路分析获得参与的相关通路,从分子生物学角度阐释十一味参芪制剂治疗肿瘤的作用机制。
2 结 果
2.1 十一味参芪制剂有效成分与肿瘤靶点 运用TCMSP、BATMAN-TCM 数据库中搜索十一味参芪制剂各味药的有效成分,共有175 个化合物,其中人参22 个、黄芪21 个、天麻23 个、当归2 个、熟地黄2 个、泽泻10 个、决明子14 个、菟丝子11 个、鹿角2 个、枸杞子60 个、细辛8 个,其中各味药的主要成分见表1。将有效成分进一步分析,共得到潜在有效靶点856 个。借助GeneCards 数据库中检索到26 151 个肿瘤相关靶点基因。通过绘制韦恩图,得到药物-疾病交互靶点821 个。见图1。
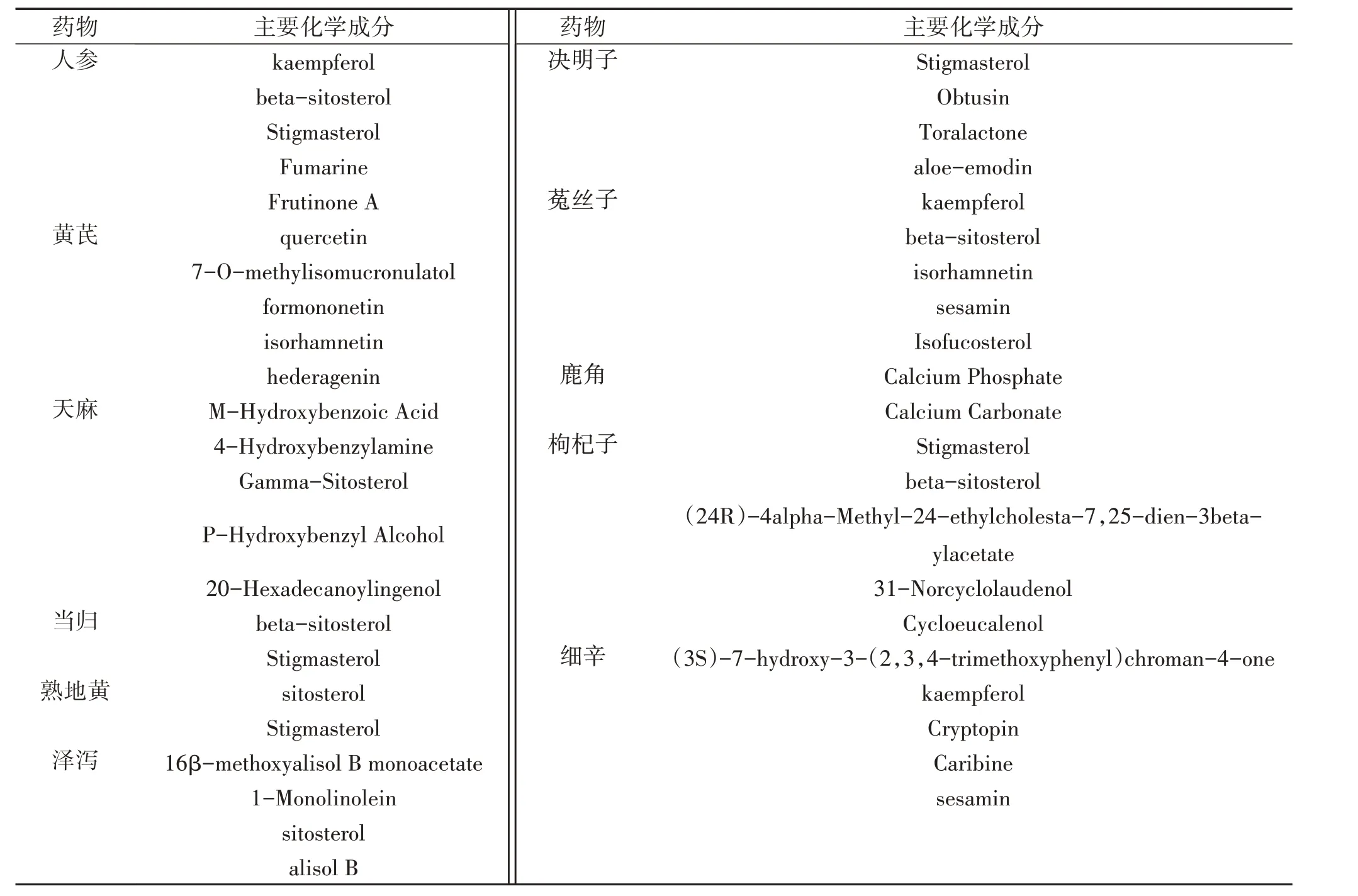
表1 十一味参芪制剂的主要化学成分

图1 药物-疾病交互靶点韦恩图
2.2 可视化网络体系及其关键靶点的获取 将821 个交集靶标导入STRING 数据库绘制PPI 网络,获得蛋白间的相互作用信息,再将网络图导入Cytoscape 3.7.2 软件进行网络拓扑分析,得到靶点连接图,见图2。发现该网络中包含了184 个节点和592 条边,217 个潜在核心靶点,节点平均度值为8.811,其中视黄醇X 受体α(retinoid X receptor alpha,RXRA)、CREB结合蛋白(CREB-binding protein,CREBBP)、核受体辅激活蛋白1(nuclear receptor coactivator 1,NCOA1)、转录中介体亚基1(MED1)、视黄醇X受体β(retinoid X receptor beta,RXRB)、视黄醇X 受体γ(retinoid X receptor gamma,RXRG)、核受体辅激活蛋白2(nuclear receptor coactivator 2,NCOA2)等82 个节点度值高于平均值,即为十一味参芪制剂干预肿瘤的核心靶点,见图3。
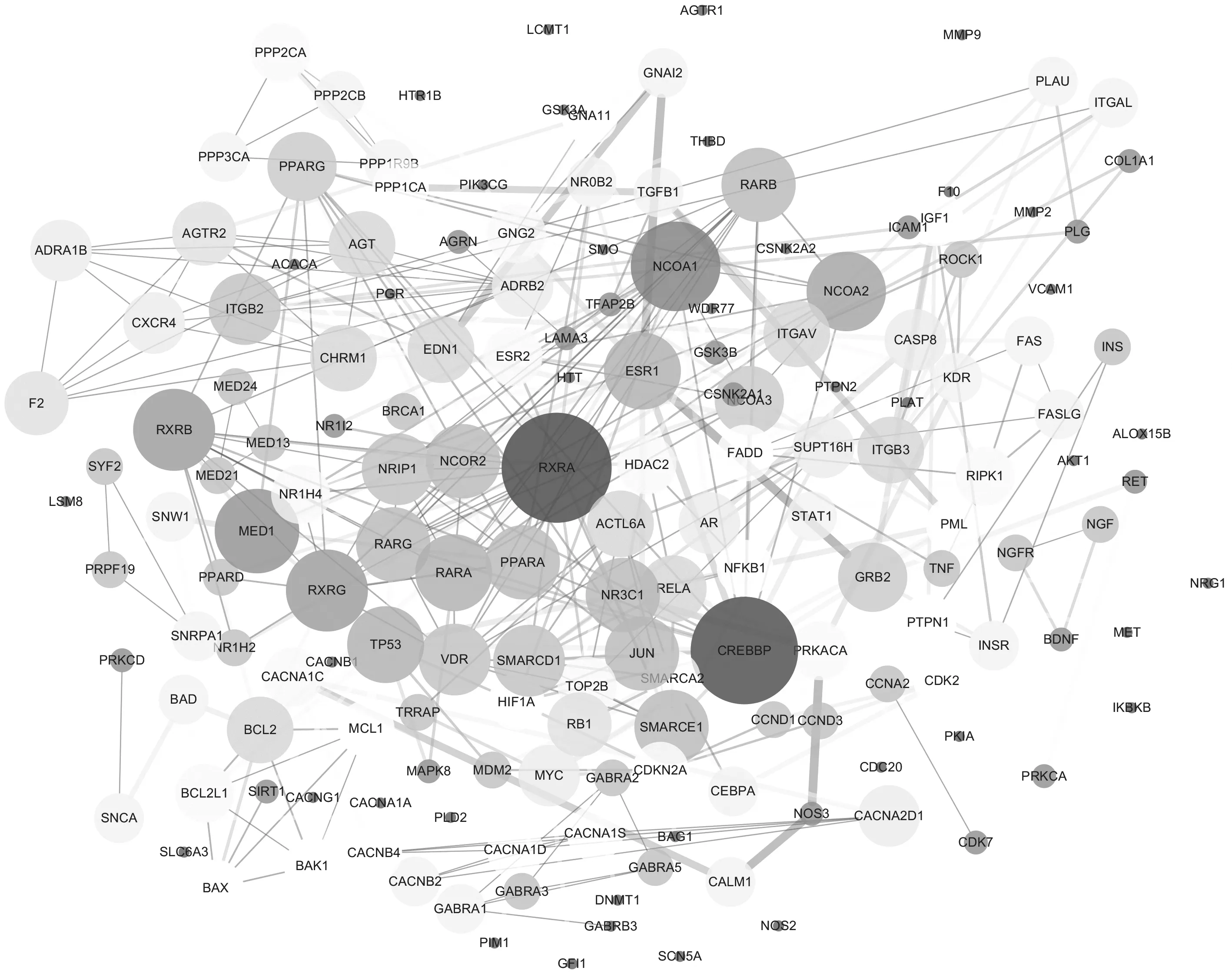
图2 共同靶点PPI 网络

图3 核心靶点
2.3 药物-靶点-疾病网络 运用Cytoscape 3.7.2软件,导入相应文件后构建“药物-靶点-疾病”相互作用网络。网络中有217 个疾病靶点,每条连线代表十一味参芪制剂与药物、药物与作用靶点、作用靶点与肿瘤之间的作用关系。见图4。
2.4 GO 功能富集分析 GO 分析分别取前10 条目录进行条形图展示,见图5。GO 分析结果显示,十一味参芪制剂的活性成分影响的相关蛋白基因主要富集在分子功能中的氧化还原酶活性、维生素结合、羧酸结合、阳离子跨膜转运蛋白活性等方面;生物过程中的细胞对无机物、有毒物质和脂多糖以及化学刺激的反应,对活性氧代谢、细胞凋亡的调节等方面;细胞组分中的树突、突触后、轴突、离子通道复合物等方面。

图4 “药物-靶点-疾病”相互作用网络

图5 十一味参芪制剂GO 基因功能富集分析
2.5 KEGG 富集结果分析 筛选前20 条通路进行部分展示,根据结果可以看出主要涉及与肿瘤相关通络(pathways in cancer)、神经活性配体-受体相互作用(neuroactive ligand-receptor interaction)、化学致癌通路(chemical carcinogenic-receptor activation)、cGMP-PKG 信号通路、MAPK 信号通路、PI3K-Akt信号通路等。见图6。
3 讨 论
在中医学中,肿瘤作为一种通常以机体局部病变为主要表现的恶性疾病,尤其是恶性肿瘤,其根本病机在于正气虚损,气血阴阳失调,致邪实亢盛,故治疗上应以扶正祛邪为主。正如《黄帝内经》所云:“有胃气则生,无胃气则亡”,顾护胃气和补益气血是扶正祛邪的关键和前提,其在抗肿瘤治疗中的作用不可忽视。十一味参芪制剂是临床上常用于补气扶正的中成药,方以黄芪和人参为君,黄芪可补气固表,益卫升阳,具有托毒生肌之功;人参大补元气,复脉固脱,健脾益肺,使五脏之气得以充实。当归补血、活血止痛,熟地黄滋阴补血,二者为臣以滋阴生血、填精生髓。佐以菟丝子、枸杞子、泽泻、决明子、鹿角、天麻,可滋补肝肾、益精生髓。全方补血与补气药配伍巧妙,共奏气血双补、健脾补肾的功效。现代药理学研究也证实,方中主要成分人参中含有的皂苷和多糖,具有提高白细胞数量,增强人体细胞免疫功能,抑制肿瘤细胞生长和诱导凋亡的作用;黄芪同样可以提高机体免疫功能,维持内环境的平衡稳定[6-7]。
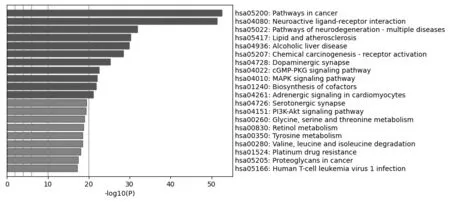
图6 十一味参芪制剂KEGG 通路分析
本研究结果发现,十一味参芪制剂干预肿瘤的主要活性化学成分包括山柰酚(kaempferol)、槲皮素(quercetin)、β-谷甾醇(Beta-sitosterol)、豆甾醇(Stigmasterol)、异鼠李素(isorhamnetin)、芝麻素(sesamin)、芦荟大黄素(aloe-emodin)、芒柄花黄素(formononetin)等。其中山柰酚、槲皮素、异鼠李素为黄酮类化合物,黄酮类物质具有多重抗肿瘤效应和广泛的生物学活性。药理学研究表明,山柰酚、槲皮素具有抗炎、抗氧化作用,可通过诱导癌细胞凋亡、增强抑癌基因活性及抑制癌基因表达等方面起到抗癌作用[8-9]。而异鼠李素不仅可以通过调控PI3K/Akt/mTOR、Ras/MAPK、Wnt/β-catenin 等 信号通路发挥抗癌作用,还可以增强包含铂类化合物、5-氟尿嘧啶、卡培他滨等多种化疗药物的抗癌活性[10]。β-谷甾醇和豆甾醇均为植物甾醇,可抑制消化道肿瘤生长。研究表明,β-谷甾醇可使胃癌细胞中AMPK、PTEN 蛋白表达增加,HS90 蛋白表达下调,进而诱导肿瘤细胞凋亡及抑制其生长[11]。王凯等[12]发现β-谷甾醇可通过抑制CDC25B 蛋白的表达,促进肝癌细胞凋亡和抑制细胞增殖。豆甾醇可通过阻滞细胞分裂周期及ROS 的氧化、钙离子浓度上升的级联反应,从而诱导人肝癌细胞SMMC-7721 凋亡[13]。芝麻素作为一种常见的天然木脂类化合物,可在抗增殖、抗转移、促凋亡和促进自噬等方面起到抗癌作用,研究表明这可能与芝麻素选择性参与NF-κB、STAT3、JNK、ERK1/2、p38 MAPK、PI3K/Akt、胱天蛋白酶-3 以及p53 信号通路有关[14]。芦荟大黄素在作用于肝癌细胞时可以通过抑制Src/STAT3 信号通路抑制其增殖与迁移[15]。芒柄花黄素作为十一味参芪制剂中君药黄芪的主要活性化学成分,已被研究证实其对肺癌、乳腺癌、胃癌、卵巢癌都有明显的抑制作用[16]。
通过对PPI 网络的深入研究发现,十一味参芪制剂治疗肿瘤的主要核心靶点有RXRA、CREBBP、NCOA1、MED1、RXRB 和RXRG 等。RXRA、RXRB、RXRG 属于类视黄醇X 受体(retinoid X receptors,RXRs)的3 种不同亚型,属于配体依赖性核受体,在细胞增殖、分化、代谢、炎症等生理功能方面发挥广泛的调控作用,其异常表达在癌症的发生、发展过程中可能发挥促进作用[17]。研究报道,CREBBP能够抑制炎性肠病相关结直肠进展,同时也是一种能够维持人体正常造血功能的重要肿瘤抑制基因[18]。NCOA1 具有促炎、促血管生成的作用,促使细胞的侵袭和增殖[19]。研究表明,MED1 基因在乳腺癌中高表达,能够促进癌细胞的增殖,沉默该MED1 基因后增殖现象明显受到抑制[20]。
为进一步研究核心靶点在基因功能和信号通路的作用,本研究进行GO 生物学功能富集分析,发现上述核心靶点基因可以通过影响活性氧代谢、细胞凋亡氧化还原酶活性、维生素结合、羧酸结合、阳离子跨膜转运蛋白活性等途径起到抗肿瘤的作用。KEGG 通路分析显示,十一味参芪制剂干预肿瘤的靶标基因主要富集的通路涉及与肿瘤相关通路、神经活性配体-受体相互作用、化学致癌作用通路、cGMP-PKG 信号通路、PI3K-Akt 信号通路、MAPK 通路等,这些通路等与癌症间接相关,可起到抗癌作用。研究表明,cGMP-PKG 信号通路对维持血管稳态具有重要的作用,激活cGMP-PKG 信号通路可抑制肿瘤细胞的血管新生,提示十一味参芪制剂可能通过激活该通路调控肿瘤[21]。PI3K-Akt信号通路参与肿瘤细胞增殖、凋亡、侵袭与迁移的调控,该通路在癌细胞中呈过度激活状态,其通路中的节点是靶向药物治疗的核心靶点[22]。MAPK信号通路是调节各种细胞过程的关键信号通路,能够抑制细胞增殖,诱导细胞凋亡,导致细胞周期阻滞[23]。
本研究应用网络药理学的方法,挖掘了十一味参芪制剂作用于肿瘤的重要活性成分及核心靶点基因,并借助KEGG 富集分析阐释其信号通路及分子作用机制,可为十一味参芪制剂干预肿瘤的临床应用提供依据,为进一步的实验研究奠定基础和提供新方向,但以上研究仍然需要通过体内、外实验针对某种具体肿瘤开展进一步验证。

