一种提高磁微粒化学发光试剂稳定性的方法
马明,王玉堂,渠海
(郑州安图生物工程股份有限公司,河南 郑州 450016)
在体外诊断(in vitro diagnosis,IVD)行业中免疫诊断是极其重要的一部分,其主要基于抗原与抗体的特异性结合,用于检测肿瘤、肝炎、病毒、激素等[1-2]。目前我国的免疫诊断技术的主流是酶联免疫和化学发光两种。化学发光技术较酶联免疫技术具有灵敏性高、测试速度快、特异性强等优点,这些优点使得化学发光正在取代酶联免疫成为更主要的检测方法[3-4]。
国内IVD 企业想要在市场上立足,并逐步替代外国厂商产品,产品质量是这一切的重中之重。在关于质量的一系列指标中,如何保证产品能够在运输、存放、使用过程的状态一致一直是一个很难解决的问题。在磁微粒化学发光试剂盒中,磁微粒混悬液组分是重要的组分,也是最不容易保持稳定性的成分。这是因为其不仅要保证磁微粒混悬液在存放过程中的不发生严重凝集和板结,也需要防止结合的抗体或抗原在会随着时间的延长发生变化[5]。
磁微粒是由是一种聚苯乙烯包裹的γ-Fe2O3的复合物,虽然表面进行改性带有羧基和氨基基团,但其含量比较少,聚苯乙烯具有很强的疏水作用力,因此磁珠在整个包被过程中会对蛋白具有很强的吸附性,磁珠与蛋白之间除了化学连接外还存在弱吸附和多重吸附[6]。这部分吸附虽然可能会提高信号值,但在包被后会对稳定性起到负面效果,在包被后进行实时放置和热加速处理过程中,弱吸附与多层吸附的抗体会缓慢脱落,导致其信号值升高或者降低,从而影响其稳定性和精密性。目前针对磁珠表面非特异性吸附有较多的研究思路,例如可以加入表面活性剂,但表面活性剂有一定的缺点,其易于和蛋白形成胶束且后续无法将其除去,因此需要对不同的表面活性剂进行筛选。通过对文献资料查阅,我们发现精氨酸在抑制蛋白吸附这方面有一定的效果[7-8]。因此可以通过精氨酸以及精氨酸复配表面活性剂将这部分抗体清除以解决磁珠包被后稳定性问题。本文对甲胎蛋白(AFP)磁微粒试剂盒中的磁微粒试剂进行研究以提出一种可以简单提高稳定性性能的方法。
1 材料和方法
1.1 材料
1.1.1 主要试剂 磁微粒(Merck 公司,羧基磁珠,10%质量浓度);包被抗体(郑州伊美诺生物技术有限公司);1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)(Sigma 公司);N-羟基丁二酰亚胺(NHS)(Sigma 公司);磁微粒偶连缓冲液0.1 mol/L pH=7.4 MES 缓冲液;磁微粒保存液:缓冲液0.1 mol/L pH=7.4 PBS 缓冲液含1%牛血清蛋白(BSA);乙醇胺(Aladdin 公司);L-精氨酸(L-Arg)(Sigma 公司);3-[(3-胆酰胺基丙基)二甲基铵基]-1-丙磺酸盐(CHAPS)(Aladdin 公司);十二烷基磺酸钠(SDS)(Sigma 公司);十二烷基聚氧乙烯(23)醚(BRIJ-35)(Sigma 公司)。
1.1.2 主要仪器 全自动化学发光测定仪AutoLumo A2000 Plus(安图生物);电热恒温培养箱(上海跃进医疗器材有限公司);振荡器(TOPSCIEN 公司)。
1.2 研究方法
1.2.1 磁微粒试剂包被方法 在4 mL 玻璃瓶中分别加入0.1 mL 10%质量浓度羧基磁珠,1 mL 偶连缓冲液,震荡混匀5 min 后磁吸分离并重复3 遍进行清洗,而后分别加入0.3 mL 0.1 mol/L EDC 溶液与0.3 mL 0.1 mol/L NHS 溶液(注:以偶连缓冲液进行溶解),室温震荡反应1 h;洗2 次后加入0.9 mL 磁微粒偶联缓冲液和0.6 mg AFP 抗体,并室温震荡反应2 h。最后加入乙醇胺60 μL 继续反应30 min,使用磁微粒保存液磁分离清洗3 次后定容至9 mL,2~8℃储存。
1.2.2 磁微粒试剂稳定性洗脱处理方法 对测试磁微粒混悬液进行磁分离后加入等体积的洗脱液,而后对洗脱条件进行调整,而后采用磁微粒保存液进行3 次清洗后重新定容到初始浓度。洗脱条件为:①采用超声清洗(15 min)与振荡器震荡(15 min);②震荡时间对比;③震荡温度对比;④精氨酸与CHAPS 复配对比;⑤精氨酸与BRIJ-35复配对比;⑥精氨酸与SDS 复配对比。
1.2.3 测试模式 由机器按照上机文件进行测试,每次加入25 μL 校准品(浓度值为0 μIU/mL、10 μIU/mL、50 μIU/mL、100 μIU/mL、500 μIU/mL、1 000 μIU/mL)、50 μL 样品稀释液、20 μL 磁珠混悬液和100 μL 酶结合物以及100 μL 底物。具体过程使用A2000plus 仪器进行检测,除磁珠混悬液其余均使用该公司在售试剂盒内组分。
1.2.4 检测指标 目前IVD 行业对化学发光试剂盒的稳定性的共识为在37℃下放置7 d 约等于试剂条件下在2~8℃下存放8~12 个月,而针对这一情况本文更进一步选择在37℃下放置10 d 来考察稳定性情况,计算浓度点发光值下降率(ROD)(%)=ABS(RLU37℃10d/RLU2~8℃-1)×100%,ROD均值为校准品各值的平均值,目前业内公认ROD值小于10%为合格标准。
2 结果
2.1 洗脱方式对磁微粒混悬液稳定性影响的结果
通过对比不同洗脱方式,我们发现超声洗脱虽然与震荡洗脱对于稳定性的影响类似,但是不论其热加速后还是热加速前的信号值均低于震荡洗脱,并且长时间的超声并放置一段时候后容易出现磁微粒凝集,因此可以选择震荡洗脱进行进一步研究。采用15%L-Arg 使用不同洗脱方式对AFP 项目磁微粒混悬液的影响如表1 所示。
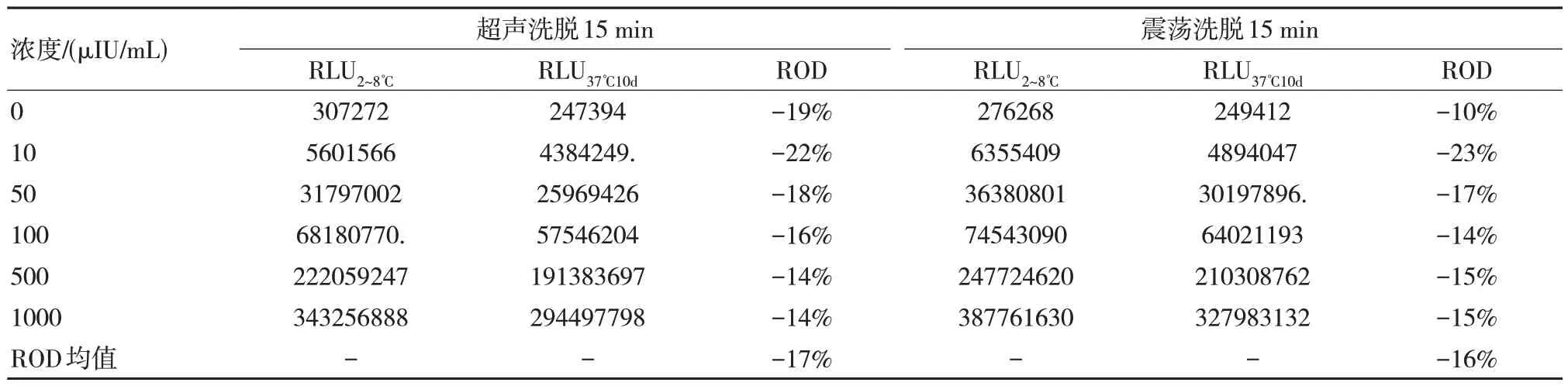
表1 磁微粒混悬液采用不同洗脱方式稳定性结果比较
2.2 洗脱时间对磁微粒混悬液稳定性影响的结果
洗脱时间的长短影响者洗脱效果,对洗脱15 min 与洗脱12 h 进行比较可以发现经过震荡洗脱12 h,其磁珠混悬的ROD 为10%,基本合格。见表2。
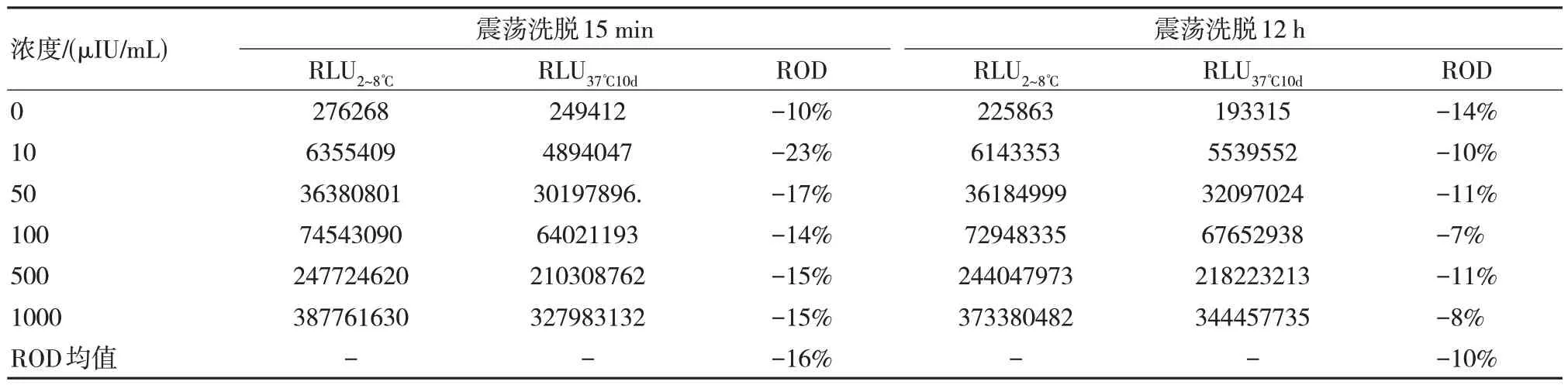
表2 磁微粒混悬液不同时间稳定性结果比较
2.3 洗脱温度对磁微粒混悬液稳定性影响的结果
由于与表1、2 所使用的不是同一批包被好的磁微粒混悬液,所以可以发现其冷藏放置的初始值并不相同,而采用37℃震荡的结果与常温震荡结果相当。且放置一段时间后上机混匀出现小颗粒凝集,所以根据以上条件,可以将洗脱工艺确定为采用振荡器常温震荡过夜洗涤的方式进行洗脱,可以有效提高稳定性。以室温和37℃烘箱进行洗脱对比,结果如表3 所示。
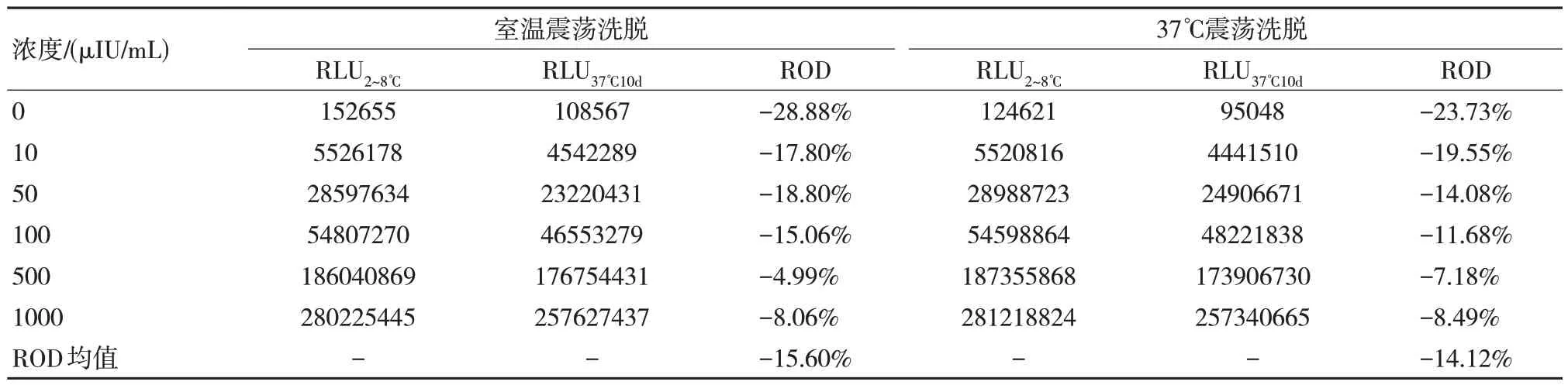
表3 磁微粒混悬液不同温度稳定性结果比较
2.4 精氨酸复配表面活性剂对磁微粒混悬液稳定性影响的结果
为了控制非特异性吸附同时增加洗脱效果,本文选择了CHAPS、SDS、BRIJ-35 与L-Arg 进行复配测试,结果如表4 所示。
依据表4 的数据发现在经过4 种洗脱液洗脱之后5%SDS+15%L-Arg 信号值最高,而5%CHAPS+15%L-Arg 信号值最低;但经过10 d 37℃的热加速放置,发现5%SDS+15%L-Arg 信号值降幅较大,即使观察其信号值也较低,因此其效果较差,而5%CHAPS+15%L-Arg 热加速前后变化较小,为以上几种方案中的最优方案。
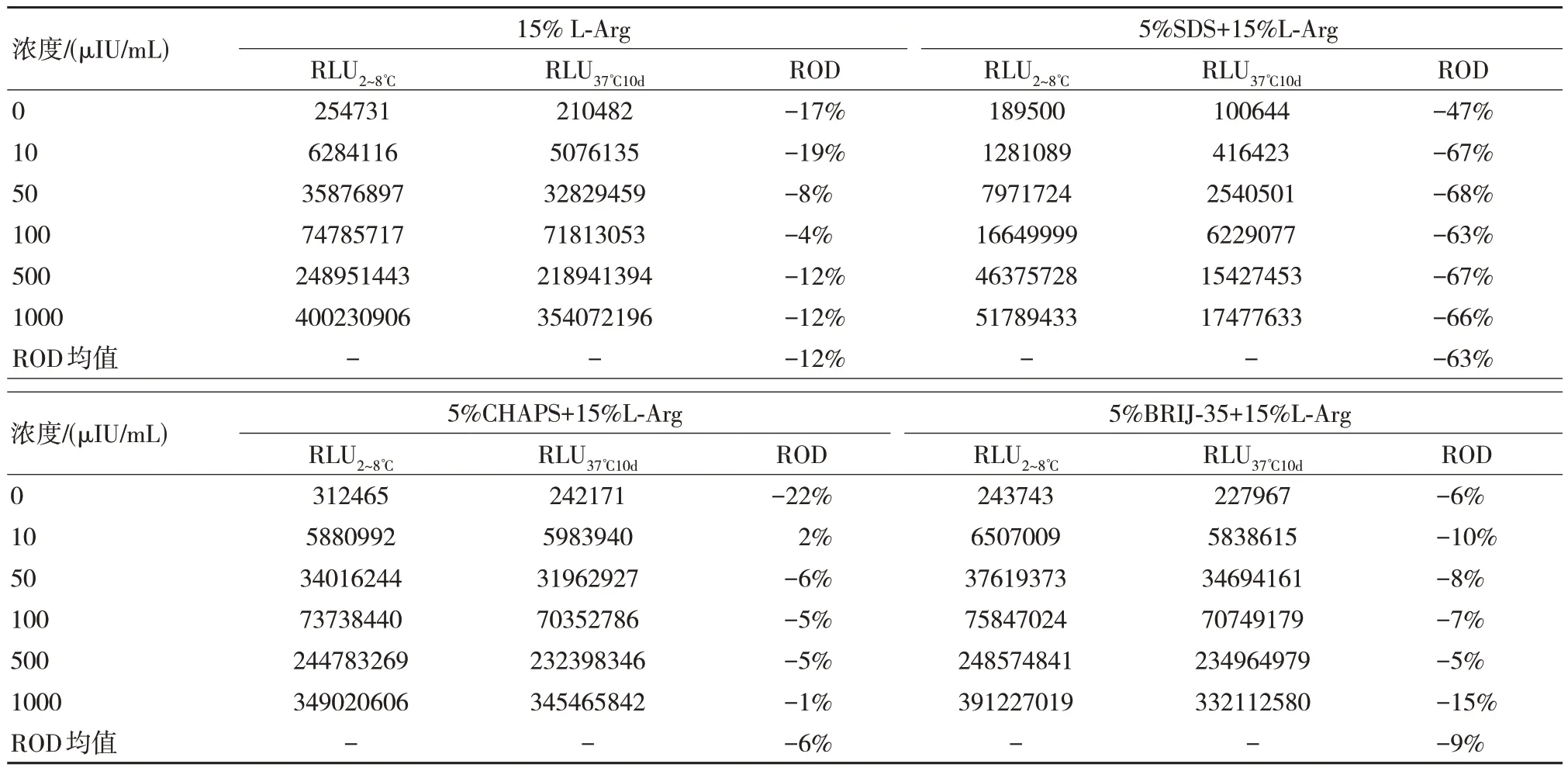
表4 L-Arg 复配不同表面活性剂稳定性结果比较
2.5 精氨酸复配表面活性剂用量对磁微粒混悬液稳定性影响的结果
根据表4 的分析除了可以得到5%CHAPS+15%L-Arg 具有较为优秀的结果之外,也可以得到5%BRIJ-35+15%L-Arg 信号值与之相当,同时BRIJ-35 成本较低,可以降低总体的成本,因此针对其调控浓度。
如表5 所示,提高了BRIJ-35 的复配比例,可以发现其可以提高稳定性,但是当提高到30%时虽然ROD 均值较低,但是观察数据可以发现其校准品低值信号值降低而高值提升,说明其可能引起了基质效应。
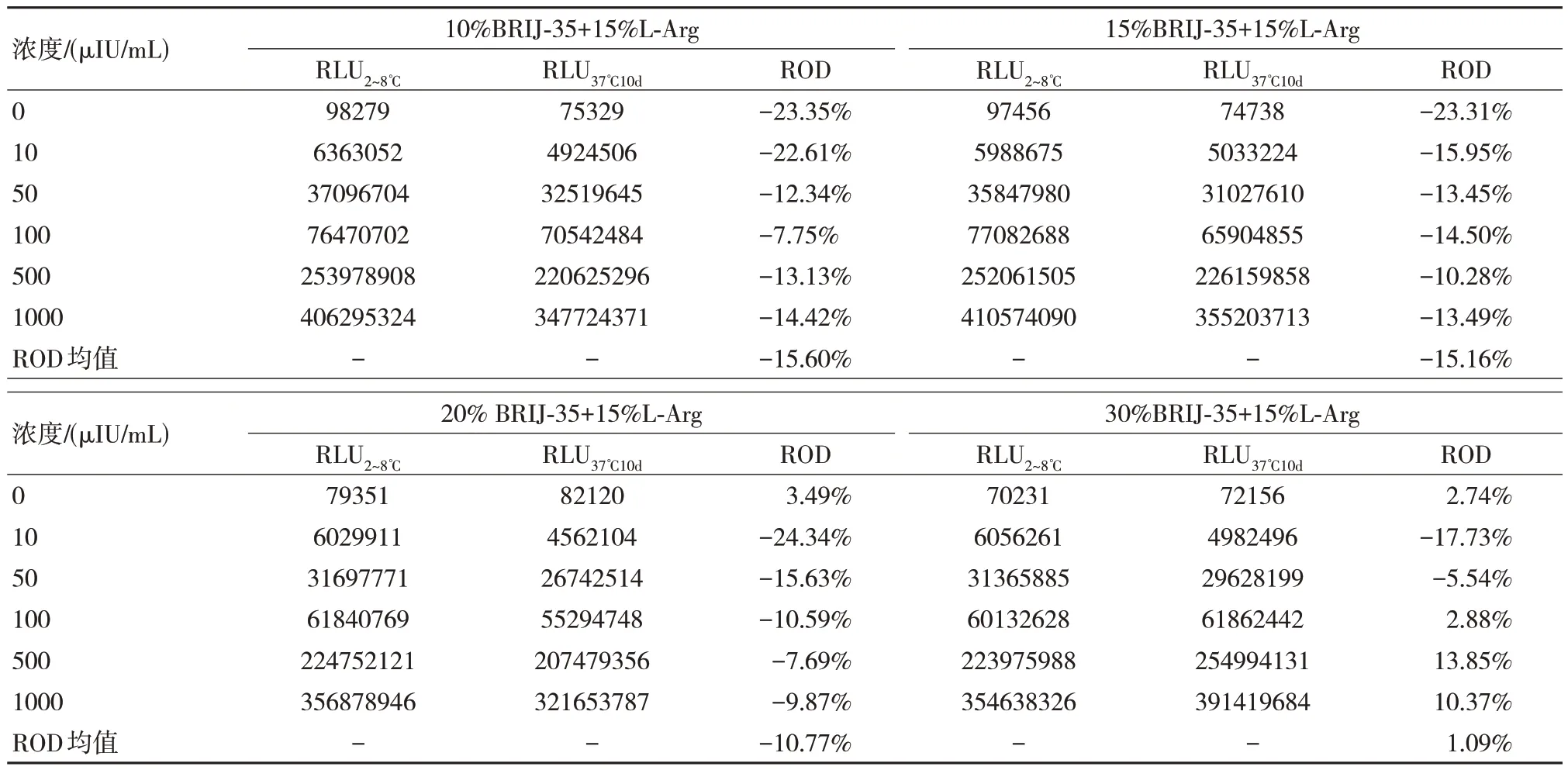
表5 不同浓度BRIJ-35 稳定性结果比较
3 讨论
通过使用洗脱,可以在不调整包被工艺与保存液的成分的情况下提高磁微粒混悬液的稳定性:采用15%精氨酸与5%CHAPS[9]进行复配对磁微粒混悬液进行等体积置换后,在振荡器上震荡反应12 h,而后用磁微粒保存液进行清洗3 次后重新定容;如果为了降低成本还可以用BRIJ-35 进行替换,但是为了达到同样的效果需要进行调控。
在包被抗体的过程中,除了一部分抗体通过化学连接在微球表面,还有一部分抗体会非特异性吸附于微球表面,这部分非特异性吸附的抗体不仅仅会在存放过程中脱落,其脱落后的位点还可能吸附其他物质从而影响后续检测的进行。而精氨酸不仅可以抑制疏水作用[10],还因其离子特性能对静电相互作用产生影响。而且对精氨酸的结构研究可以推测部分与聚苯乙烯颗粒芳香侧链结合的抗体可以被精氨酸竞争性相互作用而导致有效解吸[11]。
综上所述,使用精氨酸可以显著抑制抗体在磁微粒表面吸附。而表面活性剂如CHAPS 可以增溶膜蛋白和裂解蛋白-蛋白之间的相互作用,BRIJ-35 本身也具有类似作用,这使这两种表面活性剂成为一种适合复配的试剂。

