维生素D基因FokⅠ位点多态性与前列腺增生中核因子κB表达相关性及意义
杨国尚,阮 黎,华 兴
(1.暨南大学,广东 广州 510000;2.广州市红十字会医院 暨南大学医学院附属广州红十字会医院泌尿外科,广东 广州 510000;3.广州市红十字会医院病理科,广东 广州 510000)
维生素D受体(VDR)是维生素D主要生理功能的载体,可通过表达与核激活决定维生素D 的功能,其基因结构复杂,具有FokⅠ、BsmⅠ、ApaⅠ、TaqⅠ等单核苷酸多态性(SNP)[1]。目前发现VDR基因的多态性与人类几种疾病相关[1]。通过研究发现VDR基因FokⅠ位点SNP与前列腺增生(BPH)合并组织学前列腺炎(HP)有相关性,而HP的发生与BPH临床进展关系密切[2]。张亚群等[3]研究发现核因子(NF-κB)作为能特异性与免疫球蛋白结合的一种核蛋白,其表达与组织学前列腺炎密切相关。本课题主要研究VDR基因FokⅠ位点SNP与BPH组织中NF-κB表达的相关性,分析NF-κB信号通路是否在VDR基因SNP与BPH临床进展之间发挥作用,从而指导进一步的研究方向。
1 资料与方法
1.1一般资料:选取2015年1月~2019年12月在我院行手术治疗的BPH患者511例,通过经尿道前列腺电切(TURP)获得所有患者前列腺标本。所有标本病理结果均由两位病理医师确诊。按照VDR基因SNP基因型分为三组:FF组120例,Ff组225例,ff组166例。三组患者年龄分别为(68.1±4.6)岁、(69.3±3.5)岁、(70.2±2.9)岁,差异无统计学意义(P>0.05)。FF组、Ff组、ff组PSA值分别为(1.9±1.6)ng/ml、(2.1±1.8)ng/ml、(2.3±0.7)ng/ml,三组患者对应的前列腺体积分别为(43.1±7.6)ml、(48.2±1.6)ml、(45.2±3.6)ml,三组患者PSA值和前列腺体积比较,差异均无统计学意义(P>0.05)。本院伦理委员会批准本研究,患者均签署知情同意书。
1.2方法
1.2.1DNA的提取:抽取研究对象2 ml静脉血,加入抗凝管(含EDTA),用TIANamp Genomic DNA Kit 试剂盒(广州鲁诚)提取目标基因组。
1.2.2PCR扩增:通过GenBank检索到VDR的基因序列。广州鲁城公司利用Genefisher完成引物设计:上游序列5’ACTGACTCTGGCTCTGAC3’;下游序列5’ CACCTTGCTTCTTCTCCC 3’。对含有起始密码FokⅠ的DNA相关片段进行扩增,预期的产物片段为246 bp。PCR反应体系:0.7 μl Taq DNA聚合酶、2 μl模板DNA 、2 μl dNTPs、 8 μl上下游引物和相应的缓冲液,反应总体积为50μl。反应条件为:预变性96 ℃ 8 min, 94 ℃ 45 s,52 ℃ 60 s,72 ℃ 30 s,共40个循环。72 ℃延伸10 min。
1.2.3分析多态性基因型分析:PCR扩张目标多态性位点。10 μl PCR产物、10×buffer 1 μl、DNA 7.5 μl、牛血清白蛋白1 μl、FokⅠ限制性内切酶(广州鲁诚)0.5 μl组成总反应体20 μl系,保持37 ℃过夜,自动凝胶成像仪对2%的琼脂糖凝胶电泳酶切产物成像,检测基因型。
1.2.4NF-κB的表达:采用免疫组化SP法。将所有前列腺手术标本常规石蜡包埋,4 μm连续切片,脱蜡,梯度酒精水化。水化后的切片用PBS(pH7.4)冲洗3次,加入0.01 mmol/L柠檬酸缓冲液(pH6.0)进行抗原修复。每张切片滴加50 μl 3%过氧化氢溶液,37 ℃恒温箱孵育10 min,去除PBS,然后加山羊血清封闭。每张切片滴加50 μl NF-κB一抗(浓度为1∶1 000)后放置于4 ℃冰箱过夜,PBS冲洗,去除PBS后加入二抗,37 ℃恒温箱孵育15 min,PBS冲洗,去除PBS液后,向每张切片滴加50 μl新鲜配制的二氨基联苯胺(DAB)显色液,然后用苏木素复染2 min,0.1%盐酸溶液分化,依次予蒸馏水、PBS冲洗。梯度酒精脱水干燥后,中性树胶封片,最后在显微镜下进行观察。阴性对照部分采用PBS代替一抗。
1.2.5NF-κB的结果判定:观察着色细胞的染色强度和所占比率,两者相乘的积作为总分。NF-κB蛋白的阳性表达大多数位于细胞核,评分标准:①0分为无色,1分为淡黄色,2分为棕黄色,3分为褐色及黑色;②阳性细胞数所占比率≤10%为1分,所占比率11%~50%为2分,所占比率51%~75%为3分,所占比率>75%为4分。两种积分相乘,总分<3分为阴性,≥3为阳性。
1.3统计学方法:采用SPSS19.0分析软件进行统计分析。组间计数资料以率(%)比较,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1VDR基因FokⅠ位点SNP基因型的PCR-RFLP分析:目的片段产物经FokⅠ 酶切后,检测到3种基因型:①等位基因上存在两个酶切位点的ff基因型,电泳显示199 bp和59 bp 2条带;②没有酶切位点的FF基因型,电泳显示246 bp 1条带;③有一个酶切位点的Ff基因型,电泳显示246、199和59 bp三条带。见图1。
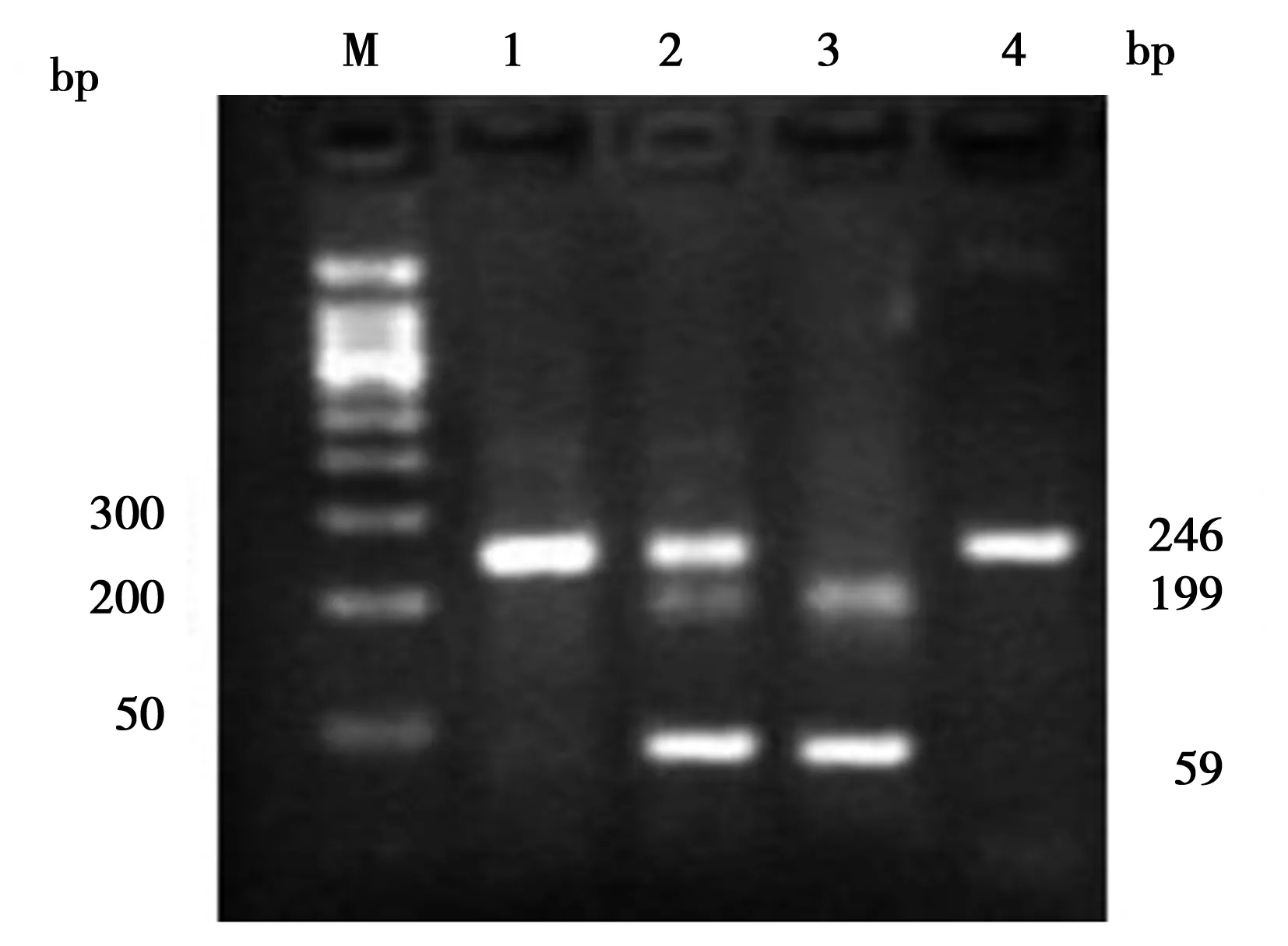
注:1为未酶切;2为Ff基因型;3为ff基因型;4为FF基因型
2.2NF-κB的表达:见图2。
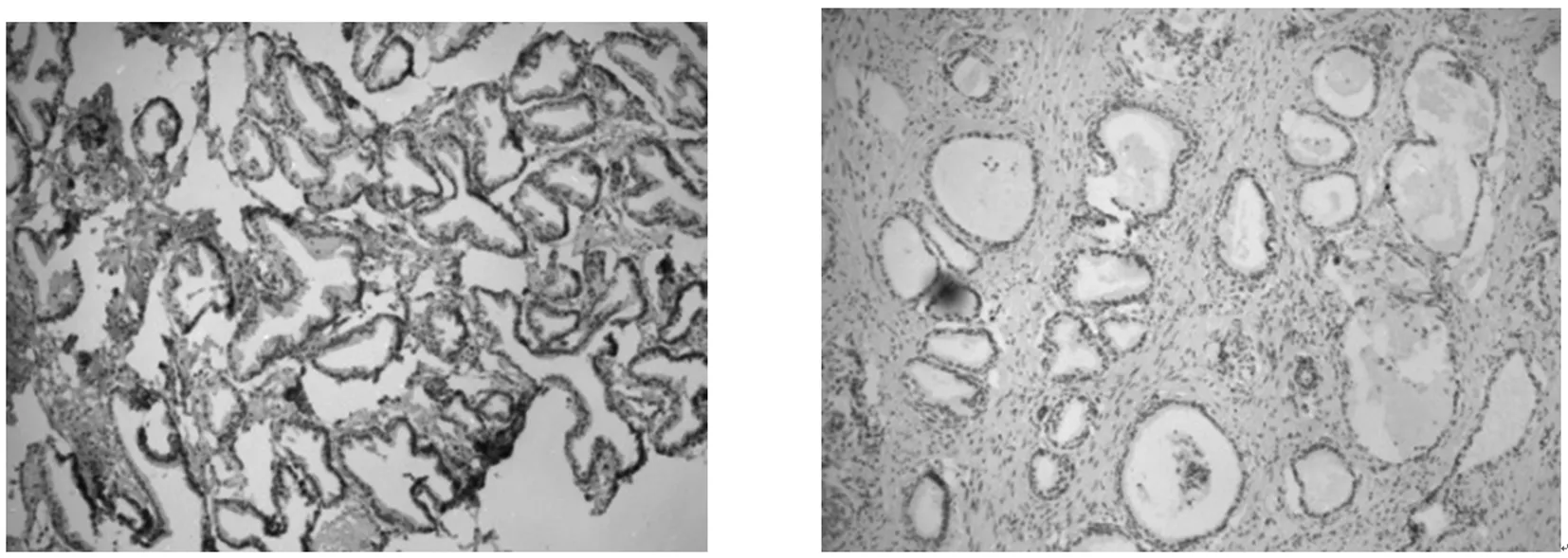
NF-κB阳性 NF-κB阴性
2.3VDR基因FokⅠ位点基因型的分布:入组人群的FokⅠ位点等位基因频率分布符合Hardy-Weinberg定律,说明该人群资料具有遗传代表性,可进一步研究和分析。结果见表1。
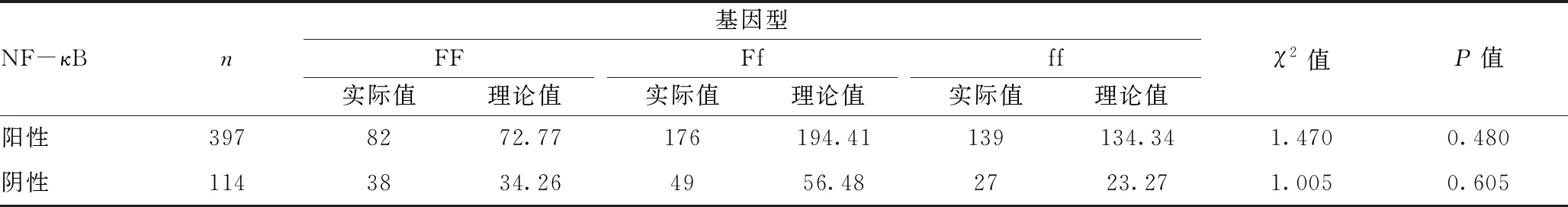
表1 入组人群FokⅠ位点基因型的Hardy-Weinberg平衡检验
2.4三组基因型患者中NF-κB表达具有差异性:FF、Ff以及ff基因型以及等位基因F和f在NF-κB表达阳性与阴性之间的分布情况。见表2。
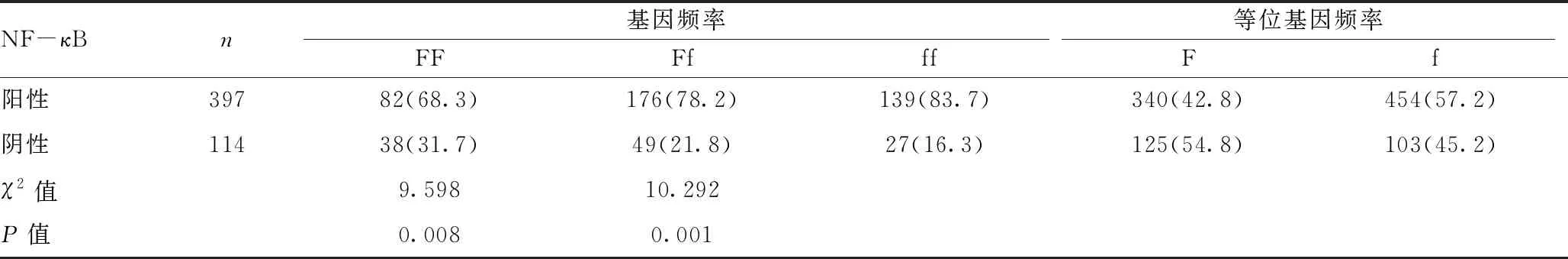
表2 NF-κB人群中FokⅠ基因型分布的差异性[n(%)]
3 讨论
BPH是由许多生理症状组成的复杂疾病。现BPH被证明可能具有遗传性[4],但其遗传基础可能由多个遗传小效应组成[5]。深入研究单核苷酸多态性(SNP)有助于阐明上述问题。有关于单核苷酸多态性(SNP)与BPH发病机制研究中, Na 等[4]通过对不同人群的关联性研究,认为GATA3位点附近的SNP(rs17144046)对BPH 和LUTS的遗传及病因起作用。目前发现部分具有与肿瘤相关性的基因位点对BPH的发病也可能起重要作用,如HOTAIR(HOX 转录反义RNA)[6]与INK4基因的多态性位点rs10757278、rs4977574和rs1333048[7]。另外RANBP3L 的 rs16902947中等位基因“G”被发现是发生BPH 的风险等位基因[8]。也有学者通过研究认为Ⅲ型5α-还原酶基因SRD5A3中的AC短重复序列与BPH的临床进展有相关性[9]。在一项针对类固醇通路中多达90个位点的SNP 研究中发现,ESR1、ESR2、HSD17B2、CYP19A1 等SNP位点显示了其在BPH 发生发展过程中的相关作用[10]。据报道,环氧酶-2 (COX-2 )上的rs2745557 位点与BPH的发生有一定相关性,且与吸烟、糖尿病、肥胖共存导致BPH发展[11]。此外,高脂饮食诱导下的BPH,STAT3和NF-κB的细胞质表达增加[12]。目前约50%患有BPH的患者合并代谢综合征(MetS),而雌激素的CYP19A1、rs700518的TT基因型被证明是MetS-BPH的危险因素[13]。随着研究的深入,SRD5A1 、SRD5A2 基因的SNP与BPH临床特征显著相关[14]。表皮生长因子(EGF)基因rs11568943、rs11569017位点SNP与前列腺体积变化有一定关系[15]。SRD5A1基因中rs166050、SRD5A2基因的rs523349和rs612224与BPH治疗效果具有相关性[14],细胞色素P450酶系中的CYP2D6 位点影响坦索罗辛药代动力学[16],对临床治疗也起重要指导作用。
目前关于VDR基因SNP导致BPH临床进展相关信号通路的研究较少。前期研究发现VDR基因FokⅠ位点SNP与BPH的临床进展有相关性[17],为了分析该SNP导致BPH发生临床进展的具体分子生物学机制,本文进行了进一步的研究。通过PCR-RFLP技术,发现前列腺组织中VDR基因启动子上的FokⅠ基因SNP与NF-κB表达的有相关性。改变VDR基因的FokⅠ的结构,会影响基因的表达及其生物学特性。NF-κB作为一种氧化还原敏感转录因子,通过氧化刺激,参与炎性反应和肿瘤的发生发展等过程[12]。有研究表明BPH组织中NF-κB呈高表达状态[18],清浊汤[18]、吡格列酮[19]等药物均可抑制NF-κB活性。结合本课题前期相关研究,认为VDR 基因SNP及NF-κB信号通路可能是BPH临床进展的其中机制之一。本课题研究结果提示NF-κB可能是VDR基因SNP导致BPH临床进展信号通路介质,需要进行进一步的分析信号通路相关的机制,从而寻找准确的信号通路,为研究BPH的临床进展提供依据。

