丹参-人参配伍调控MDSCs重塑黑色素瘤免疫微环境的研究
杨葛俊,邹珏瑶,赵涵,陈琼,何勇,陆茵,2,陈文星,2
(1.南京中医药大学药学院,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023;2.南京中医药大学江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
癌症是现代社会严重威胁人类生命健康的主要疾病之一[1],中医药在治疗肿瘤方面具有悠久的历史。大多数中医学者认为“瘀血内阻”为恶性肿瘤发生的核心病机[2],据此辨证治疗恶性肿瘤也多从活血化瘀法论治。但因活血药以调控肿瘤微环境为主,对机体免疫系统影响有限,活血益气药优于单一活血药[3]。而恶性黑色素瘤患者多有素体虚弱的症状,故临床多以活血药与补益药配伍使用,以奏扶正祛瘀,标本兼治之效。丹参、人参分别作为活血化瘀及扶正益气的代表药物之一,但二者配伍能否起到协同抗黑色素瘤转移效果,值得我们进一步探讨。
肿瘤微环境作为肿瘤的一大特征[4],是大多数恶性肿瘤分化进程的基础,在肿瘤发生发展过程中发挥着至关重要的作用。汤钊猷院士认为[5],治疗恶性肿瘤不能仅针对消灭肿瘤细胞,还要着眼于改造肿瘤所处的微环境,即重塑肿瘤微环境,使恶性肿瘤患者能够实现带瘤生存。因此,干预肿瘤微环境已成为当今肿瘤研究的一大热点。而肿瘤微环境最显著的特征之一即免疫抑制[6],免疫抑制的肿瘤微环境被认为是引发恶性肿瘤转移复发的根源之一[7]。其中骨髓源性抑制细胞(Myeloid-derived suppressor cells,MDSCs)大量浸润,在肿瘤的发生发展过程中起到关键作用,其表达与恶性肿瘤患者预后成负相关,降低MDSCs表达有助于抑制癌症的发生发展[8-9]。中药丹参中主要脂溶性成分隐丹参酮,已明确可作为天然STAT3抑制剂来调控MDSCs[10];人参中人参皂苷Rg3[11]、人参多糖[12]等均能够调节肿瘤免疫微环境,达到抗肿瘤的作用,而目前尚未有关丹参-人参配伍调控MDSCs的研究文章。目前治疗素有“癌中之王”之称的黑色素瘤仍是一项极大的挑战,从分子药物到靶向治疗再到免疫治疗,针对黑色素瘤的治疗手段经历了一次次革新。靶向MDSCs治疗恶性肿瘤的研究,已成为当前的研究热点之一[13]。因此,本研究旨在通过分子生物学手段明确丹参-人参配伍能否有效抑制黑色素瘤转移,并揭示其机制是否为协同调节MDSCs表达来重塑肿瘤微环境。
1 材料
1.1 肿瘤细胞系
小鼠黑色素瘤细胞-荧光素酶标记细胞株(B16F10-Luciferase)及小鼠黑色素瘤细胞绿色荧光稳定表达细胞株(B16F10-EGFP)均购于中国科学院细胞库。使用含有10%FBS的RPMI1640完全培养基,置于37 ℃,5%CO2的细胞恒温培养箱中进行培养。
1.2 动物
SPF级6周龄C57BL/6纯系小鼠,体质量为18~22 g,购于上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2017-0005。所有动物均饲养于南京中医药大学实验动物中心。饲养温度20~24 ℃,湿度65%,12 h光照循环时间。动物的灭菌饲料和饮用水均由实验动物中心统一提供。本实验全程遵循南京中医药大学实验动物中心管理条例,动物实验伦理批准编号:202006A025。实验动物采用异氟烷吸入麻醉,安乐死方式为给予动物过量异氟烷至深度麻醉后,颈椎脱臼处死。
1.3 药物与试剂
丹参为唇形科植物丹参SalviamiltiorrhizaBge.的干燥根和根茎(生产批号:20200513);人参为五加科植物人参PanaxginsengC.A.Mey.的干燥根和根茎(生产批号:20200621),上述药材均购于安徽省普衡药业有限公司。
苏木素-伊红(HE)染色液(Leagene,批号:DH0006),D-荧光素钾盐(CSN Pharm,批号:CSN-23607),PI染液(碧云天,批号:ST512),CCK8细胞增殖试剂盒(Cellcook,批号:CT01C),FITC anti-mouse CD3(Biolegend,批号:100204),APC anti-mouse CD4(Biolegend,批号:100516),PE CD8α(Biolegend,批号:100708),FITC CD45(Biolegend,批号:103108),APC/Cyanine7 CD11b(Biolegend,批号:101225),Percp/Cyanine5.5 Gr-1(Biolegend,批号:108427),CD8α单抗(Proteintech,批号:66868-1-Ig),CD4单抗(Proteintech,批号:67786-1-Ig),小鼠二步法检测试剂盒(中杉金桥,批号:PV-9002),两步法qPCR试剂(Vazyme,批号:R223-01),Gr-1抗体(Biolegend,批号:108403),FSP-1抗体(Abclonal,批号:A19109),Hoechst33258染色液(碧云天,批号:C1018)。
1.4 仪器
超净工作台(ESCO,型号:ESCO AC2),CO2恒温细胞培养箱(Thermo,型号:3131),流式细胞仪(Beckman Coulter,型号:CytoFLEX),半自动切片机(Leica,型号:RM2245),石蜡包埋机(Leica,型号:EG1150c),半自动多模式组织成像分析系统(Perkin-Elmer,型号:Mantra),活细胞成像分析系统(ZEISS,型号:Axio vert A1),小动物活体成像系统(Perkin-Elmer,型号:IVIS Spectrum system),酶标仪(Bio Tek,型号:Synergy2),PCR热循环仪(Thermo,型号:Veriti),实时荧光定量PCR仪(美国ABI,型号:Q6),超微量分光光度计(Thermo,型号:NanoDrop One)。
2 方法
2.1 丹参、人参药物冻干粉的制备[14]
称取丹参饮片300 g,加入2 400 mL的95%乙醇,回流提取2次,每次1 h,用纱布滤过后取滤液,得丹参醇提液。在药渣中再加入2 400 mL的双蒸水,回流提取2次,每次1 h,用纱布滤过后取滤液,得丹参水提液。将丹参醇提液与水提液合并,以抽真空方式使提取液中的水分直接升华,进而浓缩丹参提取液,-80 ℃冷冻过夜,次日于冷冻干燥机进行冻干,得丹参冻干粉1 g。人参冻干粉制备方法同丹参冻干粉。丹参1 g冻干粉相当于4.742 g生药材,人参1 g冻干粉相当于3.213 g生药量。
经中医临床丹参-人参配伍治疗恶性肿瘤处方调研发现,丹参与人参常见剂量比为2∶1,故取丹参与人参冻干粉,生药量比设为2∶1作为本实验细胞和动物给药剂量。
2.2 细胞增殖实验
将对数生长期且生长状态良好的B16F10-EGFP细胞接种于96孔板,根据分组给予不同浓度的丹参-人参含药培养基,药物以1640培养基配制为相应质量浓度的含药培养基,各给药组加入相应质量浓度的含药培养基,对照组加入不含药物的培养基。将其置于细胞恒温培养箱中继续培养。于24 h后取出一块96孔板检测,每孔加入10 μL CCK8孵育3 h后,酶标仪于450 nm波长处测定每孔的吸光度(OD)值并计算细胞相对增殖率。
2.3 丹参-人参对脾脏T淋巴细胞的影响
采用异氟烷吸入麻醉法,使C57BL/6小鼠进入深度麻醉状态后,将其脱颈处死,浸泡于75%乙醇消毒,约5 min,将其转入无菌操作台中,分离小鼠脾脏。利用脾脏T淋巴细胞分离试剂盒,分离出小鼠脾脏T淋巴细胞。将脾脏T淋巴细胞接种于6孔板内。次日,根据CCK8实验结果,设置对照组和丹参-人参不同浓度干预组(丹参-人参0.4 mg·mL-1+0.2 mg·mL-1,0.8 mg·mL-1+0.4 mg·mL-1,1.6 mg·mL-1+0.8 mg·mL-1),加入对应浓度药物,继续培养24 h后,取1×105mL-1细胞,1 000×g离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞。室温避光孵育20 min,1×PBS清洗3次后,使用流式细胞术检测丹参-人参对脾脏T淋巴细胞的凋亡影响。
2.4 构建T淋巴细胞与B16F10-EGFP细胞共培养体系
按照2.3项下方法,分离出小鼠脾脏T淋巴细胞。在12孔板内接种B16F10-EGFP细胞,细胞密度为每孔1×105个。将12孔板放置细胞恒温培养箱中继续培养约4 h,待细胞贴壁。肿瘤细胞贴壁后,按T淋巴细胞与肿瘤细胞8∶1的比例,每孔接种8×105个T淋巴细胞,继续共培养4 h。共培养结束后,给药组加入相应浓度的药物,对照组加入等量溶剂,放入恒温细胞培养箱中孵育24 h。
2.5 动物分组及给药
C57BL/6小鼠饲养于南京中医药大学实验动物中心,常规饮食适应性饲养1周后,将60只C57BL/6小鼠随机分为空白组,模型组,阳性对照(顺铂)组,丹参-人参低、中、高剂量组,每组10只。根据相关文献[15],将阳性对照组剂量设为2.5 mg·kg-1。《中国药典》中丹参和人参的成人临床用量分别为10~15 g及3~9 g,取其平均值为丹参12 g,人参6 g。根据体表面积换算成小鼠每日用量为丹参1.82 g·kg-1,人参0.91 g·kg-1,并将其作为本实验的中剂量组。按1∶2∶4的剂量比设计不同给药组,即丹参-人参低剂量组(0.91 g·kg-1+0.45 g·kg-1)、丹参-人参中剂量组(1.82 g·kg-1+0.91 g·kg-1)、丹参-人参高剂量组(3.64 g·kg-1+1.82 g·kg-1)。称取对应剂量丹参、人参冻干粉,加入双蒸水超声约20 min使其溶解,丹参-人参各剂量组小鼠给予0.2 mL灌胃,空白组及模型组给予同等体积双蒸水灌胃。
2.6 构建黑色素瘤细胞B16F10-Luciferase血行转移模型
收集对数生长期且生长状态良好的鼠源B16F10-Luciferase细胞,先用PBS缓冲液清洗2次,用0.25%胰蛋白酶消化,1 000 r·min-1离心5 min去上清,再用1 mL RPMI1640培养基重悬,计数。PBS稀释至3×105mL-1,轻轻摇晃混匀,制备B16F10-Luciferase细胞悬浮液,通过尾静脉进行注射,每只0.2 mL。尾静脉注射肿瘤细胞次日起,每天观察、记录小鼠精神状态及饮食情况,并给予丹参-人参提取物灌胃治疗。连续给药21 d后,检测生物发光信号;剥离肺组织,统计肿瘤结节数,并进行HE病理染色。
2.7 活体成像实验
应用IVIS评估小鼠体内肺部肿瘤转移情况。首先将小鼠放入麻醉箱中进行预麻,待小鼠进入深度麻醉后,向小鼠眼底静脉注射100 μL D-荧光素钾盐(1 mg·mL-1)。在注射2 min后将小鼠放入活体成像系统的暗箱室,调整平台及视野,开启激光源,采用仪器配备的软件对图像和数据进行分析处理,并获取成像图片。
2.8 流式细胞术检测荷瘤小鼠体内CD4+、CD8+T细胞及MDSCs细胞数量
利用T淋巴细胞分离试剂盒,分离出小鼠外周血及脾脏中的T淋巴细胞,用PBS清洗3次,加入1 mL RPMI1640培养基重悬,计数,调整细胞密度至1×106mL-1。根据流式抗体说明书,加入响应的抗体:anti-mouse CD3和anti-mouse CD4(或anti-mouse CD8)以及anti-mouse CD45、anti-mouse CD11b和anti-mouse Gr-1进行标记。4 ℃避光孵育45 min后,加入500 μL PBS清洗细胞3次,再加入200 μL含有3%FBS的PBS重悬细胞,流式细胞仪分析CD3+CD4+、CD3+CD8+、CD45+CD11b+Gr-1+的百分率。
2.9 免疫组织化学法检测肺组织中CD4+、CD8+T细胞的浸润
将肺组织样本切成厚度为4 μm的切片,酒精复水、二甲苯透化处理,经抗原修复后滴加灭活内源性过氧化物酶,PBS清洗3次,滴加CD4、CD8抗体置于4 ℃过夜。次日,PBS清洗3次,滴加反应增强液,室温孵育20 min。接着滴加增强酶标山羊抗小鼠IgG聚合物,室温孵育20 min后,进行DAB显色(以浅棕色为宜)。苏木素复染1 min后,脱水透化,中性树脂封片,显微镜下阅片。
2.10 免疫荧光法检测肺组织中Gr-1及FSP-1的表达
将肺组织样本切成厚度为4 μm的切片,酒精复水、二甲苯透化处理,经抗原修复后滴加一抗Gr-1及FSP-1,置于4 ℃过夜。次日,PBS清洗3次,滴加对应种属的二抗,避光,室温条件下孵育3 h。滴加防淬灭剂(含DAPI)封片。
2.11 qPCR检测肺组织中相关mRNA表达水平
采用Trizol提取小鼠肺组织总RNA,反转录为cDNA,然后进行PCR扩增,以GAPDH作为内参基因,计算目的基因的相对表达量,引物序列见表1。

表1 qPCR引物序列Table 1 Primer sequences for qPCR
2.12 统计学方法
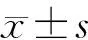
3 结果
3.1 丹参-人参配伍对B16F10-EGFP细胞增殖能力的影响
为了探究丹参-人参配伍体外对T淋巴细胞-B16F10-EGFP细胞共培养体系的影响,首先需要排除丹参-人参对B16F10-EGFP细胞增殖的直接影响。实验结果显示,与空白对照组比较,药物干预24 h后,丹参-人参(1.6 mg·mL-1+0.8 mg·mL-1)为不影响B16F10-EGFP细胞增殖的最大浓度,该浓度可用于后续实验,结果见图1。
注:与空白对照组比较,图1 丹参-人参配伍对B16F10-EGFP细胞增殖能力Fig.1 Effect of the combination of Danshen-Renshen on the proliferation of B16F10-EGFP
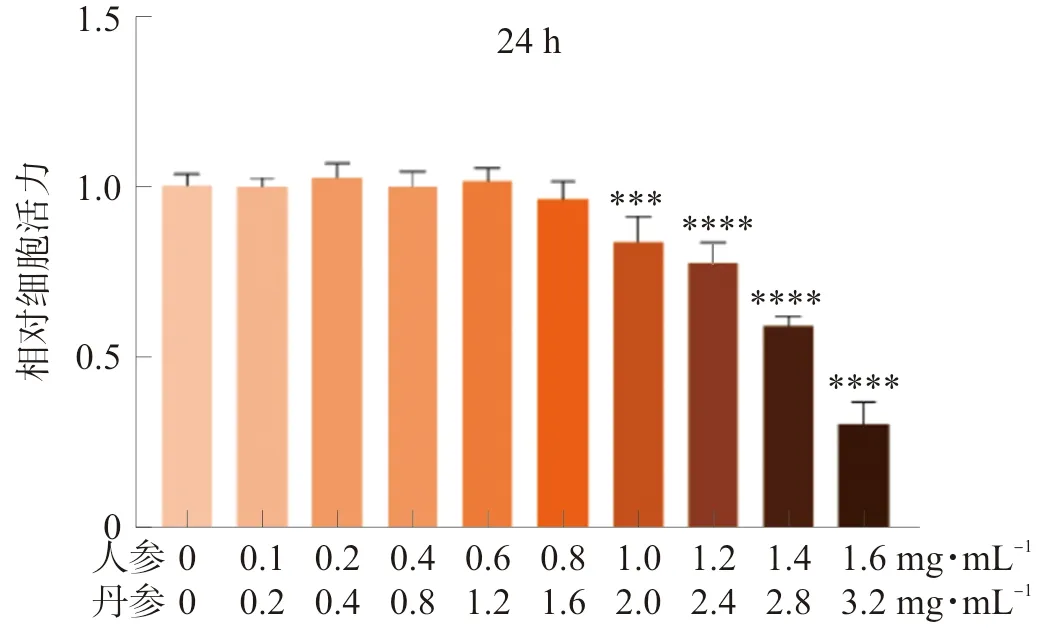
由于T淋巴细胞在体外无增殖功能,故仅需探讨丹参-人参是否会影响脾脏T淋巴细胞的凋亡。流式结果显示,丹参-人参(1.6 mg·mL-1+0.8 mg·mL-1、0.8 mg·mL-1+0.4 mg·mL-1、0.4 mg·mL-1+0.2 mg·mL-1)均不会导致T淋巴细胞凋亡。结果见图2。
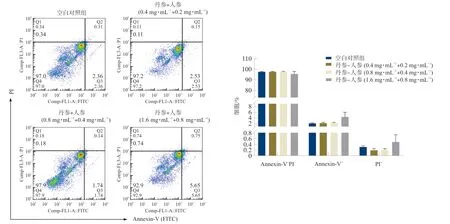
图2 丹参-人参配伍对T淋巴细胞凋亡的影响Fig.2 Effect of the combination of Danshen-Renshen on T lymphocyte apoptosis
3.2 丹参-人参对T淋巴细胞与B16F10-EGFP细胞共培养体系的影响
结果如图3所示,丹参-人参配伍可剂量依赖性地促进共培养体系中B16F10-EGFP细胞的死亡(P<0.05,P<0.01,P<0.001),说明丹参-人参配伍可增强T淋巴细胞对B16F10-EGFP细胞杀伤能力。
注:与空白对照组比较,*P<0.05,**P<0.01,***P<0.001。图3 丹参-人参对T淋巴细胞与B16F10-EGFP细胞共培养体系的影响Fig.3 Effect of the combination of Danshen and Renshen on co-culture system of T lymphocytes and B16F10-EGFP cells
3.3 丹参-人参配伍在体对黑色素瘤细胞B16F10-Luciferase转移的影响
动物活体成像结果显示,与模型组比较,丹参-人参配伍高剂量组及阳性对照组均能够显著抑制B16F10-Luciferase肺转移,且丹参-人参高剂量组抑制B16F10-Luciferase肺转移能力要优于阳性对照组(图4A~B)。体视显微镜及HE病理染色结果可见模型组小鼠肺部有明显多的肿瘤结节,丹参-人参配伍中、高剂量组小鼠的肺部转移灶面积明显缩小,且肿瘤结节也显著减少(图4C~D)。这一结果说明丹参-人参配伍可抑制黑色素瘤细胞B16F10-Luciferase在体转移。
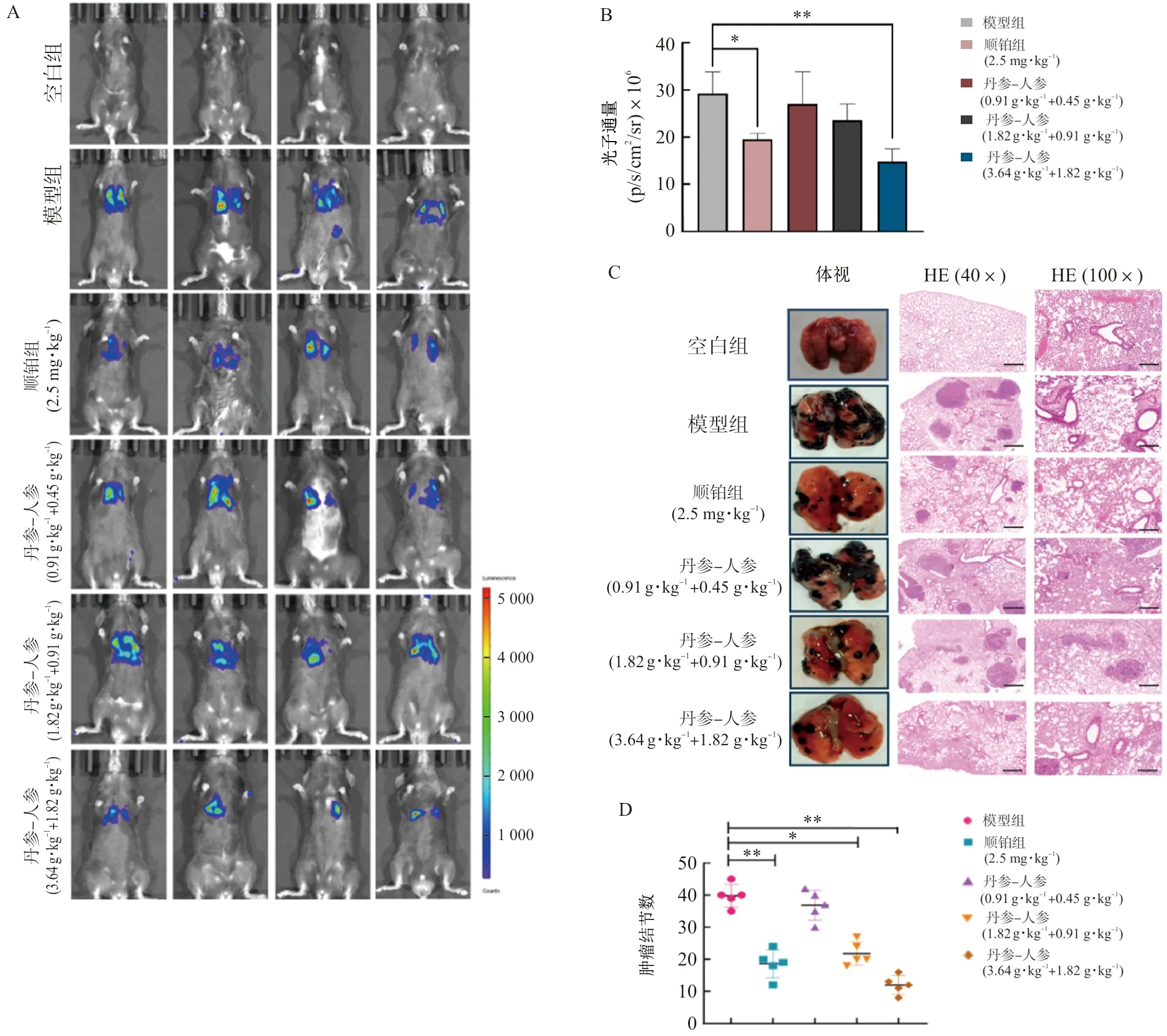
注:A~B.动物活体成像结果;C~D.体视和HE染色结果;与模型组比较,图4 丹参-人参配伍抑制黑色素瘤细胞B16F10-Luciferase转移的体内研究Fig.4 In vivo study on inhibition of B16F10-Luciferase metastasis by combination of Danshen and Renshen
3.4 丹参-人参配伍对B16F10-Luciferase荷瘤小鼠体内免疫细胞的影响
流式细胞术检测CD4+、CD8+T淋巴细胞的表达量,结果见图5,与模型组比较,丹参-人参配伍中、高剂量组能显著升高小鼠外周血及脾脏中CD4+、CD8+T淋巴细胞的数量(P<0.05,P<0.01,P<0.001)。利用免疫组化法检测B16F10-Luciferase荷瘤小鼠转移灶瘤内CD4+、CD8+T淋巴细胞的浸润情况,结果见图6,丹参-人参配伍高剂量组能显著增强荷瘤小鼠转移灶瘤内CD4+、CD8+T淋巴细胞的浸润(P<0.05,P<0.01),说明丹参-人参能够有效恢复并增强机体免疫细胞的作用。

注:与空白组比较,##P<0.01,###P<0.001;与模型组比较,

注:与模型组比较,
流式细胞术检测荷瘤小鼠外周血及脾脏中的MDSCs,结果见图7,与模型组比较,丹参-人参配伍中、高剂量组外周血及脾脏中MDSCs的数量显著减少(P<0.01,P<0.001)。通过免疫荧光对转移灶瘤内MDSCs浸润情况进行检测,结果见图8,与模型组比较,丹参-人参配伍中、高剂量组小鼠瘤内指示MDSCs浸润的CD11b和Gr-1的表达均显著减少,具有统计学意义(P<0.05,P<0.01)。

注:与空白组比较,##P<0.01,###P<0.001;与模型组比较,*P<0.05,**P<0.01,***P<0.001。
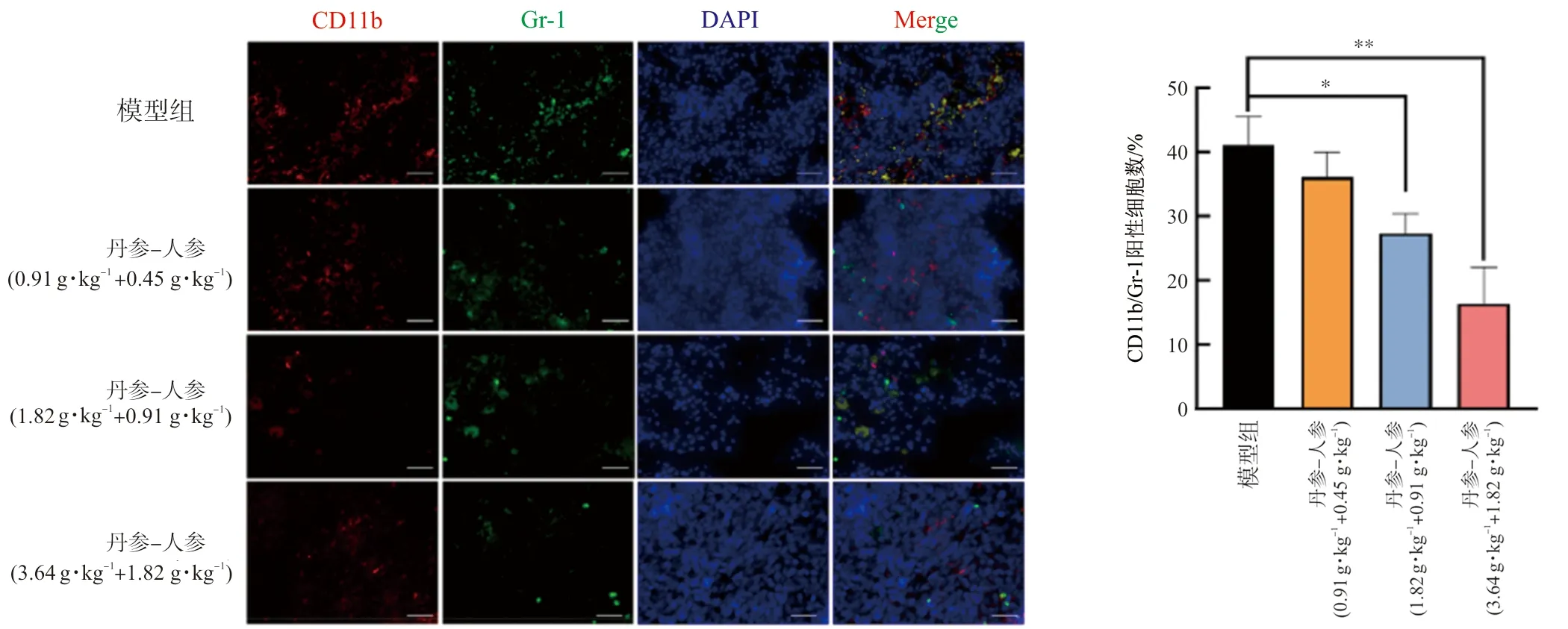
注:与模型组比较,*P<0.05,**P<0.01。图8 丹参-人参对B16F10-Luciferase荷瘤小鼠转移灶瘤内MDSCs浸润的影响Fig.8 Effect of the combination of Danshen-Renshen on MDSCs in B16F10-luc tumor bearing mice
3.5 丹参-人参配伍对MDSCs增殖相关因子mRNA的影响
研究显示[16-17],当肿瘤细胞到达转移灶定植之前,会分泌大量的刺激因子如S100A8/9、IL-6、CXCL1/2和GM-CSF等,改造组织局部免疫微环境,使其能够适合肿瘤定植并增殖形成转移灶。本研究对肺组织中S100A8/9、IL-6、CXCL1/2、GM-CSF mRNA表达水平进行检测。结果见图9,与模型组比较,高剂量丹参-人参干预能降低相关免疫抑制刺激因子mRNA的表达(P<0.05,P<0.01)。这说明丹参-人参能够抑制小鼠转移灶组织中MDSCs募集相关S100A8/9、IL-6、CXCL1/2、GM-CSF等刺激因子的表达,达到重塑免疫抑制因子微环境的作用。

注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。图9 丹参-人参配伍对MDSCs增殖相关因子mRNA的影响Fig.9 Effect of the combination of Danshen-Renshen on proliferation related factors mRNA of MDSCs
4 讨论
随着对恶性肿瘤的不断深入研究,我们发现肿瘤微环境在肿瘤的形成、转移和发展过程中起到了关键性的作用[18]。肿瘤微环境是肿瘤细胞不断增殖和发展的“温床”,肿瘤细胞与其周围复杂微环境之间存在千丝万缕的关系[19],因此,对这种复杂的网络关系进行全面分析有助于更深入地理解肿瘤增殖和转移的不同潜在机制,对于临床防治恶性肿瘤复发及转移具有重大意义。因此,针对恶性肿瘤的研究已逐渐从以癌症本身为核心的模式转变为以肿瘤微环境为中心的模式。肿瘤微环境中存在复杂的免疫抑制因素,导致相当一部分恶性肿瘤患者很少甚至几乎没有肿瘤浸润的T淋巴细胞,大大限制了免疫疗法的临床疗效。
肿瘤免疫抑制微环境中包含了大量的肿瘤浸润髓系细胞。在肿瘤等病理条件的长期影响下,骨髓细胞正常分化程序受阻,诱导MDSCs形成,同时肿瘤组织及基质细胞释放S100A8/9、IL-6、CXCL1/2、GM-CSF等刺激因子促进MDSCs增殖、活化,并促进其向肿瘤组织募集[20]。活化后的MDSCs不仅通过抑制肿瘤微环境中杀伤性T细胞及NK细胞等免疫细胞的应答发挥免疫抑制作用[21],还能通过促进肿瘤血管生成、肿瘤细胞侵袭以及建立肿瘤转移前微环境直接促进肿瘤进展[22]。因此,MDSCs对于恶性肿瘤的发生发展具有关键的促进作用,通过调控MDSCs的表达重塑肿瘤免疫微环境,有望成为临床防治恶性肿瘤的有效手段。
本实验以丹参-人参配伍作为研究对象,明确丹参-人参配伍能够有效抑制黑色素瘤肺转移,并揭示丹参-人参配伍能够通过抑制肿瘤组织分泌S100A8/9、IL-6、CXCL1/2、GM-CSF等刺激因子,减少肿瘤微环境中MDSCs的浸润,重塑肿瘤免疫抑制微环境,恢复CD8+T细胞等免疫细胞的活性,达到抑制黑色素瘤转移的目的,为临床活血益气药物配伍治疗恶性肿瘤提供了客观可靠的数据支撑。

