视网膜退行性疾病临床治疗的最新进展
姜承勇,郑家栋,颜彪,张嘉漪
复旦大学 脑科学研究院,医学神经生物学国家重点实验室/教育部脑科学前沿科学中心,上海 200032
视觉是人类及大多数动物感知外界环境信息的重要来源[1],视觉功能的实现依赖于完整的视觉环路和健康的眼周环境。视网膜退行性疾病(retinal degeneration, RD)是一种以视网膜细胞渐进性凋亡为主、视网膜的完整性被破坏直到视觉功能完全丧失的慢性疾病[2],在遗传上表现为高度异质性,具有继发性和不可逆性的特点[3-6]。全球RD患者多达0.3亿人[7]。在中国,视觉障碍是继听觉障碍之后第二大致残疾病,超过3.3%的中国人遭受不同程度的影响,其中视网膜退行性疾病是主要致盲因素之一,严重影响患者的生活质量[8]。根据发病机制的不同,视网膜退行性疾病可分为两大类别:遗传性的视网膜退行性疾病(inherited retinal degeneration, IRD)和复杂视网膜变性所导致的视网膜退行性疾病。前者是遗传变异性疾病,主要临床疾病类型是视网膜色素变性(retinitis pigmentosa, RP)[9-10]。后者受到基因和环境的共同影响,临床高发的疾病类型包括年龄相关的黄斑变性(age-related macular degeneration, AMD)[11]、糖尿病视网膜病变(diabetic retinopathy, DR)[12]和黄斑营养不良(Stargardt macular dystrophy, STGD)[13]。在过去的十几年里,我们见证了医疗领域在恢复视网膜退行性疾病患者视觉方面所取得的一系列重大技术和方法上的突破,如基因替代疗法用于莱伯先天性黑内障(LCA)患者的治疗[14],以及视网膜假体Argus II和Alpha-IMS在视网膜色素变性病人身上的应用[15-16]。除此之外,药物和神经保护因子治疗、干细胞疗法等也在实验动物研究和临床研究中崭露头角。越来越多新的治疗方法的出现有望为视网膜退行性疾病患者带来福音。
1 视网膜退行性疾病
1.1 视网膜色素变性
视网膜色素变性是一种由基因突变引起的视网膜退行性疾病,其在人群中的发病率为1/4 000[17]。患者的早期病症主要为因视杆细胞受损而导致的夜盲症。最初病变开始于视网膜赤道部,表现为周围视野的丢失;之后逐渐扩展到视野中心;最终引起视锥细胞凋亡直至患者失明[18]。视网膜色素变性患者中有15%~35%为常染色体显性遗传,症状较轻,发病时间较迟;5%~45%为常染色体隐性遗传;有5%~17%为X染色体连锁遗传,其症状较为严重[19]。此外,还有一部分是由于线粒体基因发生突变,表现为母系遗传模式[20]。与视网膜色素变性相关的突变基因编码产物大多与光感受器的信号转导和新陈代谢、基因剪切、蛋白合成以及细胞结构等相关[21]。其中位于2号染色体短臂上的视紫红质(RHO)基因是第一个被报道的视网膜色素变性致病基因[22]。视紫红质是视网膜光感受器中视杆细胞的色素分子,也是超过25%的视网膜色素变性病人的致病基因[23],RHO不同位点的突变最终都将导致视紫红质合成和定位错误。Dryja等[24-25]首次报道了由RHO P23H位点突变导致的视紫红质错误折叠,造成视杆细胞功能异常,进而引起视网膜色素变性。另外一个高发的突变基因是PDE6B,该基因突变引起cGMP-磷酸二酯酶的β亚基失活,导致视杆细胞外段cGMP浓度升高,增加了保持开放的阳离子通道,最终导致视杆细胞死亡[26-27]。此外,RPE65蛋白在视网膜色素上皮细胞中的含量较丰富,参与11-顺式视黄醇的合成,因此相关基因的突变将导致类视黄醇及其衍生物的积累;MUTYH基因突变引发DNA单链断裂,加速细胞坏死;RP1和CRB1基因突变导致微管蛋白无法合成,从而造成视网膜细胞间物质运输受阻[28-29]等异常。目前被鉴定为视网膜色素变性致病基因的数量已超过150个[18],以单基因突变为主,少部分存在双基因突变或多基因突变[30]。值得一提的是,视网膜色素变性相关的突变基因存在人种差异性。在中国人群中,CYP4V2基因突变占据了视网膜色素变性突变基因的25%[31],而在北美人群中,RHO是最主要的致病基因[32]。
1.2 年龄相关的黄斑变性
年龄相关的黄斑变性是一种慢性的退行性黄斑疾病。随着年龄的增加,视网膜色素上皮细胞、光感受器、玻璃膜(又称Bruch膜)和脉络膜复合体发生渐进性退化,进而出现色素沉着,导致患者视觉功能丢失[33],严重影响老年群体的生活质量。在西方国家,有1%~3%的老年人受到年龄相关的黄斑变性的困扰,预计到2040年全球有将近3亿人罹患年龄相关的黄斑变性[34]。一项基于761个参与者的研究表明,与正常人相比,由于眼底的病变,年龄相关的黄斑变性患者的生活受到很大的负面影响,包括情绪、日常行为等;也有研究表明年龄相关的黄斑变性患者的认知功能受到影响[35-36]。年龄相关的黄斑变性的发病机制复杂,涉及不同的文化背景、年龄、生活方式、饮食习惯、基因等影响(表1)。此外,年龄相关的黄斑变性还和其他疾病伴生,比如高血压、甲状腺机能亢进、糖尿病、阿尔兹海默症等[37]。根据发病时间的不同,可以将年龄相关的黄斑变性分为早期和晚期两个阶段:年龄相关的黄斑变性的早期病理症状不明显,主要表现为在视网膜色素上皮形成脉络膜小疣[38];晚期伴随有严重的视力丢失,并且可以进一步分为干性和湿性两种类型[39-40]。干性年龄相关的黄斑变性由于视网膜中形成脉络膜小疣,阻碍了视网膜中营养物质的供应,从而导致黄斑区光感受器细胞的大面积凋亡;湿性年龄相关的黄斑变性由于视网膜中微小血管的不断形成,容易发生血管破裂和渗出,进而引发炎症反应。与湿性年龄相关的黄斑变性不同,在干性年龄相关的黄斑变性后期,由于没有血管再生,视网膜色素上皮细胞(retinal pigment epithelium, RPE)出现凋亡并且无法支持光感受器的正常功能,因此患者往往在短时间内即丧失视觉[41]。年龄相关的黄斑变性是环境和基因共同作用的结果,目前已鉴定出超过50个年龄相关的黄斑变性的易感基因[40]。大多数基因与补体系统、细胞外基质的建成、脂质代谢等细胞生化途径相关[42],其中最主要的两个基因是CFH和ARMS2,前者的编码产物是补体因子H,而后者的功能尚不清楚[42-43]。与视网膜色素变性致病基因不同,年龄相关的黄斑变性相关基因突变主要导致眼底血管的增生,进而引发炎症反应。环境因素中年龄是最大的致病因子,几乎所有的年龄相关的黄斑变性患者年龄都超过60岁[44]。除此以外,饮食和生活习惯也与年龄相关的黄斑变性有关,长期的吸烟和胡萝卜素摄入不足将显著提高患病的概率和提前发病的时间[45]。
1.3 糖尿病视网膜病变
糖尿病视网膜病变是长期罹患糖尿病患者的典型并发症。据美国眼科医学学会的流行病学调查数据显示,全球糖尿病患者高达3.87亿人,预计到2035年将达到5.92亿人。研究发现,糖尿病视网膜病变在糖尿病人群中发病率大约为30%,其中Ⅰ型糖尿病发病率达到95% ,Ⅱ型糖尿病占50%~60%[46]。临床上根据糖尿病视网膜病变病人的临床病症,可以大致分为非增殖性糖尿病视网膜病变(nonproliferative diabetic retinopathy,NPDR)和增殖性糖尿病视网膜病变(proliferative diabetic retinopathy, PDR)[47](表1)。在早期非增殖性糖尿病视网膜病变患者的眼底,可检测到微动脉瘤或小血管的肿胀,随后肿胀的血管发生液体渗出,引发视网膜炎症反应,最终导致黄斑水肿,直接影响视网膜的功能,这个过程又称为糖尿病性黄斑水肿[48-49]。如果未及时给予干预,患者视网膜的特定区域将逐渐进入严重缺血状态,并分泌血管内皮生长因子和肿瘤坏死因子等[46,50],导致新血管的生长,而这也标志着疾病从非增殖性过渡为增殖性糖尿病视网膜病变[51-52]。在增殖性糖尿病视网膜病变期,血管向玻璃体腔的生长和侵润常导致出血,而向黄斑的侵润则会导致视力的长期丧失。此外,新生血管的瘢痕化或胶质细胞的增生会导致玻璃体和视网膜之间的牵引力增大,进而引起视网膜色素上皮与视细胞层之间发生脱离,最终使得患者失明。除此之外,因血管增生而引发的炎症反应、氧化应激、血管内皮细胞和神经节细胞的凋亡等也都参与到糖尿病视网膜病变的发病进程中[47,53]。
1.4 黄斑营养不良
黄斑营养不良是在成年人和婴幼儿中均普遍发生的一类常染色体隐性突变引起的视网膜退行性疾病。虽然其发病比例低(一般为1/8 000~1/10 000),但是发病时间早,而且发病后12~24个月内患者视觉便急剧消退[54-56]。患者的典型病症表现为中心视野丢失[57](表1)。黄斑营养不良是由遗传因素和环境因素共同参与的一类视网膜退行性疾病,其中以遗传性为主[2]。ATP级联转运家族A4(ABCA4)是黄斑营养不良患者的主要致病基因,该基因产物参与光感受器细胞中类视黄醇类物质从膜盘向胞质中的转运,从而介导视黄醇的循环使用。一旦ABCA4异常,将导致视黄酰乙醇胺(A2E)在视网膜色素上皮细胞中积累,视黄酰乙醇胺的积累最终会导致视网膜色素上皮细胞中脂褐质的沉积,即形成患者眼底荧光素血管造影上看到的黄色斑块[58-59],该时期称为少年黄斑营养不良[60]。随着疾病的进一步发展,开始出现视锥视杆细胞的死亡,脉络膜和视网膜萎缩,此时被称为保留中央凹的黄斑萎缩[59]。除了ABCA4基因,在一些病例中也筛查到由ELOVL4、PROM1基因突变所诱发的STDG样病,这两类突变基因分别对应临床上STGD3(后来发现STGD2和STDG3由同一个基因突变造成,2005年遂取消STGD2命名,https://www.ncbi.nlm.nih.gov/gene/6784)和STGD4型患者[58]。其中ELOVL4基因的表达产物在视网膜中仅定位于光感受器的内质网中,参与脂肪酸的合成,该基因的突变会导致ELOVL4定位错误,进而导致光感受器和色素上皮细胞吞噬功能异常[61-63]。PROM1基因表达产物是糖蛋白,定位于视网膜外段,参与光感受器细胞的膜盘的发生以及调节视网膜色素上皮的吞噬作用,该基因异常导致光感受器外段的功能和形态异常[64-65]。黄斑营养不良患者典型的病理特征是眼底黄斑的形成,但是由于发病早期眼底特征不明显,常被误诊为功能性视力丧失、弱视和其他形式的视网膜退行性疾病[66-67]。而在发病晚期,患者眼底呈现出类似于AMD的视网膜地理萎缩和视网膜下新生血管膜增生,因此常被误诊为AMD[59,68]。为了提高临床诊断的准确率,常采用光学相干断层成像术(OCT)、眼底自发荧光血管造影(FAF)、基于光谱阈的脉络膜OCT成像(SD-OCT)、全视野闪光视网膜电图(ffERG)以及多焦视网膜电图(mfERG)等相结合[69],可以筛查更早期的病变。此外,最新开发的分子检测和基因检测也对STGD的早期确诊和干预发挥着重要作用[54]。
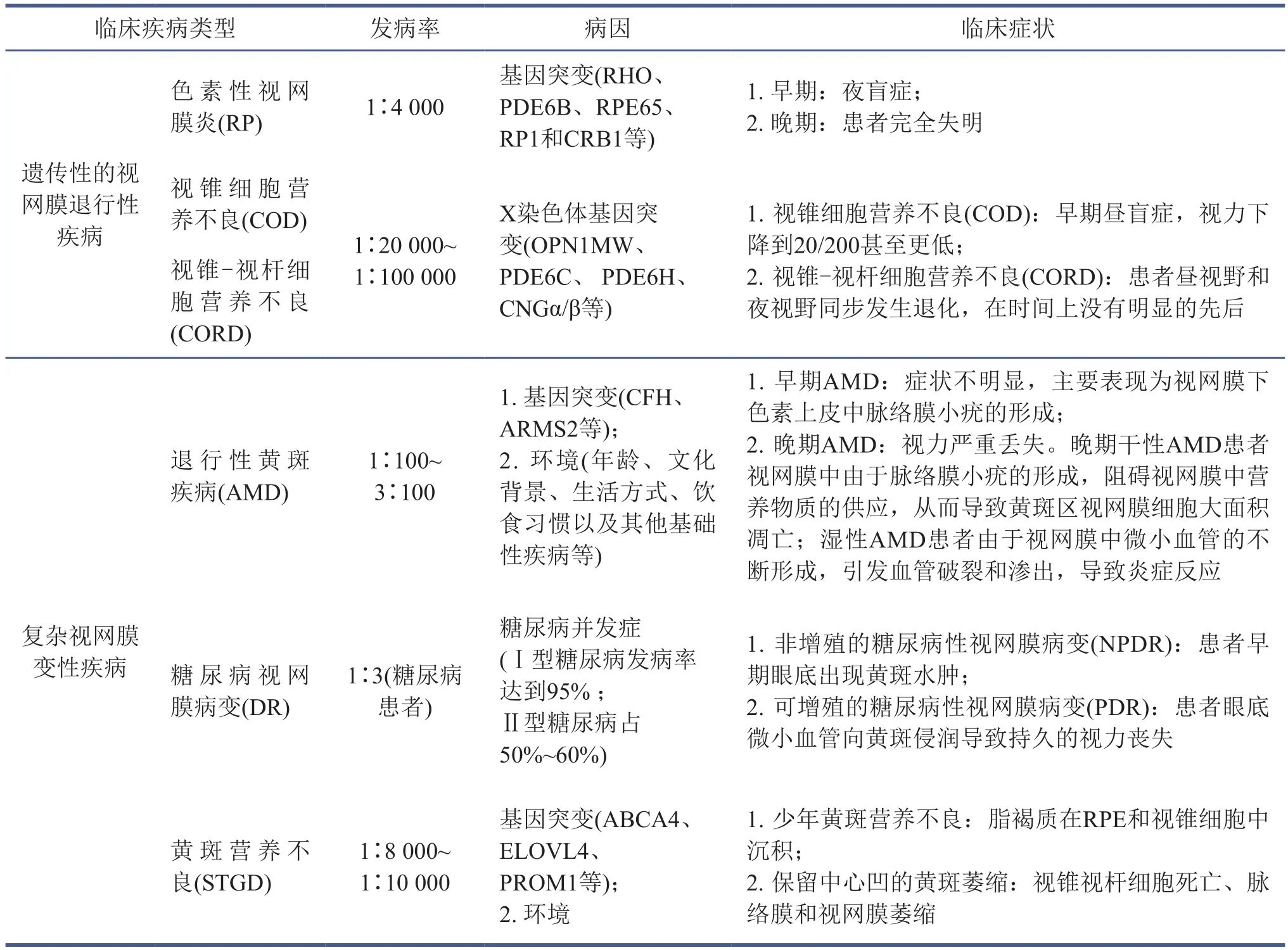
表1 视网膜退行性疾病类型及特征
1.5 其他视网膜退行性疾病
除了上述主要的视网膜退行性疾病外,在眼科临床诊断中,还可根据症状和发病机制的不同分出一些亚类,例如莱伯先天性黑内障是视网膜色素变性的一种类型,其主要特征为瞳孔光感差、发病早,且患者主要集中在婴幼儿[68,70]。其他发病率较低的视网膜退行性疾病还包括X染色体相关的视锥细胞营养不良(cone dystrophy, COD)和视锥-视杆细胞营养不良(cone-rod dystrophy, CORD),这两类疾病的临床发病率为1 /20 000~1/100 000。视锥细胞营养不良的病理特征表现为视网膜中心视锥细胞的凋亡。在患病早期,患者的中心视野和色彩分辨能力丢失,出现昼盲症;到了患病晚期,患者的周边视野逐渐发生缺失,视力下降到20/200甚至更低[71-72]。然而对于视锥-视杆细胞营养不良患者而言,由于光感受器的无差别凋亡,在患病早期昼视野和夜视野均发生退化,并且在时间上没有明显的先后。视锥细胞营养不良和视锥-视杆细胞营养不良主要的发病原因均是基因突变,目前已经鉴定出32个相关基因,大部分突变基因是二者所共有的[73],主要有视蛋白基因(OPN1MW)[74]、cGMP磷酸二酯酶基因(PDE6C、PDE6H)[75-76]、CNG通道亚基(CNGα/β)[77]等。视锥细胞营养不良和视锥-视杆细胞营养不良在发病早期常被误诊为视网膜色素变性,与视网膜色素变性不同的是患者并没有夜盲症和视野收缩等典型症状[78]。二者在发病机制上也有很大差别:视网膜色素变性主要是视杆细胞基因突变率先引起视杆细胞凋亡,患者先出现夜盲症,而后才会影响到视锥细胞;而COD/CORD主要是视锥细胞基因突变,先出现昼视野和色彩的丢失,而后才会影响到外周的视杆细胞。
2 视网膜退行性疾病相关治疗
2.1 药物和神经保护因子治疗
药物治疗作为一种保守的辅助性治疗方法,可以在一定程度上延缓疾病的进展和改善视力,但其治疗效果仍然十分有限[79]。鉴于大多数造成视网膜退行性疾病的基因突变会导致视色素循环异常,因此通过口服药物来代偿内源性视色素的功能成为了临床药物研发的热点。临床I期研究表明,RP患者在连续7天服用Zuretinol(9-顺式-视黄醇乙酸酯)后,视野和视锐度均有了显著性的恢复,且随着长期服药症状逐渐好转,目前无明显副作用的报道[79-81]。Zuretinol和内源性视蛋白形成的异视紫红质可介导视网膜的光响应[82],该药物已成为美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)的指定药品,并且同时获得了FDA的快速通道认定,与之相关的临床研究仍在进行中[83]。基于同样的原理,另外一款药物Dunaliella(富含9-顺式-β-胡萝卜素)也在29个视网膜色素变性病人身上完成了Ⅰ期临床研究,患者口服Dunaliella胶囊90天后视锥和视杆细胞的功能均获得了不同程度的恢复。该药基本没有副作用,因此已经获得了FDA的临床批准[84-85]。该药物将在青少年视网膜色素变性患者身上做进一步临床试验(表2)。目前已有三种广泛使用的玻璃体内抗VEGF药物被证明能有效预防湿性年龄相关的黄斑变性,分别是兰尼单抗、贝伐单抗和阿柏西普[86-87],主要是通过抑制VEGF的功能来抑制血管增生。糖尿病视网膜病变的病理特征与湿性年龄相关的黄斑变性极为相似,因此上述抗VEGF药物也在临床上被推荐用于糖尿病视网膜病变患者[88]。同时,糖尿病视网膜病变作为糖尿病的并发症,其治疗的另一个主要途径是对基础性疾病的治疗,比如调控患者的糖代谢等[89]。针对黄斑营养不良患者的大部分药物目前都处于临床或临床前研究阶段,主要包括Isotretinoin(临床前)、VM200(临床前)、ALK-001(Ⅱ期)、Emixustat(Ⅲ期)、Zimura(Ⅱ期)等[4,83],其中ALK-001备受期待。ALK-001作为维生素A的补充剂,在临床Ⅱ期试验中展现了良好的视网膜保护效果[90](表2)。
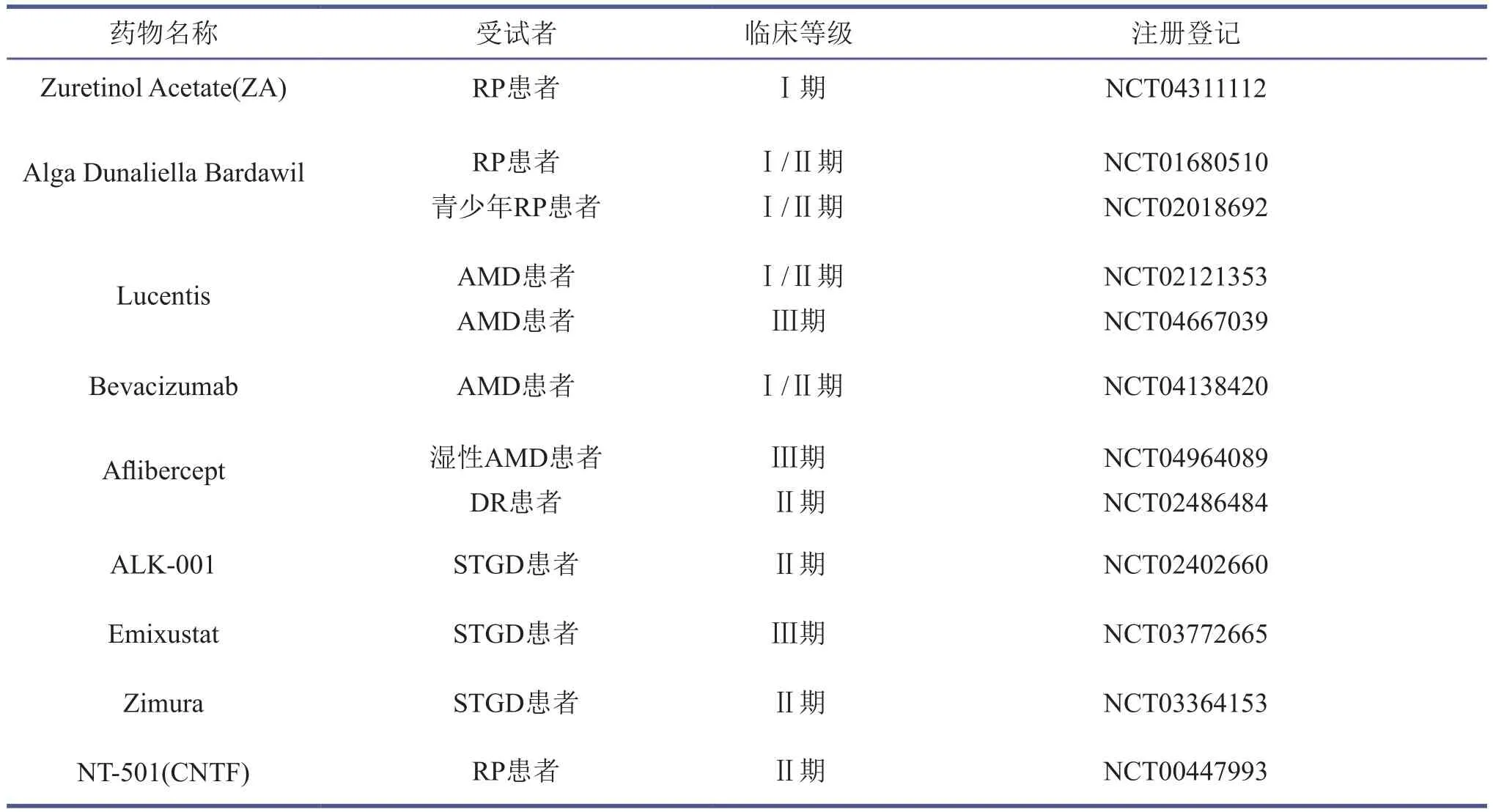
表2 药物治疗视网膜退行性疾病在临床上的最新应用
由于视网膜退行性疾病的多样性和异质性,目前的药物都只能在一定的范围内延缓病程。作为药物治疗的补充,临床上也开发出一系列神经保护制剂[79],其中备受关注的两个神经营养因子分别是睫状神经营养因子(ciliary neurotrophic factor, CNTF)和来自于视杆细胞的视锥细胞活性因子(rod-derived cone viability,RDCV)[4,91]。CNTF在盲小鼠模型[92]和特发性黄斑毛细血管扩张2型病人的临床试验[93]中均被观察到具有保护作用,而在早期或晚期视网膜色素变性病人的临床试验中却并没有显著改善患者的视力[94]。RDCV是由视杆细胞产生并作用于视锥细胞的硫氧还蛋白样分子。视锥-视杆细胞营养不良模型小鼠在通过病毒携带的方式表达了RDCV之后,小鼠的视锥细胞的凋亡比率出现了显著降低,同时小鼠的明视野也在一定程度上得到了恢复[95]。除此之外,牛磺去氧胆酸(TUDCA)[96]、维生素A[97]、二十二碳六烯酸(DHA)[98]以及叶黄素补充剂[99]在临床前研究中被证明分别通过抗凋亡和抗氧化的方式发挥神经保护作用。
2.2 基因替代疗法
基因治疗作为新兴治疗方法在最近几十年里取得了迅猛发展,其原理是通过载体将目标基因(DNA或RNA)递送到靶细胞中[100],以达到基因过表达或者敲除突变基因的目的[101]。腺相关病毒(AAV)因其转染效率高、毒性小、可以在宿主细胞中持续表达等优点而被广泛应用为基因治疗的载体[102-103]。第一例成功的基因治疗临床试验开始于2007年,通过将携带有RPE65基因序列的AAV2病毒注射到莱伯先天性黑内障患者的视网膜下,该基因的表达产物在视网膜色素上皮细胞中催化视黄醛转变为视黄醇,患者在接受治疗6个月之后,微视野检查(microperimetry)和暗适应视野检查(dark-adapted perimetry)的视功能显著改善[14,104]。作为基于该基因开发的药物,Luxturna也成为了第一个被FDA批准用于临床研究的基因产品[105]。基因治疗随后也被用于X染色体连锁遗传性疾病的治疗(CHM[106]、RPGR[107])以及年龄相关的黄斑变性的治疗中。针对年龄相关黄斑变性患者的临床治疗大部分由于副作用明显而被迫中止(比如AdGVPEDF.11D[108]、AAV2.sFLT01[109]),还有一些正处于临床研究阶段(比如AAV8-RGX-314[110]、AAV2-CD59[111])(表3)。通过去除腺相关病毒上的Rap和Cap基因而改造的重组腺相关病毒(rAAV)首先在年龄相关的黄斑变性患者中开展临床研究,一项针对38个湿性年龄相关的黄斑变性的随机临床Ⅱ期研究表明,患者在接受携带有sFLT-1基因(其表达产物是VEGF的内源性抑制因子)的rAAV治疗之后,术后最佳矫正视力(BCVA)恢复到1.0,但针对该基因疗法的进一步研究结果目前尚未公布[112]。
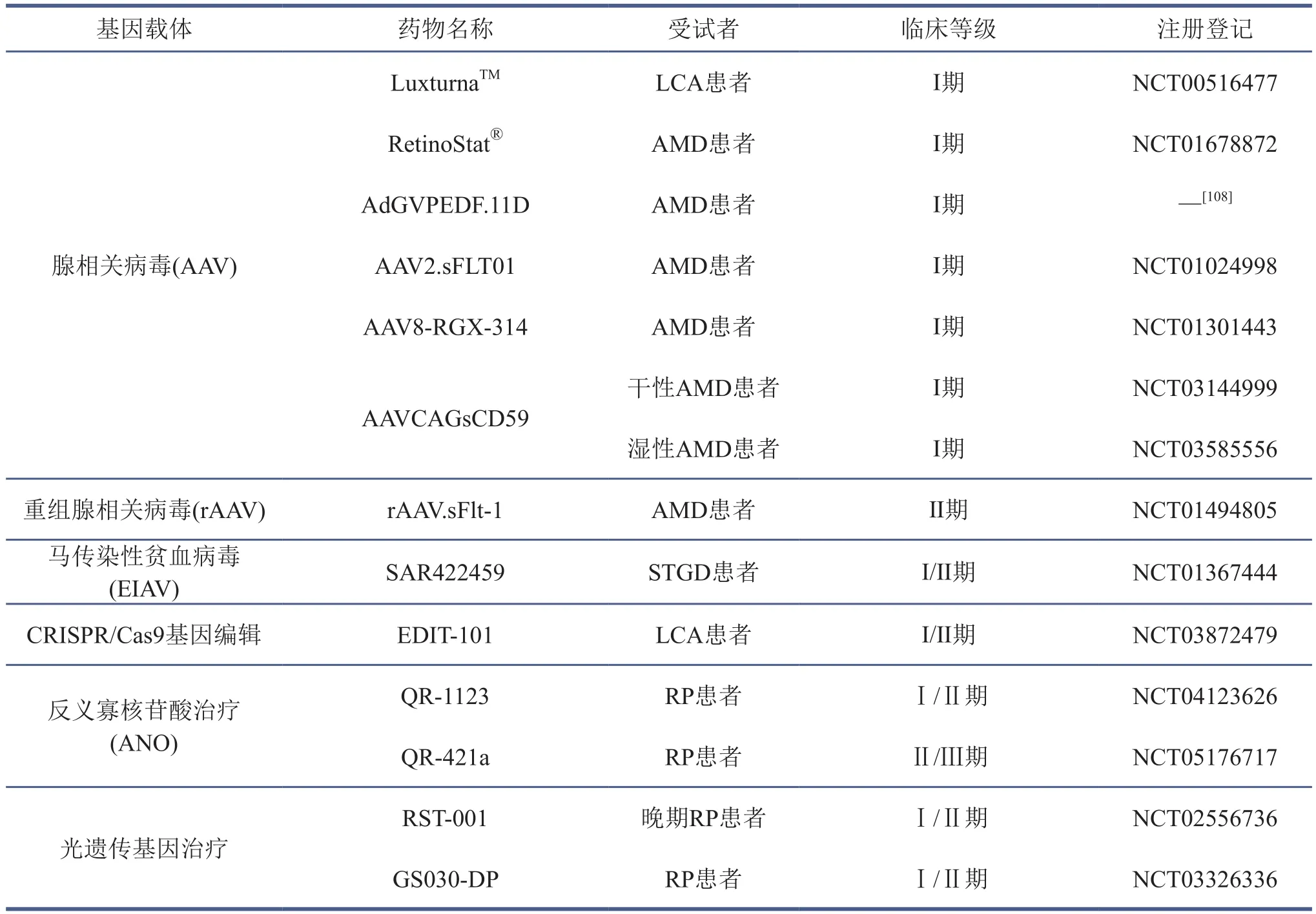
表3 基因替代疗法在临床上的最新应用
由于腺相关病毒只能搭载小于4.7 kb的核酸片段[113],为了满足大片段的外源基因插入,研究者将6.8 kb的ABCA4基因包装进马传染性贫血病毒(EIAV)驱动的慢病毒载体,注射入ABCA4敲除的黄斑营养不良模型幼鼠的视网膜下,病毒表达12个月后小鼠视网膜视黄酰乙醇胺沉积显著性减少,视觉明显改善[114]。该病毒也在2011年被批准开展I/Ⅱ期临床试验(NCT01367444)(表2),但由于潜在的副作用(患者眼压升高)而在2019年被迫终止。除了病毒载体介导的基因治疗,目前也有一些非病毒载体,比如纳米颗粒、脂质体和裸DNA等被用于细胞传递[115]。与病毒相比它们的转染效率较低,但是可以满足较大片段的外源性基因的递送。基因治疗的另一个主要问题是技术操作难度。目前大多数采用视网膜下注射(subretinal injection),该方法需要在中央凹形成一种短暂的异源性神经感觉视网膜脱离,而大多数患者视网膜细胞残留较少且厚度变薄,因此这种方式往往容易导致视网膜脱离或出现黄斑裂孔[116-117]。为此,玻璃体腔注射成为了备选的手术方案,并在X染色体连锁突变的Rs1h-/-小鼠[118]和莱伯先天性黑内障小鼠模型(rd12小鼠)[119]基因治疗上均观察到视觉恢复效果。
随着技术的革新和发展,基因治疗的形式逐渐多样化,出现了CRISPR/Cas9基因编辑、反义寡核苷酸治疗(AON)和光遗传治疗等新的基因治疗形式。CRISPR/Cas9基因编辑是通过引入一种核酸酶,在宿主细胞基因组突变位点产生断裂缺口,然后以正常的核苷酸链作为模板进行内源性DNA修复。该技术操作简单,可以特异性和永久性地修复基因,因而被广泛应用于视网膜色素变性、年龄相关的黄斑变性和糖尿病视网膜病变等多种类型视网膜退行性疾病的治疗。目前唯一进入临床I/Ⅱ期的基因编辑产品是EDIT-101,临床前试验以AAV5为载体在莱伯先天性黑内障小鼠和非人灵长类进行视网膜下注射,结果表明EDIT-101能够特异性地定位和修复模型动物CEP290基因座上发生的突变[120]。反义寡核苷酸治疗是指将外源DNA或RNA链以裸链或者腺相关病毒载体的方式进行视网膜下注射的治疗,主要功能是抑制突变基因的转录产物mRNA,从而阻止异常蛋白的翻译[121]。目前临床上有两项反义寡核苷酸治疗产品正在进行临床I/Ⅱ期志愿者招募,其中QR-1123、QR-421a分别被用于治疗RHOP23H和USH2A基因突变的视网膜色素变性患者。传统的基因治疗技术很大程度上依赖于残存的视网膜细胞,而光遗传学技术则突破了这一限制,通过使用病毒将编码光敏感蛋白的基因插入到功能丢失的光感受器细胞[122]、双极细胞[123]或者神经节细胞[124],光敏蛋白在接受光刺激后可兴奋或者抑制细胞,进而诱发下游的级联信号转导[125]。第一个用于临床治疗的光遗传产品RST-001于2016年开始临床I/Ⅱ期试验,2021年的I期报告显示患者术后视力存在感染和其他副作用[126]。另外一种针对视网膜色素变性病人的光遗传治疗药物GS030-DP于2017年启动临床研究,医生将携带有激活型光遗传基因的病毒载体注射入患者玻璃体腔,通过外部穿戴眼罩GS030-MD接受外界视觉刺激并产生激发光,患者的视神经节细胞被激活从而产生光感。目前已报道的一个RP患者在接受手术后18周就产生了部分光感,大规模的临床试验正在进行之中[127-128]。光遗传治疗虽然存在一定的优势,但由于光敏感蛋白激活需要的光强较大,如何提高细胞的光敏感性成为了当前急需解决的问题[129]。此外,治疗效果很大程度上还取决于病人视网膜的状态、术后恢复和兼容性等。
2.3 干细胞疗法和细胞再生
由于视网膜的细胞数目少且具有免疫豁免的特点,特别是对于视网膜退行性疾病晚期的患者而言,由于视网膜细胞残存较少,干细胞移植成为修复和补充凋亡细胞的理想途径[4]。具有增殖和多潜能的干细胞在来源上主要可分为两类:一类是外源性视网膜干细胞,包括间充质干细胞(mesenchymal stem cell, MSC)、人源胚胎干细胞(human embryonic stem cells, hESC)和诱导多能干细胞(induced pluripotent stem cells, iPSC)[6];另一类是内源性视网膜干细胞,例如睫状上皮来源的干细胞和色素上皮来源的干细胞[130-132](图1)。
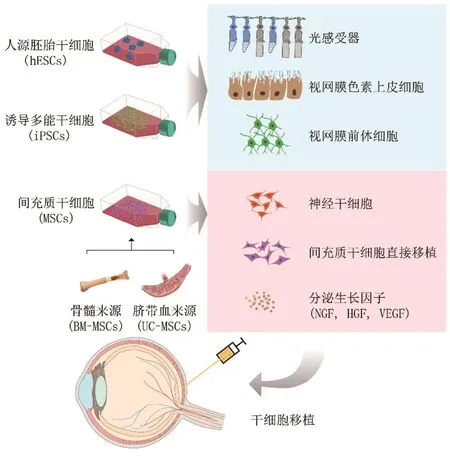
图1 干细胞治疗视网膜退行性疾病的途径和机制
色素上皮细胞作为光感受器细胞的支撑结构,没有复杂的突触连接结构,在细胞移植后结构较容易恢复[91]。此外,无论是体内的色素上皮细胞还是干细胞分化来源的色素上皮细胞都具有免疫抑制和免疫原性双重特性,这一特性能够降低移植色素上皮细胞的免疫排斥风险[133]。体外分化的色素上皮细胞可以以细胞悬液或者细胞层的方式进行移植,临床经验表明细胞层移植的方式后续细胞存活率更大[133]。Schwartz等[134]在2011年率先开展了人源胚胎干细胞来源的色素上皮细胞临床I/Ⅱ期研究(NCT01345006和NCT01344993),18名年龄相关的黄斑变性或黄斑营养不良受试者在接受了人源胚胎干细胞来源的色素上皮细胞移植12个月后,其中13名患者视网膜下色素沉积无显著性减少,但有10个患者术后最佳矫正视力评分有一定程度的提升,且未发生明显的副作用。最新的针对年龄相关的黄斑变性患者临床I/Ⅱ期研究表明,患者在接受了治疗后,视网膜萎缩明显缓解,而且长期的随访发现移植的色素上皮细胞可以长期存在并逐渐形成色素上皮细胞层[135]。尽管人源胚胎干细胞来源的色素上皮细胞在临床上取得了不错的效果,但是患者需要长期进行免疫治疗,因此研究者将目光转移到诱导多能干细胞来源的色素上皮细胞上。一项针对年龄相关的黄斑变性病人的临床研究发现,患者在接受了来自自体的诱导多能干细胞来源的色素上皮细胞治疗1年后,视力虽无显著性的改善,但是针对该病人的4年随访研究表明,接受治疗之后患者的病程出现了减缓[136-137]。国内以第三军医大学附属西南医院牵头也开展了外源RPE治疗视网膜退行性疾病的临床I期研究。早期黄斑营养不良患者在接受了胚胎来源的色素上皮细胞视网膜下注射后,在5年随访中患者视力趋于稳定,无明显的副作用,且部分患者有好转的趋势,证明了干细胞移植治疗视网膜退行性疾病的安全性[138]。相比而言,间充质干细胞因来源和扩增方便、免疫排斥风险更低而备受青睐。间充质干细胞通过不断产生多种生长因子(NGF、HGF、VEGF)作用于色素上皮细胞或者光感受器,可通过替补凋亡的光感受器和分泌免疫调节因子(IL-6、TGF-β)抑制炎症反应等方式发挥治疗效果[139]。目前有大量的相关研究正在开展临床试验,比如:将骨髓间充质干细胞(BM-MSCs)用于视网膜色素变性患者的治疗(I期)[139];将脐带血间充质干细胞(UC-MSCs)用于恢复视网膜色素变性病人的光感(Ⅲ期)[140-141](表4);在使用骨髓间充质干细胞治疗非增殖性糖尿病视网膜病变患者3~6个月后,患者的术后最佳矫正视力得到了显著性恢复[142]。由于色素上皮细胞缺乏光敏感性,一旦光感受器凋亡,即使采用干细胞来源的色素上皮细胞治疗也无法逆转患者失明的进程,但可通过光感受器细胞移植来补充凋亡的光感受器。例如,研究者在获得了处于增殖高峰的胚胎期的视杆细胞悬液后,将视杆细胞移植到盲小鼠的视网膜外段,成功地在盲小鼠上再生了一层光感受器[143],并且能够显著恢复盲小鼠的视觉功能[144],但是相关方法尚未有临床应用。对于晚期的视网膜退行性患者而言,光感受器和双极细胞均严重缺失,此时进行视网膜神经节细胞移植或者尝试采用体外培养的3D视网膜类器官在不久的未来或将为患者带来福音[145-146]。
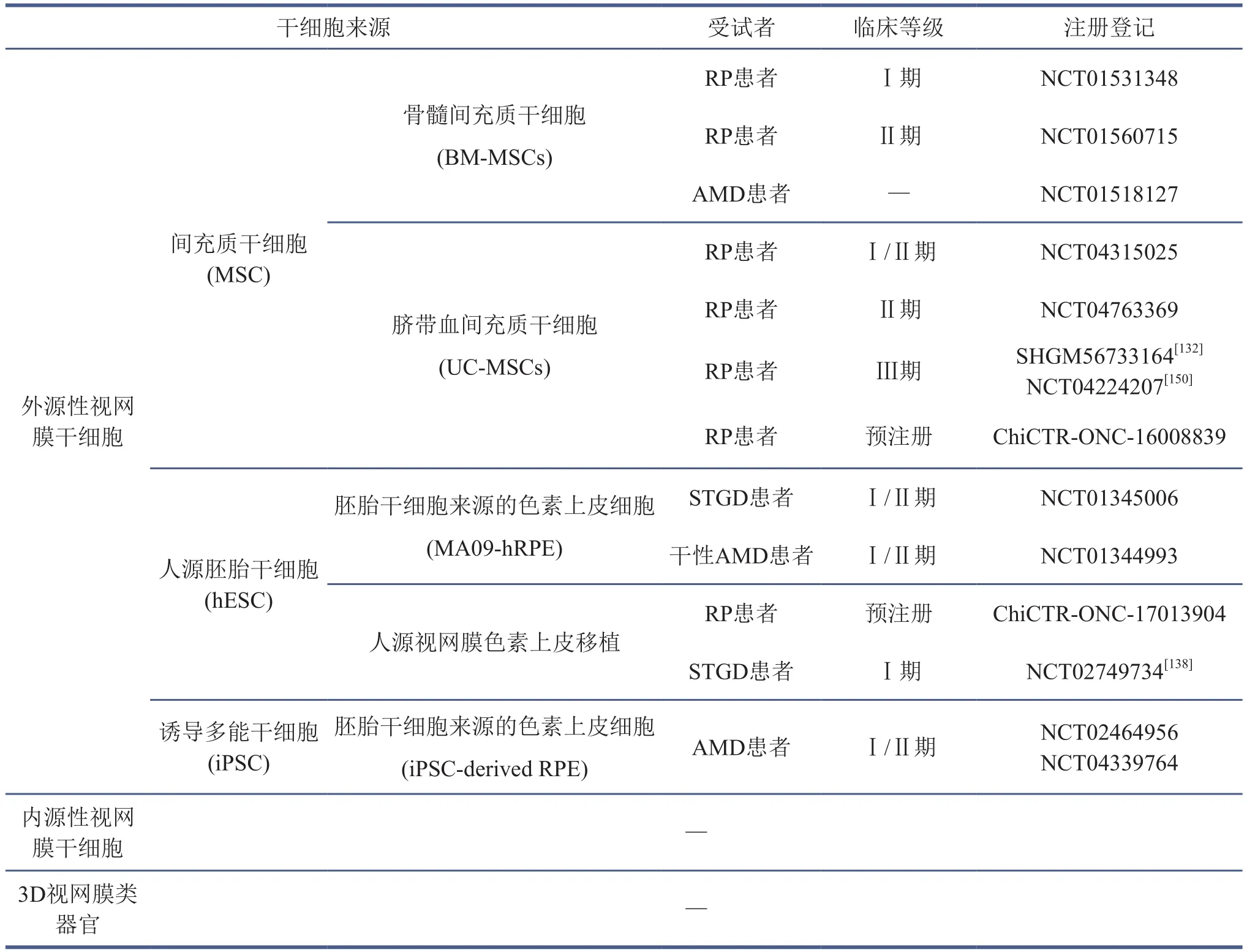
表4 干细胞治疗视网膜退行性疾病的临床研究最新进展
虽然干细胞治疗具有明显的优势,但潜在的风险也不能被忽视。Jeffrey等[147]在2017年报道了三例年龄相关的黄斑变性女性患者在接受脂肪细胞来源的干细胞治疗后产生严重的副作用,患者的视力在术后1年降低到20/200直至完全失明,并伴随着高眼压等症状。此外,临床上有部分患者接受干细胞治疗后出现严重的炎症反应、视网膜脱落以及其他并发症[148-149]。与此同时,例如干细胞在移植后如何整合到新的视网膜结构中等一系列问题仍然有待解决。这表明,干细胞治疗虽然有很大的应用前景,但还有很长的路要走。在最近几十年里,干细胞治疗临床申请便多达69个。尽管如此,目前只有两个进入临床Ⅲ期研究,且还没有一项基于干细胞移植的产品被批准用于患者治疗[150-151]。
2.4 视觉假体
人类致力于视觉修复的努力从未止步,视觉修复的方法也层出不穷。视网膜假体移植是其中一种方法[15,91],其原理是将视觉信号转变为电信号直接刺激视网膜内层细胞,从而帮助失明患者恢复光感。目前关于视觉假体和人工视觉的研究和开发主要集中在视网膜假体和皮质假体,而视网膜假体根据植入位置的不同主要分为视网膜外假体、视网膜下假体和脉络膜假体[152]。视网膜外假体绕过视网膜的内核层与神经节细胞贴合,直接刺激神经节细胞以引起视觉响应[153-154]。这类视觉假体只要在神经节细胞存活的视网膜中即可使用,植入手术也相对容易。视网膜下假体位于视网膜与色素上皮之间,主要通过激活残存的视网膜内层细胞引起神经节细胞响应[155]。此类假体利用残存的视网膜结构将信号放大,故而仅需要较低的刺激强度,但是植入手术较为复杂[156]。脉络膜假体位于脉络膜和巩膜之间,植入方法的侵入性较小,手术风险较小[157],但是因为刺激电极与视网膜神经元之间的距离较大,所以需要较大的电流才能引起视觉感知。另外,脉络膜上放置假体有较大的电流扩散风险,造成了空间分辨率的下降[158]。
通过电刺激恢复视觉的临床应用最早可以追溯到1775年,Charles Le Roy等采用电流刺激视皮层恢复了视觉损伤患者的部分视感[156],而间隔两个半世纪后,第一款可以用于视网膜色素变性患者临床治疗的视觉假体ArgusⅡ才被FDA批准(2013年),也是目前全球使用最广泛的视网膜外植入假体[159]。ArgusⅡ由植入眼部的设备和佩戴于体外的设备两部分组成,其中:植入眼部的设备主要包含有一个具有接收与发射信号功能的线圈和一个与之相连并植入到视网膜黄斑表面的电极微阵列,电极微阵列由60个直径为200 µm的电极通道组成;体外设备则主要由摄像机、发射器和视频处理器组成。使用时摄像机拍摄的视频先由视频处理器加工为电信号,再由发射器无线传输至植入体内的接收线圈,然后由线圈经丝状线缆传至电极微阵列,并刺激视网膜细胞,从而在视觉系统中成像[154]。第一批30个视网膜色素变性患者在美国和欧洲接受了视网膜外植入ArgusⅡ手术,患者在植入后1年和3年的平均视敏度为2.5 logMar,在这两个时间点的最佳视敏度为1.9 logMar(20/1 588)[154,160]。连续5年的随访也表明,患者在识字符、整理内务、行走避障等行为上均有所进步,生活质量显著提升。然而,其中有12位患者(40%)发生了严重不良事件,主要症状为结膜糜烂[160]。目前Second Sight医疗公司已不再进行新版本ArgusⅡ的商业发布。
Alpha IMS是唯一一个获得CE认证的视网膜下植入物,由德国蒂宾根大学眼科中心的Eberhart Zrenner团队研发。Alpha IMS由一个3 mm2的芯片和外部电源及各种组件组成,其中芯片在视网膜下植入,而外部电源和感应线圈相连置于眼外[161]。Alpha IMS的I期临床试验于2010年开始,部分患者植入Alpha IMS后可以识别少数字母,检测运动和不同形状的物品[162]。第二代Alpha AMS芯片上的光电二极管提高到了1 600个,使用寿命也有了很大的提高,并在2016年获得CE认证,其安全性和有效性在15名视网膜色素变性患者身上进行了验证[163]。另外一款用于视网膜下植入的视觉假体是PRIMA,在年龄相关的黄斑变性患者身上进行了临床试验,该电极包含378个直径100 μm的近红外光电器件,不需要外部供电[164]。其他的视网膜下植入假体还包括IMI、IRIS以及EPI-RET3[165]等(表5),但是都处于临床试验阶段。用于脉络膜上植入的视觉假体主要包括BVA和STS。前者是由澳大利亚仿生视觉研究联盟团队研发的,植入眼内的设备包含33根刺激电极。该产品在2012年启动的视网膜色素变性病人临床试验中展示了较高的稳定性和安全性,患者Landolt-C视敏度能达到20/4 451[157,166]。BVA团队目前正在开发下一代44通道完全可植入设备,并在开展临床前的研究[167]。STS是由日本的Fujikado等研发的,该电极阵列由49根直径500 μm的电极组成[168],目前已经完成3个视网膜色素变性病人的临床研究,患者在手术后视觉功能得到显著性改善,并能够完成一些简单的视觉引导行为[169-170]。
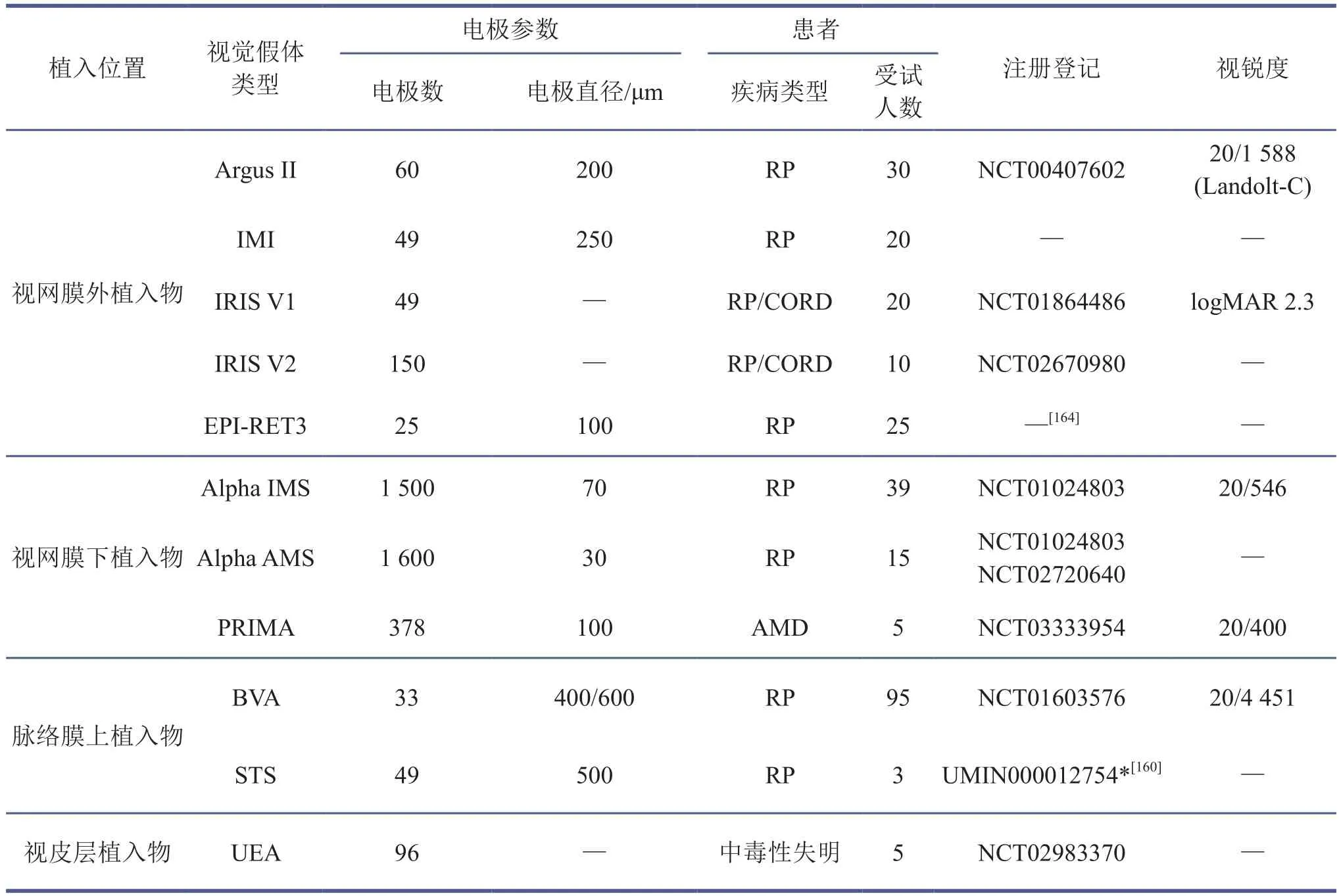
表5 临床治疗视网膜退行性疾病的视觉假体研究
对于视网膜结构完全丢失的患者,研究者尝试直接在枕叶的视皮层给予患者电刺激。研究者将视皮层假体UEA植入完全致盲的患者视皮层下,该电极阵列由96个1.5 mm长的电极排列在10×10的栅格内,单根电极的刺激阈值为66.8±36.5 μA。最新研究报告显示,采用多根电极同步刺激,可以诱发患者的光感,接受刺激后患者也能识别一些简单的字母和物体轮廓[171]。另外一款基于多点序列刺激原理的视皮层假体VCP也在病人身上进行临床评估,按照一定的频率和序列进行刺激,患者能够报道部分刺激所对应的视觉信息[172]。就刺激模式而言,除了上面提到的电刺激,还包括光遗传学、光驱动外源性材料、超声波和磁场等方式,但大多处于临床前阶段。总而言之,视觉假体在某些方面展现出了较为满意的视觉恢复效果,但同样存在一些问题。比如电极的密度、几何形状、通道布局和电极阵列的返回配置的限制导致视觉假体的空间分辨率较差。其他方面包括刺激脉冲类型和参数、电流扩展、通道间干扰、手术植入位置等也显著影响其分辨率[173-174]。
3 总结和展望
目前全球有超过1 400万人因视网膜退行性疾病而失明,已经发展成为亟待解决的公共卫生问题[175]。在老龄化问题日益严重的当下,帮助视网膜患者重获光明不仅能够提高患者的生活质量,也为社会和国家释放了一部分医疗压力,是全社会共同的期望和美好愿景。视网膜退行性疾病多数由遗传调控,少数还受到环境因素的影响。由于其发病机制的复杂性和基因突变的异质性,目前针对神经退行性疾病并没有有效的治疗方法。但是在最近几十年里,大量的治疗方法和技术为广大患者带来了福音。药物治疗在一定程度上能够缓解疾病进程,但是无法逆转视网膜功能退化的进程;基因替代疗法对于特异性基因突变的早期视网膜退行性疾病患者有较明显的治疗效果,但对于光感受器残存较少的晚期视网膜退行性疾病患者治疗效果不佳;细胞治疗虽然可以用于晚期视网膜退行性疾病的治疗,但临床上的副作用较大,目前还没有相关产品被批准用于临床治疗。相比而言,视觉假体是目前视觉恢复领域治疗效果较为理想的途径之一,患者在植入假体后最佳视力可以达到20/546,但是仍然无法帮助患者获取精细的视觉信息[162]。
总而言之,目前视网膜退行性疾病的治疗方法各有利弊,还需要不断的探索和发展。随着科学技术的进步和视网膜退行性疾病发病机制研究的不断深入,相信不断会有新兴疗法可以克服挑战,甚至可能出现几种治疗手段的相互结合、相互辅助,有望帮助患者恢复视觉。

