红树林放线菌抗沃柑病原真菌的研究
李菲 杨玲 王巧贞 许秀松 黄庶识 杨慧欢 覃仙玲,*
(1 广西科学院广西近海海洋环境科学重点实验室,南宁 530007;2 广西科学院 广西海洋天然产物与组合生物合成化学重点实验室,南宁 530007;3 广西师范大学 生命科学学院,桂林 541006;4 广西师范大学 珍稀濒危动植物生态与环境保护教育部重点实验室,桂林 541006;5 南宁学院机电与质量技术工程学院,南宁 530200)
柑橘是我国重要的水果产业,品种多,分布广,种植规模和产量均居全球第一[1]。沃柑系以色列研发的杂交柑橘品种,由于晚熟高糖和早结丰产等优点,在我国广受青睐[2-4]。沃柑晚熟,需要越冬,但又不防冻,因此适合我国广西等积温高的地区种植。截至2018年底,广西沃柑种植面积约200万亩(13.33万hm2),产量约100万吨,位居全国第一位[5]。沃柑作为广西柑桔产业的支柱产品,对广西的农业经济有着重大意义。然而,柑橘培育过程中发生的病虫害不容小觑。据美国植物病理学会网站记录,柑橘真菌性病害60余种,其危害程度因地区和品种而异[6]。为顺利开展沃柑病害中病原真菌的防控工作,本课题组在广西南宁上林沃柑培育基地开展了沃柑病害的调查,结果发现沃柑枝叶及果实在生长过程中,会出现不同程度的真菌感染,病征与柑橘炭疽病、柑橘溃疡病及柑橘黑点病的症状相似,为弄清病原真菌种类及寻找针对性的防治方法,本研究对沃柑叶斑病害中病原真菌进行分离和初步鉴定,并开展了红树林放线菌抗沃柑病原真菌的研究。
放线菌,尤其是链霉菌是天然抗菌活性产物的主要来源,约2/3的抗生素是由放线菌产生[7]。放线菌作为土壤中的优势菌群,经过数十年来大规模的挖掘和筛选后,普通生态环境中挖掘出新颖的放线菌资源越来越困难,故人们将目光转向了特殊生态环境。红树林作为海陆交界的特殊生态系统,其微生物群落在适应生态环境与自我保护中,通过通信、觅食、拮抗等互作的微生物生存机制,来适应谓之“生命极限”的特殊环境,其独特的生境必然会造成其代谢出更具特点的化合物及其相应的生物活性[8]。研究发现,红树林土壤放线菌不仅产生多种功能酶[9],而且还分泌具有抗菌、抗肿瘤、抗氧化等药用活性的代谢产物[9-12]。本研究以分离到的植物病原真菌为指示菌,从红树林放线菌中筛选出了具有显著抑菌活性的菌株,为沃柑叶斑病害的防控奠定了基础。
1 材料与方法
1.1 试验材料
1.1.1 供试样本
(1)病害样本于2021年10月采集自广西农业科学院园艺研究所的沃柑培育基地,采集有明显病症部位的叶片样品,装于密封袋带回实验室进行研究。
(2)健康叶片样本采自广西农业科学院科研基地,选取形态相近且健康的沃柑带叶枝条若干,放置于密封袋保存带回实验室备用。
1.1.2 主要试剂和仪器
(1)试剂 培养基原料、TAE缓冲液、2×EasyTaqMasterMix、引物(ITS1和ITS4)、DNA marker、GoldView核酸染料,Chelex 100树脂(Bio-Rad),其他有机试剂(分析纯)等购于北京康为世纪生物科技有限公司。
(2)仪器 SW-CJ-2F型超净工作台(杭州佳滤设备有限公司),HH·B11-BS-Ⅱ型恒温培养箱(东莞市恒宇仪器有限公司),Tgradient型PCR扩增仪(德国Biometra),电泳仪(美国BioRad),Gel Logic 2200Pro凝胶成像仪(Carestream),VB-55型高压灭菌锅(德国Systec),MINI-6k型迷你离心机(常州市国旺仪器制造有限公司),MINIB-100型金属浴(杭州米欧仪器有限公司),恒温振荡器(美国Crystal),N1000型旋转蒸发仪(日本Eyela)和光学显微镜(日本Nikon)等。
1.1.3 培养基
真菌分离、纯化及拮抗菌筛选培养基:PDA固体培养基(土豆200.0 g,葡萄糖20.0 g,去离子水1000 mL,琼脂14.0 g,pH 6.8~7.2)。
发酵培养基:改良InternationalStreptomycesProject 2(ISP2)固体培养基[14]。
1.1.4 供试放线菌菌株
选取24株于2021年11月分离自广西茅尾海红树林自然保护区内桐花树根际土壤的放线菌,通过EzBioCloud数据库(https://www.ezbiocloud.net/)在线比对[15],这些放线菌隶属于12属,其中5株链霉菌属(Streptomyces),5株红球菌属(Rhodococcus),3株微杆菌属 (Microbacterium),3株小单孢菌属 (Micromonospora),2株类诺卡菌(Nocardioides),壤霉菌属(Agromyces)、短状杆菌属(Brachybacterium)、戈登菌属(Gordonia)、棒状杆菌属(Corynebacterium)、栖白蚁菌属 (Isoptericola)、分枝杆菌属(Mycobacterium)和Phycicoccus属各1株;均保藏于广西科学院北部湾海洋微生物种质资源库中,具体信息见表1。
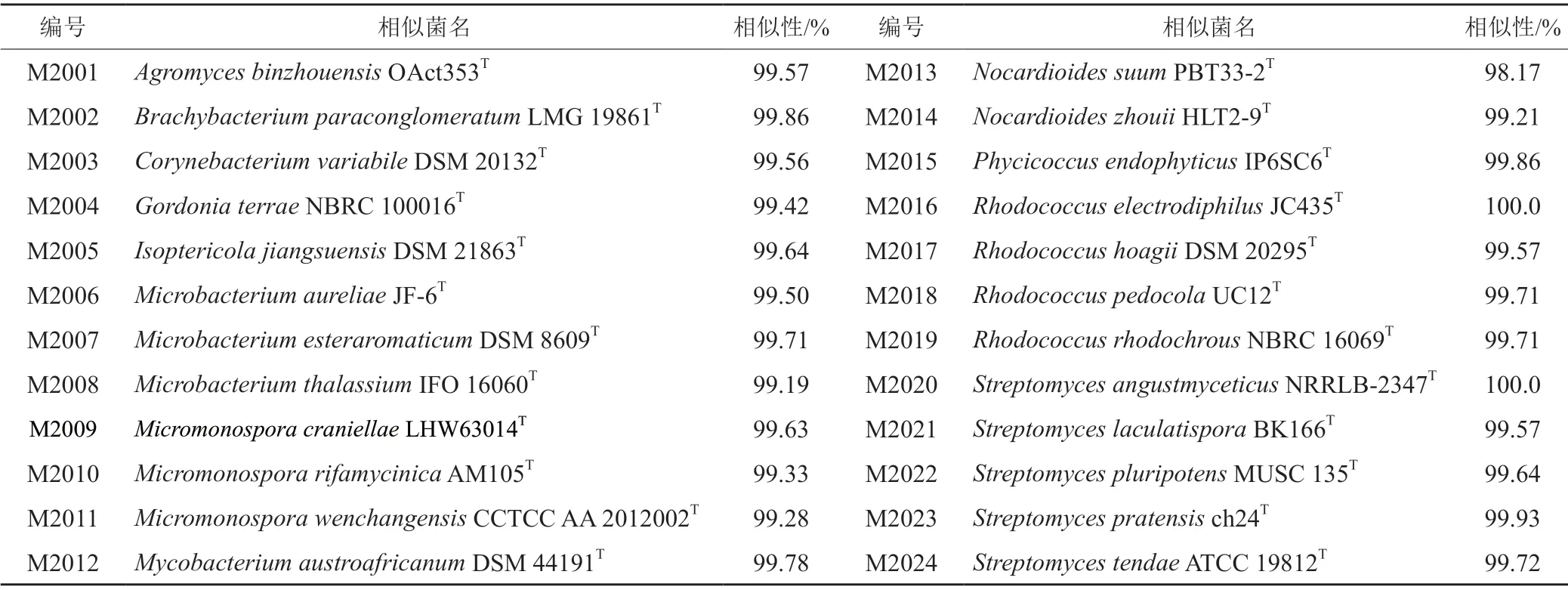
表1 拮抗实验用红树林放线菌信息Tab.1 Actinomycete strains from mangrove for antagonistic assay
1.2 病原真菌分离与鉴定
1.2.1 菌株分离纯化
用自来水冲洗患病叶片组织后,依次用75%乙醇和5%次氯酸钠溶液浸泡组织各5 min,每次消毒后用灭菌水反复冲洗3次。处理后的病样组织置于超净工作台晾干,用无菌剪刀将有病样部位剪成小块,分散铺于PDA固体培养基上,28℃培养3~5 d。观察平板上菌落生长情况,挑取肉眼可见菌落进行纯化培养,并将纯化好的菌株接种至PDA试管培养基中,待其生长至对数期后进行斜面保藏。
1.2.2 真菌生长速率测定及形态观察
用打孔器(直径6 mm)取新鲜的菌苔边缘的菌丝块转接于PDA培养基(直径90 mm)中央,置于28℃培养,每株菌3组平行。用十字交叉法测量菌落直径,待菌丝长满即停止测量,菌落平均生长速率单位为mm/d。挑取PDA表面的分生孢子,在光学显微镜下观察其形态。
1.2.3 真菌菌株基因测序和系统发育分析
采用chelex-100树脂[16]快速提取待测真菌的基因组DNA作为PCR模板,对待测菌进行PCR扩增。引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′),特异性扩增出各个菌株的ITS1-5.8S-ITS2区域,基因序列长度约为550 bp;扩增条件:94℃预变性8 min,94℃变性30 s,55℃退火30 s,72℃延伸2 min,共30个循环,循环结束后,72℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测合格后,委托生工生物工程(上海)股份有限公司进行测序分析。序列经BioEdit Sequence Alignment Editor软件整理后,测序结果在NCBI中进行BLAST同源性比对,分别获得同源性相近的菌种序列,运用MEGA7.0软件,采用Neighbor-Joining法构建系统树,对各菌株的系统发育地位进行分析[17]。
1.2.4 致病性测定
参照赵洪涛等[18]的方法,按照柯赫氏法则,对分离到的疑似致病菌株进行回接验证。具体操作如下,将新鲜叶子从枝条上剪下,用自来水进行表面冲洗后,再用75%乙醇溶液对其表面消毒3次,每次消毒后用无菌水冲洗3遍,置于超净工作台中晾干。用无菌牙签在叶面上有序扎数个孔。用无菌生理盐水制备真菌分生孢子液,悬浮液浓度约为1×107CFU/mL。滴加10 μL在扎孔处,对照组则滴加10 μL无菌生理盐水。接种后的叶片置于玻璃平皿中,底部放入润湿的无菌纱布,每组3张叶片,每组3个平行,置于28℃的人工气候箱中,12 h光照/12 h黑暗交替培养,注意补水保湿;定期观察叶片发病情况,对发病叶片进行病原菌的分离和鉴定。
1.3 拮抗菌的筛选及活性测试
1.3.1 菌株抑菌活性初筛
采用平板对峙法对24株供试菌株进行拮抗活性筛选,用无菌打孔器将分离到的病原真菌制成6 mm菌饼,接种于PDA固体平板中央,放置28℃培养,病原真菌C1和C4培养2 d,C2和C3培养1 d后,再将待测放线菌接种于PDA固体平板四周,每板接4株细菌;以仅接种病原真菌菌饼的PDA固体平板为空白对照组,放置28℃培养5~7 d,观察并记录病原真菌的生长情况。
1.3.2 菌株发酵产物的抗菌活性测试
选取初筛活性良好的菌株进行菌株发酵产物活性检测,旨在确定活性产物极性。选择改良ISP 2培养基作为摇瓶发酵培养基。采用与文献[19]相同的菌株发酵条件及其次级代谢产物的提取方法。受试菌株留存3类样品:①发酵液离心后的上清原液(下文简称为原液);②上清乙酸乙酯萃取后的甲醇浓缩物(下文简称酯相);③菌体丙酮浸提后的甲醇溶解液(下文简称菌体浸提物);3种样品均用一次性过滤器(0.22 μm孔径)处理后使用。采用牛津杯法[20]检测菌株发酵产物的抑菌活性,以改良ISP2液体培养基/甲醇溶液为空白对照,每个牛津杯加入初始样液150 μL,置于28℃培养箱培养7 d,观察并记录指示真菌的生长情况,并计算拮抗菌株发酵产物的抑菌率,公式如下:
抑菌圈直径=对照组病原菌直径-实验组病原菌直径
抑菌率=抑菌圈直径/对照组病原菌直径×100%
1.3.3 活性菌株发酵产物的病害防治测试
选取真菌C4侵染健康的沃柑叶片,测试活性菌株发酵产物的病害防治效果。试验设计2组,按“1.2.4”处理新鲜的待试沃柑叶片。试验1:用无菌牙签在叶面上有序扎8~10个孔,将发酵原液/酯相均匀喷洒至叶片的正面和背面,晾干后,在扎孔处滴加10 μL真菌C4的分生孢子液(浓度约为1×107CFU/mL)。试验2:用无菌牙签在待试沃柑叶面上有序扎8~10个孔,将10 μL真菌C4的分生孢子液(浓度同上)滴加在扎孔处,培养至叶片出现病斑,再将发酵原液/酯相均匀喷洒接种至叶片的正面和背面。两组实验均以喷洒改良的ISP2液体培养基/甲醇溶液作为空白对照,接种后的叶片均置于玻璃平皿中,底部放入润湿的无菌纱布,每组20张叶片,置于28℃的人工气候箱中,12 h光照/12 h黑暗交替培养,注意补水保湿,定期观察叶片发病情况,统计叶片上病斑数量,并计算沃柑叶片的病情指数和菌株发酵产物的防治效果。
参照文献[18]方法,将病情分级标准制定如下:0级,无病斑;1级,每叶有1~3个病斑;3级,每叶有4~6个病斑;5级,每叶有7~10个病斑。
病情指数=[Σ(各级病叶数×相对级数值)/(试验总叶数×5)]×100%
防治效果=(对照组病情指数-处理组病情指数)/对照组病情指数×100%
1.4 目标菌株基因组序列antiSMASH在线预测与分析
对目标菌株进行基因组测序分析。将菌株接种于改良ISP2液体培养基中,28℃、180 r/min摇瓶震荡培养5 d,8000 r/min离心10 min收集菌体,用无菌水洗涤3次后装入15 mL离心管,迅速冷冻后寄送至上海美吉生物医药科技有限公司完成基因组的提取、测序、组装和注释。基因组序列通过antiSMASH服务器(https://antismash.secondarymetabolites.org/)进行次级代谢生物合成基因簇的预测。
2 结果与分析
2.1 病原真菌分离与鉴定
2.1.1 菌落形态、生长速率及分生孢子等形态学观察
从病样组织中分离出7个菌株,根据其菌落及分生孢子形态特征(图1)分为4种真菌:①C1菌落呈棕黑色,橙红色气生菌丝致密,常产生橙色露珠状液滴使之呈红色,生长缓慢(8.02 mm/d);分生孢子呈短杆状或椭圆状。②C2菌落呈紫红色,后期产生紫红色色素,气生菌丝白色浓密,生长较快(16.21 mm/d);分生孢子呈镰刀形。③C3菌落呈粉红色,气生菌丝白色浓密,生长较快(16.13 mm/d);分生孢子呈镰刀形。④C4菌落呈白色或奶白色,气生菌丝灰白色浓密,生长较慢(12.58 mm/d);分生孢子呈砖格状或镰刀形。

图1 病样分离菌株的菌落及分生孢子形态Fig.1 Colony and conidia morphology
2.1.2 病原真菌的分子生物学鉴定
经测序比对,真菌C1的ITS基因序列与Boeremia exigua(登记号MH484014.1)完全一致;真菌C2、C3和C4均属于镰刀菌属(Fusarium)菌株,其ITS基因序列分别与层出镰刀菌Fusariumproliferatum(登记号HQ380763.1),藤黑镰孢菌Fusariumfujikuroi(登记号KJ000429.1)和腐皮镰刀菌Fusarium solani(登记号KT184399.1)一致,并对其构建Neighbour-Joining系统发育树(图2);并根据真菌鉴定手册及相关文献报道[21-25],这些真菌的分子鉴定结果与观察到的生物学特性相吻合。

图2 基于ITS基因序列构建菌株C1,C2,C3和C4的N-J系统发育树Fig.2 N-J phylogenetic tree of the strain C1,C2,C3 and C4 based on the ITS gene sequences
2.1.3 致病性测定
按照柯赫氏法则,通过针刺接种法将疑似致病菌株C1~C4的分生孢子接种到健康的沃柑叶片上。结果表明,接种C1的叶片在第5天出现褐色病斑,棕色处呈凹陷空洞,病健交界处出现黄绿晕圈(图3a);接种C4的叶片在第2天出现黑色病斑,外延微微隆起,黑色病斑向外扩张,病症恶化速度极快(图3d);且从各自发病的叶片上,重新分离到C1和C4菌株。接种层出镰刀菌C2(图3b)和藤黑镰孢菌C3(图3c)则均与对照组的表征相同,未见病灶。可见,真菌C1和C4均能感染沃柑叶片,且真菌C4的感染情况较真菌C1的感染情况严重。

图3 C1-C4菌株致病性测定结果(真菌感染5~7d)Fig.3 Orah leaf infected by fungal strain C1-C4 after 5-7 days
2.2 拮抗菌活性测试
2.2.1 拮抗菌的筛选
采用平板对峙法对24株红树林放线菌进行拮抗活性初筛,筛选到1株链霉菌M2020对4株病原真菌表现出显著活性(图4A组)。再用牛津杯法对菌株M2020的发酵原液、发酵液酯相及菌体浸提物进行抑制病原真菌C1~C4的活性测试。结果显示,M2020菌体浸提物对真菌C1~C4均无抑菌活性,M2020的发酵原液对真菌C1、C2和C3无抑制作用,对真菌C4有抑制活性,抑菌圈小于等于22.74 mm,抑菌率为45.33%。M2020的发酵液酯相对真菌C1、C2、C3和C4均有抑制效果(图4B组),抑菌圈直径分别为25.70、47.60、37.10和25.30 mm,抑菌率分别为63.61%、62.63%、53.22%和47.65%。
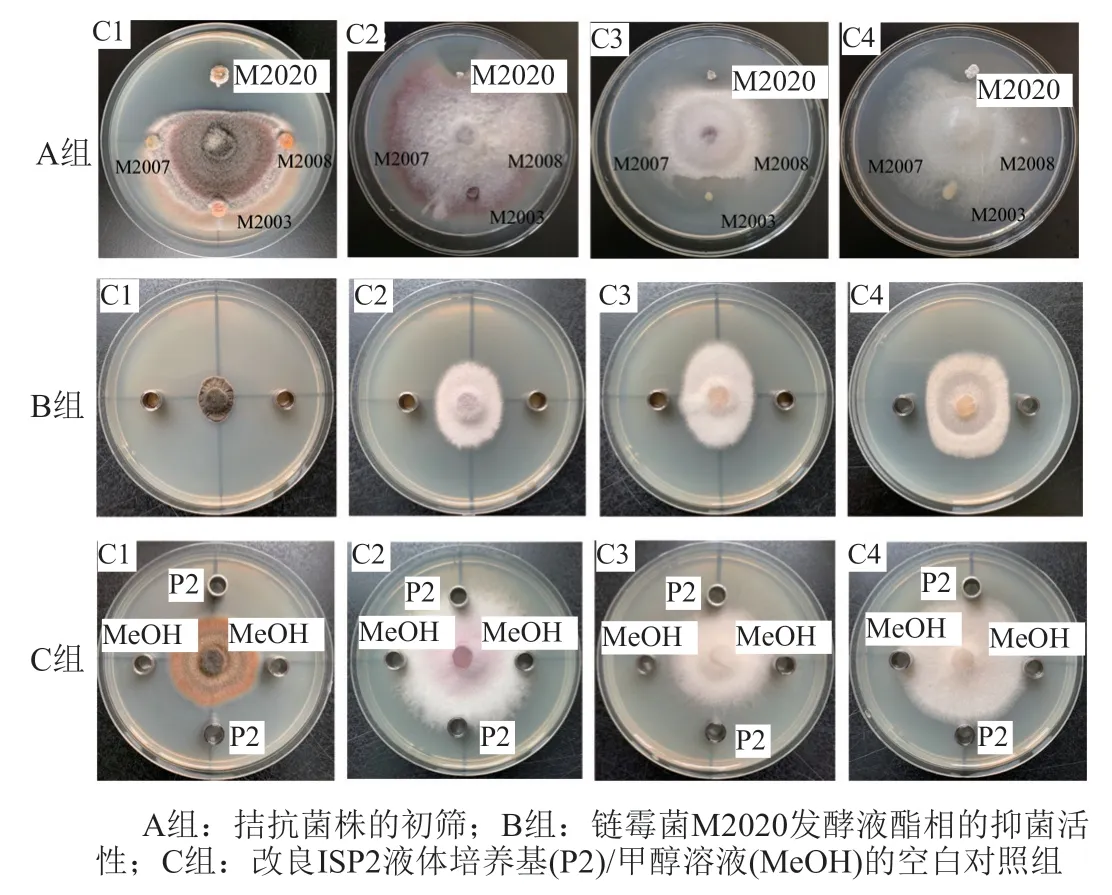
图4 链霉菌M2020抗真菌C1~C4活性Fig.4 Antifungal activities of strain M2020 against fungal strains C1~C4
2.2.2 链霉菌M2020的防病害效果
以致病真菌C4作为指示菌株,通过针刺接种法将其分生孢子接种到健康的柑桔叶片上,用菌株M2020的发酵原液和酯相处理叶片,观察叶片出现病害的情况,从而判断M2020菌株的防病害效果。结果表明,菌株M2020的发酵原液和酯相对真菌C4侵染有显著抑制效果。试验1中,发酵原液处理组有2片叶子出现褐色病斑,部分叶片的扎孔处均有患病后结痂痕迹(图5A-1),酯相处理组中有5片明显病征的叶子,部分病斑出现中心斑块淡化(图5A-2);结合叶片患病指数和防治效果(表2),试验1中发酵原液处理后的叶片患病率较低(患病指数为8.42%),即发酵原液防止真菌C4侵染效果较好(防治效果为89.87%)。试验2中,发酵原液处理组有5叶片出现黑色病斑,有3处黑斑呈向外扩张恶化严重(图5B-1);酯相处理组中多数叶斑呈现结痂状态。从表2可知,试验2中发酵酯相处理的叶片患病率较低(患病指数为5.00%),即发酵液酯相在沃柑叶片出现叶斑后的控制效果佳(防治效果为94.56%)。综上,在沃柑叶斑病害(真菌C4感染)的防治上,可先用菌株M2020发酵原液处理叶片来预防病原真菌侵染;若叶片出现病症,可用发酵液酯相控制该病害的扩大。

图5 M2020发酵产物对沃柑叶片患病前/后处理的药效试验图Fig.5 Field test of strain M2020 fermentation products on pretreatment or post treatment of Ora
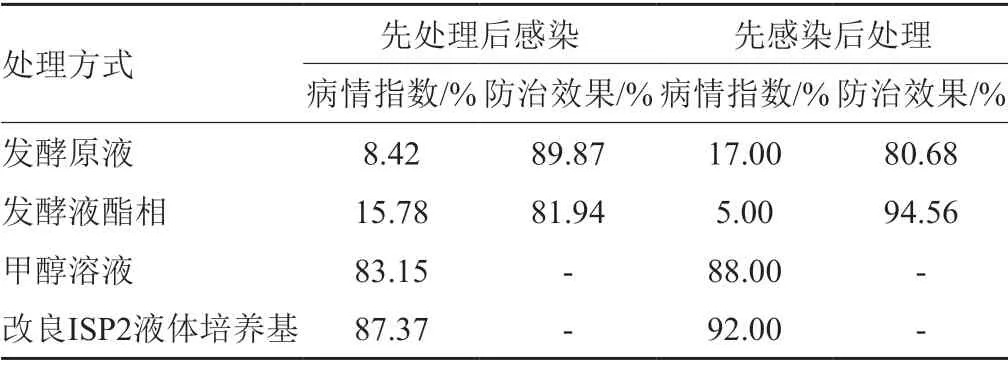
表2 M2020发酵产物对沃柑叶片患病前/后处理的药效试验结果Tab.2 Field test of strain M2020 fermentation products on pretreatment or post treatment of Orah
2.3 链霉菌M2020次级代谢产物合成潜力分析
基于基因组信息对链霉菌M2020合成次级代谢产物的潜力进行预测,菌株M2020基因全长8.1 Mbp,GC含量为72.2 mol%。经antiSMASH预测分析,其潜在的次级代谢产物生物合成基因簇(biosynthetic gene cluster,BGC)共有38个(表3),主要包含聚酮类(T1PKS、T2PKS和T3PKS)、非核糖体多肽类(NRPS)、萜烯类(terpene)、非α-多聚氨基酸类(NAPAA)、核糖体合成和翻译后修饰肽(RiPP-like) 、羊毛硫肽类(lanthipeptide)、嗜铁素(siderophore) 和四氢嘧啶(ectoine)等已知基因簇。
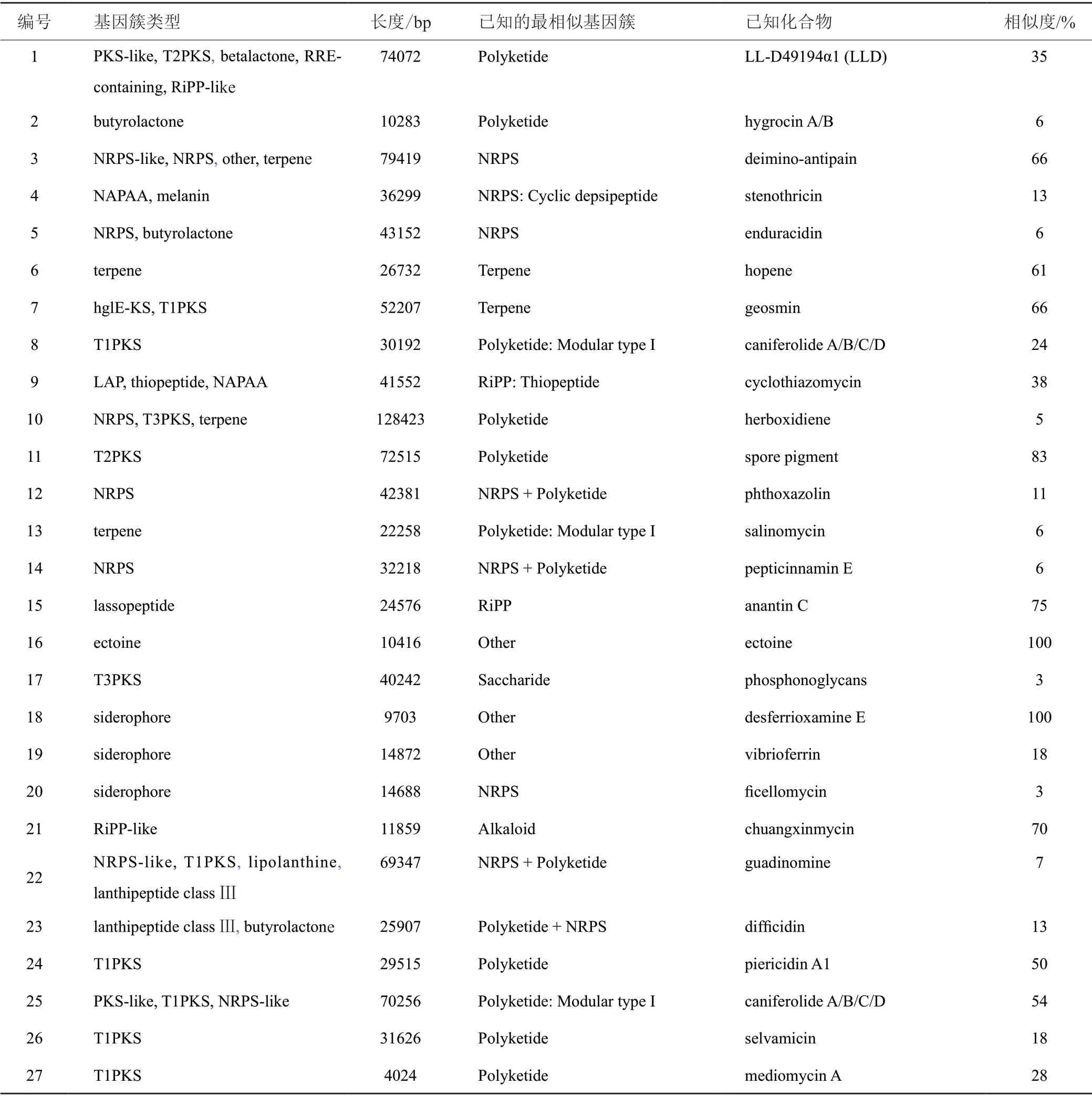
表3 M2020次级代谢产物生物合成基因簇Tab.3 Secondary metabolite biosynthesis gene clusters of M2020
此外,T1PKS(5451、18350和46353 bp)terpene(20950 bp) lanthipeptide class Ⅲ(22729 bp)RiPP-like(10227 bp和10842 bp) lassopeptide(22442 bp)other(32525 bp) butyrolactone (10342 bp和10920 bp)基因簇未匹配到同源基因簇的序列。
3 结论与讨论
广西的沃柑种植面积位居全国第一位,对广西的农业经济意义明显。本研究针对沃柑真菌病害,从广西南宁采集的沃柑叶片上分离到代号C1~C4的4株真菌,经初步鉴定,分别为大豆茎点霉、层出镰刀菌、藤黑镰孢菌和腐皮镰刀菌。文献调研表明,大豆茎点霉是破坏性极强的病原真菌,可导致棉花[26]、秋葵[27]、烟草[28]及大豆[29]等农作物患病。镰刀菌是另一类分布广泛的植物病原真菌,能侵染多种粮食和饲料作物的根、茎、叶及果实而引起根腐、穗腐和茎腐等病害[30]。其中腐皮镰刀菌是由厚垣孢子可通过微小创面进入植物体的维管束中萌发,导致一系列植物腐烂病害[31]。本研究的回接实验证实了大豆茎点霉C1和腐皮镰刀菌C4能导致沃柑的健康叶片染病。
在此基础上,利用广西红树林特境来源的24株放线菌对4株病原真菌(代号C1~C4)进行拮抗活性筛选,其中链霉菌M2020对真菌C1~C4均表现出拮抗活性,其活性物质分布在发酵原液和酯相中。经16S rRNA基因序列比对分析,菌株M2020与链霉菌Streptomyces angustmyceticusNRRLB-2347T系统发育最为密切,相似率为100%。文献调研表明,Streptomyces angustmyceticus对植物病原真菌具有高效广谱抑制活性,如对大白菜叶斑病病原菌Colletotrichumsp.和Curvularia lunata的抑菌率达75.6%和69.5%[32],对植物病原真菌尖孢镰刀菌黄瓜专化型(Fusarium oxysporumf.sp.cucumerinum,Foc)、禾谷镰刀菌(Fusarium graminearum)和灰葡萄孢(Botrytis cinerea)均有很好的抑制作用[33]。为预测菌株M2020潜在合成产物,对其全基因组进行次级代谢产物生物合成基因簇比对分析。菌株M2020的基因组中预测出38个BGC,其中与已有基因簇相似度较高(30%~100%)的BGC有12个,对应合成具有抑菌活性的已知化合物有4类,即大环内酯caniferolide A/B/C/D、硫肽类抗生素环噻唑霉素cyclothiazomycin、创新霉素chuangxinmycin和聚酮类piericidin A1,菌株M2020可能会产生这些具有抑菌活性的化合物或其类似物。此外,有15个BGC与已有基因簇相似值低于30%,11个BGC未匹配到同源基因簇,这些未知BGC的存在暗示菌株M2020有产生新抗生素的潜力。值得一提的是,S.angustmyceticusNRRLB-2347T生产的一种核苷类抗生素狭霉素(angustmycins),具有很好的植物生长调节活性和一定抑菌活性[34]。总之,链霉菌M2020具有显著且广谱的抑制真菌活性效果,在沃柑真菌病害防治上得到了一定的验证。然而,该菌株的抑菌活性是由何种次级代谢产物决定,是否产生狭霉素,其对田间沃柑真菌病害的药效如何,是否对柑橘其他真菌病害有防治潜力等问题,均是亟须进一步研究的内容。

