BI-RADS超声分类联合超声剪切波弹性成像对乳腺癌的诊断价值
杨 娟
(西平县妇幼保健院超声科,河南省西平县 463900)
乳腺癌是女性发病率最高的恶性肿瘤,主要与乳腺良性疾病、乳腺腺体致密、激素水平、长期接触射线等有关,以乳腺肿块为主要表现[1]。乳腺肿块有良恶性之分,早期明确乳腺肿块性质,对治疗方案的选择及患者预后具有重要意义。相关研究提出,早期乳腺癌及时诊治后5年生存率可达95%,而晚期乳腺癌患者5年生存率低于30%,早期诊断对乳腺癌患者的预后十分重要[2]。乳腺超声、钼靶X线片、MRI都是临床诊断乳腺癌的常用方法,MRI费用昂贵,钼靶X线片易受腺体致密度影响。而我国女性乳腺腺体以致密型乳腺居多,体积较小,高频超声可清楚观察乳腺边界、形状、回声、钙化情况,是临床进行乳腺癌筛查的首选方法[3]。乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)超声分类可对乳腺肿块进行风险评估,对肿块的良性、恶性性质进行鉴别诊断。本文以病理结果为金标准,探讨超声剪切波弹性成像(shear wave elastography,SWE)联合BI-RADS超声分类对乳腺癌的诊断价值。现将结果报告如下。
1 资料与方法
1.1 一般资料 研究对象为本院2019年5月至2020年12月收治的68例乳腺肿块患者。患者年龄22~71(43.8±4.9)岁;已婚45例,未婚23例;文化程度:高中及以下17例,大专33例,本科及以上18例;肿块直径0.9~5.9(2.7±0.6)cm。纳入标准:(1)所有患者均为单发肿块;(2)术前均接受SWE联合BI-RADS超声分类检查;(3)临床资料完整;(4)对本次研究均知情同意,主动配合研究。排除标准:(1)合并有其他肿瘤;(2)血液系统疾病;(3)精神疾病;(4)中途退出研究者。
1.2 方法
1.2.1 常规二维超声检查和SWE检查 采用美国GE-E8超声诊断仪进行超声检查,包含SWE软件,L15-4线阵探头,探头频率:5~11 MHz。引导患者取仰卧位,双手上举显露腋窝和乳房。先行常规二维超声检查,以乳头为中心,沿顺时针方向进行放射状扫描,观察病灶的超声表现(肿块边缘、形态、毛刺、后方回声、钙化等),采用彩色多普勒超声检测血流情况。然后切换至SWE双幅成像模式,调整取样框角度,嘱患者深吸气并屏气,探头垂直于病灶进行扫描,图像稳定后冻结,采用杨氏模量标尺测量相关数据,连续测量4次,取平均值,记录肿块弹性模量值的最大值(Emax)、最小值(Emin)、平均弹性值(Emean)及其标准差(Esd)。由两名临床经验超过5年的影像科医生对二维超声图像、SWE图像进行分析,商量后得出统一结论。常规超声检查提示恶性标准:病灶边界模糊、形态不规整、纵横比≥1,内部有不均匀回声,伴有微钙化现象,血流信号≥2级[4]。SWE检查诊断恶性肿块的标准:Emax<70 kPa为良性、Emax≥70 kPa为恶性,Emean<40.5 kPa为良性、Emean≥40.5 kPa为恶性,Esd<16.5 kPa为良性、Esd≥16.5 kPa为恶性,Emin≤7.6 kPa为良性、Emin>7.6 kPa为恶性;满足其中3项及以上即可确诊为恶性。
1.2.2 BI-RADS超声分类 分类前先搜集患者的病史、饮食习惯、哺乳史、婚育史、生活习惯等个人信息,便于进行综合诊断。 按照2013版BI-RADS 分类标准对病灶进行分类[4]:1类为阴性;2类为良性,乳腺癌预期风险为0;3类为良性可能性大,乳腺癌预期风险≤2%;4类为恶性不除外(4a类乳腺癌预期风险为3%~10%,4b类乳腺癌预期风险为11%~49%,4c类乳腺癌预期风险为50%~95%);5类为恶性可能性大,乳腺癌预期风险>95%;6类为恶性,乳腺癌预期风险为100%。联合诊断恶性肿块标准:BI-RADS超声分类联合SWE检查诊断乳腺癌良恶性时,两者有一项提示为恶性即诊断为恶性。
1.2.3 病理检查方法 采用粗针进行组织学穿刺,采集病变组织。将采集的病变组织制成切片,在显微镜下观察以明确其性质,将病理分级为5级者诊断为恶性。
1.3 观察指标 根据病理结果将乳腺肿块分为恶性肿块和良性肿块,比较良恶性肿块的弹性模量值(Esd、Emax、Emin和Emean)。并以病理诊断为金标准,分析两种方法单独及联合诊断乳腺癌的效能,并确定Emax的临界值。
1.4 统计学方法 采用SPSS 21.0统计学软件分析数据。计量资料以均数±标准差(x±s)表示,组间比较采用t检验;计数资料以例数(n)或百分率(%)表示,组间比较行χ2检验。以受试者工作特征(receiver operating characteristic, ROC)曲线评价SWE、BI-RADS超声分类单独及联合诊断乳腺癌的效能。以P<0.05为差异有统计学意义。
2 结 果
2.1 良恶性乳腺肿块超声SWE参数比较 所有患者的乳腺肿块经病理检查确诊为良性44例,恶性24例。恶性肿块的Emax、Emean、Esd值均高于良性肿块,Emin值显著低于良性肿块,差异均具有统计学意义(均P<0.05)。见表1。
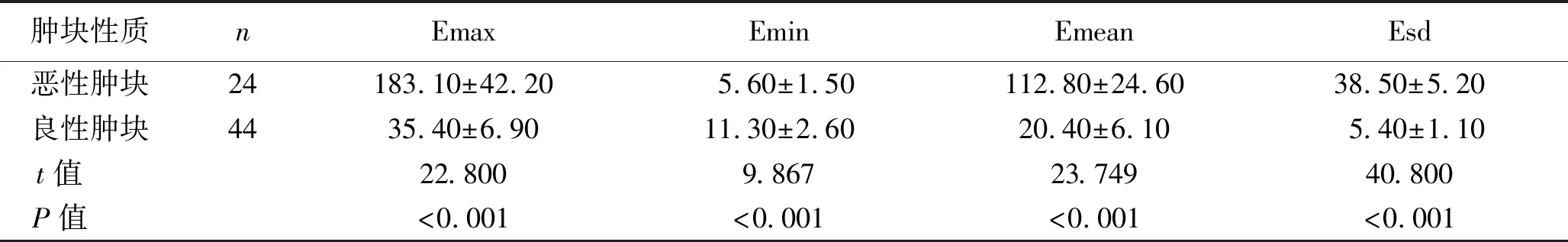
表1 良恶性乳腺肿块超声SWE参数比较 (x±s,kPa)
2.2 BI-RADS超声分类及SWE检查诊断结果 BI-RADS超声检查诊断为恶性肿块16个(4b类 2个,4c类9个,5类5个),良性肿块52个(2类13个,3类28个,4a类11个),见表2。SEW检查诊断为恶性肿块10个,良性肿块58个。

表2 BI-RADS超声分类诊断结果
2.3 SWE、BI-RADS超声分类单独及二者联合诊断乳腺良恶性结节的效能 ROC曲线分析结果显示,SWE的最佳临界值为 Emax=70 kPa。SWE、BI-RADS超声分类单独及联合诊断的曲线下面积(area under curve, AUC)分别为0.708(95%CI: 0.566~0.851,P=0.005)、0.737(95%CI: 0.601~0.873,P=0.001)、0.862(95%CI: 0.756~0.968,P<0.001),联合诊断的AUC最大。见表3。

表3 SWE、BI-RADS分类与二者联合诊断乳腺良恶性结节的效能
3 讨 论
近年来,随着环境的恶化、生活节奏的加快,女性乳腺癌发病人数持续增多[5]。乳腺癌发病率占女性恶性肿瘤首位,且每年以3%的速度持续上升,发病年龄也呈年轻化趋势,严重威胁女性身心健康。超声检查是目前临床筛查致密型乳腺癌的常用手段,具有简单快捷、对机体无辐射、诊断准确率高的特点[6-7]。BI-RADS分类是美国放射学会推荐用于判断乳腺病灶形态的分类标准,对乳腺癌的诊断准确率高,但是特异度低,4a类病变中常有良性病变,增加了不必要的活检穿刺。SWE是一种超声定量检测方法,其利用超高速成像获取剪切波图像、测量弹性模量值,通过组织硬度、弹性模量值、颜色判定肿块性质[8]。SWE克服了静态弹性成像的频率、探头压力大小等因素的影响,检查时间短、可重复操作,较常规超声有明显优势。BI-RADS分类联合SWE检查可准确判定乳腺肿块的性质,提高对乳腺癌的诊断准确率。
常规超声检查中,恶性肿块边缘有毛刺、分叶、成角,形态不规则,有微钙化病灶,纵横比大于1,后方回声减弱,周围结构有明显改变。BI-ARDS超声分类通过多切面扫描观察乳腺肿块内部血供、肿块边界、形态、周围组织回声等情况,综合评估肿块性质。多次扫描能优化图像质量,降低乳腺癌的漏诊率和误诊率。BI-RADS分类中5类患者的恶性度超过95%,而 4类患者恶性肿块的可能性为3%~95%,低于4类患者多为良性,但是4类患者假阳性率高,导致诊断特异度低,不利于疾病的定性[9-10]。SWE技术利用探头产生的声辐射脉冲在肿块内产生声切波,通过测量剪切波速度评估组织弹性模量[14]。恶性组织和细胞外基质的硬度均较高,有不均匀分布的胶原蛋白交联现象,颜色主要为绿色,颜色杂乱。硬度区域主要位于病灶周围,即“硬环征”,独立的“硬环征”是乳腺恶性肿块的典型特征[11-12]。良性肿块质地较软,胶原纤维分布范围小,成分均匀分布;颜色主要为蓝色,均匀分布[13-14]。本研究结果显示,与良性肿块相比,恶性肿块的Emax、Esd、Emean值高,Emin值低,说明恶性肿块的Emax值显著高于良性组织,结合Emax值可以预测较软的乳腺病灶多为良性,较硬病灶多为恶性。但是SWE的检查结果受操作者主观判断、操作手法的影响较大,容易出现误诊、漏诊。在检查时操作者应熟知SWE成像原理,正确进行操作,尽量避免主观因素产生的不良影响。同时应结合常规超声检查结果进行综合判断,对不具备典型特征的病例应进行穿刺活检,以提高诊断准确率。BI-RADS分类的作用是使乳腺影像报告标准化,医师能通过分类快速了解病情。BI-RADS分类结果同样受超声医生的主观因素影响,不同医生的经验、对肿块的定义分类标准掌握程度有差异,导致结果存在误差。在诊断时应结合患者病史、既往超声检查结果、触诊等进行综合判断,以减少漏诊。本研究中ROC曲线分析结果显示,SWE联合乳腺BI-RADS超声分类诊断乳腺癌的AUC最大,联合诊断为乳腺癌肿块性质的判定提供了定量、可重复信息,提高了诊断的准确性。恶性组织内部有液化坏死区,导致组织硬度存在差异,明显“硬环征”为肿块恶性定性提供了有力的影像学证据。联合诊断使二者优势互补,大大提高了诊断准确率,有利于指导临床下一步治疗。
综上所述,采用SWE联合乳腺BI-RADS超声分类诊断乳腺肿块性质的准确率较高,可减少良性肿块的活检次数,避免了不必要的创伤,值得推广应用。

