湖南省部分地区猪伪狂犬病病毒的分离及主要毒力基因序列扩增与分析
林 源,杨 青,何世成,谭 磊,方 铃,唐小明,王卫国,彭 志,胡巧云,张 坤,鲁杏华,刘道新,王昌建
(1.湖南省动物疫病预防控制中心,湖南 长沙 410014;2.湖南农业大学动物医学院,湖南 长沙 410128)
猪伪狂犬病(Pseudorabies, PR)是由猪伪狂犬病病毒(Pseudorabies virus, PRV)感染宿主所引发的一种高度接触性传染病,不同发育阶段猪群对该病均易感,其中仔猪和保育猪感染该病后可出现发热、神经症状、呕吐和腹泻等临床症状,且死亡率高;肥育猪感染后出现呼吸症状,但死亡率较低;公猪可出现睾丸炎,影响其繁殖性能;繁殖母猪可出现明显的临床症状,如流产、死胎等[1-2]。目前,PR是危害我国养猪业的主要传染病之一,该病的发生与流行给我国养猪业造成巨大的经济损失[3]。
PRV属于疱疹病毒科,该病原可感染多种动物,其中包括猪、犬、牛、羊等多种家畜,也有虎、狼等野生动物[4]。此外,最近研究表明,人对PRV也易感,且人感染该病后可出现脑炎、视力减退等临床症状,甚至死亡[4-5]。因此,PRV是一种严重威胁养猪从业人员甚至是消费者健康的传染性病原[4-5]。PRV为大型DNA病毒,其基因组大小约143 kb,可编码至少72种蛋白,这些蛋白参与病毒衣壳、包膜及间质的形成,其中gE、gB、gC、gH、gG和TK等是决定PRV免疫或毒力的重要基因,研究这些基因变异情况可初步分析毒株的遗传进化情况。
本研究于2017—2018年从湖南省部分地区共分离到5株PRV野毒,通过对以上病毒TCID50(半数组织培养感染剂量)进行测定及对其毒力或免疫相关基因序列扩增、测序与分析,旨在初步分析近湖南省部分地区PRV病原特性及基因遗传变异情况,为相应的防控措施制定提供科学依据。
1 材料与方法
1.1 病料来源
2017—2018年从湖南长沙、株洲、岳阳和怀化等4个地区的8个猪场采集疑似感染PR的仔猪组织样品8份,每份样品包括1头猪的淋巴结、脾、肺、脑等组织。以上猪场新生仔猪均出现疑似PR临床症状,主要包括角弓反张、呕吐、腹泻及昏睡等,部分病例剖检可发现病猪脑膜充血或出血明显,肾脏表面有明显的出血点,且淋巴结肿大等,采集以上组织病料用于病原检测及病毒分离。
1.2 主要试剂
DMEM培养基、FBS血清、0.25%含EDTA胰酶购自于Gibco公司;猪肾上皮细胞(PK15)由湖南省动物疫病预防控制中心保存;病毒基因组(DNA/RNA)提取试剂盒购自于北京天根科技有限公司;2×PCR预混液、DL 2 000 DNA Marker和反转录试剂盒等购自于TaKaRa公司;猪伪狂犬病病毒(PRV)/猪瘟病毒(CSFV)/猪蓝耳病病毒(PRRSV)/猪圆环病毒2型(PCV2)四通道荧光定量PCR检测试剂盒、猪细小病毒(PPV)荧光定量PCR检测试剂盒均购自中山大学达安基因股份有限公司。
1.3 病料处理及基因组提取
每份样品分别取各组织混合剪碎后加入适量灭菌PBS溶液,研磨后反复冻融3次,离心取上清液置于1.5 mL离心管中。根据病毒基因组(DNA/RNA)提取试剂盒说明书对组织上清基因组进行提取,将提取后的核酸保存于-70 ℃。
1.4 常见猪病的检测
用商品化荧光定量PCR检测试剂盒对步骤1.3提取的核酸进行PRV、PCV2、PPV、PRRSV及CSFV检测,检测方法参照试剂盒说明书。
1.5 病毒的分离与鉴定
将步骤1.4检测结果为PRV阳性的样品组织上清液与适量DMEM培养基混合,0.22 μm滤膜过滤后将滤液接种于单层PK15细胞,并设置阴性对照。37 ℃孵育2 h后弃去上清液,PBS清洗后加入含2% FBS的DMEM培养基,置于细胞培养箱孵育3 d,每日观察细胞病变情况,若出现细胞病变(CPE),则连续传代3代,取第3代细胞上清液提取核酸,利用商品化荧光PCR检测试剂盒对提取的核酸进行PRV鉴定。
1.6 病毒空斑纯化
将步骤1.5鉴定为PRV阳性的病毒液进行梯度稀释(10-1~10-6),500 μL/孔加入长满单层PK15细胞的6孔板中37 ℃孵育1 h,以PBS溶液洗涤2次,每孔加入2 mL培养液(含5% FBS的2×DMEM与2%低熔点琼脂糖1∶1混匀),待培养液凝固后倒置放入培养箱中培养。出现空斑后,挑取产生单个空斑的病毒加入500 μL DMEM中吹打混匀,反复冻融3次后进行下一轮纯化,进行5轮纯化后收获病毒液,保存于-70 ℃。
1.7 病毒滴度测定
用DMEM将病毒液梯度稀释(10-1~10-9),100 μL/孔加入长满单层PK15细胞的96孔板中,每个稀释度接种1列,设3列只加DMEM作阴性对照,37 ℃孵育2 h后用PBS溶液洗涤2次,其后每孔加入100 μL含2% FBS的细胞维持液,置于37 ℃、5% CO2培养箱中培养,每天观察细胞病变并计数,根据Reed-Muench法计算病毒的TCID50。
1.8 PRV免疫与毒力相关基因序列扩增、测序及分析
参考文献[6]分别合成用于扩增PRV免疫与毒力相关基因(gB、gG、gH、gI、gL、gM、gE、TK和PK)的引物(表1),引物均由上海英俊生物技术有限公司合成。将纯化后的病毒液提取核酸,分别进行免疫与毒力相关基因的PCR扩增,PCR反应体系(50 μL)为2×PCR预混液25.0 μL、上下游引物各1.0 μL、DNA模板3.0 μL及双蒸水20.0 μL;反应条件为98 ℃ 1 min;98 ℃ 10 s,56~60 ℃ 30 s,72 ℃ 90 s,共35个循环;72 ℃ 7 min。取5.0 μL PCR产物于1.0%凝胶电泳进行电泳检测,剩余的PCR产物送至擎科(长沙)生物科技有限公司对各基因序列进行双向测序。利用DNAstar软件将测序结果进行拼接,从GenBank下载国内外具有代表性的PRV毒株各免疫与毒力相关基因,利用DNAstar软件进行核苷酸与氨基酸序列同源性比对。将常用于构建遗传进化树的gE、gB和TK基因序列依次串联,利用MEGA 7.0软件进行遗传进化分析。

表1 本研究PCR扩增所用引物相关信息
2 结果
2.1 病料的检测
将8份组织样品处理后提取基因组核酸,用荧光定量PCR法分别检测PRV、PCV2、PPV、PRRSV及CSFV核酸。结果表明,8份组织样品中5份为PRV阳性,且CSFV、PRRSV、PPV和PCV2均为阴性(图1)。
2.2 PRV分离鉴定与TCID50测定
将5份PRV阳性组织样品上清分别接种于单层PK15细胞,36 h后均出现细胞聚集、变圆成空泡、脱落等明显细胞病变,对照组细胞无病变现象(图1)。分别取第3代细胞上清提取核酸,用荧光PCR方法进行PRV检测,结果显示,5份样品均为PRV阳性,证明分离出5株PRV野毒,并根据地区来源将5株病毒分别命名为HuN-HH株、HuN-YY株、HuN-NX株、HuN-ZZ株和HuN-LY株。

图1 感染PRV后PK15细胞病变情况
对各P R V野毒进行噬斑纯化(图2),将第5代纯化病毒扩增后进行滴度测定,滴度分别为10-6.37TCID50/100 μL(H u N-H H株)、10-7.12TCID50/100 μL(H u N-Y Y株)、10-7.44TCID50/100 μL(HuN-NX株)、10-7.62TCID50/100 μL(HuN-ZZ株)和10-7.94TCID50/100 μL(HuN-LY株)。

图2 分离病毒的空斑形成
2.3 PRV毒株免疫与毒力相关基因序列扩增结果
以5株PRV DNA基因组为模板,利用PCR扩增以上病毒的免疫(gB、gG、gH、gI、gL和gM)和毒力(gE、TK和PK)相关基因序列,部分PCR产物凝胶电泳检测结果如图3所示,各基因序列对应PCR产物与预期大小基本一致,说明以上基因序列均成功扩增。
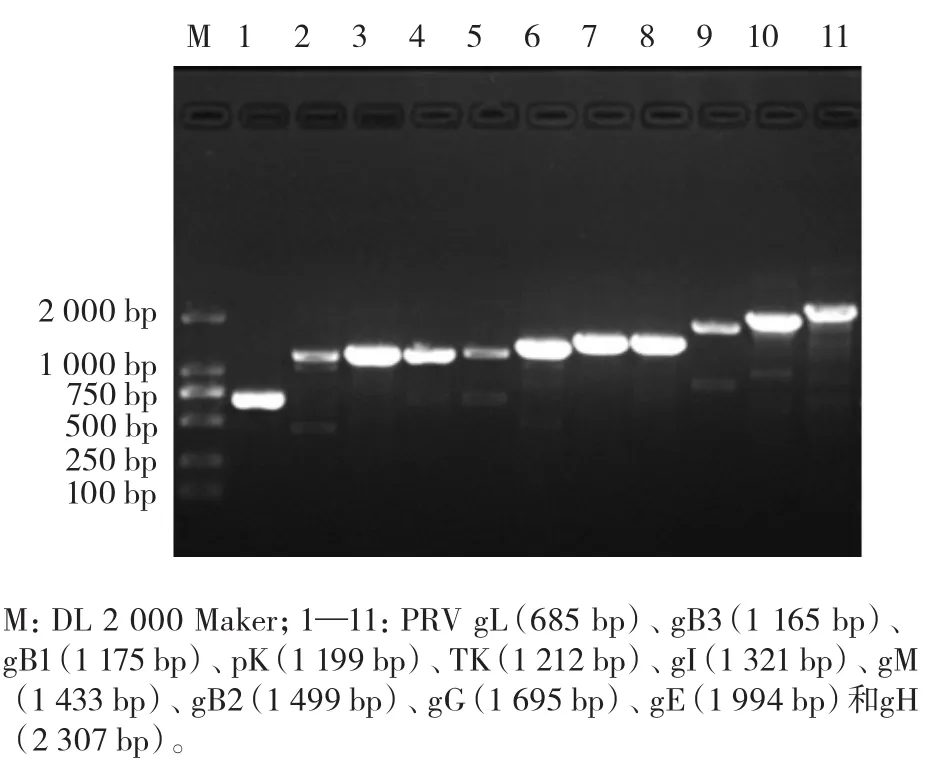
图3 PRV免疫与毒力相关基因PCR扩增产物凝胶电泳结果
2.4 PRV免疫与毒力相关基因序列比对及同源性分析结果
将以上PCR产物送至擎科(长沙)生物科技有限公司进行双向测序,其后将返回的序列进行拼接,并与GenBank收录的国内部分PRV变异株(HeN1、BJ-YT、JS-2012和TJ株)、传统株(Ea和Fa株)和疫苗株(Kaplan、Becker和Bartha株)对应核苷酸序列进行多重序列比对同源性。其中不同基因核苷酸序列比对结果表明:与国内流行变异株相比,本研究获得的部分毒株gE和gG核苷酸序列有连续碱基缺失或插入,其中HN-YY、HN-LY和HN-NX株的gE基因序列在第1 472~1 474位出现3个连续碱基缺失(ACG),导致其氨基酸序列第491位有天冬氨酸(D)缺失;HN-YY株的gG基因序列在第876~990位有一段连续碱基插入,导致其对应氨基酸序列第329~366位插入一段氨基酸序列(SPAAPVEGAGDGEEGHGDEEDEELTSSDL DNIEIEVVG)。此外,不同基因核苷酸序列均有出现碱基突变情况,部分导致对应的氨基酸出现变异。
序列同源性分析结果如表2所示,本研究获得的5株PRV野毒免疫及毒力相关基因序列相对较为保守,其中gB、gH、gI、gL、gM、gG、gE、TK和PK核苷酸(对应氨基酸)序列同源性分别为100.0%(100.0%)、9 9.9%~1 0 0.0%(9 9.7%~1 0 0.0%)、9 9.8%~1 0 0.0%(9 9.7%~1 0 0.0%)、1 0 0.0%(1 0 0.0%)、9 9.9%~1 0 0.0%(9 9.6%~1 0 0.0%)、9 9.8%~1 0 0.0%(9 9.1%~1 0 0.0%)、9 9.9%~1 0 0.0%(99.7%~100.0%)和100.0%(100.0%);5株P R V与国内流行的P R V变异株对应序列同源性分别为1 0 0.0%(1 0 0.0%)、9 9.8%~1 0 0.0%(9 9.7%~1 0 0.0%)、9 9.4%~1 0 0.0%(9 9.7%~1 0 0.0%)、1 0 0.0%(1 0 0.0%)、9 9.9%~1 0 0.0%(9 9.8%~1 0 0.0%)、9 9.9%~1 0 0.0%(9 9.8%~1 0 0.0%)、9 9.9%~1 0 0.0%(9 9.7%~1 0 0.0%)、9 9.7%~1 0 0.0%(9 9.6%~1 0 0.0%)和9 9.8%~1 0 0.0%(99.6%~100.0%)。由表2可知,本研究获得的所有毒株与国内流行变异毒株(如JS-2012株和HeN1株)对应基因核苷酸和氨基酸序列同源性均高于国内流行的传统毒株(如Ea株和Fa株)国外流行毒株(如Bartha株和Kaplan株)。
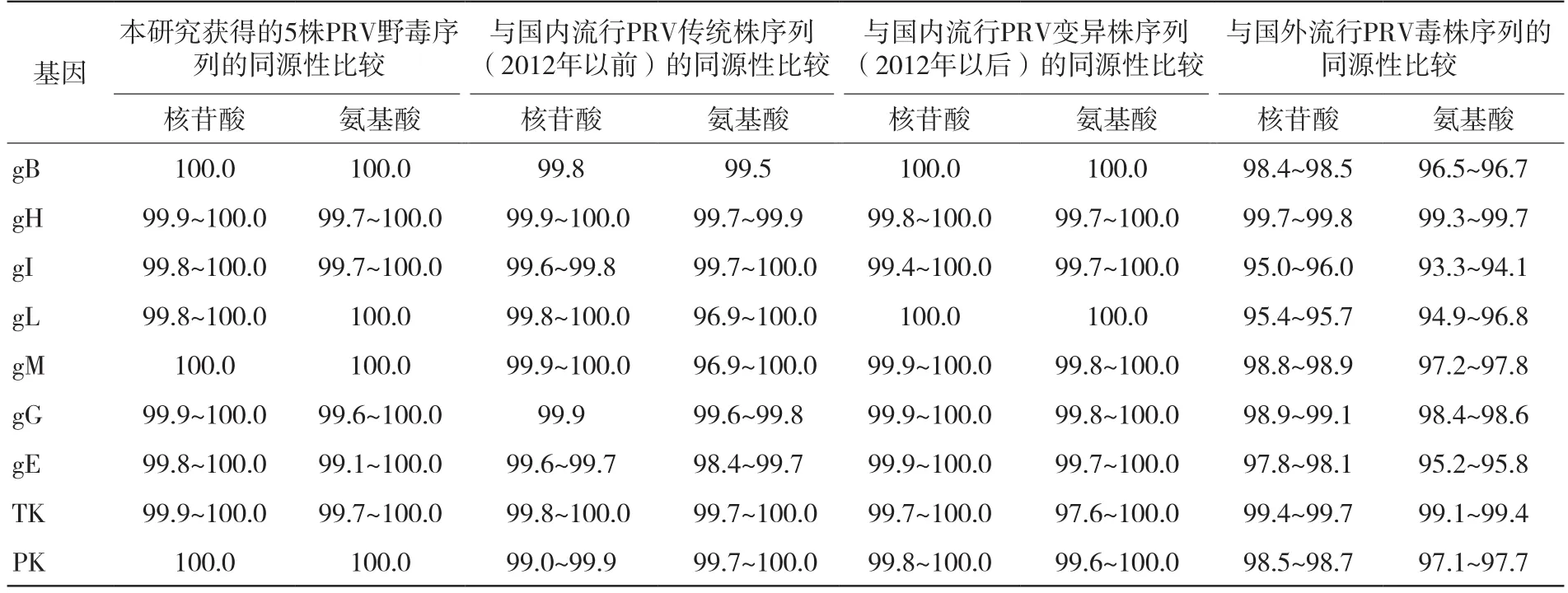
表2 本研究获得的PRV毒株与国内外代表性毒株对应序列同源性比较结果 %
2.5 PRV毒株免疫与毒力相关基因序列遗传进化分析
为分析本文获得PRV毒株的遗传进化关系,基于PRV分离株gE核苷酸序列推导氨基酸序列,应用MEGA7.0软件构建系统进化树。结果如图4所示,国内外所有PRV毒株在系统进化树上可聚为2个分支(genotype Ⅰ和genotype Ⅱ),其中国外流行毒株则属于genotype Ⅰ分支,而国内流行的毒株属于genotype Ⅱ分支。此外,国内2012年以前流行毒株和2012年以后流行毒株可分为2个小分支,分别命名为传统株和变异株。本研究获得的5株PRV野毒与国内2012年后流行的PRV变异株聚为同一分支,与2012年以前的PRV流行株(如Ea和Fa)相隔较近,但与国外流行毒株(如Becker和Kaplan)所属分支亲缘关系较远,上述结果表明,本研究分离得到的毒株均为PRV变异株。
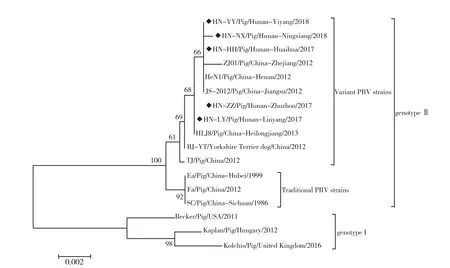
图4 基于PRV gE氨基酸序列构建系统进化树(菱形代表本研究分离PRV毒株)
3 讨论
猪伪狂犬病是严重影响我国养猪业健康发展的重要疫病之一,该病是由PRV感染所引起。根据PRV的基因组特点,我国流行的PRV毒株可分为2种基因型,分别为PRV传统株和变异株[7]。以2012年为分界线,2012年以前流行的PRV毒株均属于传统株,而2012年以后流行的PRV毒株则主要为变异株,且大量研究表明PRV变异株对宿主(小鼠模型)的致病力远高于传统株[8]。尽管目前我国政府及相关养猪企业出台并实施了一系列针对猪伪狂犬病的防控措施,但该病仍然在我国流行趋势严重。
PRV属于疱疹病毒科成员,其基因组较大(约143 kb),可编码至少72种蛋白,其中部分编码蛋白与病毒毒力或免疫相关,如gB蛋白是PRV感染宿主细胞必须的,该蛋白可诱导机体产生中和抗体;gG蛋白是病毒在增殖过程中大量释放的一种谈蛋白,可以使机体不易识别入侵的病毒;gL蛋白参与病毒的体外感染和复制等[6];而gE、TK和PK等基因主要与病毒的毒力或致病性等相关[6]。由于PRV基因组庞大,这导致扩增其全基因组序列去分析基因变异情况相对困难,所以研究人员一般通过分析这些与免疫及毒力相关基因序列信息来初步确定毒株基因组变异情况[1,6,8]。
近年来,湖南省生猪养殖业发展较为迅速,但部分猪场仍然存在PRV野毒流行情况[9-10]。为初步分析近年来湖南省部分地区猪场流行的PRV野毒基因变异情况,本研究于2017—2018年从湖南怀化、益阳和宁乡等地区5个疑似发生PRV感染的猪场采集病料样品,通过前期病原检测确定以上猪场发病均由PRV感染引起。其后我们对病料处理后进行病毒分离,最终成功分离出5株PRV野毒,进一步TCID50测定以上5株病毒滴度分别为10-6.37、10-7.12、10-7.44、10-7.62和10-7.94TCID50/100 μL,这与国内流行的PRV变异株滴度基本一致[8]。其后我们对本研究分离的5株PRV野毒的gB、gG、gH、gI、gL、gM、gE、TK和PK基因序列进行扩增与分析,这9个基因与PRV的毒力或免疫相关,通过分析这些基因序列变异情况可初步确定PRV的变异情况[6]。结果发现本研究分离的毒株大部分基因序列与国内流行的PRV变异株相应序列同源性很高,这表明这些基因序列十分保守,仅仅有部分核苷酸碱基出现突变。与国内流行的PRV变异株相比,HN-YY、HN-LY和HN-NX株的gE基因序列在第1 472~1 474位出现3个连续碱基缺失(ACG),导致其氨基酸序列第491位有天冬氨酸(D)缺失,而这个现象同样在国内流行的PRV传统毒株(Ea株)和国外流行毒株(Kaplan株)存在。此外,HN-YY株的gG基因序列在第876~990位有一段连续碱基插入,而有文献表明gG基因可能参与PRV的免疫诱导等[11],但这段连续氨基酸序列的插入是否会影响该毒株诱导机体产生更强或更弱的免疫应答还需要进一步试验探索。
将本研究获得毒株与GenBank收录的国内外具有代表性PRV毒株进行系统进化树构建,结果发现本研究获得的5个毒株均与国内2012年后流行的PRV变异株聚为同一分支,与国内流行的PRV传统株和国外流行毒株(疫苗株)相距较远,这提示湖南省部分地区流行的PRV毒株仍为变异株。虽然目前大部分猪场通过加强免疫接种疫苗(如Bartha或HB-98疫苗)可有效防控PRV野毒感染,但目前我国PRV流行情况仍然不容客观,这可能主要与许多散养户未免疫接种PRV相关疫苗或养殖水平较低等有关[6],但这也提示我们需要研发以PRV变异株为亲本的新型疫苗,这样可能对猪伪狂犬病的防控更为有效。

