红果参果化学成分及其α-葡萄糖苷酶抑制活性研究
黄春跃,马梦洁,牛莉鑫,靳建杰,吴 蔓,田 蓓,胡 晓,
(1.中国医药工业研究总院,上海 201203;2.上海医药工业研究院有限公司,创新药物与制药工艺国家重点实验室,上海 201203;3.贵州创兴农业发展有限责任公司,贵州铜仁 554300)
糖尿病(diabetes mellitus,DM)是以多种病因引起的以慢性高血糖为特征的代谢紊乱性疾病,分为1 和2 型糖尿病。其中2 型糖尿病(type two diabetes mellitus,T2DM)是糖尿病的主要类型,占糖尿病发病率的90%~95%[1]。受不健康的饮食结构和生活方式等因素的影响,全球糖尿病的发病率不断攀升,预计2030 年达到5.78 亿例,2050 年达到7 亿例[2],已经成为继心血管疾病和癌症之后,威胁人们生命的第三大杀手[3]。
α-葡萄糖苷酶抑制剂能抑制人类小肠粘膜刷状缘上的α-葡萄糖苷酶对碳水化合物的转化,从而降低餐后血糖,是治疗2 型糖尿病的重要靶点之一[4]。目前临床上用于治疗2 型糖尿病的α-葡萄糖苷酶抑制剂主要包括阿卡波糖、伏格列波糖、米格列醇三种[5],但是这些药物也会引起患者诸如腹泻、腹痛、肠胃胀气等不良反应[6]。天然来源的α-葡萄糖苷酶抑制剂一直是近年来研究的热点,国内外学者已经从天然植物中提取到多种能够抑制α-葡萄糖苷酶活性的化合物,如多酚[7-9]、多糖[10-12]、黄酮[13-15]、生物碱和萜类[16]等。同时研究人员发现黑醋栗、蓝莓、蓝果忍冬、桑椹等小型浆果对α-葡萄糖苷酶抑制活性显著[17-18],是天然的α-葡萄糖苷酶抑制的良好来源。
红果参为桔梗科金钱豹属植物长叶轮钟草Campnumoea lancifolia(Roxb.)Merr.的根,其性平、味甘、微苦,具补虚益气、祛痰止痛功效,主要用于劳倦气虚乏力,跌打损伤和肠绞痛[19]。长叶轮钟草的果实即红果参果为小型浆果,普遍作为水果使用,具有滋补,保健等功效[20]。少量研究文献报道显示红果参果富含黄酮类、多糖类以及酚酸类等化学成分[21],具有清除羟基自由基、超氧阴离子自由基和DPPH 等自由基的作用,有较好的体外抗氧化作用[22-25]。
目前红果参从野生到规范化种植,并在我国西南地区作为经济水果规模种植,带动了当地的扶贫产业和经济发展。但对红果参果化学成分和生物活性研究相对薄弱,制约了其开发和利用,而关于红果参果的α-糖苷酶抑制活性和潜在抗糖尿病作用未见报道。本研究以人工规模栽培的红果参果为研究对象,制备两种提取物,并对其多糖、总黄酮、总花色苷、总多酚等大类成分含量进行测定。通过UPLC-QTOFMS 技术对其化学成分表征和结构鉴定,并对红果参果提取物样品以及其代表性成分的α-葡萄糖苷酶抑制活性考察。旨在对红果参果资源的开发利用提供更多的科学实验依据和数据支撑,为天然来源的α-糖苷酶抑制剂的发现提供更多选择。
1 材料与方法
1.1 材料与仪器
5 批红果参鲜果(批号1-A-7,2-A-9,3-B-11,4-A-12 和5-B-5)采摘时间2021 年3 月8 日,贵州创兴农业发展有限责任公司;矢车菊素-3-O-葡萄糖苷 批号ST04290120MG,纯度≥98.0%,上海诗丹德技术有限公司;对硝基苯-α-D-葡萄糖苷(p-nitrophenyl-α-D-glucopyran oside,pNPG)批号C12462390,纯度99%,上海麦克林生化科技有限公司;α-葡萄糖苷酶 批号SLBT8587,酶活力18.5 U/mg(G5003-100UN),美国Sigma 公司;阿卡波糖水合物 批号G1718046,纯度≥98%,阿拉丁试剂(上海)有限公司;党参炔苷、木犀草素-7-O-葡萄糖苷、芦丁、木犀草素、芹菜素 实验室自制对照品;乙腈 质谱级;其他试剂 均为分析纯。
ZG TP101 电子分析天平 松竫精密天平;PHS-3C pH 计 上海精密科学仪器有限公司;UV-2600紫外-可见分光光度仪 SHIMADZU;HWS-24 电热恒温水浴锅 上海齐欣科学仪器有限公司;BUCHI Lyovapor™ L-200 冷冻干燥机 瑞士步琦有限公司;梅特勒MS105DU 电子天平 梅特勒·托利多公司;KQ-250DE 型数控超声波清洗器 昆山市超声仪器有限公司;Waters ACQUITY UPLC I-Class 串联Xevo G2-XS QTOF 质谱仪 美国沃特世公司;Sigma 1-14k 离心机 美国Sigma 公司;EPOCH 酶标仪 美国Bio-Teck 公司;Minipore 纯化水系统 德国Merck 公司。
1.2 实验方法
1.2.1 红果参果乙醇提取物的制备 参考宛美志等[26]的方法稍作修改。称取5 批等质量的红果参鲜果(约100 g)于烧杯中,用料理机匀浆,按照料液比1:10(g/mL)加入含0.1%盐酸的65%乙醇水溶液,保鲜膜封口,水浴温度40 ℃,提取120 min,过滤,滤液转入旋转蒸发仪浓缩除去乙醇,浓缩液冷冻干燥得红果参果乙醇提取物,分别记为批号1-A-7、2-A-9、3-B-12、4-A-12 和5-B-5,密封,避光贮存在-80 ℃冰箱中,备用。
1.2.2 红果参果粗多糖的制备 参考陈莉华等[22]的方法稍作修改。称取5 批等质量的红果参鲜果(约100 g)于烧杯中,用料理机粉粹匀浆,按照料液比1:20(g/mL)加入去离子水,保鲜膜封口,热水超声(功率250 W,频率40 kHz,80 ℃)提取三次,每次45 min,提取液过滤,合并浓缩至一定体积,加入四倍量无水乙醇,过夜,离心(转速5000 r/min)15 min,冷冻干燥得红果参果粗多糖。
1.2.3 红果参果粗多糖含量测定 以硫酸-苯酚法显色[23],紫外可见分光光度法测定红果参粗多糖多糖含量。
称取干燥至恒重的葡萄糖,配制成100 μg·mL-1标准使用液。分别移取0、0.1、0.2、0.4、0.8、1.0 mL标准使用液置于10 mL 刻度管中,补充蒸馏水至1.0 mL。分别加入苯酚试剂1.0 mL,摇匀,于冷水浴中缓缓加入3.0 mL 硫酸,立刻摇匀。静置5 min 后,置于沸水浴加热15 min,取出后立即以流水冷却至室温。以相应试剂为空白,在λ=488 nm 处以紫外可见分光光度计测定吸光度,以吸光度(A)为纵坐标,葡萄糖溶液浓度(μg/mL)为横坐标绘制标准曲线y=47.6125x-0.0818(R2=0.9925)。
取1.2.2 项下的红果参果粗多糖约10 mg,精密称定,置10 mL 容量瓶中,加水至刻度线,摇匀。精密量取0.1 mL,照标准曲线的制备项下的方法,自“补充蒸馏水至1.0 mL”起,依法测定吸光度,从标准曲线上读出供试品溶液中无水葡萄糖的浓度,计算出红果参果粗多糖中多糖含量。
1.2.4 红果参果乙醇提取物黄酮含量测定 总黄酮的测定采用硝酸铝-亚硝酸钠法[27]测定。
精密称取芦丁对照品10 mg,置10 mL 量瓶中,用70%乙醇溶解后并稀释定容,摇匀,即得1 mg/mL的芦丁对照品溶液。精密量取对照品溶液0.2、0.4、0.8、1.0、1.6、2.0 mL,分别置25 mL 量瓶中,各加50%乙醇溶液补足至6 mL,再分别加入5%亚硝酸钠溶液1 mL,摇匀,放置6 min;加10%硝酸铝溶液1 mL,摇匀,放置6 min;加4%氢氧化钠溶液10 mL后再加水稀释至刻度,摇匀,放置15 min。以相应的试剂为空白对照,照紫外-可见分光光度法(通则0401),在510 nm 的波长处下测定吸光度。以吸光度(A)为纵坐标,芦丁溶液浓度C(mg/mL)为横坐标绘制标准曲线:y=12.0350x-0.0136(R2=0.9996)。
取红果参果乙醇提取物0.2 g,精密称定,置50 mL具塞锥形瓶中,精密加入50%乙醇20 mL,密塞,称定重量,超声处理(功率250 W,频率40 Hz)15 min,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过。精密量取滤液3 mL,置25 mL 容量瓶中,再加入50%乙醇溶液3 mL 照标准曲线的制备项下的方法,自“加入5%亚硝酸钠溶液1 mL”起,依法测定吸光度,从标准曲线中读出供试品溶液中芦丁浓度,再换算成提取液中总黄酮的质量,计算红果参果乙醇提取物中总黄酮含量。
1.2.5 红果参果乙醇提取物总花色苷含量测定 采用pH 示差法,参考文献[28-31]的方法。取红果参果提取物约50 mg,精密称定,置于10 mL 量瓶中,用0.1%盐酸甲醇溶液溶解并定容,作为供试品溶液。
取供试品溶液两份各1 mL,分别用pH1.0 的氯化钾缓冲溶液和pH4.5 的乙酸钠缓冲溶液稀释至10 mL,混匀后于室温条件下静置反应30 min,分别在波长520 和700 nm 处,用1 cm 比色皿测定吸光度,重复操作3 次,取平均值。按照下列公式计算总花色苷的含量:

式中:ΔA 为缓冲液稀释后的吸光度;V 为花色苷供试品溶液体积,mL;n 为稀释倍数;M 为矢车菊素-3-葡萄糖苷摩尔质量,449.2 g/mol;ξ为矢车菊-3-葡萄糖苷消光系数,26900 L/(mol·cm);m 为称取样品质量,g;b 为比色皿厚度,cm。
1.2.6 红果参果乙醇提取物总多酚含量测定 参照谭晓舒等[32]的方法并做适当修改。
标准曲线制作:精密称取没食子酸10 mg,用乙醇溶解后用蒸馏水定容至10 mL,配制成1 mg/mL标准储备液。准确移取没食子酸标准储备液0.1、0.2、0.3、0.4、0.5、0.6、0.7 和0.8 mL,用乙醇溶液稀释成质量浓度为10、20、30、40、50、60、70、80 μg/mL的溶液。吸取对照品溶液各0.5 mL 于10 mL 比色管中,先后加入2.5 mL 稀释10 倍的福林酚试剂(0.1 mol/L)、2.0 mL 7.5%的碳酸钠溶液,充分混匀,黑暗处反应1 h,用紫外可见分光光度计在765 nm波长处测定吸光度值,吸光值(A)为纵坐标,以没食子酸浓度(mg/mL)为横坐标绘制标准曲线:y=0.0055x-0.1363(R2=0.9996)。同样吸取样品溶液0.5 mL,依法测定,根据标准曲线计算供试品溶液中的总酚含量,结果表示为没食子酸(gallic acid equivalents,GAE)当量浓度即μg(GAE)/mL,进一步计算出样品中的多酚含量。
1.2.7 红果参果乙醇提取物的化学成分鉴定 通过实验室前期的质谱色谱条件优化,采用UPLC-QTOFMS 技术对红果参果乙醇提取物进行化学成分分析。
供试品溶液制备:取红果参果乙醇提取物适量,精密称定,置入25 mL 具塞锥形瓶中,精密加入含1%甲酸的甲醇溶液10 mL,密塞,称重,超声处理(功率250 W,频率40 Hz)30 min,放冷,再称定重量,用相应溶剂补足减失的重量,摇匀,滤过。
对照品溶液配制:取党参炔苷、木犀草苷、芦丁、木犀草素和芹菜素的对照品适量,用甲醇配制成混合标准备品溶液,备用。
UPLC 条件:Waters ACQUITY I-class 超高效液相色谱仪;Waters ACQUITY UPLC HSS T3 色谱柱(2.1 mm×100 mm,1.8 μm);流动相系统:0.1%甲酸水(A):乙腈(B);流速:0.30 mL/min;洗脱程序:0~1 min,98% A;1~15 min,98%~80% A;15~20 min,80%~69% A;20~28 min,69%~58% A;28~35 min,58%~20% A;35~38 min,20% A;38~41 min,20%~0 A;柱温:35 ℃;进样量:1.0 μL。
MS 条件:Waters Xevo G2-XS QTOF 质谱仪,离子源为电喷雾离子源(Electrospray ionization,ESI);正、负离子扫描模式,飞行时间质量分析器;源电压:2.5 kV(-),3.0 kv(+);碰撞气体为氮气,N2流速:800 L/h;毛细管温度400 ℃;锥孔气体流速:100 L/h;气源温度:120 ℃;采用全扫描方式,质量扫描范围50~1500 Da;碰撞诱导解离电压:6 V(低能量)、30~60 V(高能量)
1.2.8α-葡萄糖苷酶活性测定α-葡萄糖苷酶活性参考文献[33-34]方法测定略作改动。在96 孔板中加入各样品溶液10 μL 和0.2 U/mL 的α-葡萄糖苷酶溶液60 μL,于37 ℃摇床中孵育10 min,再加入2.0 mmo/L 的pNPG 溶液80 μL,继续37 ℃摇床中孵育20 min 后立即用0.2 mol/L 的Na2CO3溶液50 μL 终止反应,于405 nm 波长处测定吸光度值A,每个样品平行测定3 次。以阿卡波糖为阳性对照,按照抑制率(%)=[1-(A 样品组-A 样品空白组)/(A 阴性组-A 空白组)]×100,计算抑制率,并用SPSS18.0 软件求出相应的IC50值。样品溶液包括红果参果乙醇提取物样品溶液、红果参果粗多糖样品溶液、木犀草素、矢车菊素-3-O-芸香糖苷和党参炔苷溶液。
1.3 数据处理
所有实验均重复操作3 次,采用Excel 软件对数据进行整理绘图,采用SPSS18.0 计算IC50。
2 结果与分析
2.1 红果参果样品含量测定结果
多糖、黄酮、多酚和花色苷是植物果实的重要大类成分,因此本研究考察了红果参果提取物中各大类成分的含量。5 批粗多糖多糖的含量分别为27.59%±1.89%、33.20%±2.62%、34.62%±2.06%、37.59%±2.34%和33.47%±2.51%,含量范围在27.59%~37.59%,其中4-A-12 批次多糖含量最高,为37.59%;1-A-7 批次多糖含量较低,为27.59%,与其他4 批样品存在显著性差异(P<0.05),红果参果乙醇提取物的测定结果见表1。
表1 红果参果乙醇提取物的总黄酮、总花色苷及总多酚含量(,n=3)Table 1 Contents of total flavonoids,total anthocyanins and total phenols in ethanol extracts of HGSG (,n=3)
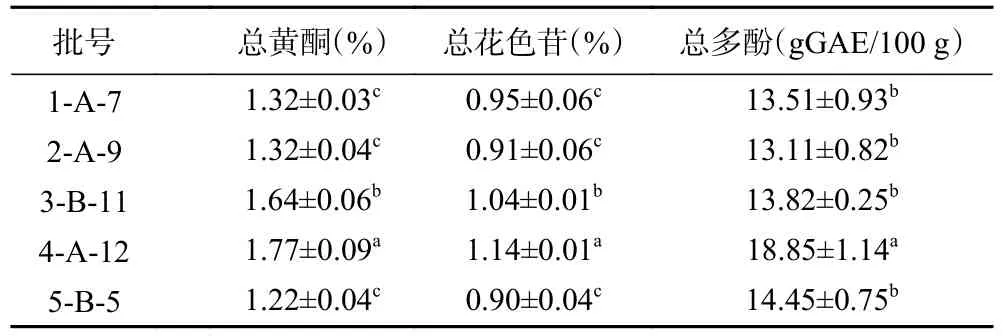
表1 红果参果乙醇提取物的总黄酮、总花色苷及总多酚含量(,n=3)Table 1 Contents of total flavonoids,total anthocyanins and total phenols in ethanol extracts of HGSG (,n=3)
注:同列不同小写字母表示差异显著(P<0.05)。
由表1 可见,不同批次红果参提取样品的总黄酮、总花色苷和总多酚含量存在一定的差异。5 批红果参果提取物的总黄酮含量为1.22%~1.77%,其中5-B-5 批次黄酮含量较低,1.22%,4-A-12 批次黄酮含量最高,为1.77%;总花色苷含量为0.90%~1.14%,5-B-5 花色苷含量最低为0.90%,4-A-12 批次花色苷含量最高,为1.14%;总多酚含量在13.11~18.85 gGAE/100 g 之间,其中2-A-9 总多酚含量最低为13.11 gGAE/100 g,4-A-12 批次总多酚含量最高,为18.85 gGAE/100 g。5 批红果参果提取物中4-A-12 批次的多糖、总黄酮、总花色苷和总多酚含量均最高,其中多酚比桑葚、蓝莓及黑加仑等浆果更高,黄酮含量相当[35];2-A-9 批次提取物与其他批次的提取物相比含量差异相对较小,因此,后续选择来源于2-A-9 的粗多糖和乙醇提取物做后续的研究。
2.2 红果参果乙醇提取物的化学成分结构鉴定分析
采用Waters ACQUITY UPLC HSS T3 色谱柱,以添加0.1%甲酸的水溶液-乙腈为洗脱流动相来增加花色苷的稳定性和分离度[36],建立UPLC-QTOFMS 分析方法。由于红果参乙醇提取物所含化学成分在正、负离子模式下有一定差异,因此本研究在正、负离子模式下,对2-A-9 红果参果乙醇提取物进行数据采集,其质谱基峰离子色谱图见图1。
采用Waters Masslynx 软件和UNIFI 数据处理系统对质谱数据进行处理,通过精确分子量、质谱碎片裂解规律、化合物极性及保留时间分析,并结合参考文献及对照品比对,在红果参果乙醇提取物中共鉴定出21 个化合物,包括10 个黄酮、3 个有机酸、3 个花色苷、3 个酚酸、1 个氨基酸和1 个聚炔,见表2。从表2 中可见红果参果实化学成分种类丰富,富含多种活性成分。矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-芸香糖苷和飞燕草素-3-O-芸香糖苷为三种花色苷成分,已被证实具有良好的降糖活性[45-46]。鉴定的非花色苷类酚性成分以黄酮和酚酸类成分为主,其中黄酮类成分最为丰富,10 个黄酮类成分中8 个为黄酮糖苷,主要是木犀草素的糖苷类成分,糖基以葡萄糖、芸香糖为主,同时还检测到木犀草素和芹菜素游离的苷元。3 个酚酸类物质为咖啡酸和绿原酸类成分。这些天然来源的黄酮类物质和酚酸类物质均具有一定的降糖作用[47-49],这为后续的深入研究提供了科学依据。此外,从红果参果中首次鉴定出具有抗炎、抗癌等药理活性的聚炔类党参炔苷成分[50]。
2.3 α-糖苷酶抑制活性
本研究采用pNPG 法,以2-A-9 红果参果乙醇提取物、2-A-9 粗多糖及其主要代表成分为代表考察红果参果的体外α-葡萄糖苷酶抑制活性。如表3 所示,红果参果乙醇提取物和粗多糖在2.00 mg/mL 下显示出较强的抑制活性,抑制率在80%以上;在1.00 mg/mL 的浓度下,木犀草素对α-葡萄糖苷酶的抑制率超过90%,显示出较强抑制活性;在1.00 mg/mL的浓度下矢车菊素-3-O-芸香糖苷的α-葡萄糖苷酶抑制活性较弱,抑制率为30%;党参炔苷对α-葡萄糖苷酶无抑制作用。
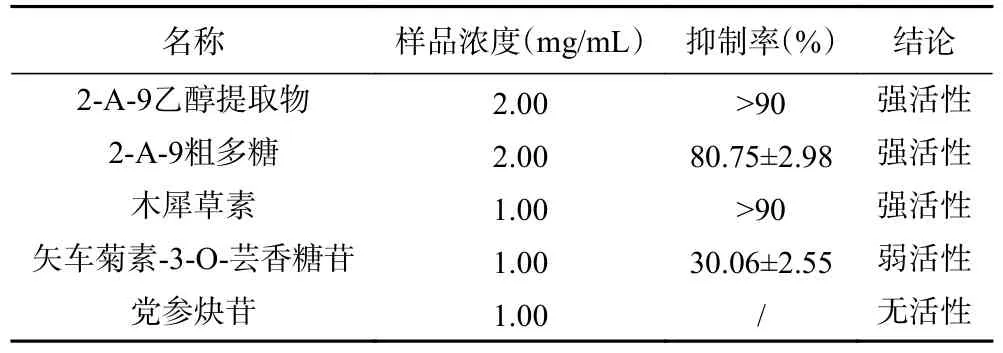
表3 样品α-糖苷酶抑制活性实验Table 3 α-Glycosidase inhibitory activity test
进一步考察红果参果乙醇提取物、红果参果粗多糖和代表黄酮成分木犀草素在不同浓度下的α-葡萄糖苷酶的活性抑制能力,见图2,阳性对照阿卡波糖的抑制能力见图3。可见各实验样品在一定的质量浓度(红果参粗多糖6.72~107.5 μg/mL、红果参乙醇提取物质量浓度2.79~89.25 μg/mL、木犀草素0.75~12.06 μg/mL)范围内对α-糖苷酶活性的抑制呈现质量浓度依赖,随着各样品质量浓度的增加对α-葡萄糖苷酶活性的抑制作用加强。采用SPSS18.0 软件对实验数据进行分析,计算出实验样品的半数抑制浓度IC50,红果参果乙醇提取物、粗多糖、木犀草素和阿卡波糖对α-葡萄糖苷酶半数抑制浓度IC50分别为7.52、37.43、8.03 和616.17 μg/mL,4 个实验样品对α-葡萄糖苷酶活性的抑制作用强度:红果参果乙醇提取物>木犀草素>粗多糖>阿卡波糖,三个样品的抑制活性均显著高于临床糖尿病常用的药物阿卡波糖(P<0.05),红果参乙醇提取物的IC50与木犀草素相当,约为阿卡波糖的82 倍,具有更强的抑制作用。蓝莓乙醇提取物α-糖苷酶抑制活性(IC50=13.0 mg/mL),阿卡波糖(IC50=3.09±0.14 mg/mL)[51];桑葚乙酸乙酯提取物(IC50=72.01±4.18 μg/mL),阿卡波糖(IC50=77.05±6.10 μg/mL)[52];蓝果忍冬多糖HEP-2(IC50=1.56 mg/mL),阿卡波糖(IC50=10.13 mg/mL)[53],与这些浆果提取物相比红果参果提取物对α-葡萄糖苷酶活性的抑制作用更有优势。

图2 木犀草素和红果参果样品的α-葡萄糖苷酶活性的抑制作用Fig.2 α-Glucosidase inhibition of luteolin and HGSG samples
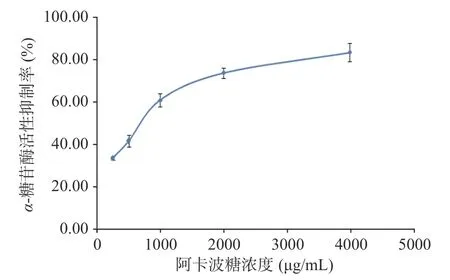
图3 阿卡波糖的α-葡萄糖苷酶活性的抑制作用Fig.3 α-Glucosidase inhibition of acarbose
3 结论
本文采用经典的紫外分光光度法测定红果参果乙醇提取物中总黄酮、总花色苷和总多酚等大类成分含量,进一步通过UPLC-QTOF-MS 技术对其化学成分进行分析和结构鉴定,结果显示红果参果乙醇提取物富含花色苷、酚酸、木犀草素及其糖苷黄酮类等多种酚类活性成分。本研究首次对红果参果乙醇提取物和粗多糖的体外α-葡萄糖苷酶抑制活性进行考察,对红果参果降糖作用的药理价值进行评估。实验结果显示红果参果乙醇提取物和粗多糖均对α-葡萄糖苷酶活性有良好的抑制作用,红果参果乙醇提取物在7.52 μg/mL 质量浓度下与木犀草素(8.03 μg/mL)抑制作用相当,具有更强的α-葡萄糖苷酶抑制作用。红果参果乙醇提取物α-葡萄糖苷酶抑制活性优于粗多糖以及木犀草素、党参炔苷和矢车菊素-3-O-葡萄糖苷等三个不同结构类别的代表化合物,可能是多成分协同作用的结果,初步推断黄酮类、酚酸类等酚类成分可能是红果参果抑制α-葡萄糖苷酶活性的重要药效物质基础。酚类物质作为小浆果代谢过程中重要的次生代谢产物,存在于浆果的茎叶、果肉以及种皮中,其含量仅次于纤维素、半纤维素和木质素,具有多种药理活性[54]。黄酮类化合物又是酚类中的重要组成部分,众多研究显示其具有良好的抗糖尿病活性作用,有望成为用于调节2 型糖尿病中的餐后高血糖更安全的替代品[55]。
本研究结果丰富了红果参果的化学成分库并首次报道其潜在的天然降糖能力。后续尚需要对红果参果的α-葡萄糖苷酶的抑制类型及抑制作用机理进行深入研究,进一步明确其药效物质成分群,为红果参果开发为降糖功能性食品提供更多的实验依据,为新型的天然α-糖苷酶抑制剂的开发提供新的来源。

