斑点追踪超声心动图评价左房功能及其在房颤中临床价值的研究进展
包丽莲 程 蕾 黄国倩 包丽雯△
(1复旦大学附属中山医院心内科 上海 200032;2复旦大学附属华山医院心内科 上海 200040)
斑点追踪超声心动图(speckle tracking echocardiography,STE)是心超领域较新的一项技术,是继组织多普勒技术(tissue doppler imaging,TDI)后,目前广泛使用的定量评价心肌机械性功能的方法[1-2],从而获得心肌的形变程度(应变)及形变速度(应变率)。比起传统基于容积计算得到的功能参数,通过形变分析获得的心脏功能参数受容量因素的影响相对较小,能够在多种生理及病理状态下提供重要的临床信息[3-4]。STE 能够克服TDI 的主要技术缺陷,如角度依赖[5]、操作繁琐、重复性差等[6],在临床及科研中更为常用。虽然磁共振技术能够实现对心肌的形变分析[7-8],但受限于高昂的费用、复杂的采图及耗时的图像分析,在临床难以广泛使用。因此,STE 是目前分析心肌形变能力最适合的工具。
STE 技术首先被应用于左室功能评价,左室整体纵向应变(global longitudinal strain,GLS)被认为比左心室射血分数(left ventricular ejection fraction,LVEF)更敏感,具有更好的预后价值[9-10],而其在左房的应用明显滞后于左室,于2004 年被首次提出,近年来才逐渐发展成熟起来[11]。本文首先探讨STE 在左房功能评价中的应用,鉴于左房的形态及功能重构与房颤的发生发展密切相关,同时阐述左房应变在房颤中的应用价值。
形变参数——应变及应变率一维物体产生的形变只有拉长或缩短,应变计算公式为:
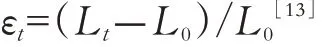
其中εt为t时刻的应变,Lt为物体在t时刻的长度,L0为初始长度,相对于初始长度的瞬时形变称为拉格朗日应变;另外,也可以t时刻前一时刻的长度作为参照衡量形变程度,参照长度并非始终恒定而是不断变化的,这样计算得到的应变称为自然应变。计算心肌应变时,由于自然应变受心肌的初始长度L0影响较小,故使用自然应变更为合适[12]。二维物体形变可发生在多个方向,除沿x 轴及y 轴的长度变化外,还可发生上下、左右的相对扭转形变(剪切应变),故二维物体存在4 个应变。心肌组织作为三维物体,形变更为复杂,包括沿x 轴、y 轴、z 轴3 个方向的长度应变及6 个剪切应变[13]。
应变通常以百分比(%)表达,若心肌增长/增厚为正值,缩短/变薄则为负值。当心肌收缩时,长度缩短、室壁增厚,故心肌的纵向应变及环向应变均为负值,而径向应变为正值。联合3 个方向上的应变能够综合评价心肌的收缩功能。
应变率(strain rate,SR)指形变的速度,即单位时间内的应变,计算方式如下:
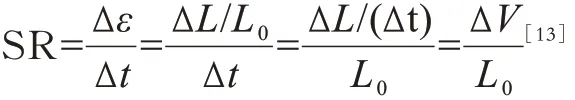
其中,ΔV为两点间心肌的速度差,应变率的方向与应变的方向一致。
室壁运动(motion)及室壁形变存在一定差异[14-15]。物体发生位置改变即为运动,但这一过程未必伴随形变(如物体各个部分移动速度相同时),而当物体不同部位移动速度存在差异时就会产生形变。通过组织多普勒技术所测得的心肌运动速度(velocity)描述的即为室壁运动,无法区分心肌的主动运动及受临近组织影响而产生的被动运动,而应变及应变率通过心肌形变分析得到,能够区分出心肌的主动运动,因此形变参数评价心肌功能更有价值[13]。虽然形变同样是容量依赖性,也无法直接测量心肌收缩力,但考虑到心肌排血的终末部分更多依靠心肌细胞主动收缩后的惯性,故比起传统的射血分数,收缩期峰值应变和应变率能更好地反映心肌收缩力[16]。
斑点追踪技术原理“斑点”意指心肌组织中的“点”,由超声声束在心肌纤维中的反射、折射、散射而随机产生,而“追踪”即对这些声学斑点在心动周期中的空间位移进行分析。斑点追踪的后处理软件通常将一组斑点视作为一个单位,这一组斑点就如同“指纹”,通过逐帧分析这些斑点的空间运动,就能够直接计算出应变(%);将斑点在两帧之间的位移除以两帧的时间差可获得组织运动的速度,在此基础上进一步求空间导数即可获得应变率(1/s)[17-20]。
二维斑点追踪的技术优势与不足TDI 是最早用于心肌形变分析的技术,通过测量从心肌返回的超声信号的频移变化来测定心肌组织的运动速度,通过测量心肌间速度的梯度可得到心肌应变率,进一步对时间积分即可获得心肌应变。然而,TDI 最大的不足在于角度依赖性,要求声束与心肌运动方向尽可能平行;此外,TDI 测量应变率及应变操作繁琐,耗时长,受噪声信号影响大,可重复性一般;TDI 只能测量单个维度的纵向应变,而无法测量环向及径向应变。这些缺陷限制了TDI 在临床及科研中的应用[13]。
二维斑点追踪超声心动图(two dimensional STE,2D-STE)问世后很快成为了心肌形变分析更优的方法,它克服了TDI 的角度依赖性,半自动化软件使操作更为便捷,重复性更好,并且能在2 个维度上进行分析。对图像质量的高要求可能是限制其应用的主要因素之一。其次,2D-STE 的帧频显著低于TDI,可能导致欠采样(under-sampling)的问题,尤其是在心动过速的患者中更为明显,心动周期中较短的时相(如等容收缩及等容舒张期)无法被准确捕捉到。提高帧频虽可以改善欠采样的问题,但会导致图像空间分辨率下降,使追踪效果不理想[21];降低帧频虽能改善图像的空间分辨率,但帧与帧之间的差距过大,可能导致软件无法在下一帧追踪到上一帧的斑点,追踪效果同样不理想[22-23]。
二维斑点追踪技术评价左房功能的操作左房功能的2D-STE 分析首先需要定义感兴趣区域(region of interest,ROI),包括左房的内膜边界及外膜边界(若在房间隔一侧则为房间隔的对边)。2018 年的欧洲专家共识建议选择心尖四腔切面进行分析,从一侧二尖瓣环水平的心房内膜开始勾勒内膜边界,跨过肺静脉及左心耳口,直到对侧二尖瓣环水平。在此基础上也可加入心尖二腔切面,通过双平面计算左房应变。2D-STE 的分析基于二维灰阶图像,故在采图时应注意通过调整深度、增益以及避免切面短缩来获得最佳图像,同时使左房在整个心动周期中尽可能清晰地呈现[24]。部分追踪软件仅对左房内膜进行追踪,而部分软件需对一定厚度的心房壁进行追踪,鉴于左房壁极薄,这两种方法实际上覆盖的区域相差不大。共识推荐将3 mm 设置为ROI 的默认宽度[23]。不同于左室,在分析左房应变时,进一步区分内膜及中膜应变意义不大。
完成ROI 的定义后,软件便可在一个心动周期内追踪心房壁的运动,继而输出形变参数的结果。研究者需对追踪质量进行评价及调整,若存在较大范围的回声失落(涉及1/3 及以上心房边界),则应放弃对应结果;此外,若存在1 个以上心房节段的追踪不满意,结果同样应酌情舍弃[25-26]。
最终2D-STE 对左房形变分析的输出结果如图1 所示,软件自动将左房分为6 个节段,分别输出每个节段对应的应变-时间曲线,同时以白色虚线反映6 个节段的平均值,即心房整体纵向应变。
研究表明,心房不同节段的收缩及舒张功能存在一定差异,后壁的应变值最小,可能是由于肺静脉的附着限制了其形变程度[27];下壁的应变值最大,可能是由于此处心房肌相对最厚;由于左房顶相对固定于纵膈中,故心房的应变值从房室连接处到左房顶逐渐减小。目前绝大部分研究所使用的参数为整体纵向应变,但由于房间隔的结构异常(如房间隔瘤及房间隔缺损)可能影响应变值,加上房间隔侧的应变还受到右房压力的影响,故部分研究只关注左房侧壁的应变[28]。考虑到左房壁极薄,并且图像质量往往不足以支持可靠的局部心房壁追踪,加之肺静脉的插入及左心耳的存在也使定义左房分段变得困难,因此目前共识暂不推荐进一步对左房分亚节段进行形变分析[25]。
同时使用心尖四腔及两腔平面进行分析,则可获得12 个亚节段[29];在此基础上进一步加入心尖三腔平面,通常仅纳入心房的下后壁而忽略对应升主动脉的节段,由此可获得15 个亚节段[30-32]。基于双平面的12 节段模型忽略了心房后壁,故所测得的应变值有一定程度的高估;由于心尖四腔平面包括了房间隔及肺静脉这两个低应变的区域,故所测得的应变值低于在心尖二腔平面测得的应变值。由此可见,选择不同的追踪平面会直接影响测得的应变值,因此2D-STE 测量左房应变时切面的选择还需要共识进一步予以规范。
斑点追踪分析输出结果与左房功能的对应关系左房的形变在整个心动周期中可分为3 个时相。从左室舒张末期、二尖瓣关闭至二尖瓣开放,为左房的储器期,这一过程包括左室等容收缩期、心室收缩及左室等容舒张期。这一时期血液不断从肺静脉流入左房中,故称为储器期。从二尖瓣开放至左房收缩前,血液被动地从心房流入心室,此期为左房的管道期,而房颤心律的患者由于左房失去收缩功能,故管道期一直持续到心室舒张期末。最后,从心房开始收缩直到心室舒张末期、二尖瓣关闭,为左房收缩期。储器、管道、收缩泵,即为左房的三大生理性功能[33-34]。
左房功能与心房应变-时间曲线的对应关系如图1 所示,可见存在两种不同起始参照点的选择方法。以心室舒张末期、二尖瓣关闭为起始参照,多数软件会以心电图QRS 波起点或R 波上升支作为参照(图1A),随后一段应变曲线对应左房储器期,左房应变值逐渐增大,并于储器期末、二尖瓣开放前达到最大值,即为储器期应变(left atrial strain reservoir,LASr)。进入管道期后,左房应变逐渐减小,并形成一个平台,对应心室舒张后期,意味着此时左房几乎不产生形变。随着心房开始收缩,应变曲线继续下降,并于心房收缩期末、二尖瓣关闭时回到基线。心房开始收缩时刻的应变值代表收缩功能,即为收缩期应变(left atrial strain contraction,LASct),LASct 与LASr 之 间 的 差 即 为 管 道 期 应 变(left atrial strain conduit,LAScd)。亦可以心房开始收缩作为起始参照(图1B),应变曲线先下降,于心房收缩期末达到最低点,随后开始上升,并在心房储器期末(二尖瓣开放前)达到最高点,随着二尖瓣开放,应变曲线又逐渐下降并回到基线,整条应变-时间曲线由一负一正两个峰组成,两个峰的顶点分别代表LASct 及LAScd,二者绝对值相加为LASr。

图1 二维斑点追踪技术评价左房的形变-时间曲线Fig 1 Left atrial strain-time curve assessed by 2D-STE
鉴于上述两种参照点处于心动周期中的不同时刻,对应的左房容积不同,而应变值与初始时刻的心肌长度(L0)有关,故两种方法测得的应变在数值上不同,但可以互相转化。以P 波作为初始参照获得的应变(atrial contraction LASxx,acLASxx)转换为以QRS 波作为初始参照测得的应变(enddiastole LASxx,edLASxx),转换公式如下:

反向转换的计算公式如下:
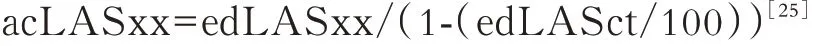
这两种初始参照点的选择方法各有利弊:以心室舒张末期为参照(QRS 波)适用于所有患者(窦性心律或房颤心律),并且LASr 的获取更直观,即从基线到最高点的距离,而目前绝大部分研究围绕LASr 及其预后价值开展;选择心房收缩作为初始参照,获得的LASct 为负值,能体现出心房肌纤维的缩短,更符合实际生理,但无法在房颤或房扑的人群中使用。2016 年的欧洲共识建议根据被检者的心律决定参照点的选择:处于窦性心律时,以心房收缩的开始作为参照;处于房颤心律时,以心室舒张末期为参照[35]。但如此操作并没有确切的理论依据,也不利于统一化操作,故2018 年的欧洲共识推荐一律以心室舒张末期为参照,若选择不同的参照点,则需要明确指出并进行数值转换[25]。
三维斑点追踪技术评价心房功能除前文所述,2D-STE 还存在以下不足:分析基于二维图像,结果的准确性易受图像采集的影响;测得的容积均基于一定的几何假设;心脏是一个复杂的三维器官,其运动不限于二维平面,因此当心肌斑点沿z 轴运动到二维平面以外时,就会产生失追踪现象[27]。三维斑点追踪技术(three dimensional STE,3DSTE)能够解决上述问题。3D-STE 是实时三维心超与斑点追踪技术的结合,三维全容积成像能够避免采图时的短缩,也能够捕捉到全部斑点,在3 个维度上进行追踪,更符合心脏运动的真实生理情况[36]。目前3D-STE 在左房中的应用经验还比较缺乏,将为左室设计的3D-STE 软件直接套用到左房,一直以来都存在争议,原因是左房与左室在结构、室壁厚度等方面相去甚远,直接将为左室设计的分段方式、算法等套用到左房,势必会影响结果的准确性。目前陆续上市了专为左房优化设计的斑点追踪分析软件,未来还需要积累在左房应用的操作经验,以便早日形成规范化操作流程。
左房应变在心房颤动中的应用
评价左房重构 房颤患者的心房存在形态及功能的重构。间质纤维化是房颤的一个重要特点,纤维化干扰心肌正常的电传导、导致小折返环的产生,进而房颤的易感性增高并持续存在[37-39]。研究表明房颤患者的各个心房形变参数均有所减退[40-41],并且房颤病程越长,纤维化程度越高,应变值减退越显著[42]。在既往无房性心律失常病史的人群中,LASct 用于预测房颤的发生具有最佳的敏感度及特异度,其理论基础在于,左房泵功能减退反映了心房的结构重构,一定程度上代表了向房颤发展的起始不良过程[43]。
心源性卒中 缺血性卒中是房颤高致残性、高致死率的严重并发症之一[44],心房收缩功能丢失及血流在心房内淤滞促使血栓形成,进而脱落导致脑梗。左房应变在这一临床背景下具有多重价值。在阵发性、持续性或永久性房颤患者中,左房峰值纵向应变(即LASr)均与卒中独立相关,因此左房应变可用于评价血栓风险[41]。研究显示左房应变与CHADS2评分负相关,还能进一步为卒中风险分层提供参考[40,45]。
在另一方面,约25%的卒中在完善了各项检查后仍被判定为隐源性卒中,其中大部分最终明确为阵发性房颤[46]。左房应变能够敏感地反映出左房功能减退,能够在隐源性卒中患者中提示心源性病因,故有助于识别出“隐匿”的阵发性房颤[47]。
窦律的恢复及维持 房颤患者转复及维持窦性心律的方法包括药物复律、电复律及导管消融。据报道,首次电复律的成功率在90%以上[48],但约50%的患者会在一年内复发[49]。患者接受电复律或消融后,LASr 先出现减退(心肌顿抑),随后在数月内逐渐恢复并改善[11]。研究表明,LASr 是复律后房颤复发的重要预测因子,而复律后长期维持窦律的患者LASr 相对更高[50]。心房应变在接受导管消融治疗患者中的指导意义更加重要。左房重构程度与消融成功率相关,基线及消融术前的LASr能够预测术后心房的逆向重构(容积减小),若术前LASr 明显减退,提示心房重度纤维化,术后难以逆转[51]。LASr 在阵发性及持续性房颤患者中均能预测房颤消融术后窦性心律维持的成功率,如果术后LASr 改善不明显,则更有可能发生房颤复发[52-54]。因此,LASr 能够帮助我们挑选更适合接受房颤消融术的患者,从而节省医疗资源;若观察到术后患者的LASr 无明显改善,则提示房颤复发风险较高,有必要采取更频繁或更长时间的心电监测。
在瓣膜病及冠心病患者中预测房颤 二尖瓣的病变往往引起左房扩大及重构,进而提高房颤的易感性。研究显示LASr 与二尖瓣返流的程度和心房纤维化的程度强相关,并且在合并阵发性房颤的患者中LASr 减退更加明显[55]。在接受二尖瓣手术的患者中,左房应变能够预测术后房颤的发生[56]。在二尖瓣狭窄的患者中,左房应变同样能预测房颤的发生,具有较高的敏感度及特异度[57]。
冠脉搭桥术后约50%的患者可能发生房颤[58],这可能与先前存在的左房功能异常相关,常见原因包括高龄、高血压、心房缺血及过重的容量负荷。左房应变能够早期发现心房功能的异常,可用于术前评估,识别出术后发生房颤的高危患者[59-60]。
结语左房容积与左房功能具有重要的临床应用价值,在各种生理、病理状态下,左房功能的改变被认为早于心房结构及容积改变,是更敏感的指标。STE 是目前对心肌机械性能直接进行形变分析的最优技术,随着经验积累和技术改进,STE 的应用会更加广阔,并为临床提供更多指导信息。
作者贡献声明包丽莲文献检索,论文构思、撰写和修订。程蕾 技术分析,制图,论文修订。黄国倩 文献检索,论文构思和指导。包丽雯 文献检索,论文构思、指导和审校。
利益冲突声明所有作者均声明不存在利益冲突。

