脑特异性miRNA-9介导IGF-1R信号对脑缺血再灌注神经损伤大鼠的保护及作用机制
邓娅,王顺先
(1.达州中医药职业学院基础医学部,四川 达州 635000;2.川北医学院附属医院神经内科,四川 南充 637000)
脑血管疾病具有发病率高、死亡率高特点,其中缺血性脑疾病发病率占脑血管疾病80%以上[1]。脑缺血再灌注损伤(cerebral ischemia/ reperfusion injury,CI/RI)指突然中断脑组织供血且在恢复脑供血时错过了最佳的时间,导致脑功能不仅没得到改善,反而加重大脑功能障碍和结构损伤[2]。脑缺血可改变脑血管内皮细胞的状态,由正常时的静止到缺血时的促炎,进而加速了血脑屏障的破坏。此外,脑缺血还会诱发多种基因突变,其中微小核糖核酸(miRNA)可能介导CI/RI的发生发展[3]。miRNA可通过调控基因的表达介导多种疾病的发生发展。miRNA-9是一类主要在神经系统中表达的小分子RNA,其在神经组织分化、脑成熟中发挥重要作用[4],可介导多种生物学功能,包括影响脑发育,调节神经干细胞的增殖、分化和凋亡等[5]。但目前miR-9对CI/RI的作用机制报道极少。脑缺血性损伤后机体组织处于复杂的、多基因作用的神经保护网络中,其中胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)在该网络中起重要作用[6],可通过维持细胞生长和抑制细胞凋亡来促进受损神经细胞的恢复[7]。本研究拟探讨miR-9治疗CI/RI模型大鼠的疗效,并观察其能否通过调控IGF-1对CI/RI大鼠进行保护。
1 材料与方法
1.1 实验动物
40只SD大鼠均购自川北医学院医学院动物实验中心,许可证号:SCSK(川)2018-18。大鼠均为6周龄,体重200~220 g,雌性、雄性大鼠均为20只。所有大鼠均饲养在统一的动物房内,室温恒定22~24 ℃,相对湿度50~55%,光照12 h/ 12 h昼夜交替。本次动物实验符合动物伦理委员会批准(2022-0028)。
1.2 试剂和仪器
miR-9 inhibitor质粒、miR-NC质粒(生工生物工程技术服务有限公司);IGF-1抗体、 IGF-1R抗体(南京建成生物工程研究所);β-actin抗体、辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG(武汉三鹰生物技术有限公司);放射免疫沉淀法裂解缓冲液(RIPA裂解液)、二辛可宁酸(BCA)蛋白试剂盒、SDS-PAGE凝胶配制试剂盒、聚偏二氟乙烯膜(PVDF)和化学发光试剂盒(上海碧云天生物技术公司);L3000015LipofectamineTM2000转染试剂(上海恒斐生物科技有限公司);MA-688PCR仪(中国伯乐有限公司);CH-6010型机械匀浆机(瑞士kinemaica公司)脑立体定位仪(型号 51700,美国Stoelting公司)、全自动发光仪(型号AC-CESS2,美国贝克曼库尔特公司)。
1.3 分组和模型制备
将大鼠分为sham组、CI/RI组、miR-NC组和miR-9 inhibitor组,每组各10只。本实验根据MCAO法[6]制备CI/RI大鼠模型。麻醉各组大鼠并固定,沿大鼠颈部中线剪2 cm的切口,将大鼠颈部皮肤逐层分离,暴露颈总、颈外和颈内动脉并游离,暂时将颈总和颈外动脉夹闭,并于颈外动脉处用剪刀剪一个小口,去掉动脉夹,插入线栓,感觉到有稍微的阻力时停止插入。2 h后把插入的线栓拔出形成再灌注,用丝线扎紧动脉的残端,逐层缝合颈部皮肤。Sham组大鼠和其它各组大鼠的操作步骤相同,但不进行结扎。造模成功标准:大鼠出现神经功能缺损。本研究制备的所有CI/RI模型大鼠均造模成功。
再灌注5 min时,miR-NC组大鼠经左侧脑室注射2 μL浓度为100 μmol/L miR-NC质粒干预,miR-9 inhibitor组大鼠经左侧脑室注射2 μL浓度为100 μmol/L miR-9 inhibitor质粒干预,sham组和CI/RI在大鼠注射100 μmol/L生理盐水干预。24 h后行后续实验。
1.4 神经行为学评分
参照既往研究[8]中方法检测神经功能,1~3分为成功制备CI/RI模型。见表1。

表1 神经功能评分标准
1.5 检测方法
1.5.1 RT-PCR检测各组海马组织中miR-9表达水平 每组取部分大鼠,颈椎脱臼处死后剪下头颅,沿枕骨大孔剪开颅骨,取出完整的脑组织,生理盐水清洗脑组织上血迹。切除小脑,分开左右脑半球,将左脑下方的脑桥剥离开,可见一月牙状结构即为海马组织,将海马组织剥离,置于冻存管中液氮冻存。各组取50 mg海马组织,将1 mL裂解液加入到海马组织中,用均浆器冰上研磨,置于EP管中静置,使核酸与蛋白质完全解离。加入200 μL氯仿,振荡为乳状后静置4 min,13 000 rpm离心10 min,收集上层含RNA的无色水相层约500 μL,纯化并鉴定RNA的完整性。取纯度和完整性较好的RNA,65 ℃热变形5 min,去除RNA形成的高级结构以提高转录效率,置于冰上预冷。配置逆转录体系,振荡均匀后瞬时离心后进行逆转录反应。将获得的cDNA稀释50倍,根据逆转录试剂盒说明书配制20 μL荧光定量聚合酶链式反应(PCR)反应体系:95 ℃下变性30 s,循环条件为95 ℃ 5 s,60 ℃ 10 s,72 ℃ 15 s,共40个循环,最后72 ℃延伸2 min。2-△△Ct法计算miR-9的相对表达水平。引物序列见表2。
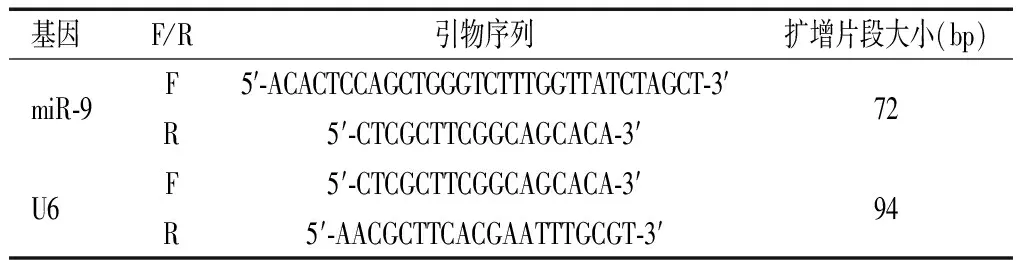
表2 引物序列
1.5.2 TTC染色检测各组脑梗死面积 取各组部分大鼠脑组织,于-20 ℃环境冷冻30 min。取出冷冻后的脑组织切成厚度为2 mm的组织切片,用2%TCC染色液染色脑组织切片,避光孵育组织切片30 min,每隔5 min对切片进行翻动,避免染色不均。用多聚甲醛溶液固定组织切片,分析各组大鼠脑梗死面积。
1.5.3 HE染色检测各组脑组织病理学变化 给药24 h后,取各组部分大鼠麻醉并处死,取出脑组织置于多聚甲醛溶液中,固定24 h后置于石蜡中,包埋组织后切片,厚度为4 μm,将苏木素染色液加入到组织切片中,3 min取出用伊红染色,将中性树脂加入到组织切片中封片,最后用显微镜观察变化。
1.5.4 TUNEL染色检测各组神经元凋亡情况 按照1.5.3中方法制备脑组织切片,将组织切片进行脱蜡处理,后将酒精加入到组织切片中浸泡,取出组织置于TUNEL染色剂中。中性树脂封片,纤维镜下观察组织切片中细胞凋亡情况。
1.5.5 蛋白印迹法检测脑组织中IGF-1、IFG-1R蛋白表达 给药24 h后,取各组部分大鼠麻醉并处死,取脑组织50 mg,加入300 μL含有蛋白酶抑制剂的RIPA裂解液中,均浆器冰上研磨组织10 min,于4 ℃下16 000 rpm离心10 min,收集120 μL上清液于EP管中,加入4×上样缓冲液40 μL,沸水中煮沸5~10 min使蛋白质变性,冰上冷却2 min存于-20 ℃冰箱保存,用于蛋白电泳上样,离心管中剩余上清液用BCA法测定蛋白浓度。取适量蛋白质,加入上样缓冲液,95 ℃煮沸5 min,进行SDS-PAGE电泳。电泳后,将分离的蛋白条带转至PVDF膜上,5%脱脂牛奶室温封闭2 h。蛋白样品中分别加入IGF-1(1∶500)、IGF-1R(1∶500)、β-actin(1∶1 000)一抗,4 ℃孵育过夜。三乙醇胺缓冲盐溶液-吐温20(TBST)洗膜后,加入HRP标记的二抗IgG(1∶2 000)。37 ℃孵育2 h。TBST洗膜,加入增强型化学发光(ECL)液避光显影。Image J图像软件分析各蛋白条带的灰度值。以β-actin为内参,目标蛋白与β-actin条带灰度值的比值表示目标蛋白的相对表达水平。
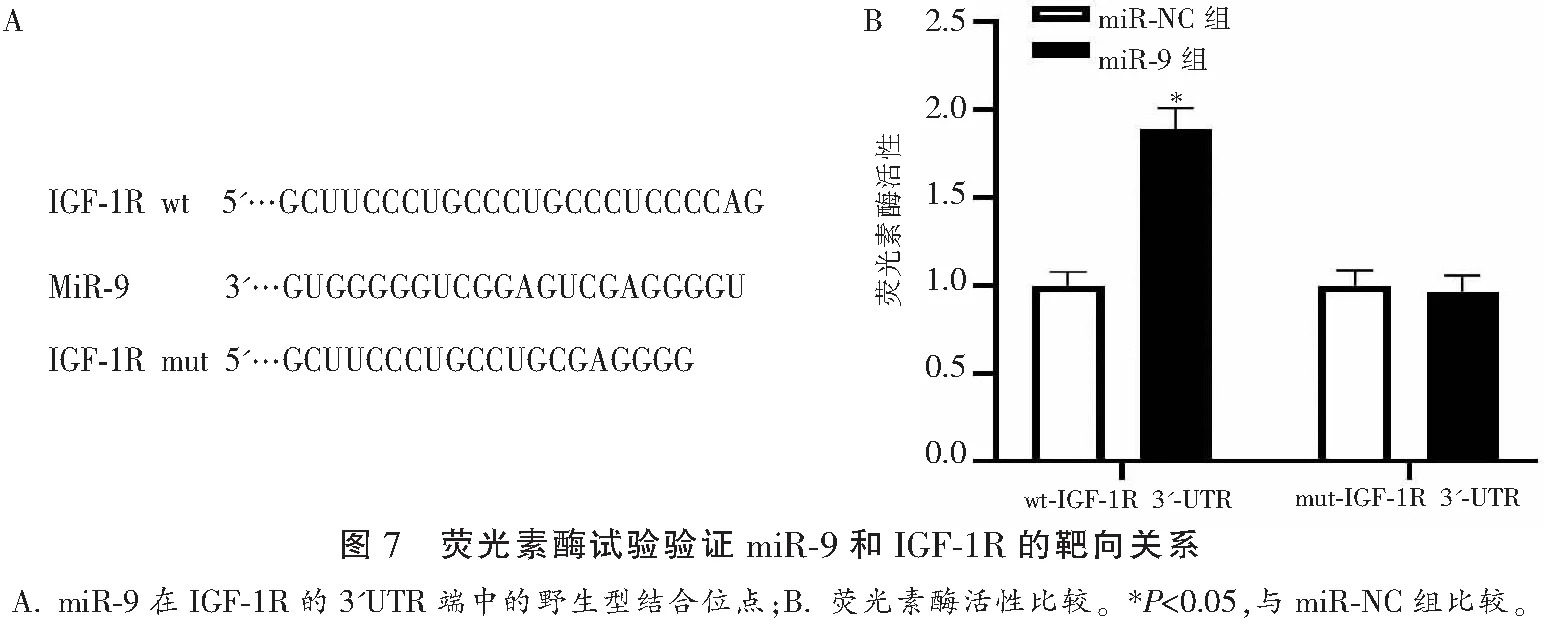
1.5.6 双荧光素酶报告靶基因荧光检测 采用TargetScan7.1在线靶基因预测软件验证了IGF-1R是miR-9的假定靶点。IGF-1R的野生型(wide type,wt)3′-URT包含预测的miR-9结合位点和突变型(mutant,mut)IGF-1R 3′-URT被上海基因有限公司化学扩增,并插入pMIR报告荧光素酶报告质粒生成荧光素酶质粒,分别称为pMIR-IGF-1R-3′-URTwt和pMIR-IGF-1R-3′-URTmut。转染前1 d将HEK-293T细胞接种到24孔板中,使用与pMIR-IGF-1R-3′-URTwt、pMIR-IGF-1R-3′-URTmut和miR-NC或miR-9质粒共转染。转染48 h后检测其荧光素酶活性。见表3。

表3 共转染分组
1.6 统计学分析
2 结果
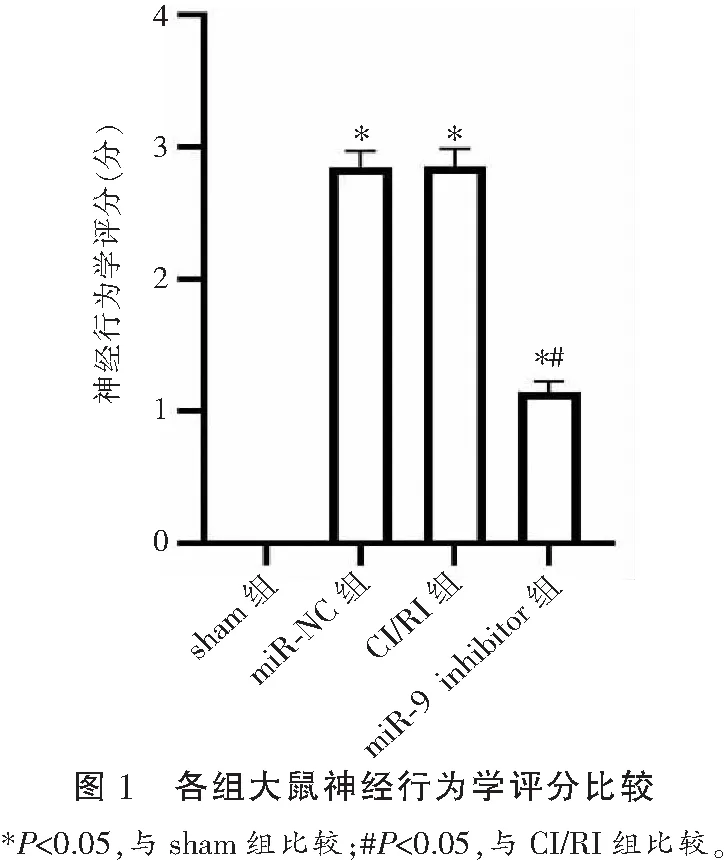
2.1 各组大鼠神经行为学评分比较
sham组大鼠神经功能评分为0。CI/RI组(2.85±0.12)高于sham组(P<0.05);miR-9 inhibitor组(1.15±0.08)低于CI/RI组(P<0.05);CI/RI组与miR-NC组(2.86±0.13)比较,差异无统计学意义(P>0.05)。见图1。
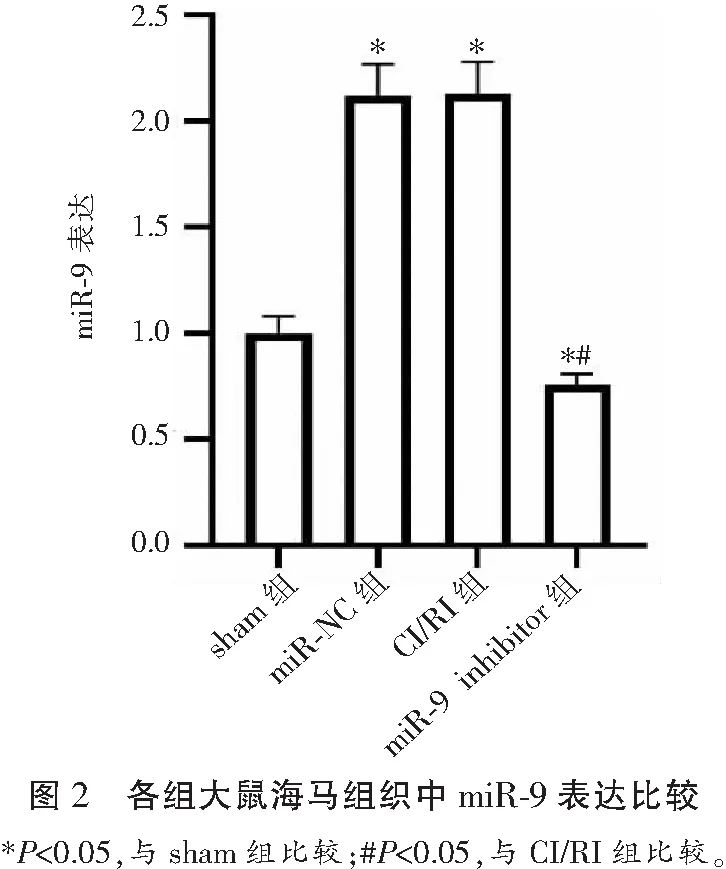
2.2 各组大鼠海马组织中miR-9表达水平比较
CI/RI组大鼠海马组织中miR-9相对表达量(2.13±0.14)高于sham组(1.00±0.09)(P<0.05);miR-9 inhibitor组大鼠海马组织中miR-9相对表达量(0.78±0.07)低于CI/RI组(P<0.05);CI/RI组大鼠海马组织中miR-9相对表达量和miR-NC组(2.12±0.14)比较差异无统计学意义(P>0.05)。见图2。
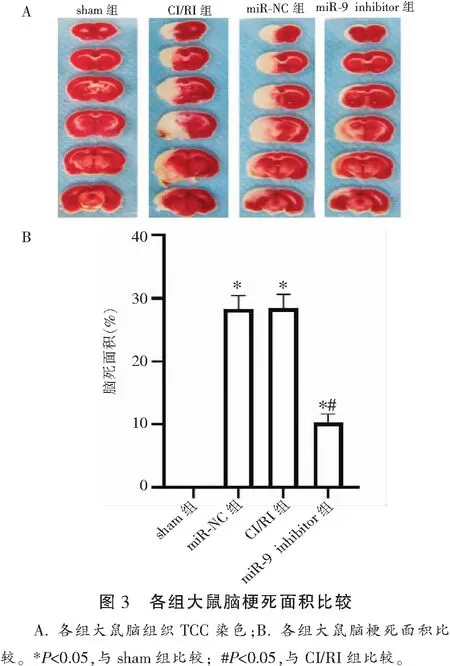
2.3 各组大鼠脑梗死面积比较
CI/RI组大鼠脑梗死面积(28.13±1.26)多于sham组(P<0.05);miR-9 inhibitor组大鼠脑梗死面积(9.24±1.05)小于CI/RI组P<0.05);且CI/RI组大鼠脑梗死面积与miR-NC组(28.56±1.27)比较差异无统计学意义(P>0.05)。见图3。
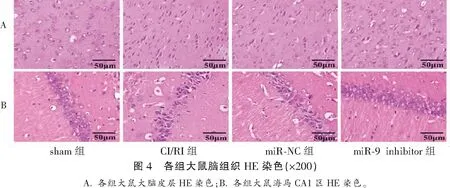
2.4 各组大鼠脑组织病理学变化比较
和sham组相比,CI/RI组神经元大量坏死,细胞核固缩并出现大量溶解,神经元排列无规则且稀疏;海马带宽度不规则,CA1区椎体的数量也较sham组减少,且排列无规律;和模型组相比,miR-9 inhibitor组神经元损伤得到明显改善,细胞形态基本趋于正常,海马带整齐排列,且CA1区椎体细胞排列紧密、整齐,细胞极性变好;miR-NC组和CI/RI组大鼠脑组织病理学比较无明显差异。见图4。
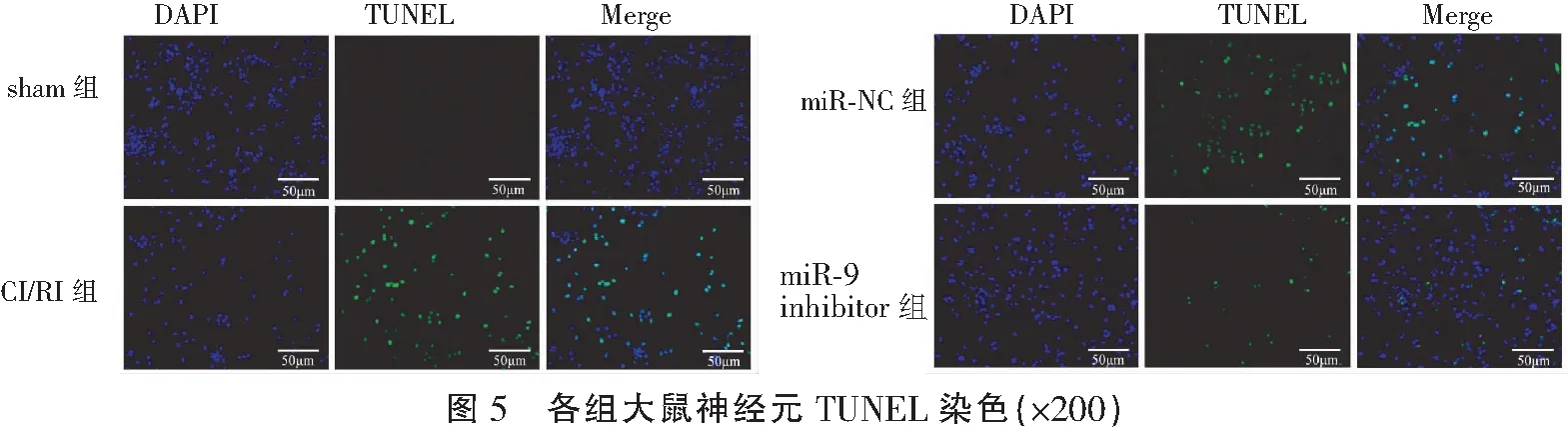
2.5 各组大鼠神经元凋亡比较
和sham组相比,CI/RI组大鼠神经元凋亡数量(37.45±2.37%)增加(P<0.05);和CI/RI组相比,miR-9 inhibitor组大鼠神经元凋亡数量(8.42±1.17%)减少(P<0.05);且CI/RI组大鼠神经元数量和miR-NC组(38.01±2.40%)比较,差异无统计学意义(P>0.05)。见图5。
2.6 各组大鼠脑组织中IGF-1、IFG-1R蛋白表达水平比较
和sham组相比,CI/RI组大鼠脑组织中IGF-1、IFG-1R蛋白表达升高(P<0.05);miR-9 inhibitor组大鼠脑组织中IGF-1、IFG-1R蛋白表达高于CI/RI组(P<0.05);CI/RI组大鼠脑组织中IGF-1、IFG-1R蛋白表达和miR-NC组比较,差异无统计学意义(P>0.05)。见图6。
2.7 miR-9靶向关系预测和鉴定
软件显示IGF-1R的3′UTR端与miR-9有碱基互补结合点位。在细胞中转染野生型IGF-1R(IGF-1R-WT)时,miR-9组的荧光素酶活性高于miR-NC组(P<0.05),但两组的突变型IGF-1R(IGF-1R-MUT)比较,差异无统计学意义(P>0.05)。见图7。
3 讨论
脑缺血会因多种因素导致神经元损伤,其发病机制与时间、空间级联反应密切相关。脑缺血/再灌注损伤由多种病理过程所导致,例如氧化应激、细胞凋亡等多种病理生理过程,彼此间相互作用导致神经功能障碍[8-9]。大量研究[9-10]证明,miRNA可介导脑缺血子再灌注损伤的发生发展。部分研究[11]发现,miR-9在脑内高表达,能通过促进神经干细胞的生物学活性而影响大脑和神经元。本研究结果显示,在脑缺血再灌注损伤大鼠模型中miR-9呈高表达,提示miR-9参与了大鼠CI/RI的过程,和既往研究[11]结果基本一致。
脑缺血/再灌注损伤时脑损伤程度可根据神经功能评分来进行判定,当评分升高,说明脑损伤程度越重[12]。本研究中,通过对CI/RI大鼠侧脑室注射miR-9 inhibitor质粒发现,CI/RI大鼠脑组织中miR-9表达显著降低,且大鼠的神经功能评分明显降低,提示miR-9可改善CI/RI大鼠神经功能损伤。本研究继续抑制CI/RI大鼠miR-9表达可减少CI/RI大鼠脑梗死面积,改善神经元状态,减少神经元凋亡,提示抑制脑特异性miR-9能通过减少大鼠脑梗死面积和神经元凋亡保护缺血再灌注大鼠脑组织,能维持神经细胞的发育和分化。Tan等[13]研究发现,miR-9能对脑的发育进行有效调节。张玉敏等[14]研究证实,高表达miR-9可促进缺血性脑卒中患者血清中的炎症因子含量增加。
多肽生长因子IGF-1可对脑损伤中的神经营养产生保护作用,其可通过结合IFG-1R来发挥多种生物学功能,包括促进神经功能恢复、抑制神经元细胞凋亡等[15]。IGF-1与IGF-1R在正常脑组织有少量表达,而脑缺血损伤发生后,脑组织中IGF-1与IGF-1R表达水平明显增加[16]。本研究显示,CI/RI组大鼠脑组织中IGF-1和IGF-1R蛋白表达均明显增加,提示缺血再灌注损伤可促进脑组织中IGF-1与IGF-1R表达,通过miR-9 inhibitor干预后CI/RI大鼠脑组织中IGF-1与IGF-1R表达明显高于CI/RI模型组,提示抑制miR-9能进一步促进内源性IGF-1与IGF-1R的合成与表达。IGF-1与IGF-1R表达上调,可调控下游信号通路,从而减轻缺血性脑损伤病情的发展,发挥神经保护作用[17]。王杰华等[18]研究证实,在脑缺血再灌注损伤中可通过促进IGF-1与IGF-1R表达改善脑损伤。为了探究miR-9对CI/RI大鼠的脑保护机制,本研究还验证了IGF-1R和miR-9的靶向关系,miR-9可靶向抑制IGF-1R表达,提示抑制miR-9可靶向上调IGF-1R表达而发挥对CI/RI大鼠的脑保护作用。
综上所述,抑制miR-9可对脑缺血再灌注损伤大鼠脑组织产生保护作用,其作用机制与促进IGF-1R信号通路相关。
——一道江苏高考题的奥秘解读和拓展

