长白山阔叶红松林主要树种凋落叶分解速率及其与叶性状的关系
秦立厚,刘琪璟, 孙 震,徐振招,斯庆毕力格,3
1 北京林业大学 林学院,北京 100083 2 国家林业和草原局调查规划设计院,北京 100714 3 鄂尔多斯市林业和草原事业发展中心,鄂尔多斯 017010
凋落物分解在森林生态系统物质循环过程中起着重要的桥梁作用,是地上、地下物质循环和能量流动的枢纽。森林生态系统每年净初级生产力约有一半以上通过凋落物分解的方式转移到土壤中[1],可为植物生长提供70%的营养物质[2]。凋落物分解的速率直接影响了森林生态系统养分输入的快慢,进而会对森林生态系统生产力水平产生影响。开展森林生态系统调落物分解的研究可进一步了解森林生态系统养分循环、能量流动与凋落物分解之间的联系,对评价凋落物分解速率对森林生产力的影响具有重要的参考价值。
凋落叶自身性质与凋落叶分解速率密切相关。凋落叶自身性质主要指凋落叶的物理、化学特性。物理性质主要包括凋落物的面积、比叶面积、叶片干物质含量、叶片抗张强度、叶片厚度、是否被有绒毛、蜡质等[3—4]。分解较慢的树种一般具有较厚的表皮、角质层和蜡质层,这些性质决定了该物种叶片具有较差的透水性、适口性及不易破碎性等特性,降低凋落物的分解速率[5—6]。另外,凋落叶的比叶面积及叶片干物质含量对凋落物的分解速率也有一定的影响,比叶面积越大分解速率越快[3],干物质含量越高分解速率越低[4]。此外,同一树种在不同海拔甚至不同部位由于其物理性质的不同,其分解速率也存在一定差异。例如由于树冠下部的叶片比顶部叶片柔软,其分解速率要比树冠顶部叶片分解的快[7];Vitousek等认为同一物种高海拔地区的叶片厚度大、结构粗糙,其分解速率要低于低海拔地区的叶片[8]。凋落叶化学性状对分解同样起着重要作用。凋落物中含有不同的有机化合物,如难分解的有机成分如木质素、纤维素、半纤维素等,易分解的成分如多糖、氨基酸等。目前,研究凋落物质量的常用指标主要有凋落物初始氮、磷、木质素、纤维素含量及各成分的比值[9—11]。氮含量作为一个重要的影响因子,主要是由于分解者的生长发育需要氮元素,初始氮含量较低的凋落叶不能为分解者提供足够的营养供应,因此会抑制凋落叶的分解[12]。不同分解时期影响凋落物分解速率的因素会有所改变。在分解初期主要受凋分解者所需的必要元素(N、P等)含量的影响,而在分解后期主要受木质素、纤维素、酚类等含量的影响[13]。由于木质素、纤维素较难分解,在分解后期随着木质素、纤维素含量的不断增加分解速率也随之减慢[14]。同时,磷含量也可能是影响凋落物分解的重要因子,特别是在磷储量较低的生态系统中[15]。
除了凋落叶自身特性会影响分解速率外,微生物和土壤动物也会对凋落叶分解速率产生影响。与土壤动物相比,微生物的作用相对较小。例如Vossbrinck等研究发现添加微生物后分解速率由原来的7.2%增加到了15.2%[16]。而土壤动物对凋落物分解的影响在不同气候区表现不同。具体表现为由温带到热带地区土壤动物对凋落物的分解影响逐渐增大[17]。包剑利等研究了土壤动物对长白山牛皮杜鹃凋落物分解的影响[18]。结果表明中小型土壤动物对牛皮杜鹃分解的贡献率为16.88%、大型土壤动物对牛皮杜鹃分解的贡献率为8.69%。可见,在长白山地区影响凋落叶分解的主要因素可能是凋落叶自身性质。
阔叶红松林是我国东北地区非常典型的地带性森林群落,群落内结构复杂、物种多样性丰富、森林蓄积量大,对维持区域生态系统稳定性具有重要作用[19—20]。明确阔叶红松林影响凋落叶分解的自身因素对预测不同树种凋落叶分解速率,评估凋落叶分解动态有重要意义。基于此,本研究以阔叶红松林内30个常见树种凋落叶为研究对象,比较不同树种及不同生活型在分解速率上的差异,明确凋落叶性状与分解速率的关系,以期丰富长白山阔叶红松林生态系统的基础数据,为理解阔叶红松林生态系统功能和养分循环提供依据。
1 研究区概况
本研究位于长白山国家级自然保护区内。该保护区地处127°42′—128°16′E 与41°41′—42°25′N之间,是我国保存较为完整的森林生态系统保护区之一。长白山自然保护区属于温带大陆性气候,四季分明,凉爽宜人,年平均气温为3.66℃,年均降水量为735.73 mm[21]。低温多雨的特点使得该地区常年湿润,空气湿度在70%左右。由于保护区内海拔差异接近2000 m,气候垂直变化差异明显,植被组成上呈垂直分布规律,由低到高以依次成了阔叶红松林带、云冷杉林带、岳桦林带、高山苔原带等植被带。阔叶红松林带处于海拔1100 m以下的地域,是长白山地区典型的地带性植被类型。阔叶红松林垂直结构明显,主林层主要树种主要有红松(Pinuskoraiensis)、紫椴(Tiliaamurensis)、蒙古栎(Quercusmongolica)、色木槭(Acermono)、水曲柳(Fraxinusmandshurica)、春榆(Ulmusjaponica)、糠椴(Tiliamandshurica)等树种,此外还分布有大青杨(Populusussuriensis)、山杨(Populusdavidiana)、白桦(Betulaplatyphylla)等少量先锋树种。亚林层主要有假色槭(Acerpseudosieboldianum)、青楷槭(Acertegmentosum)、水榆花楸(Sorbusalnifolia)、黑樱桃(Cerasusmaximowiczii)等树种。
2 研究方法
2.1 样地和物种选择
于2010年5月在长白山自然保护区原始阔叶红松林内(42°24′01″N,128°05′51″E)设置了边长为100 m的方形样地。2020年5月对样地进行了复测,复测时将样地划分为10 m×10 m的小样方,对样方内所有胸径大于5cm 的样木进行每木检尺,记录树种名称、胸径、树高、冠幅、样木位置、立木类型等相关信息。对于灌木或幼树的调查,只调查对角线所在的样方,记录基径 >1 cm的灌木或幼树基径、高度、冠幅。调查完成后,选择21个乔木树种和9个灌木树种来研究分解速率与凋落叶分解的关系。具体乔、灌树种见表1。
2.2 凋落叶采集与叶性状测定
于2019年9月至10月采用收集器收集法采集30个物种新鲜凋落叶。收集器边长为0.7m,底部为孔径为1mm的尼龙网,距离地面高度设置为30cm。由于部分灌木树种较少,在采集叶片时选择已枯死但还未凋落的凋落叶。对于这些树种每个树种至少从3株目标树种上选取。
为了研究长白山阔叶红松林内主要树种凋落叶分解速率与凋落叶初始叶性状的关系,本研究选择比叶面积(SLA)、叶片厚度(LT)、叶片韧性(TH)、抗拉强度(TS)、标准持水力(WHCstd)、饱和持水力(WHCmax)等6个物理性状,凋落叶初始C、N、P、木质素、纤维素(Cellulose)含量5个化学性状,C∶N、N∶P、C∶P、L∶N、L∶P 5个化学计量比。其中,SLA通过凋落叶单面叶面积与干重的比值计算得出。LT通过游标卡尺进行测定。
TH和TS通过拉力计测定。以将单位宽度叶片撕裂的力作为叶片TS的测量值[22]。将同一树种的叶片浸湿后避开叶脉用刀片切成0.5 cm宽的长条,一端用夹子夹紧并固定,另一端固定在韦度电子手持式推拉力计(数显)上,拉动拉力计直至叶片断裂,记录叶片断裂时的瞬时拉力,每组测量10片,重复3次。以单位面积固体物穿过叶片所用的力作为叶片TH的测量值[22]。同一树种的叶片浸湿后将叶片覆盖在大小合适的圆环上,在叶片上部再加一个孔径大小相同的圆环以固定叶片四周,圆环中应尽量避免叶脉的存在。将直径恰当且横截面平整的铁丝固定于韦度电子手持式推拉力计(数显)上,记录铁丝刺穿叶片时的瞬时推力即为叶片的韧性。每组测量10片,重复3次。
标准持水率为叶片在水中浸泡1h后叶片增重与叶片干重的比值。饱和持水率则为叶片在水中浸泡24h后叶片增重与叶片干重的比值[22]。
化学性状的测定:烘干后的凋落叶经研磨仪(MM400)粉碎后过60目筛测定各项指标。使用总元素分析仪(FLASH 2000 CHNS/O)测定凋落叶中全C、全N。样品经消煮后使用紫外分光光度计(760 CTR)采用钼锑抗比色法测定凋落叶全P含量。凋落叶初始木质素和纤维素含量通过酸性洗涤法测定[23—24]。
2.3 凋落叶分解实验
于2019年9—10月在长白山阔叶红松林内采用收集器法收集30个树种新鲜凋落叶。采集回的凋落叶在60℃的温度下烘干至恒重[25]。烘干完成后,每个树种分别称取6g凋落叶放入尼龙网袋中,网袋大小为20cm×25 cm,网眼直径为1mm。为了防止烘干后的凋落叶还存在一定的水分,将烘干后的凋落叶又分别取3份(每份重6g)放在烘箱中置于75℃下继续烘干至恒重,以对尼龙网袋中的重量进行校正。烘干后的样品经粉碎、过筛后用于测定各树种不同分解时间养分含量。养分含量的测定方法见 2.2 中 “化学性状的测定”。
所有实验准备完成后,于2019年10月26日将360个(30个树种×3次重复×4次回收)尼龙网袋放入3个地势平坦且没积水的样地中。分解袋布设完成后,分别于180d、240d、300d和365d后分4次回收分解袋。回收后的分解袋带回实验室内并取出袋内的凋落叶,仔细清除掺杂的泥土、植物根系和土壤动物等。随后将清理干净的剩余凋落叶置于烘箱中于75℃ 温度下烘干至恒重并称重。
2.4 数据处理
分解袋回收到实验室并烘干称重后,凋落叶质量损失率(R)通过公式(1)计算:
(1)
式中Mt为经过时间t的分解后凋落叶剩余干重(g),M0为分解袋内凋落叶分解样初始干重(g)。
不同树种凋落叶的分解速率k通过Olson指数衰减模型来拟合计算[26],修正后的Olson 模型可表示为:
(2)
式中Mt为经过时间t的分解后凋落叶剩余干重(g),M0为分解袋内分解样初始干重(g),α为修正系数,k为凋落叶分解系数。
根据公式(3)和(4)用于计算各树种凋落叶分解50%和95%所需要的时间:
t0.5=ln(0.5)/(-k)
(3)
t0.95=ln(0.05)/(-k)
(4)
式中t0.5表示凋落叶分解50%所用的时间(半衰期),t0.95表示凋落叶分解95%所用的时间。
采用单因素方差分析比较不同生活型凋落叶的分解速率;利用Pearson相关分析方法,分析凋落叶性状与分解速率的相关关系。所有的统计分析都在SPSS 19.0种完成。
3 结果与分析
3.1 不同物种叶性状比较
表1 为30个树种实测6个物理性状值。可见,30个树种的物理性状在种间差异较大。其中,WHCstd最大的树种为怀槐348.32%,最小的为红松仅为40.43%,最大值是最小值的8.62倍。不同树种SLA的均值为345.45 cm2/g,以水榆花楸SLA最大为594.49 cm2/g,红松SLA最小仅为76.58 cm2/g。对于不同树种凋落叶LT,以红松的LT度值最大为0.62mm,最小值为0.032 mm为白牛槭,所有树种凋落叶LT均值为0.1mm。不同树种TH在0.5—2.41 N/mm之间,均值为1.17 N/mm,以蒙古栎凋落叶TH最大,黄檗最小。不同树种凋落叶TS在0.68—3.17 N/mm2之间,以蒙古栎凋落叶TS最大,水曲柳叶片TS最小,所有树种凋落叶TS均值为1.38 N/mm2。

表1 不同树种凋落叶物理性状
长白山阔叶红松林内常见树种的叶化学性状及化学计量学特征种间差异较大(表2)。叶片N含量最大的树种为东北山梅花,N含量为1.7%,最小的为红松为0.75%,均值为 1.09%,变异系数为20%。叶片C含量最大的树种为红松,C含量为50.94%,最小的为东北溲疏为37.85%, C含量整体均值为43.90%,变异系数较小仅为9%,可见碳含量在不同种间变异较小。叶片P含量在0.06%-0.18%之间,以东北山梅花含量最高,红松最低。30个树种的P含量整体均值为0.12%,变异系数为27%。木质素(L)含量整体均值为20.20%,变异系数为19%,以红松最高为30.06%,东北山梅花最低为14.5%。纤维素含量最大值为29.5%(早花忍冬),最小值为12.8%(春榆)。30个树种的纤维素含量整体均值为20.48%,变异系数为19%。
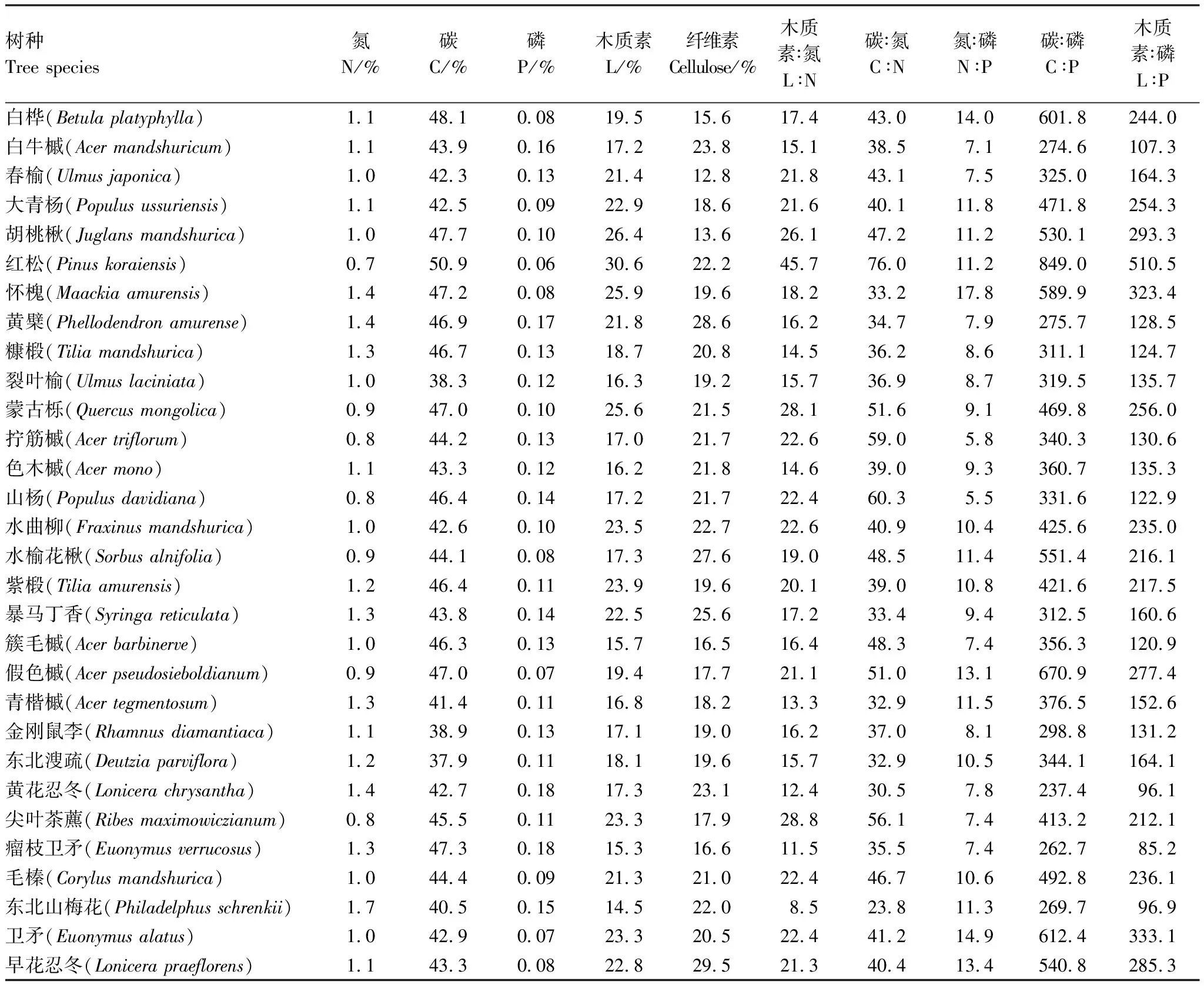
表2 不同树种凋落叶化学性状
对于其他5个化学计量特征L∶N、C∶N、N∶P、L∶P和C∶P变化范围分别介于8.53—45.7,23.8—76.0,5.5—17.8,85.2—510.5和237.4—849.0之间,均值分别为19.47、41.28、10.00、196.42。在5个化学计量学特性中以L∶P变异性最大,变异系数达到47%,C∶N变异性最小变异系数为27%。
3.2 不同树种凋落叶分解速率
经过365d的分解,不同树种凋落叶的质量损失率表现出较大的差异(表3)。30个树种凋落叶质量损失率在20.56%—92.11%之间,损失率均值为56.04%,变异系数为26.85%。以东北山梅花损失率最高为92.11%,其次为黄花忍冬(85.19%)和瘤枝卫矛(84.61%)。质量损失率较低的树种主要有红松、蒙古栎、胡桃楸、春榆、白桦等,质量损失率不足40%。质量损失率最低的为红松,仅为20.56%。不同生活型总质量损失率比较发现(图1),3种生活型质量损失率存在显著差异(P=0.004),以乔木树种质量损失率最最低为48.23%,灌木树种质量损失率最高为69.63%。

图1 不同生活型树种凋落叶质量损失率比较

表3 不同树种不同时间段质量损失率
不同树种凋落叶分解负指数衰减模型拟合结果如表4所示。由表可知,不同树种凋落叶Olson负指数衰减模型都表现出较好的拟合效果,决定系数R2均在0.87—0.99之间。不同树种的分解系数(k)以瘤枝卫矛最大为1.64,红松最小仅为0.24。30个树种分解50%和95%所需的时间有较大的差异。凋落叶分解50%和95%所需的时间均以红松所需的时间最长,瘤枝卫矛所需的时间最短。红松分解50%所需的时间为2.86年,分解95%所需的时间为12.37年。瘤枝卫矛分解50%所需的时间最短为0.43年,分解95%所需的时间为1.83年。
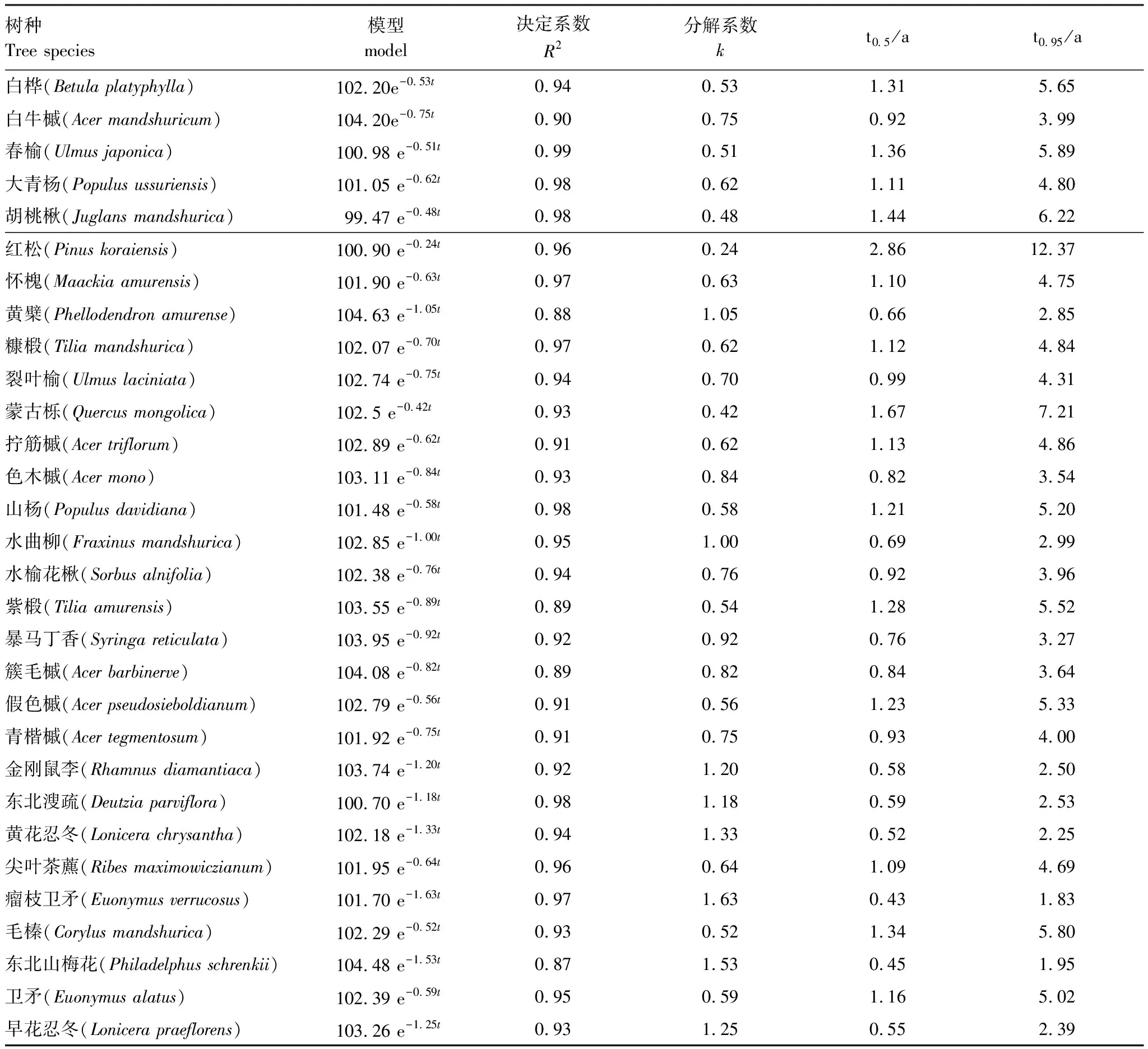
表4 不同树种凋落叶分解Olson负指数衰减模型
3.3 分解速率与凋落叶性状的关系
不同物理性状对凋落叶分解的影响不同。图2为阔叶红松林内所选30个树种叶片物理性状和分解速率k的关系。30个树种WHCmax、SLA、LT及TH与凋落叶分解速率存在显著的相关关系(P<0.05),其中WHCmax、SLA与凋落叶分解速率为正相关关系,LT及TH与凋落叶分解速率呈负相关关系。不同物理性状以WHCmax与凋落叶分解速率的相关性最高为0.55。对于其他物理性状,WHCstd和TH则与叶凋落物分解没有显著相关性(P>0.05)。
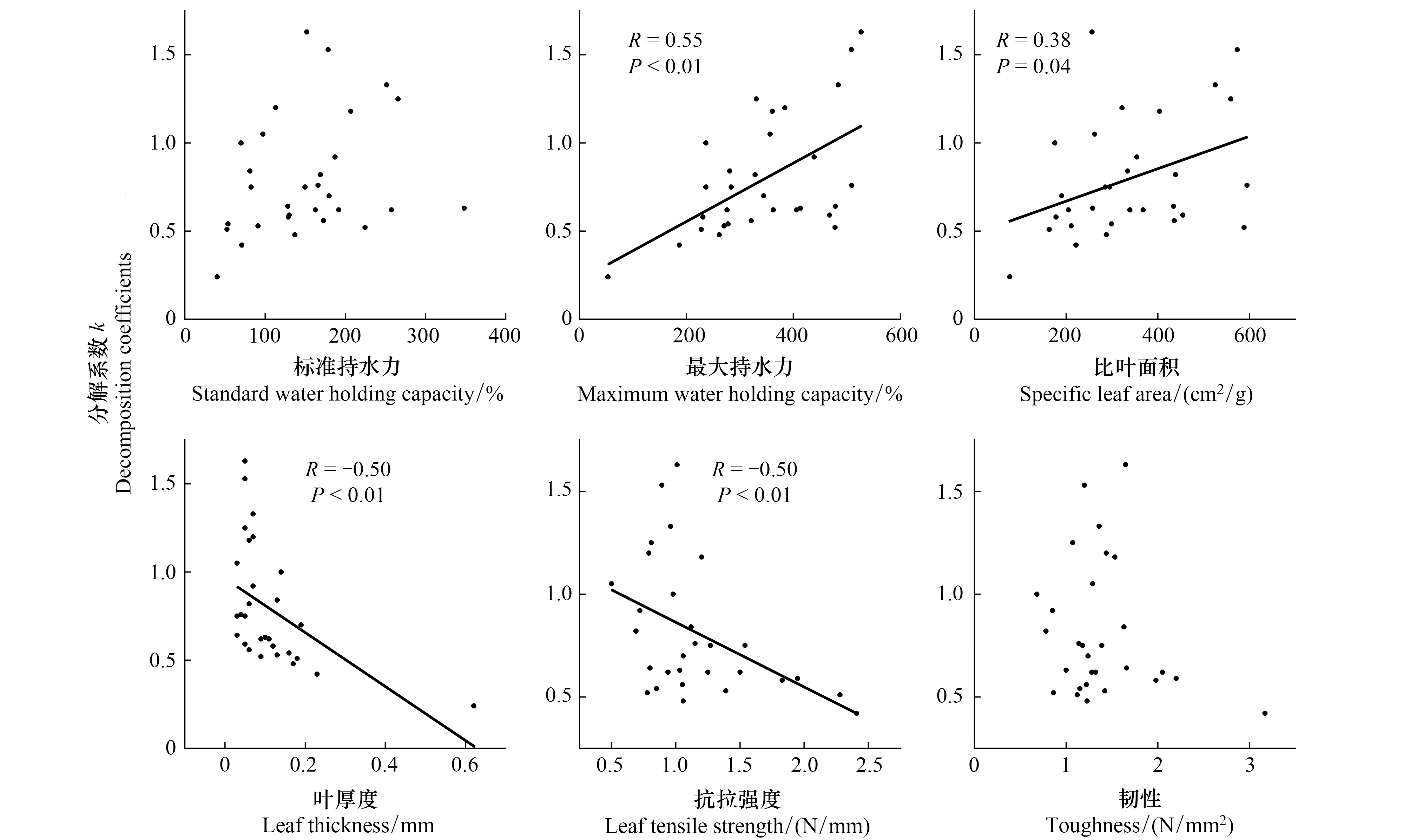
图2 凋落叶分解速率与物理性状间的相关性
凋落叶化学元素的含量对分解速率有一定的影响,不同化学元素对凋落叶分解速率的影响见图3。可以看出,30个树种叶N、C、P及木质素均与叶凋落物分解存在显著的相关关系(P<0.05),其中N和P与叶凋落物分解速率为正相关关系,C和木质素与叶凋落物分解呈负相关关系。而凋落叶纤维素则与叶凋落物分解没有显著相关性(P>0.05)。不同化学性状以叶片N与叶凋落物分解速率的相关性最强为0.63。对于不同的化学计量比,L∶N、C∶N、L∶P、C∶P与叶凋落物分解呈显著负相关性。其中以L∶N值对凋落叶分解速率的解释能力最强,相关性为-0.66。N∶P对凋落叶分解速率的解释性较差。

图3 凋落叶分解速率与化学性状间的相关性
凋落叶物理性状、化学性状在不同时间段内对凋落叶质量损失量的影响程度不同(表5)。具体表现为,在实验前180d和180—240d,叶片WHCmax、LT、叶片N含量、木质素、L∶N、L∶P与各阶段质量损失率有显著相关性。在第三阶段(240—300d),物理性状仅LT与此价段质量损失率存在显著相关性,化学性状木质素、L∶N、C∶N、L∶P与此阶段质量损失率存在显著相关性,可见此阶段影响凋落叶分解的主要因素为凋落叶内化学物质含量的影响。分解到最后一个阶段时,物理性状仅凋落叶WHCmax和SLA与此阶段质量损失率存在显著相关性,化学性状N、P、L∶N、C∶N、C∶P、L∶P与此阶段质量损失率存在显著相关性。

表5 不同分解阶段质量损失率与凋落叶性状的关系
4 结论与讨论
凋落物分解在森林生态系统物质循环中发挥着重要作用,是地上、地下物质循环和能量流动的枢纽。本研究通过测定30个树种的1年的分解速率,研究了长白山阔叶红松林内常见树种凋落叶分解速率与叶性状的关系,有助于增加长白山阔叶红松林生态系统的基础数据,丰富阔叶红松林的生态学理论,为研究阔叶红松林的养分循环和物质流动提供依据。
研究表明,凋落叶分解与凋落叶质量、叶片结构等功能性状有密切关系[27]。对于物理性状,凋落叶分解速率与凋落叶饱和持水率、叶片厚度、比叶面积和抗拉强度之间存在显著相关性,此结论与Makkonen 等、Vaieretti等的研究结果相同[22,28]。饱和持水率与凋落叶分解存在较强的相关性,原因可能为具有高饱和持水率的凋落叶具有较强的获取水分和保留水分的能力,能改善分解者周围的小气候,可以为分界者提供所必需的水分[22]。另外,饱和持水率可能与叶片干物质含量具有相同的解释。叶片干物质含量反映了叶肉和结构化合物的比例关系[29]。叶片干物质含量越高,叶肉和表皮(光组织)所占比例越低,维管组织和厚壁组织(木质素、纤维素)所占比例越高,其分解速率越慢[30—31]。比叶面积与凋落物分解成正比,说明比叶面积越大,分解速率越快。其原因是比叶面积与叶的粗糙度呈反比,凋落叶越粗糙分解速率越慢[15]。另外,比叶面积大代表着单位重量的叶片有更大的面积与分解者接触,进而提高了分解速率[32]。叶片抗拉强度一般与叶片的物理防御相关。高抗拉强度具有较高的物理防御能力,这类凋落叶组织密度较高,会降低土壤动物的适口性,也会使分解者花费更多的能量和时间去分解这些难分解物质从而降低分解速率[33]。但是本研究发现同样代表物理防御能力的叶片韧性与凋落物分解却没有显著相关性,这与Gallardo 等[5]的研究有一定差异。
凋落叶化学性状是最常用来解释凋落叶分解速率的指标。已有研究证明了多个化学成分会影响凋落叶的分解速率,如叶片N、P、木质素、纤维素、L∶N等[27]。许多研究发现凋落叶N含量对分解速率的解释能力较强,因为N元素是分解者生长发育、生理代谢不可缺少的元素,分解者在分解初期更倾向于分解N含量高的凋落物。随着分解的进行,N含量不断下降,分解者继而转向P含量较高的凋落叶[34],因此P含量对凋落叶的分解也有一定的预测作用。本研究中凋落叶N和P含量均与叶片分解速率呈显著正相关关系,此结论与前人研究结果一致。凋落叶C含量与凋落物分解呈负相关关系,与一些研究的结论相同[4]。C含量对于高木质化组织的分解预测能力较强,而且与木质素、纤维素等难分解物质有很强的相关性。木质素、纤维素及木质素和氮的比值也在多项研究中被证明与凋落叶分解存在一定的关系,本研究的结果与以往研究结论相似。但是本研究中纤维素并没有显现出与凋落叶分解有一定的相关性,与部分研究结论相反。
在同一林型内,可以认为凋落叶分解所处的环境因素和分解者因素是相同的。因此,凋落叶分解实验除了受凋落叶自身特性的影响外还会受实验材料的影响。研究表明,实验过程中所用的分解袋网孔大小也会对凋落叶分解速率有较大影响,例如李艳红分别使用6目、30目和260目的网袋研究了不同孔径下凋落叶的分解速度,结果表明不同孔径下的分解速率差异显著[35]。对长白山地区来讲,不通孔径分解袋对凋落叶的影响可能较小甚至不会产生显著性差异,蒋云峰利用孔径为0.1mm、2mm和4mm的分解袋研究了阔叶红松林内红松、水曲柳、紫椴和色木槭的分解特征,结果表明水曲柳和紫椴经过1年的分解不同孔径分解袋中的损失率没有显著差异,红松和色木槭仅0.01mm孔径网袋内的凋落叶损失率与2mm和4mm的存在差异,2mm和4mm孔径网袋内的凋落叶损失率没有显著性差异[36]。本研究使用1mm孔径的网袋保证了实验材料的一致性,可以认为真实反映了不同树种在分解速率快慢上的差异。

