民族药用植物鬼吹箫地上部分化学成分及其镇痛活性研究
胡 满 王 迪 肖朝江 姜 北*
1.云南省滇西抗病原植物资源筛选研究重点实验室(培育),云南 大理 671000;2.大理大学药物研究所/大理大学药学院,云南 大理 671000
鬼吹箫(LeycesteriaformosaWall.)为忍冬科鬼吹箫属植物,该属植物种类较少,全世界仅有8种,我国有6种,主要分布于西南部的温带和亚热带山区[1];云南有4种,是该属植物的主要分布地区,除滇南外,几乎遍布于全省各地[2]。鬼吹箫又名风吹箫、火炮筒、鬼炮仗、空心木等,在云南分布广泛,生于海拔1400~3300 m的大部分地区,资源丰富,为多种民族常用药用植物,白族称作“需改”“厚双柱”[3],彝族称作“乃替没”,具有破血调经、祛风除湿、化痰平喘、利水消肿的功效[3],主要用于治疗膀胱炎、水肿、支气管哮喘、食积、腹胀、风湿痛、痔疮等,外用可治疗骨折,叶可作凉药[2-3]。在笔者前期开展的滇西地区特色植物镇痛活性筛查实验研究中,发现鬼吹箫提取物具有显著的镇痛活性,文献检索[4-5]结果显示该植物仅见化学成分与抗肿瘤活性研究报道,未见有镇痛活性及其相关活性成分研究。为进一步了解鬼吹箫提取物化学组成及镇痛活性成分,近来笔者对采自云南大理的鬼吹箫地上部分进行了初步的化学成分与单体成分镇痛活性研究。结果从鬼吹箫地上部分乙醇提取物乙酸乙酯部位与正丁醇部位中共分离得到7个单体化合物,分别鉴定为木犀草素(1)、木犀草素-5-O-β-D-葡萄糖苷(2)、松柏醛(3)、乌索酸(4)、乙酰熊果酸(5)、β-谷甾醇(6)、胡萝卜苷(7),其中部分化合物显示出一定的镇痛活性。化合物结构如图1所示。
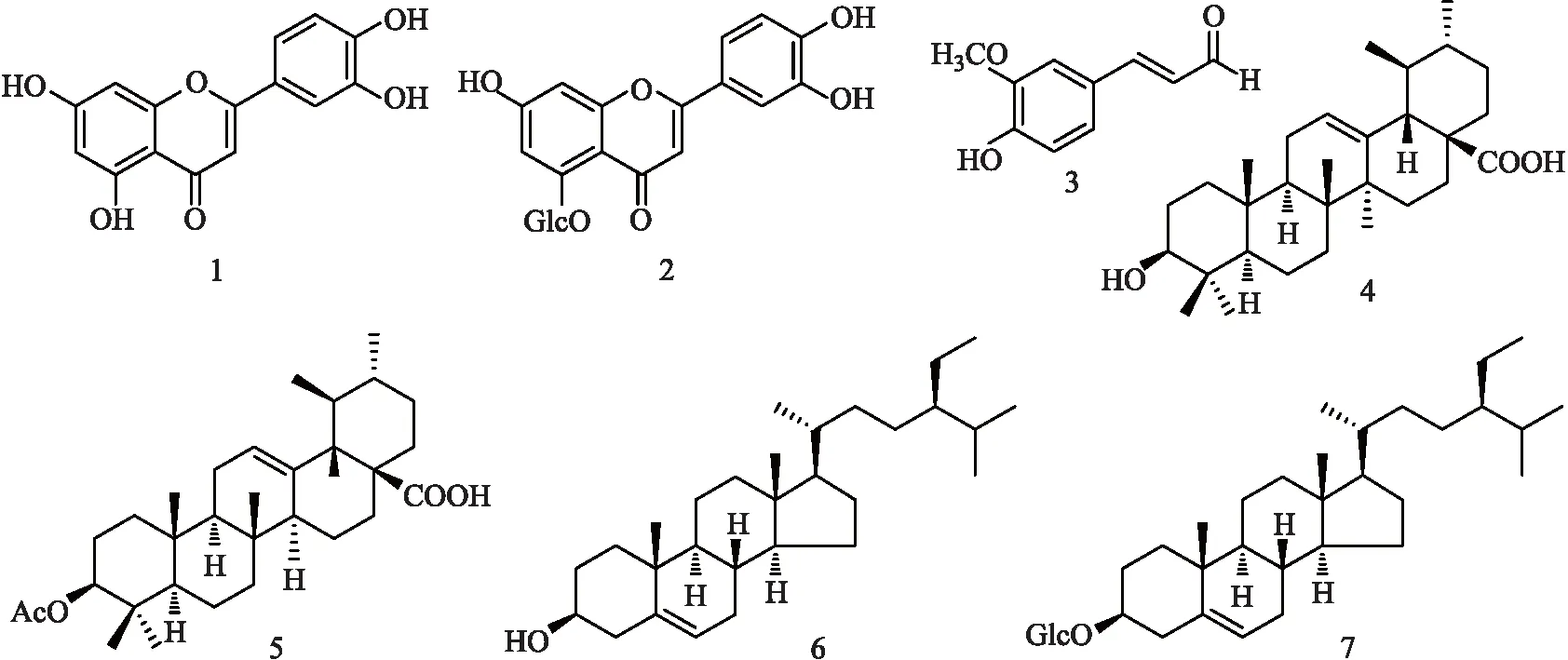
图1 化合物1~7的结构图
1 材料与仪器
1.1 仪器与试剂 Bruker Avance III-400核磁共振波谱仪(德国布鲁克公司),四甲基硅烷(TMS)为内标;RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);AL204电子天平(梅特勒-托利多仪器上海有限公司);柱层析硅胶、薄层层析GF254硅胶板(青岛海洋化工厂);Sephadex LH-20葡聚糖凝胶(瑞典Amersham Biosciences公司);反相硅胶RP-18(日本Fuji公司);D-101型大孔吸附树脂(天津波鸿树脂科技有限公司);石油醚、氯仿、乙酸乙酯、丙酮、甲醇等有机试剂均为工业级溶剂,重蒸后使用。
1.2 植物样品 植物样品于2016年3月采自云南大理市南郊,由大理大学张德全博士鉴定为忍冬科鬼吹箫属植物鬼吹箫(LeycesteriaformosaWall.)。植物标本(编号:20140504-3)保存于云南省滇西抗病原植物资源筛选研究重点实验室。
1.3 实验动物 昆明种小鼠,SPF级,体质量18~22 g,雌雄各半(湖南斯莱克景达实验动物有限公司)。动物饲养于IVC中,标准环境:温度(20±1)℃,相对湿度(60±5)%,标准颗粒饲料喂养。
2 提取与分离
鬼吹箫植物地上部分(3.4 kg)粉碎后按1∶8(w:V)加入95%乙醇,回流提取3次,每次90 min,合并滤液减压浓缩后悬浮于适量蒸馏水中,依次用石油醚、乙酸乙酯、正丁醇1∶1(V∶V)进行萃取,回收溶剂后得到鬼吹箫不同极性部位浸膏,其中乙酸乙酯部位35.4 g,正丁醇部位220.0 g。
取乙酸乙酯部位浸膏30.0 g进行硅胶柱层析,以氯仿/甲醇体系进行梯度洗脱(1∶0~0∶1),合并相同馏分后得到14个组分(A~N)。C组分通过硅胶柱层析(氯仿/丙酮50∶1)、Sephadex LH-20(氯仿/甲醇1∶1)纯化得到化合物3(9 mg)和化合物6(15 mg);J组分经硅胶柱层析(氯仿/甲醇40∶1)得到化合物4(2.3 g);G组分先用硅胶柱层析(氯仿/甲醇100∶1),之后经Sephadex LH-20柱层析(氯仿/甲醇1∶1)得到化合物5(8 mg);L组分经过RP-18和Sephadex LH-20(氯仿/甲醇1∶1)柱层析,再结合重结晶方法得到化合物1(15 mg)和化合物7(16 mg)。
取正丁醇部位浸膏100.0 g以适量蒸馏水溶解后用D-101型大孔吸附树脂进行柱层析,以水/甲醇(1∶0-0∶1)进行梯度洗脱,合并相同馏分得到5个组分I-VI,III馏分进行RP-18反相柱层析(水/甲醇1∶1),得化合物2(20 mg)。
3 结构鉴定
化合物1:C15H10O6,黄色粉末。1H-NMR (CD3OD, 400 MHz)δ:7.36-7.38 (2H, overlap, H-2′,6′), 6.89 (1H, d,J=9.0 Hz, H-5′), 6.52 (1H, s, H-3), 6.42 (1H, d,J=2.0 Hz, H-8), 6.19 (1H, d,J=2.0 Hz, H-6);13C-NMR (CD3OD, 100 MHz)δ:165.9 (C-2), 104.9 (C-3), 183.5 (C-4), 162.9 (C-5), 99.8 (C-6), 166.0 (C-7), 94.7 (C-8), 159.1 (C-9), 104.9 (C-10), 120.0 (C-1′), 113.8 (C-2′), 146.7 (C-3′), 150.7 (C-4′), 116.5 (C-5′), 123.3 (C-6′)。以上数据与文献[6]报道的基本一致,故化合物1被确定为木犀草素。
化合物2:C21H20O11,黄色粉末。1H-NMR (C5D5N, 400 MHz)δ:7.91 (1H, d,J=1.9 Hz, H-2′), 7.53 (1H, dd,J=8.4, 1.9 Hz, H-6′), 7.50 (1H, d,J=2.0 Hz, H-6), 7.31 (1H, d,J=8.4 Hz, H-5′), 6.99 (1H, d,J=2.0 Hz, H-8), 6.91 (1H, s, H-3), 5.40 (1H, d,J=7.5 Hz, H-1″), 4.46-4.37 (5H, overlap, H-2″,3″,4″,6″), 4.05 (1H, m, H-5″);13C-NMR (C5D5N, 100 MHz)δ:162.5 (C-2), 106.9 (C-3), 178.3 (C-4), 160.2 (C-5), 105.5 (C-6), 164.3 (C-7), 99.5 (C-8), 159.6 (C-9), 109.6 (C-10), 122.9 (C-1′), 114.4 (C-2′), 147.7 (C-3′), 151.3 (C-4′), 116.8 (C-5′), 119.2 (C-6′), 106.7, (C-1″), 75.4 (C-2″), 77.5 (C-3″), 71.1 (C-4″), 79.3 (C-5″), 62.3 (C-6″)。以上数据与文献[7]报道的基本一致,故化合物2被确定为木犀草素-5-O-β-D-葡萄糖苷。
化合物3:C10H10O3,淡黄色粉末。1H-NMR (CDCl3, 400 MHz)δ:9.65 (1H, d,J=7.8 Hz, H-9), 7.40 (1H, d,J=15.8 Hz, H-7), 7.12 (1H, dd,J=8.2, 1.8 Hz, H-6), 7.06 (1H, d,J=1.8 Hz, H-2), 6.96 (1H, d,J=8.2 Hz, H-5), 6.60 (1H, dd,J=15.8, 7.8 Hz, H-8), 3.96 (3H, s, 3-OCH3);13C-NMR (CDCl3, 100 MHz)δ:126.8 (C-1), 109.5 (C-2), 147.0 (C-3), 149.0 (C-4), 115.0 (C-5), 124.2 (C-6), 153.2 (C-7), 126.6 (C-8), 193.7 (C-9), 56.1 (3-OCH3)。以上数据与文献[8]报道的基本一致,故化合物3被确定为松柏醛。
化合物4:C30H48O3,白色针状结晶(氯仿/甲醇)。在TLC上多种溶剂系统(石油醚/乙酸乙酯、氯仿/丙酮、环己烷/异丙醇)分别展开时,化合物2与乌索酸对照品Rf值及斑点颜色均一致,故化合物4被确定为乌索酸。
化合物5:C32H50O4,白色粉末。1H-NMR (CDCl3, 400 MHz)δ:5.24 (1H, brs, H-12), 4.49 (1H, m, H-3), 2.18 (1H, d,J=11.2 Hz, H-18), 2.04 (3H, s,-OAc), 1.07, 0.95, 0.94, 0.87, 0.86, 0.85, 0.77 (各3H,7×CH3);13C-NMR (CDCl3, 100 MHz)δ:38.3 (C-1), 23.6 (C-2), 81.0 (C-3), 37.7 (C-4), 55.3 (C-5), 18.2 (C-6), 32.8 (C-7), 39.5 (C-8), 47.5 (C-9), 36.9 (C-10), 23.3 (C-11), 125.7 (C-12), 138.0 (C-13), 42.0 (C-14), 28.1 (C-15), 24.1 (C-16), 48.0 (C-17), 52.6 (C-18), 39.0 (C-19), 38.8 (C-20), 30.6 (C-21), 36.7 (C-22), 28.1 (C-23), 16.7 (C-24), 15.5 (C-25), 17.0 (C-26), 23.6 (C-27), 182.8 (C-28), 17.1 (C-29), 21.3 (C-30), 171.1 (-C=O), 21.2 (-CH3)。以上数据与文献[9]报道的基本一致,故化合物5被确定为乙酰熊果酸。
化合物6:C29H50O,白色晶体(丙酮)。在TLC上多种溶剂系统(石油醚/乙酸乙酯、氯仿/甲醇、环己烷/异丙醇)分别展开时,化合物3与β-谷甾醇对照品Rf值及斑点颜色均一致,故化合物6被确定为β-谷甾醇。
化合物7:C35H60O6,白色粉末。1H-NMR (C5D5N, 400 MHz)δ:5.37 (1H, brs, H-6), 4.59 (1H, d,J=10.6 Hz, H-1′), 0.91 (3H, s, CH3), 0.89 (3H, t,J=7.1 Hz, H-21), 0.86 (3H, s, CH3), 0.67 (3H, s, H-18), 3.98-4.46 (7H, overlap, H-3,2′,3′,4′,5′,6′);13C-NMR (C5D5N, 100 MHz)δ:37.3 (C-1), 30.1 (C-2), 77.9 (C-3), 39.1 (C-4), 140.7 (C-5), 121.7 (C-6), 32.0 (C-7), 31.8 (C-8), 50.1 (C-9), 36.2 (C-10), 21.1 (C-11), 39.7 (C-12), 42.3 (C-13), 55.6 (C-14), 24.3 (C-15), 28.3 (C-16), 56.0 (C-17), 12.0 (C-18), 19.0 (C-19), 36.7 (C-20), 18.8 (C-21), 34.0 (C-22), 26.2 (C-23), 45.8 (C-24), 29.3 (C-25), 19.2 (C-26), 19.8 (C-27), 23.2 (C-28), 11.8 (C-29), 102.4 (C-1′), 75.1 (C-2′), 78.4 (C-3′), 71.5 (C-4′), 77.9 (C-5′), 62.6 (C-6′)。以上数据与文献[10]报道的基本一致。同时在TLC上以氯仿/甲醇、环己烷/异丙醇分别展开时,化合物6与胡萝卜苷对照品Rf值及斑点颜色均一致,故化合物7被确定为胡萝卜苷。
4 镇痛活性测试
取昆明种小鼠36只,雌雄各半,随机分为6组,每组6只。其中溶媒对照组灌胃给予含0.5% CMC-Na的生理盐水、阳性对照组灌胃给予吲哚美辛(20 mg/kg),吲哚美辛和待测化合物均以含0.5% CMC-Na的生理盐水混悬。给药60 min后,各组小鼠腹腔注射0.6%冰醋酸溶液,剂量为0.1 mL/10 g。随后记录小鼠在给药后15 min内的扭体次数,镇痛率(%)=(溶媒对照组扭体次数-给药组扭体次数)/溶媒对照组扭体次数×100%。
根据所分离得到的化合物的重量,对化合物1、4、6、7进行了镇痛活性测试。活性试验结果(表1)显示,化合物1、4、6可明显抑制醋酸诱发的小鼠扭体次数,表明化合物1、4、6具有一定的镇痛活性。

表1 鬼吹箫中部分化合物镇痛活性结果
5 讨论
本实验从鬼吹箫地上部分分离得到了7个化合物,其中化合物木犀草素、木犀草素-5-O-β-D-葡萄糖苷、乌索酸、乙酰熊果酸、胡萝卜苷是首次从该植物中分离得到。与之前有关该植物研究中主要分离得到三萜类与环烯醚萜类成分不同[5],本研究得到几个酚性成分(木犀草素、木犀草素-5-O-β-D-葡萄糖苷、松柏醛),考虑到植物样品采集地点与时间存在较大的差异,上述成分是否与这些差异有关需要进一步研究。小鼠体内镇痛实验结果表明,化合物木犀草素、乌索酸、β-谷甾醇能明显抑制醋酸诱发的小鼠扭体次数。文献查阅发现,黄酮和三萜类化合物常具有抗炎镇痛作用[11-13],木犀草素、乌索酸、β-谷甾醇抗炎镇痛作用亦有研究报道[13-15]。综合上述实验和文献调研结果,说明黄酮和三萜类化合物可能均为鬼吹箫镇痛效果的物质基础。本研究进一步证实了白族医、彝族医等将鬼吹箫用于治疗关节痹痛、跌打损伤、瘀血肿痛等病症具有合理性。

