“隧道法”腹腔镜解剖性右半肝切除术19例报告
陈 龙,漆 瞻,张志远,申伟文,张 伟,
(1.西南医科大学临床医学院,四川 泸州,646000;2.简阳市人民医院肝胆胰外科)
1991年第一例腹腔镜肝脏切除术的报道标志着肝脏切除手术开始步入微创领域,距今已过去了三十年,这段时间里,随着手术经验的积累及腔镜器械水平的提升,腹腔镜下肝脏切除术的安全性、可行性已得到大量证实,手术技术也已上升到目前的精准解剖性肝切除阶段[1-2]。然而,腹腔镜下解剖性肝切除术仍具有很大的挑战性,尤其半肝切除这样的大范围切除手术,至今尚无统一的标准术式[3-4]。笔者团队自开展腹腔镜手术以来,积累了大量的手术经验,自2019年开始探索“隧道法”腹腔镜解剖性右半肝切除术,取得了满意效果。本文旨在通过回顾分析2019年1月至2021年10月为19例患者行“隧道法”腹腔镜右半肝切除术的临床资料,探讨其可行性与安全性。
1 资料与方法
1.1 临床资料 回顾分析2019年1月至2021年10月在西南医科大学附属医院简阳市人民医院肝胆外科行“隧道法”腹腔镜解剖性右半肝切除术19例患者的临床资料。纳入标准:(1)术前Child评分为B级及以上;(2)病变局限于右半肝且不影响第一、第二肝门解剖;(3)术前完善相关检查,未发现血管及胆道变异;(4)无明显手术禁忌;(5)无腹部手术史;(6)术前签署知情同意书。19例患者中男11例,女8例,46~77岁,术前Child评分均为A级;本文已通过西南医科大学附属简阳市人民医院伦理委员会讨论。
1.2 手术方法 体位及孔位分布:患者取仰卧分腿位左偏;脐上1 cm做1.5 cm切口,穿刺气腹针建立气腹,压力维持在13 mmHg,置入腹腔镜作为观察孔,脐上5 cm平右腹直肌外缘做1.5 cm切口为主操作孔,脐上3 cm平右腹直肌外缘及右腋前线平脐处做0.5 cm切口为副操作孔,主刀立于患者右侧,第一助手立于患者左侧。分离肝周粘连,切除胆囊,常规预置第一肝门阻断带。分离肝圆韧带、镰状韧带、右三角韧带等肝周韧带,解剖第二肝门,暴露肝中静脉及肝右静脉根部,掏出肝右静脉与肝中静脉之间的腔静脉窝,由头侧向足侧建立肝上隧道。见图1。分离出右肝与右肾上腺之间的间隙,显露下腔静脉,离断下腔静脉前方部分尾状叶肝组织,沿下腔静脉与Laennec膜之间的间隙,逐步由足侧向头侧分离,建立肝下隧道,直至与肝上隧道会师,用红尿管悬吊肝脏。见图2、图3。红尿管悬吊右半肝,游离右肝蒂,直线切割闭合器伸入隧道,第一枪离断右肝蒂,标记缺血线。见图4、图5。切割闭合器继续沿隧道进入,尿管继续提拉肝脏,第二枪离断右肝静脉,继续扩大隧道,于背侧肝中静脉根部的右侧壁分离肝实质,直至显露肝中静脉全程。沿缺血线及肝中静脉组成的断肝平面快速离断肝脏,合成夹及钛夹夹闭所遇血管及胆管。切除后肝断面见图6。用电凝棒、止血纱等处理创面出血,取出标本,留置引流管。

图1 在第二肝门处建立肝上隧道

图2 沿下腔静脉建立肝下隧道
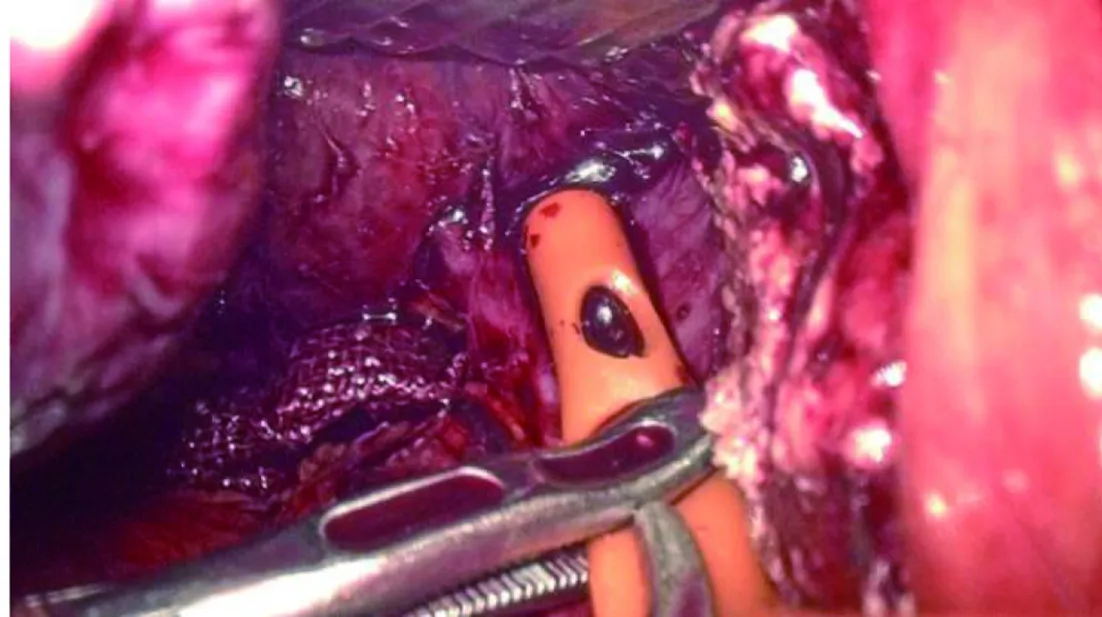
图3 将红尿管穿过隧道
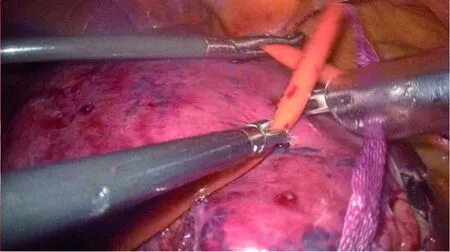
图4 通过红尿管提拉肝脏
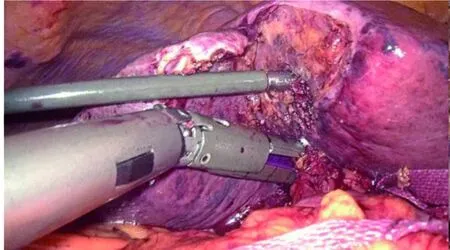
图5 离断右肝蒂,标记缺血线

图6 肝断面
1.3 观察指标 手术时间、出血量、输血量、术后住院时间、术后并发症(主要包括肝功能衰竭、胆漏、出血等)。
2 结 果
19例患者均顺利完成手术,无中转开腹、术中输血,手术时间205~257 min,平均(222.1±16.9)min,术中失血量250~350 mL,平均(305.3±36.9)mL,住院7~11 d,平均(9.4±1.3)d。术后发生肝功能衰竭2例,胆漏1例,并发症发生率为15.8%,均予以保守治疗后好转出院。术后病理诊断:右肝内胆管结石9例,右肝恶性肿瘤7例,肝良性肿瘤3例。
3 讨 论
由于右半肝独特的肝内脉管系统及解剖位置,使得腹腔镜下右半肝切除术的难度更高,学习曲线更加陡峭,这主要表现在右肝显露、出血控制及术后并发症减少等方面,因此目前其依然是具有挑战性的手术,手术方式依然有待标准化、流程化[5-6]。右半肝切除术的关键主要在于手术入路的选择、肝脏血流的控制、断肝平面的确定[7]。
关于手术入路的问题,应根据患者具体解剖情况进行个性化的选择。“前入路”因有助于减少术中失血及肝脏的翻动,进而有助于降低肿瘤传播,目前应用最多,其安全性、可行性也已得到大量证实[8]。近年提出的“尾侧入路”也为腹腔镜右半肝切除术提供了新的思路,其安全性、可行性也得到了一定证实,但应用较少,还需要更多临床实例进一步研究[9-10]。而关于断肝平面,众所周知,两条线确定一个平面,因此断肝平面的确定依赖于我们以哪两条线来确定,不论是前入路还是尾侧入路,在断肝平面的确定上都具有一定的局限性。“前入路”为优先离断入肝血流,标记缺血线,再利用术中超声找到肝中静脉的位置,进而确定切肝平面,尽管目前术中超声在肝脏切除术中的应用已十分常见,但这对于大多基层医院而言还有一段距离,并不利于手术方式的推广;此外,经前入路离断肝实质时具有一定的盲目性,过程中容易损伤肝中静脉,一旦损伤,容易失去切肝的方向。“尾侧入路”则是利用Cantlie线与术中超声寻找肝中静脉来确定切肝平面,其局限性与“前入路”类似。近年,随着吲哚菁绿的研究越来越深入,其在腹腔镜手术中的应用也越来越多,截至目前,已有大量用于确定断肝平面的报道,其有效性、安全性也得到证实,但由于患者个体化的差异,使得吲哚菁绿的显影效果不尽相同,其荧光染色程度也受诸多因素影响,因此在推广上还需进一步研究[11-13]。
笔者团队自开展腹腔镜手术以来,积累了大量的手术经验,针对腹腔镜右半肝切除所采用的“隧道法”能较好地弥补以上不足。1802年Laennec膜被首次发现,经过大量的研究证实其存在,并发现因为Laennec膜的存在,使得肝脏与周围组织、肝脏的脉管系统之间均存在一定的天然间隙[14-15],这也是我们“隧道”建立的解剖学依据。其实早在2001年,Belghiti就曾提出利用Laennec膜建立“隧道”,从而起到肝脏的提拉及显露[16],截至目前,大量的外科医生将其应用于肝脏切除术中,并且优化了手术流程,再一次证明“隧道”建立的可行性及安全性[17-18]。我们所采取的“隧道法”是利用这些天然间隙,分别建立肝上肝下隧道,优先离断出入肝血流,确定断肝平面,进而快速离断肝脏。此方法的优点在于:(1)利用腹腔镜的放大特点,直视下建立肝上肝下隧道,减少盲目性与出血风险。(2)隧道成功建立后,有两个好处,首先是利用尿管穿通,进行肝脏的提拉,充分暴露手术视野;其次利用直线切割闭合器快速离断右肝蒂及肝右静脉,从背侧较快显露肝中静脉全程;(3)以缺血线与肝中静脉确定断肝平面,使得断肝时速度更快、精度更高,符合当前精准肝切除的趋势,并且不必借助术中超声的引导,利于推广应用。
笔者体会,此方法的关键在于隧道的安全建立,在此操作过程中我们的经验是:(1)建立隧道时优先建立肝上隧道,再建立肝下隧道,再由肝下隧道逐步向上与肝上隧道贯通,这样建立隧道的操作基本都在直视下完成,避免了盲目性操作引起的出血。(2)由于肝下隧道是沿下腔静脉前壁建立的,因此在隧道的建立过程中可能遇到部分肝短静脉分支;小分支尽量直接用超声刀离断,避免上止血夹从而压缩隧道空间;较大的分支可用钛夹夹闭离断。(3)建立隧道时尽量钝性分离,因为间隙是天然存在的,钝性分离效果可观,并且可有效避免部分肝短静脉损伤出血。(4)对于巨大肿瘤或肿瘤位置影响隧道建立的患者,建立隧道困难较大,且容易失败,因此充分的术前评估格外重要。(5)建立隧道困难时,为确保手术安全应及时改为前入路或经肝实质入路断肝。
切除过程中我们认为:(1)用直线切割闭合器进行第一枪离断右肝蒂时,首先夹闭右肝蒂,然后观察肝脏缺血范围是否有误,避免鲁莽切断,造成左肝血供受损。(2)用直线切割闭合器进行第二枪离断肝右静脉时需注意,第二肝门处应看到直线切割闭合器的头端,确保肝右静脉能完整离断,也确保未夹住膈肌等其他重要组织。(3)中心静脉压的控制在断肝过程中至关重要,相关资料显示,低中心静脉压能显著减少失血量、输血量及输血例数,并对术后肝功能、肾功能、并发症等无明显影响[19],因此断肝过程中中心静脉压应尽量保持相对低值。
综上所述,笔者团队施行的腹腔镜下隧道法解剖性右半肝切除术安全、有效,并在一定程度上为患者预后提供了更加有力的保障,为腹腔镜下解剖性右半肝切除提供了新的思路,也为标准化术式提供了一种可能,但病例数仍较少,需要大量研究进一步证实。

