河流型水牛LPL基因在不同组织及泌乳期的表达水平分析
梁莎莎,庞春英,邓廷贤,陆杏蓉,段安琴,马小娅,梁贤威
(中国农业科学院广西水牛研究所/农业农村部(广西)水牛遗传繁育重点实验室,南宁 530001)
水牛奶乳汁浓厚,营养丰富,具有较高的乳脂肪(8.0%)、乳蛋白(4.5%)和不饱和脂肪酸比例,以及较低水平的磷脂和胆固醇[1],有“奶中之王”之称。牛奶脂肪主要由甘油三酯(超过95%)组成,其脂肪酸(FA)可源于瘤胃发酵的碳水化合物,或通过脂蛋白脂肪酶的作用直接来源于血浆[2]。脂蛋白分解酶(lipoprotein lipase,LPL),全称为三脂酰甘油蛋白脂酰基水解酶,又称为脂蛋白脂肪酶或脂蛋白酯酶[3],于20世纪40年代被Hahn等[4]在开展犬体内脂肪吸收实验中发现,是由机体肝外组织的心肌细胞、脂肪细胞和骨骼细胞以及乳腺细胞等实质性细胞合成和分泌的一种糖蛋白[5]。脂蛋白脂肪酶(LPL)是脂质代谢的关键酶,在脂肪组织和牛奶的脂肪组成中发挥着重要作用[5]。LPL还能在细胞表面受体与脂蛋白间起到一种桥梁作用,因为它能同时结合细胞表面的特异性蛋白与脂蛋白,这将有利于细胞对脂蛋白的吸收[6]。LPL基因在动物的多个组织和器官中均有表达,广泛分布于心脏、骨骼、脂肪以及泌乳期乳腺等组织中[7,8]。Casciano等[9]发现LPL有助于在表达MYC致癌水平的人类乳腺上皮细胞中促进脂肪酸氧化。Chen等[10]发现LPL具有较强的细胞摄取能力、较强的细胞活力抑制作用、较强的抗肿瘤作用和明显的细胞凋亡诱导能力,可作为转移性乳腺癌治疗的潜在应用。Wang等[11]发现LPL的表达量与单不饱和脂肪酸具有正相关性,而与饱和脂肪酸具有负相关性。Zhao等[12]发现与干奶期相比,山羊的LPL mRNA表达量在泌乳初期显著增加。大量研究表明,LPL基因对哺乳动物的乳房相关疾病、泌乳性能等方面起重要作用。然而目前关于水牛LPL基因的研究较少,本文通过对水牛LPL基因编码序列进行克隆及生物信息学分析,并检测该基因在水牛不同组织和不同泌乳时期乳腺组织中的转录水平,以期为今后深入挖掘水牛LPL基因功能提供基础。
1 材料
1.1 试验组织样品
试验水牛乳腺及其他组织cDNA来自广西水牛研究所。不同组织表达分析使用的样本品种为尼里水牛,月龄约为48个月,其中泌乳时期的3头;不同泌乳时期表达分析使用的乳腺组织样本,品种为摩拉水牛,月龄约为72个月,泌乳时期分别为产犊后第7天(D7)、50天(D50)、140天(D140)和280天(D280),每个泌乳时期各3头。所有样本均保存于-80℃。
1.2 主要试剂
反转录试剂盒购于Thermo公司;普通琼脂糖凝胶回收试剂盒购自OMEGA公司;PowerUp SYBR Green Master Mix购自Life公司;pMD18-T载体、Premix Taq酶均购自TaKaRa公司。
1.3 主要仪器
NanoDrop2000紫外分光光度计(Gene,USA),Biometra Tprofessional多功能快速梯度PCR仪(Biometra,GRE)和Roche Lightcycler 480实时荧光定量PCR仪。
2 方法
2.1 水牛LPL基因克隆及引物设计
使用NanoDrop 2000紫外分光光度计和1.0%的琼脂糖凝胶对cDNA样本进行质控。质控后的基因组cDNA样本稀释至30~40ng/μL。以GenBank中黄牛LPL基因序列(GenBank登录号:NM_001075120.1)为模板,使用Primer3.0在线软件设计引物,克隆引物序列为F:5’-ATGGAGAGCAAGGCCCTACTTC-3’,R:5’-TCAGCCAGACTTTCTATTCAGGG-3’;qPCR引物序列为F:5’-GACACTTGCCACCTCATTCC-3’,R:5’-GTCCGGTTCCCTCTTGTACA-3’,均由华大基因合成。
2.2 PCR扩增与克隆测序
PCR反应体系(50μL):DNA模板1μL,Premix Taq 25μL,上、下游引物各2μL,ddH2O 20μL;PCR反应程序:94℃预变性3min,94℃变性30s,60℃退火30s,72℃延伸30s,35个循环,72℃延伸8min。取50μL PCR产物进行1.0%琼脂糖凝胶电泳检测,对目的片段进行胶回收,胶回收产物与pMD18-T载体连接6h后,直接转化大肠杆菌DH5α感受态细胞,经筛选挑菌培养后,委托华大基因进行测序,测序结果经比对拼接后,获得水牛LPL完整CDS序列。
2.3 水牛LPL基因的组织表达分析
将水牛的乳腺、心、输卵管、肺、脾、肾、卵巢、大肠、淋巴、子宫、胃、肝、大脑和垂体共14种组织的cDNA稀释至30~40ng/μL,使用实时荧光定量PCR检测LPL以及GAPDH的基因的表达。反应体系(20μL):PowerUp SYBR Green Master Mix 10μL,Rnase water 8μL,上、下游引物各0.5μL,cDNA 1μL;反应条件:95℃ 30s,95℃ 5s,60℃ 30s,40个循环。
2.4 水牛LPL基因的不同泌乳时期乳腺表达分析
将水牛不同泌乳时期乳腺组织的cDNA稀释至30~40ng/μL,使用实时荧光定量PCR检测LPL以及GAPDH的基因的表达。反应体系(20μL):PowerUp SYBR Green Master Mix 10μL,Rnase water 8μL,上下游引物各0.5μL,cDNA 1μL;反应条件:95℃ 30s,95℃ 5s,60℃ 30s,40个循环。
2.5 数据分析
使用PSORT Ⅱ Prediction在线网站(https://psort.hgc.jp/form2.html)进行蛋白质亚细胞定位预测;使用SignalP 5.1在线软件进行信号肽分析;使用TMHMM在线软件(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构预测;使用SPSS 16.0对组织和泌乳期乳腺表达结果作单因素方差分析并使用GraphPad Prism 7软件作表达量对比图。
3 结果与分析
3.1 水牛LPL基因CDS序列的克隆
PCR扩增产物经1%琼脂糖凝胶电泳检测,出现了1个单一DNA条带,片段大小为1 437bp,与预测的片段大小一致(图1)。将扩增出来的PCR产物送公司测序拼接后,获得了水牛LPL基因完整的CDS序列,该序列长为1 437bp,可编码478个氨基酸残基。
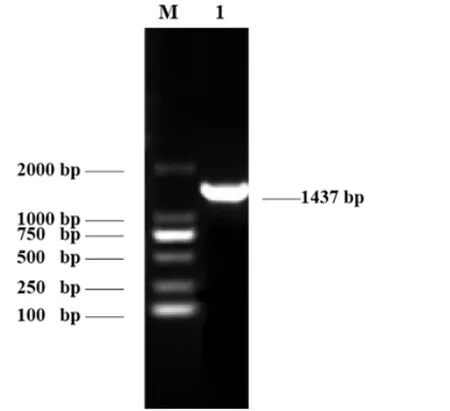
图1 水牛LPL基因PCR产物1%凝胶电泳图
3.2 水牛LPL亚细胞定位预测
使用PSORT Ⅱ Prediction在线软件预测水牛LPL亚细胞定位结果表明:定位于细胞外(包括细胞壁)、线粒体、内质网和空泡的比例分别为55.6%、22.2%、11.1%和11.1%,说明水牛LPL主要分布于细胞外。
3.3 水牛LPL信号肽及跨膜结构预测
运用SignalP 5.1和TMHMM在线软件对水牛LPL蛋白进行信号肽和跨膜结构分析(图2、图3)。信号肽分析结果显示,该蛋白的信号肽的切割位点位于SRGGL之间,概率为0.4029;跨膜结构分析显示,该蛋白不存在跨膜域,故此蛋白不属于跨膜蛋白,可能属于分泌蛋白。

图2 水牛LPL基因编码蛋白信号肽预测

图3 水牛LPL蛋白跨膜结构预测结果
3.4 水牛LPL基因的组织表达分析
使用SPSS 16.0对组织表达结果作单因素方差分析,选择Duncan' s法进行各组织间的多重比较,运用GraphPad Prism 7软件对qPCR结果作表达量对比图。结果显示,LPL在水牛乳腺、心和输卵管组织的相对表达量极显著高于其他组织器官(P<0.01),其中在乳腺的相对表达量最高,其他组织的表达量从高到低依次为心、输卵管、肺、脾、肾、卵巢、大肠、淋巴、子宫、胃、肝、大脑和垂体(图4)。

图4 LPL基因在不同组织中的表达
3.5 水牛LPL基因的不同泌乳时期表达分析
使用SPSS16.0对乳腺组织表达结果作单因素方差分析,选择Duncan's法进行各个泌乳时期的多重比较,运用GraphPad Prism 7软件对qPCR结果作表达量对比图。结果显示,LPL在水牛泌乳盛期和泌乳中期的乳腺组织中表达量极显著高于泌乳早期和泌乳后期(P<0.01),其中在泌乳盛期最高(图5)。
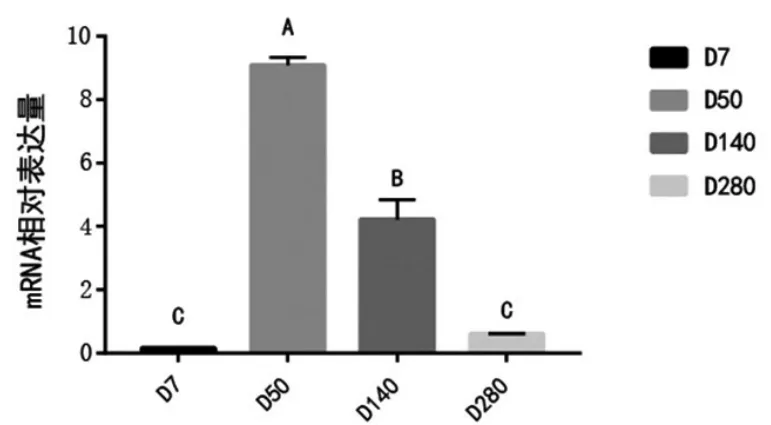
图5 LPL基因在不同泌乳期中乳腺组织的表达
4 讨论
许多组织依赖血浆甘油三酯(TG)作为脂肪酸后续氧化或储存的重要来源。血浆TG被包装成富含TG的脂蛋白和极低密度脂蛋白(VLDL),它们分别来自饮食或在肝脏中合成的TG。血浆TG的利用依赖于脂蛋白脂酶(LPL),它附着在毛细血管内皮上,催化TG的水解使其分裂为脂肪酸,因此LPL最初被称为清除因子脂肪酶[13]。LPL调节循环TG的水解以及大多数组织(包括乳腺和脂肪组织)对脂肪酸的吸收,对乳汁中长链脂肪酸的摄取和分泌以及哺乳幼崽对高脂饲粮的吸收至关重要。LPL普遍缺失的小鼠在出生时的血浆TG水平明显升高,并且由于无法处理乳汁脂质而在24h内死亡[14]。在哺乳期的雌性中,LPL的表达似乎受到调节,在脂肪组织中的表达水平显著降低,而在乳 腺中的表达水平很高[15]。本试验同样发现,LPL基因在泌乳期水牛的乳腺组织中相对表达量极显著高于其他组织器官(P<0.01)。分泌性乳腺上皮细胞和位于乳房腺泡邻近结缔组织中的间质细胞,都可能代表了脂质耗尽的乳腺脂肪细胞的退化,都被认为是哺乳期乳腺中LPL的来源[16]。LPL活性在泌乳乳腺中增加,获取循环TG加入乳脂。在人类妊娠期间,乳汁合成速率非常慢,随着乳脂合成的开始,产后乳汁中的LPL立即增加。随着逐渐断奶乳汁分泌的减少,乳汁中LPL活性显著降低[17]。诸多因素影响水牛泌乳量及乳成分,其中泌乳期显著影响水牛乳的干物质、非脂乳固体、脂肪、蛋白、乳糖以及酪蛋白含量[18]。本试验中泌乳期表达分析则发现,LPL在泌乳盛期的表达量极显著高于其他泌乳时期(P<0.01),结合生物信息学分析发现该蛋白属于分泌蛋白且主要分布在细胞外,推测LPL可能在乳腺上皮细胞内合成后分泌到细胞外,催化甘油三酯的水解,从而影响乳汁中的脂肪沉积,且在奶水牛泌乳盛期可能起重要作用。
5 结论
本试验运用PCR扩增技术与TA克隆技术成功克隆了水牛LPL基因的CDS序列,CDS序列长为1 437bp,编码478个氨基酸。生物信息学分析表明,该蛋白主要分布在细胞外,属于分泌蛋白。组织表达分析结果显示LPL在水牛乳腺组织中的表达量最高。泌乳期表达分析结果显示LPL在水牛泌乳盛期的乳腺组织中表达量最高。此次对水牛LPL基因的组织表达和泌乳期表达分析为日后进一步探讨水牛及其他物种LPL基因的功能提供了理论基础。

