烟叶中β-胡萝卜素高效降解菌株的筛选鉴定及发酵条件优化
龙章德,王敏,薛云,孙建生,刘启斌,刘鸿,毛多斌,魏涛
1.广西中烟有限责任公司 技术中心,广西 南宁 530001;2.郑州轻工业大学 食品与生物工程学院,河南 郑州 450001
0 引言
类胡萝卜素是存在于植物和微生物中的亲脂性异戊二烯类色素,已知有700多种,主要包括β-胡萝卜素、α-胡萝卜素、叶黄素、番茄红素等,其中β-胡萝卜素分布最广[1-3]。β-胡萝卜素因含有3~15个共轭双键而表现出高度不饱和性,通过酶或光氧化可降解产生C-13、C-11、C-10、C-9等衍生物,这些衍生物中包括α-紫罗兰酮、β-紫罗兰酮、二氢猕猴桃内酯等重要的香料物质,因此β-胡萝卜素及其降解产物在食品、化妆品、酒类风味发酵、烟草加工等行业均具有广泛应用[4-5]。β-胡萝卜素裂解产物β-紫罗兰酮和β-大马酮是西红柿的主要风味成分[6];β-胡萝卜素降解形成的类异戊二烯的 C-10化合物组分对柑橘果汁的香气影响很大[7];葡萄酒主要香气成分异戊二烯衍生物(如β-突厥烯酮、β-紫罗兰酮等)也是β-胡萝卜素降解产物[8]。新鲜烟叶中的类胡萝卜素种类除上文提及的外,还具有新叶黄素、紫黄素、八氢番茄红素等,类胡萝卜素总含量不高,一般为0.1%~1.1%,将β-胡萝卜素添加到烟丝中能有效提高卷烟香味品质[9-10]。
目前β-胡萝卜素的降解方式有物理降解、化学降解和生物降解[11-12]。物理降解需要进行高温处理,不便应用于实际生产;化学降解需要加入化学试剂催化裂解,化学试剂难以去除,且产生的废液会污染环境[4-5]。生物降解是利用微生物及其所产生的酶催化降解β-胡萝卜素,具有降解专一性强、效率高、反应条件温和等特点,但是目前已报道的能降解β-胡萝卜素的微生物还比较少,主要是酵母菌、芽孢杆菌和巴氏葡萄球菌等,能应用到工业生产中的菌株更少[13-15]。
豫烟13是近年来培育的烤烟纯系新品种,烤后原烟颜色均匀、结构疏松、油分较足、化学成分协调,在我国黄淮烟区和东北部分烟区种植较为广泛。本研究拟从豫烟13烟叶中筛选能够降解β-胡萝卜素的新型微生物菌种,通过单因素试验和正交试验对其发酵条件进行优化以提高菌株降解β-胡萝卜素的能力,以期为工业化降解β-胡萝卜素提供新的菌种资源和理论参考。
1 材料与方法
1.1 材料与仪器
实验材料:三门峡烟区种植的新鲜豫烟13烟叶,自行采集得到。
主要试剂:β-胡萝卜素(纯度96%),购于上海麦克林生化科技有限公司;蔗糖、酵母粉、磷酸氢二钾、硝酸钠,均为分析纯,购于国药集团有限公司。
富集培养基[14]:K2HPO41 g/L,MgSO4·7H2O 0.5 g/L,硝酸钠 3 g/L,KCl 0.5 g/L,FeSO4·7H2O 0.01 g/L,蔗糖30 g/L,酵母粉3 g/L。
发酵培养基和分离培养基:在富集培养基的基础上添加质量浓度为20 mg/L的β-胡萝卜素。
主要仪器:SW-CJ-IF型单人双面净化工作台,苏州净化设备有限公司产;LDZX-50KBS 型立体压力蒸汽灭菌器,上海申安医疗器械厂产;UV-1500紫外分光光度计,上海美析仪器有限公司产;5810R型离心机,德国Eppendorf公司产;7890C型GC-MS色谱联用仪,美国Agilent公司。
1.2 实验方法
1.2.1 菌株筛选初筛:称取10 g烟叶于100 mL无菌水中浸泡24 h,取2 mL加入到富集培养基中,于30 ℃、150 r/min条件下培养得到菌源液。对菌源液进行稀释涂布,每个浓度梯度涂布3个平行平板,以添加β-胡萝卜素空白平板为对照,置于30 ℃条件下培养,每隔12 h观察平板褪色情况,挑选透明圈明显的、形态较好的单菌落,反复划线分离纯化。
复筛:挑选出透明圈明显的单菌落接种于发酵培养基中,于30 ℃、150 r/min条件下发酵。通过对发酵液中β-胡萝卜素降解率和降解产物的分析筛选出降解β-胡萝卜素能力较强的菌株。
β-胡萝卜素降解率的测定方法:β-胡萝卜素降解率的测定采用分光光度法。以接种的发酵培养基作为实验组,未接种的发酵培养基作为对照组,发酵12 h后分别以培养基作为空白测定实验组和对照组的吸光度,降解率(R)计算公式[17]如下。
式中:C实验为实验组中β-胡萝卜素的质量浓度/(μg·mL-1);C对照为对照组中β-胡萝卜素的质量浓度/(μg·mL-1)。
β-胡萝卜素降解产物检测方法:用GC-MS对发酵液中的β-胡萝卜素降解产物进行检测。GC检测条件[16]为HP-5柱(30 m×0.25 mm×0.25 μm);高纯氦气作载气,流速为1 mL/min;程序升温:40 ℃,保持2.5 min,以2 ℃/min 的升温速度升至280 ℃并保持5 min;进样量为1 μL;不分流;采用全扫描模式。MS检测条件为溶剂延迟时间8 min;质量扫描范围30~500 amu;进样口温度250 ℃;传输线温度280 ℃;离子源EI温度230 ℃,电离能70 eV;检测器温度280 ℃;全离子扫描(Scan)模式。
1.2.2 菌株鉴定将筛选出的菌株用结晶紫染色2分钟,分别在低倍镜、高倍镜和油镜下观察菌株菌落特征与形态。然后利用16S rDNA鉴定方法进行分子生物学鉴定。提取细菌核基因组DNA,并以提取的DNA为模板,进行16S rDNA扩增,所用引物为27F(正向引物:5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(反向引物:5′-TACGGCTACCTTGTTACGACTT-3′)。聚合酶链式反应(polymerase chain reaction,PCR)扩增反应体系为:1.0 μL基因组DNA(20 ng/μL)、39.0 μL ddH2O、5.0 μL 10×Buffer(含2.5 mmol/L Mg2+),1.0 μL Taq 聚合酶(5 U/μL),1.0 μL dNTP(10 mmol/L),1.5 μL 27F引物(10 μmol/L),1.5 μL 1492R引物(10 μmol/L)。测序由上海派森诺生物科技有限公司完成。用NCBI Blast程序将拼接后的序列文件与NCBI 16S数据库中的数据进行比对,得到与待测菌株序列相似性最大的物种信息,以16S rDNA同源性为基础,利用MEGA7.0软件进行系统分析。
1.2.3 菌株发酵条件优化单因素试验:在前期实验的基础上,分别以碳源(蔗糖、麦芽糖、果糖、乳糖、葡萄糖)、碳源质量浓度(10 g/L、30 g/L、50 g/L、70 g/L、90 g/L)、氮源(胰蛋白胨、硝酸钠、(NH4)2SO4、尿素)、氮源质量浓度(1 g/L、3 g/L、5 g/L、7 g/L、9 g/L)、酵母粉质量浓度(1 g/L、3 g/L、5 g/L、7 g/L、9 g/L)、初始pH值(5.0、6.0、7.0、8.0、9.0)、温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)、接种量(1%、3%、5%、7%、9%)为考查因素,研究单因素试验条件下β-胡萝卜素的降解率。
正交试验:在单因素试验的基础上,以β-胡萝卜素降解率为考查指标,利用发酵培养基中适宜碳源的质量浓度(A)、适宜氮源的质量浓度(B)、酵母粉质量浓度(C)和初始pH值(D)4个因素设计L9(34)正交试验。
数据处理:采用Excel 2016对实验数据进行统计分析,利用SPSS 17.0进行显著性差异分析。
2 结果与分析
2.1 菌株筛选结果
从烟叶中筛选到9株能降解β-胡萝卜素的菌株,其中菌株YT-3降解能力最强,β-胡萝卜素降解率为81.65%(如图1所示)。用GC-MS检测菌株YT-3发酵液,分析出发酵液中含有醛类、酮类、醇类、烯烃类、有机酸和酯类等多种化合物,β-胡萝卜素降解产物主要香味物质如表1所示,其中β-环柠檬醛(3.21%)、β-紫罗兰酮(5.35%)和二氢猕猴桃内酯(12.26%)在改善烟叶品质和制备食品香料方面具有重要作用。因此,进一步对菌株YT-3的β-胡萝卜素降解能力进行研究。

表1 菌株YT-3降解产物主要香味物质
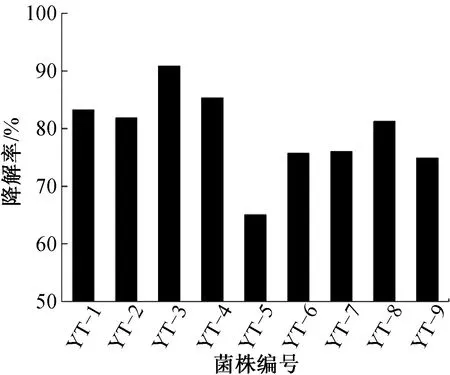
图1 9株降解β-胡萝卜素菌株降解率比较
2.2 菌株鉴定结果
2.2.1 菌株YT-3的菌落特征与形态在固体培养基上划线培养菌株YT-3,其形态特征为菌落较小,色白,表面光滑,湿润,边缘整齐,不易挑起。经革兰氏染色在显微镜下观察,菌体形态为短杆状,菌体呈红色,是革兰氏阴性(G-)菌(如图2所示)。

图2 菌株YT-3的菌落和细胞形态
2.2.2 菌株YT-3分子进化树分析结果由分子鉴定结果可知,菌株YT-3的16S rDNA序列长度为1421 bp(如图3所示,图中1—3为16S rDNA,Maker为DNA分子量标准)。将该16S rDNA序列在NCBI Blast同源序列检索,结果表明,该菌株与霍氏肠杆菌亚种16S rDNA基因序列同源性较高。菌株YT-3系统进化树如图4所示。由图4可知,菌株YT-3与Enterobacterhormaecheisubsp.xiangfangensisstrain 10-17遗传距离较近,结合形态学结果,将YT-3菌株鉴定为霍氏肠杆菌亚种。目前,霍氏肠杆菌EnterobacterhormaecheiA20已被发现可以有效将叶黄素降解为8-甲基-α-紫罗酮、3-羟基-α-紫罗酮、3-氧代-α-紫罗兰酮等[18-19]。菌株YT-3是发现的另一株能够类降解胡萝卜素物质(β-胡萝卜素)的霍氏肠杆菌亚种。

图3 菌株YT-3 PCR扩增电泳图
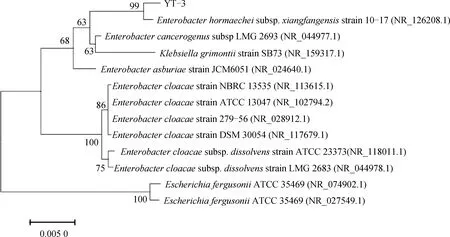
图4 菌株YT-3系统进化树
2.3 菌株发酵条件优化结果
2.3.1 单因素试验结果碳源种类和质量浓度对菌株YT-3的β-胡萝卜素降解率和细胞干重的影响如图5所示。由图5可知,菌株YT-3在不同碳源下降解β-胡萝卜素的活性为蔗糖>麦芽糖>葡萄糖>乳糖>果糖,以蔗糖为碳源β-胡萝卜素降解率最高,达到82.5%,菌株的细胞干重为1.18 g/L。蔗糖是一种非还原性的双糖,既能为菌株的生长提供足够碳源和能源物质,又能保证菌株YT-3高效降解β-胡萝卜素底物。当蔗糖质量浓度为30 g/L时,β-胡萝卜素降解率达到82.90%,菌株能正常繁殖生长且完全降解底物。因此,初步选择30 g/L蔗糖作为发酵培养基的碳源。
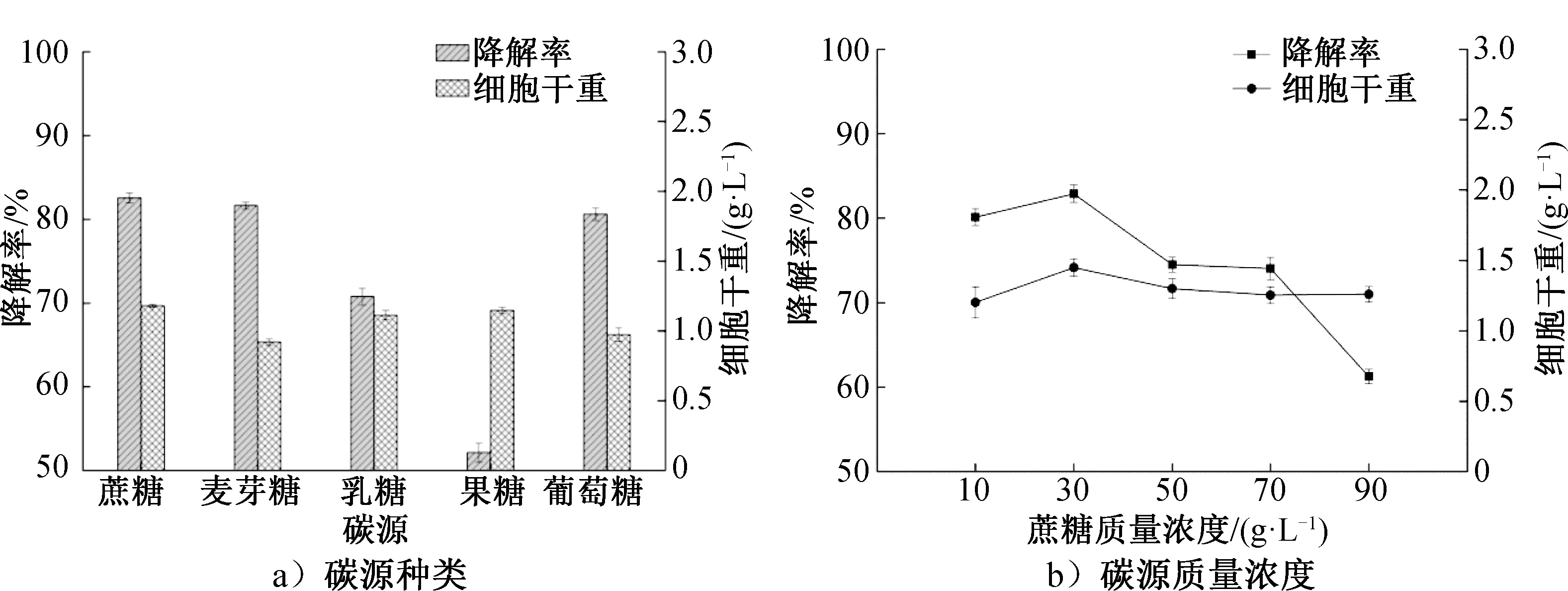
图5 碳源对菌株YT-3的β-胡萝卜素降解率和细胞干重的影响
氮源种类和质量浓度对菌株YT-3的β-胡萝卜素降解率和细胞干重的影响如图6所示。由图6可知,以硝酸钠为氮源时,菌株YT-3对β-胡萝卜素的降解能力最大,降解率为84.9%。硝酸钠质量浓度为3 g/L时,降解率最高为87.7%,菌株的细胞干重为1.66 g/L。氮源质量浓度过高,会使菌体生长过于旺盛,pH值偏高,不利于代谢相关酶的产生和活力保持。因此,初步选择3 g/L硝酸钠作为发酵培养基的氮源。
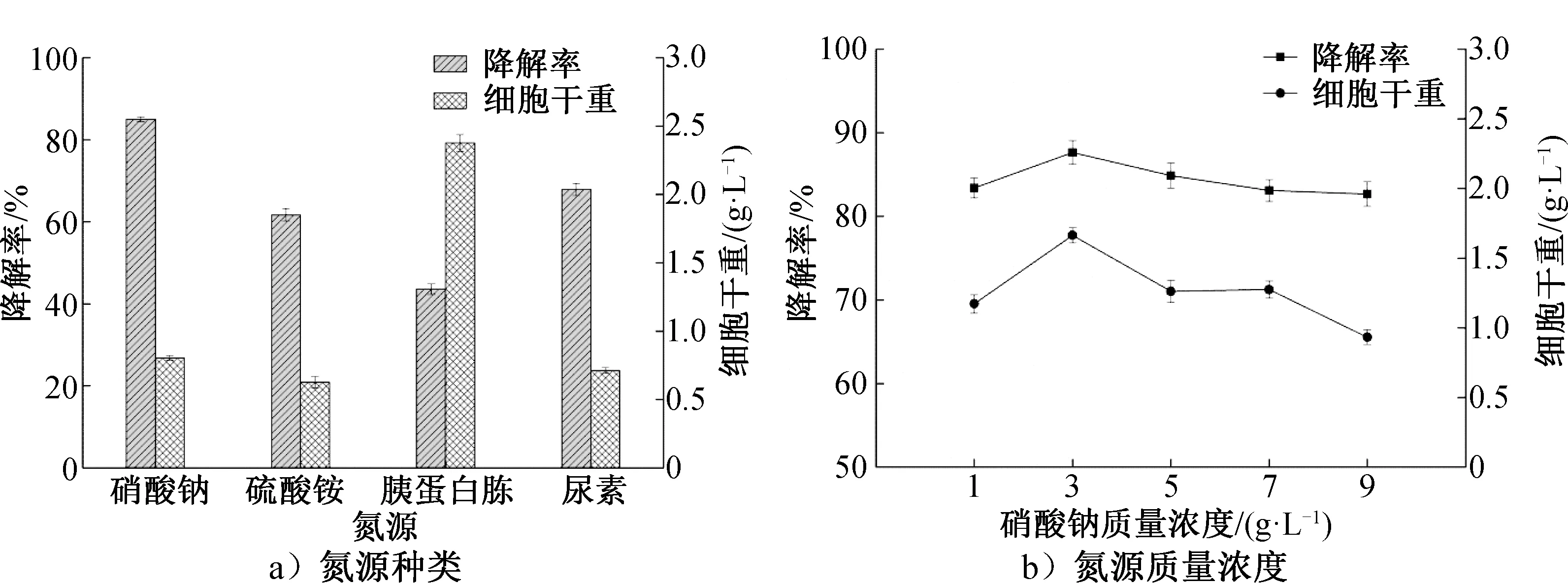
图6 氮源对菌株YT-3的β-胡萝卜素降解率和细胞干重的影响
酵母粉质量浓度、初始pH值、培养温度和接种量对β-胡萝卜素降解率和菌株细胞干重的影响如图7所示。由图7a)可知,酵母粉质量浓度对β-胡萝卜素降解率影响较大。当酵母粉质量浓度为3 g/L时,既能保证菌株YT-3快速生长,又能提高β-胡萝卜素降解率,降解率最大达到88.3%;当酵母粉质量浓度为9 g/L时,菌株生长状况最好,但是对β-胡萝卜素的降解能力最低。因此,初步选择酵母粉浓度为3 g/L。由图7b)可知,在初始pH值<7.0时,随着pH值增大,β-胡萝卜素降解率随之增大;pH值>7.0时,降解率逐渐降低;pH值为7.0时,降解率达到最高,为89.1%,菌株的细胞干重也最高,为1.33 g/L。因此,初步选择发酵初始pH值为7.0。由图7c)可知,培养温度小于30 ℃时,随着温度升高,菌株新陈代谢加快,降解率提高;温度为30 ℃时,降解率最大,为89.6%,菌株的细胞干重较高,为1.20 g/L;温度大于30 ℃时,菌株生长繁殖受到一定影响,降解率呈下降趋势,但在30~40 ℃时,降解率增大,可能是因为β-胡萝卜素受高温影响发生热裂解[5-6]。因此,温度过高或过低都不利于β-胡萝卜素降解。可见,选择最适培养温度为30 ℃。由图7 d)可知,接种量小于5%时,培养基中的营养物质得到有效利用,菌株能够良好生长,降解率随接种量增加而提高;接种量为5%时,降解率达到最大为89.9%,菌株的细胞干重亦达到较高值,为1.39 g/L;接种量大于5%时,降解率降低,可能是因为接种量过大导致发酵液供氧不足,造成菌株产酶下降[20]。因此,选择最适接种量为5%。
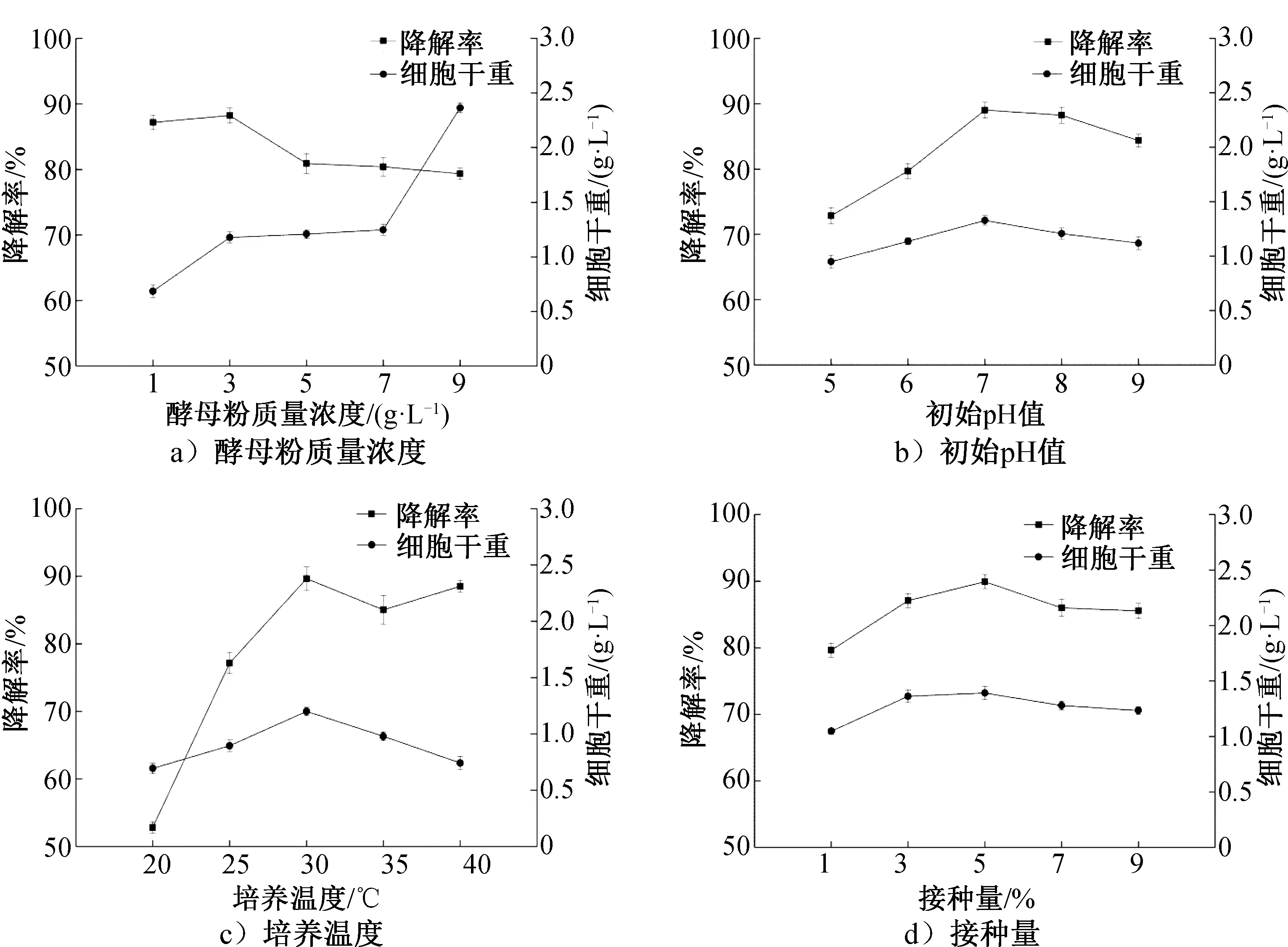
图7 酵母粉质量浓度、初始pH值、培养温度和接种量对菌株YT-3的β-胡萝卜素降解率和细胞干重的影响
2.3.2 正交试验结果在单因素试验的基础上,以发酵培养基中蔗糖质量浓度(A)、硝酸钠质量浓度(B)、酵母粉质量浓度(C)和初始pH值(D)4个因素设计正交试验,因素水平见表2。菌株YT-3降解β-胡萝卜素发酵条件优化正交试验结果见表3,方差分析见表4。由表3可知,极差R的大小依次为A>B>D>C,这说明各因素对降解的影响顺序是蔗糖质量浓度>硝酸钠质量浓度>初始pH值>酵母粉质量浓度。由表4可知,蔗糖质量浓度、硝酸钠质量浓度、初始pH值对β-胡萝卜素降解率均有极显著影响。由所得数据预测最优发酵条件为A2B3C2D2,即蔗糖质量浓度为30 g/L,硝酸钠质量浓度为4 g/L,酵母粉质量浓度为3 g/L,初始pH值为7.0。在该条件下进行验证实验,β-胡萝卜素降解率为97.05%。

表2 β-胡萝卜素降解条件优化正交试验因素水平表
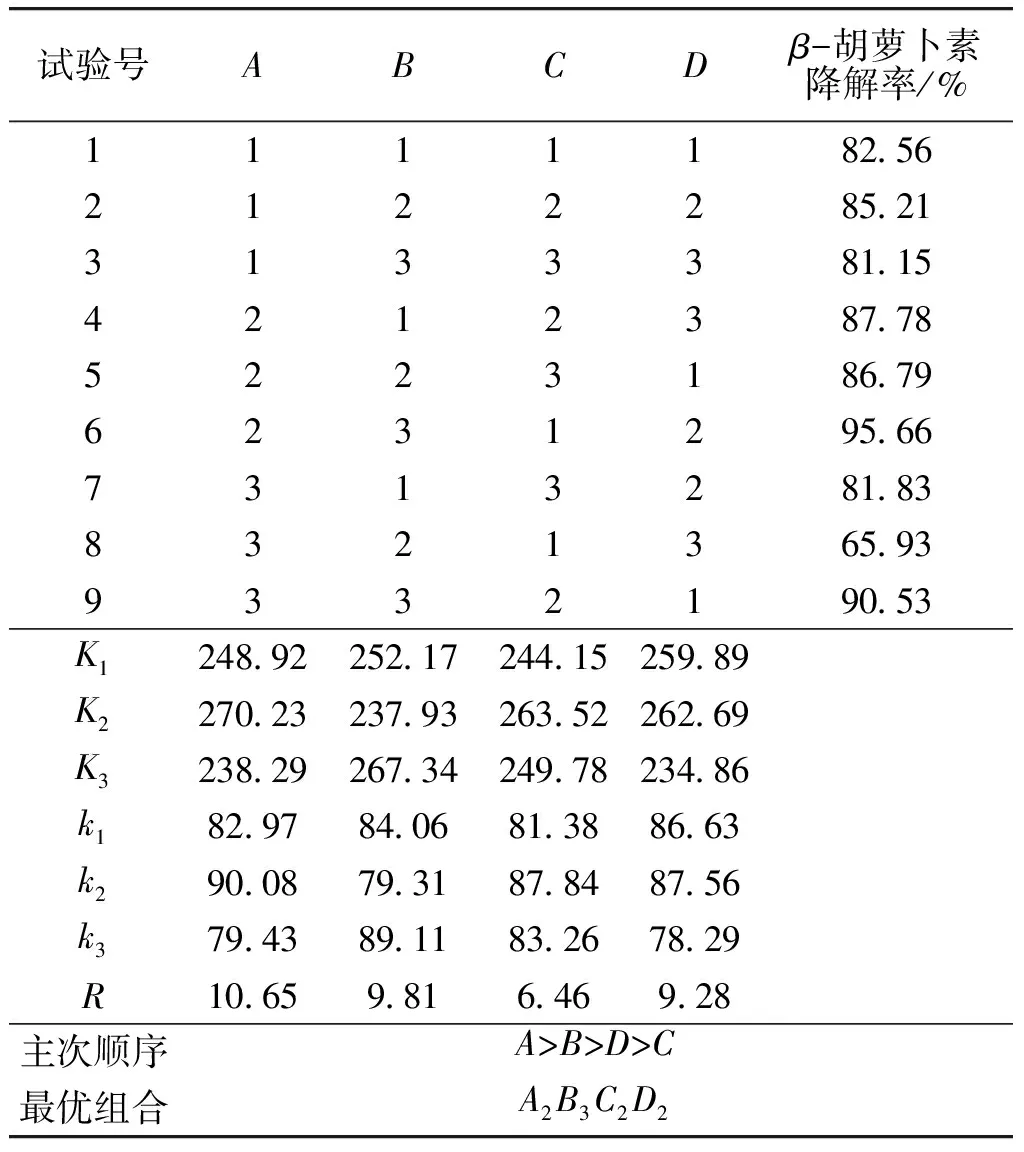
表3 β-胡萝卜素降解条件优化正交试验结果
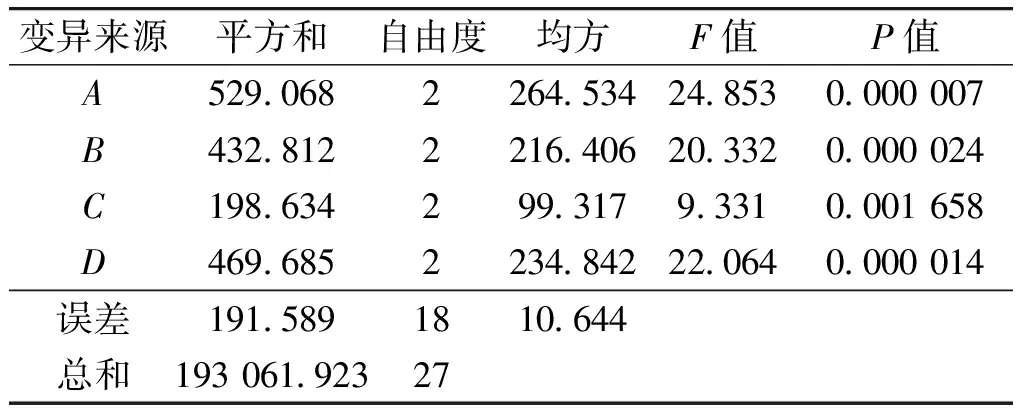
表4 正交试验结果方差分析
3 结论
本文从豫烟13烟叶中分离到一株能高效降解β-胡萝卜素的菌株YT-3,将该菌株在含有β-胡萝卜素(20 mg/L)发酵培养基中培养,β-胡萝卜素可被有效降解为β-紫罗兰酮、二氢猕猴桃内酯和β-环柠檬醛等香味物质。根据经典形态学和16 S rDNA系统进化树分析,鉴定该菌株为霍氏肠杆菌亚种(Enterobacterhormaniisubsp.YT-3)。经单因素试验和正交试验优化得到菌株YT-3降解β-胡萝卜素最佳发酵条件为:硝酸钠质量浓度4 g/L、蔗糖质量浓度30 g/L、酵母粉质量浓度3 g/L、初始pH值7.0,在该发酵条件下β-胡萝卜素降解率达到97.05%。本研究可为β-胡萝卜素降解菌株的开发利用提供参考,也可为β-胡萝卜素降解产物在食品、化学领域和香精香料行业中的应用提供技术基础。

