siRNA下调SCN9A表达对慢性炎性痛模型大鼠疼痛的影响
姜晓阳,张 园,刘亚华,侯彦深 (.新疆医科大学附属肿瘤医院麻醉与围术期医学中心,新疆 乌鲁木齐 8300;.新疆医科大学附属肿瘤医院检验科,新疆 乌鲁木齐 8300)
慢性炎性痛广泛存在于各种急、慢性疾病中,是一种极其复杂的病理生理现象,严重影响患者生活质量。目前临床上以药物、神经破坏、神经阻滞等治疗为主,但存在药物耐受、副反应较多、需反复治疗等局限性,严重影响治疗效果及患者满意度[1-2],因此需寻找更安全有效、作用持久、副作用小的治疗方法。电压门控性钠通道Nav1.7特异性表达于脊髓背根神经节,具有缓慢失活和缓慢复活的特点,能对较小的阈下刺激去极化,产生神经冲动[3-4],临床认为这种效应很可能使Nav1.7成为神经元兴奋的第1张“多米诺骨牌”,从而传递疼痛信号。随着对疼痛机制的深入研究,已有研究发现,编码Nav1.7的基因SCN9A功能缺失性突变是导致痛觉完全消失的关键因子[5]。以往有关疼痛的基因治疗多针对急性疼痛及神经压迫疼痛进行研究,尚缺乏对慢性炎性痛的特异性研究。基于此,本研究以SCN9A为靶点,以慢病毒为载体,利用RNA干扰技术,探讨SCN9A对慢性炎性痛模型大鼠疼痛的影响,以期为疼痛基因靶向治疗提供新思路。
1 材料与方法
1.1 实验动物
18只雄性SPF级SD大鼠(9周龄,体质量180~200 g),由新疆医科大学动物中心实验室提供,动物生产许可证号:SYXK(新)2018-0003,每笼4只,于温度(22±2)℃、湿度40%~60%、昼夜交替12 h环境中饲养。
1.2 主要仪器与试剂
仪器:热刺痛仪(PL-200)购自成都泰盟软件有限公司,机械痛测量仪(Electric Von Frey)购自上海玉研科学仪器有限公司,微量注射器(25 μL)购自上海安亭微量进样器厂,GYQ型便携式氧气筒购自冀州市佳光医疗器械有限公司,-80 ℃冰箱购自赛默飞世尔(苏州)仪器有限公司,全波长酶标仪(1510)购自赛默飞世尔(苏州)仪器有限公司,RT-PCR检测仪(7500FAST)购自美国应用生物系统公司。
试剂:SCN9A siRNA慢病毒载体(LV-SCN9A-RNAi)购自上海吉凯基因技术有限公司,七氟烷购自上海恒瑞医药有限公司,完全弗氏佐剂购自广州赛国生物科技有限责任公司,TRIzol购自美国Thermo Scientific,SYBRGreen PCR试剂盒、cDNA试剂盒购自美国Biosystems,增强型RIPA裂解液购自天津博士德生物工程有限公司,辣根酶标记山羊抗兔IgG、辣根酶标记山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司。
1.3 分组与建模
将18只大鼠随机分成3组,每组6只。其中空白组大鼠不作任何处理,模型组、干预组大鼠于右后足皮下给予0.1 mL完全弗氏佐剂建立慢性炎性痛模型,模型组建模后于蛛网膜下腔注射空白慢病毒载体,干预组建模后于蛛网膜下腔注射LV-SCN9A-RNAi。
慢性炎性痛模型的建立:8%七氟烷诱导约1 min,麻醉起效后改用4%七氟烷维持麻醉。大鼠平放于桌面上,拉直后腿,75%酒精消毒右后掌,于大鼠足底注射0.1 mL完全弗氏佐剂,拔出注射器后用无菌棉球按压注射位点。大鼠右后足肿胀,不能触及地面,表明慢性炎性痛模型建立成功。
大鼠鞘内置管:模型组和干预组大鼠腹腔注射水合氯醛,麻醉起效后取俯卧位,背部剪毛、消毒、铺巾。在L3~L4作一皮肤正中切口,切开皮下筋膜,紧贴L3~L4棘突钝性分离一侧背脊肌、筋膜和韧带,暴露L3~L4棘突间隙。用蚊式钳轻提L3椎体棘突,以弯针轻轻挑破黄韧带及硬脊膜。经黄韧带破口置入PE-10导管。将导管牢固缝于韧带上,逐层缝合肌肉、筋膜。以硬膜外穿刺针在大鼠皮下穿一隧道,将导管的另一端引出于大鼠颈背部,用加热过的止血钳夹闭导管外口。缝合皮肤并消毒,单笼喂养。大鼠出现以下情况则排除:下肢出现跛行、瘫痪、行为异常等肢体运动障碍,局部感染,导管脱落等。
1.4 疼痛行为学测定
于建模前及建模后1 d、2 d、5 d、8 d、12 d测定大鼠右后肢机械刺激缩足反射阈值(paw mechanical withdrawal threshold,PMWT)和热刺激缩足反射潜伏期(paw withdrawal thermal latency,PWTL)。PMWT:用Electric Von Frey纤维丝对准大鼠足底中部垂直施加压力,记录大鼠不能耐受压力迅速撤回后足时的压力值(g),重复测量3次取均值。PWTL:大鼠置于热刺痛仪,光源强度为5%,适应环境后将辐射光源集中在右后足中心,按下启动键,自动记录大鼠舔或者抬起右后足时的潜伏期(s),重复测量3次取均值。
1.5 RT-PCR检测大鼠背根神经节组织SCN9A mRNA表达
于建模后第13天处死大鼠,取L4~L5背根神经节组织,采用TRIzol提取总RNA,Nanodrop仪检测RNA浓度、纯度。采用RT-PCR检测SCN9A mRNA表达情况。参照逆转录试剂盒操作说明书反转录RNA,得到模板单链cDNA,调整浓度为400 ng/μL,按照PCR试剂盒说明书进行PCR扩增,反应条件为95 ℃预变性1 min,92 ℃变性10 s,60 ℃退火30 s,70 ℃延伸30 s,连续循环40次。2%琼脂糖凝胶电泳、溴化乙锭处理PCR产物后检测扩增结果。以β-actin作为内参,根据目的RNA与β-actin的Ct值计算相对表达量,以2-ΔΔCt表示,其中ΔΔCt=(Ct目的基因-Ctβ-actin)-(Ct对照目的基因-Ct对照β-actin)。
1.6 Western blot检测脊髓GFAP、OX42和背根神经节组织SCN9A蛋白表达
采用Western blot检测L4~L5脊髓GFAP、OX42和L4~L5背根神经节组织SCN9A蛋白表达水平。用眼科剪将组织剪成0.1~0.2 g,置于EP管中,加入1 mL RIPA裂解液(80 μL RIPA+10 μL蛋白酶抑制剂+100 μL磷酸酶抑制剂+10 μL PMSF)置于冰上,充分匀浆后4 ℃裂解30 min,4 ℃ 15 000 r/min离心10~15 min,取上清液,BCA法测定蛋白浓度。将待测蛋白样本进行10%SDS-PAGE凝胶电泳,80 V进行浓缩胶电泳,进入分离胶电泳后将电压调整为100 V,待条带全部跑开至分离层胶下缘后停止电泳,然后转移至PVDF膜上,用5% BSA封闭2 h,分别加入GFAP(1∶1 000)、OX42(1∶2 000)、SCN9A(1∶500)一抗,4 ℃孵育过夜后,加入二抗[Nav1.7的二抗为辣根酶标记山羊抗兔IgG(1∶5 000);β-actin的二抗为辣根酶标记山羊抗小鼠IgG(1∶5 000);GFAP的二抗为辣根酶标记山羊抗兔IgG(1∶5 000)],温孵1 h。底物化学发光法显影,置于全能型成像分析仪(Bio-Rad)检测蛋白条带,以β-actin为内参,Image J软件分析图像灰度值,检测目的蛋白的相对表达量。
1.7 统计学方法

2 结果
2.1 LV-SCN9A-RNAi对慢性炎性痛大鼠PMWT的影响
各组大鼠建模前PMWT比较差异无统计学意义(P>0.05),模型组、干预组建模后1 d、2 d、5 d、8 d、12 d的PMWT均明显低于空白组,差异有统计学意义(P<0.05),干预组建模后2 d、5 d、8 d、12 d的PMWT明显高于模型组,差异有统计学意义(P<0.05),见表1。
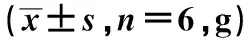
表1 慢性炎性痛大鼠建模前后PMWT变化
2.2 LV-SCN9A-RNAi对慢性炎性痛大鼠PWTL的影响
各组大鼠建模前PWTL比较差异无统计学意义(P>0.05),模型组、干预组建模后1 d、2 d、5 d、8 d、12 d的PWTL均明显短于空白组,差异有统计学意义(P<0.05),干预组建模后2 d、5 d、8 d、12 d的PWTL明显长于模型组,差异有统计学意义(P<0.05),见表2。
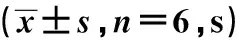
表2 慢性炎性痛大鼠建模前后PWTL变化
2.3 LV-SCN9A-RNAi对大鼠背根神经节组织SCN9A mRNA表达的影响
干预组SCN9A mRNA相对表达量为(4.57±1.02),高于空白组的(1.02±0.15),低于模型组的(13.46±3.51),差异均有统计学意义(P<0.05)。
2.4 LV-SCN9A-RNAi对大鼠背根神经节组织SCN9A及脊髓GFAP、OX42蛋白表达的影响
干预组SCN9A、GFAP、OX42蛋白表达水平高于空白组,低于模型组,差异均有统计学意义(P<0.05),见表3、图1。
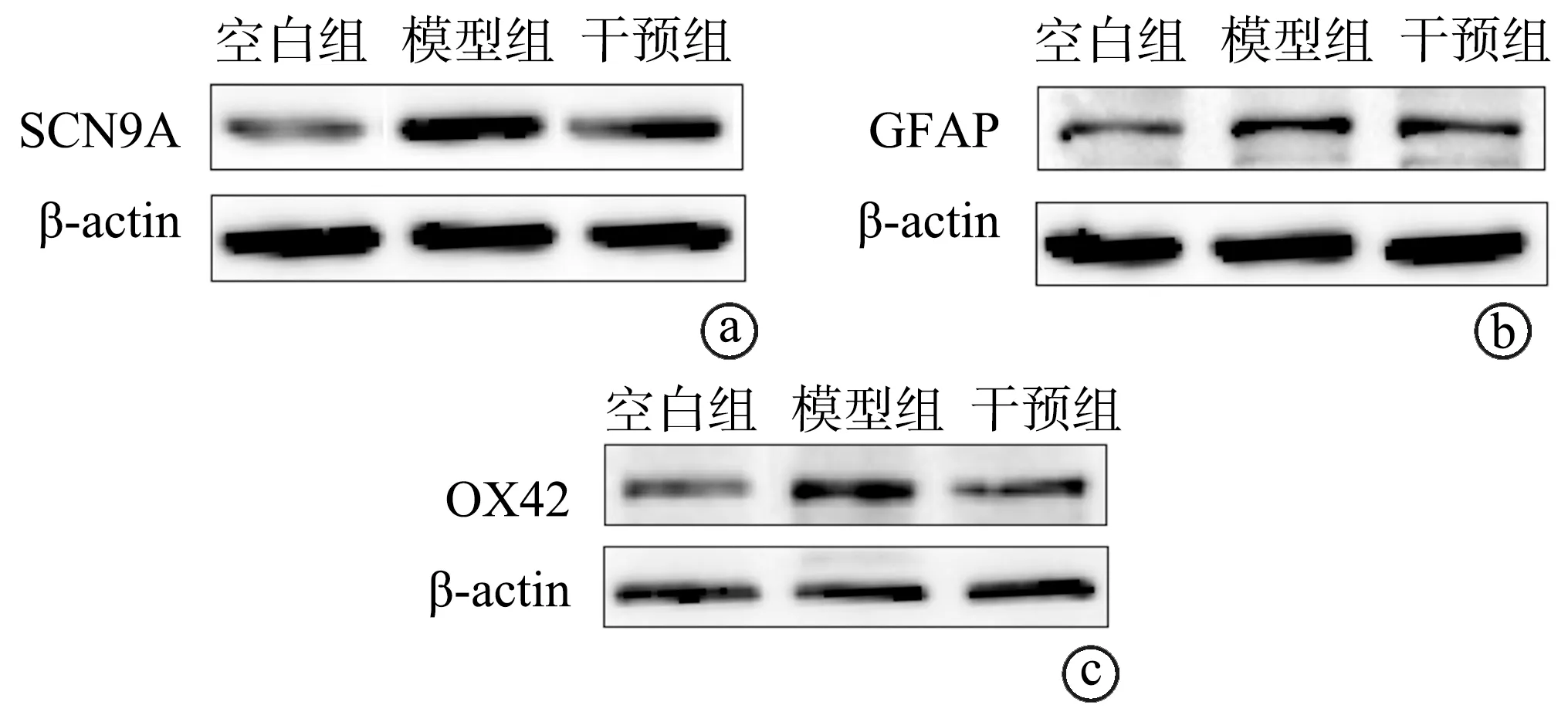
a:SCN9A蛋白表达电泳图;b:GFAP蛋白表达电泳图;c:OX42蛋白表达电泳图图1 蛋白表达电泳图
3 讨论
背根神经节是痛觉传入第一级神经元,在痛觉的产生机制中起着关键作用。研究发现,在神经系统受损后,初级感觉神经元的自发性活动、高兴奋性以及异常高频放电参与疼痛的发生,该过程由感觉神经元的电压门控性钠通道介导或者调控[6-7]。SCN9A为电压门控性钠通道,该基因主要表达于背根神经节,且集中于与伤害性感受器有关的小直径c类神经纤维[8]。研究发现,在原发性红斑肢痛症、阵发性剧痛症等患者中,SCN9A基因序列出现功能增强型突变[9-10],而单文琪等[10]认为人类先天无痛症电压门控性钠通道Nav1.7的SCN9A基因功能缺失性突变是痛觉完全消失的关键原因。基于以上研究推断,敲除或下调SCN9A基因表达可抑制疼痛产生,获得良好的镇痛效果。因此,本研究采用慢病毒介导的RNA抑制大鼠SCN9A基因表达,探讨疼痛基因治疗的安全性和可行性,为疼痛基因治疗提供一定的依据。
本研究发现,于大鼠右后足皮下给予0.1 mL完全弗氏佐剂建立慢性炎性痛模型后,大鼠足底出现红肿热痛、自我保护和缩足行为,右后足不能触及地面,且干预组和模型组的PMWT、PWTL明显低/短于空白组;进一步分析发现,干预组建模后2 d、5 d、8 d、12 d的PMWT、PWTL明显高/长于模型组,表明蛛网膜下腔注射LV-SCN9A-RNAi可有效减轻慢性炎性痛模型大鼠疼痛程度,改善疼痛行为学表现。有研究发现,Nav1.7与机械痛和炎性痛密切相关[11-12]。在炎性痛觉过敏的发展过程中,伤害性神经元中Nav1.7的表达增加,而抑制Nav1.7可以减轻炎性痛和痛觉过敏[13],本研究结果与以上研究结果一致。本研究中干预组SCN9A mRNA及蛋白表达水平高于空白组,低于模型组,说明下调SCN9A的表达可缓解大鼠疼痛症状。
脊髓星形胶质细胞激活标记物GFAP及小胶质细胞激活标记物OX42表达水平与炎性痛有关,出现炎性痛时,脊髓星形胶质细胞、小胶质细胞被激活,诱导GFAP、OX42蛋白表达,促进胶质细胞释放神经递质,进而刺激神经元,导致疼痛信号放大;相反,抑制胶质细胞的激活可缓解疼痛[14-15]。脊髓胶质细胞激活后可释放兴奋性氨基酸、P物质、IL-1β、TNF-α、诱导型—氧化氮合酶等多种前疼痛物质,同时神经元和胶质细胞之间具有正反馈调节作用,从而导致疼痛反应加重[16-17]。本研究中,干预组的GFAP、OX42蛋白表达水平高于空白组,低于模型组,表明下调SCN9A表达可抑制脊髓小胶质细胞、星形胶质细胞的激活,进而抑制慢性炎性痛的中枢敏化过程。
综上所述,蛛网膜下腔注射LV-SCN9A-RNAi可抑制大鼠背根神经节的SCN9A表达,从而有效减轻慢性炎性痛模型大鼠的疼痛程度,改善疼痛行为学。

