先天性心脏病新生儿血浆circRNAs芯片数据的生物信息学分析*
潘秋亚,赵 静#,崔 玥,张雯婷,恽 琪,郑爱斌,姚圣连,张 伟,陈 云,顾 猛▲
1.常州市儿童医院儿科,江苏常州 213003;2.高邮市中医医院儿科,江苏扬州 225699
先天性心脏病(CHD)指出生时即存在的心血管结构或功能异常,其发病率在各类出生缺陷疾病中占首位,是中国大城市5岁以下儿童的首要死因。出生后严重CHD易导致新生儿因呼吸或循环衰竭而死亡,存活者常继发心、肺及脑等重要器官损伤而导致生长发育及智力发展障碍[1-2]。该病严重威胁婴幼儿生命和健康,给社会和家庭带来了沉重负担,是一类急待解决的优生优育难题。环状RNA(circRNAs)是一种在哺乳动物细胞中发现的新型非编码RNA,具有疾病特异性、组织特异性和时序特异性,随着现代科学技术的发展,其调控功能越来越被人们重视[3]。circRNAs在CHD发生、发展中发挥着重要作用,有望成为一种新的潜在的CHD诊疗生物标志物或治疗靶点[4]。本研究通过人类circRNA基因芯片检测CHD新生儿和健康体检新生儿血浆中的circRNAs表达谱,分析差异表达的circRNAs,利用生物信息学方法构建新生儿CHD的circRNA-miRNA-mRNA的调控网络,揭示miRNA表达调控机制,探讨新生儿CHD的可能发病机制,为预防新生儿CHD发生、发展提供新的理论依据。
1 资料与方法
1.1一般资料 本研究采用病例对照研究设计来进行CHD新生儿血浆中circRNA芯片数据的生物信息学分析。经常州市儿童医院伦理委员会批准和签署知情同意书,本研究收集2020年在常州市儿童医院新生儿科收治的经超声心动图确诊的CHD患儿及同期健康新生儿血浆标本各13例,为去除非研究目的相关因素干扰,13例CHD新生儿均经遗传学基因筛查排除遗传性疾病。 其中3例CHD患儿标本和3例健康新生儿标本送上海康成生物工程有限公司进行血浆中的circRNA进行检测,剩余标本用于验证芯片结果的可靠性。
1.2方法
1.2.1芯片分析 应用Arraystar circRNA基因芯片(上海康成生物工程有限公司)对3例CHD新生儿及3例健康新生儿血浆标本中的circRNA进行检测。
1.2.2circRNA的鉴定及注释 根据已有研究关于circRNA结构特征及剪接序列特征,采取以下措施进行circRNA鉴定:(1)splice sites两端是GU/AG;mismatch≤2;(2)Back-spliced junctions reads≥2;(3)two splice sites≤100 kb。基于circRNA在基因组中的位置关系及与蛋白编码基因的关系,对筛选获得的circRNA进行注释,主要分为两个部分,circRNA位置关系分类及circRNA功能注释。circRNA分类注释主要依据circRNA在基因组中基因位点关系进行注释,分为5类,即intronic circRNA、exonic circRNA、antisense circRNA、senseoverlaping circRNA及intergenic circRNA。circRNA功能注释是基于circRNA形成机制,主要依据circRNA对应的circRNA-hosting gene功能进行circRNA的GO注释及KEGG注释。
1.2.3差异基因的筛选 将原始数据导入SAM软件分析,采用t检验计算P值,以P<0.05为差异有统计学意义。对芯片原始结果用R软件包进行标准化和数据分析。通过P值/FDR筛选组间差异表达circRNAs(FDR>2.0,P<0.05)。将数据导入Pusamen1.10和Cluster 3.0 软件进行系统聚类分析,软件输出聚类图及火山图来显示新生儿CHD血清中差异circRNAs的情况。
1.2.4基因本体分析和信号通路分析 将差异表达基因导入DAVID和Pathway Studio 5.0分析软件,计算分类种类、每个种类的基因数及P值等内容,并且根据P值大小依次输出。Fisher确切概率法检验两个小数据分类的关联,P值表示GO富集差异表达基因的意义,P值越低,差异性越大(P<0.05)。借助KEGG数据库对CHD差异表达基因进行研究。
1.2.5circRNA/miRNA结合位点分析 每个FDR>2的circRNA均用美国Arraystar公司的miRNA结合位点预测软件预测5个高匹配值的miRNA结合位点。通过部分序列互补分析circRNA结合的miRNA,形成cirRNA-miRNA关系网络图。
1.2.6miRNA靶基因预测 利用GCBI网站(http://www.targetscan.org)进行micRNA的靶基因预测。
1.2.7应用Cytoscape软件构建网络图 构建每个FDR>2的circRNA与之预测结合的前5位高匹配值的miRNA的CircRNA/miRNA网络图;构建前5位的miRNA至少有一个是文献报道与CHD相关的miRNA的circRNA/miRNA网络图;通过靶基因预测与参考文献结合选取结合CHD相关的miRNA数目最多的hsa_circRNA_091419,来构建circRNA/miRNA或 circRNA/miRNA/mRNA 网络图。
1.3统计学处理 以CircRNA芯片结果为基础,采用SPSS20.0统计软件进行数据处理及统计分析,采用t检验,筛选出组间FDR>2的基因为表达显著上调基因,所有差异性基因均满足P<0.05。同时将所有差异性表达基因导入R 软件包后,得出GO分析和信号通路分析结果。
2 结 果
2.1CHD新生儿血浆标本中差异表达circRNAs谱的表达特征 将CHD新生儿血清(n=3)与正常健康新生儿血清(n=3)进行配对分析,用微阵列探针共检测得到1 711个circRNAs,其中差异表达的 circRNAs 375个,在CHD新生儿血清中表达上调的circRNAs 115个,下调的circRNAs 260个(FDR>2,P<0.05)。
2.2差异表达circRNAs的验证 为保证芯片结果的准确可靠性,从差异表达前20条circRNAs中随机选取5条circRNAs(hsa-circ-091419、hsa-circ-402458、hsa-circ-406494、hsa-circ-016545、hsa-circ-102016),采用实时荧光定量聚合酶链反应(qRT-PCR)对10对标本(10例CHD新生儿血浆和10例健康新生儿血浆)中的该5条circRNAs水平进行检测,结果以GAPDH为内参进行标定。相对表达量通过扩增产物所需的循环次数Ct值计算,应用2-ΔΔCt法,其中ΔCt=Ct标本-CtGAPDH。结果显示,PCR的折叠变化与芯片结果虽有所不同,但其表达的趋势与芯片相同,说明两种方法结果的一致性良好,表明芯片结果是可靠的,可以用于后续的研究,结果见图1。
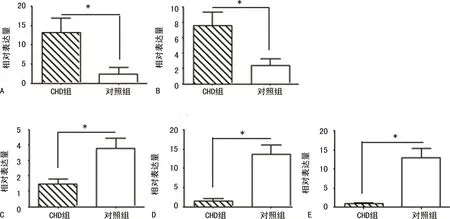
注:A~E分别为CHD组与对照组hsa-circ-406494、hsa-circ-402458、hsa-circ-102016、hsa-circ-091419、hsa-circ-016545 circ RNAs相对表达量,*表示P<0.001。
2.3circRNA/miRNA的结合位点分析 circRNA具有miRNA的分子海绵作用,通过作用于疾病相关的miRNA,影响疾病的发生、发展。通过美国Arraystar公司的miRNA结合位点预测软件,对每个差异表达的circRNA预测5个高匹配值的miRNA结合位点。375个差异表达的circRNAs预测结合了1 546个miRNAs,其中包括14个CHD相关的miRNAs。
2.4信号通路及circRNA/miRNA相互作用的网络构建 对差异表达的14个miRNAs的靶基因进行信号通路分析,结果显示富集总分排名前3位的通路局灶性黏连、肌动蛋白细胞骨架调节、血管平滑肌收缩均与CHD的病理相关。在这14个CHD相关的miRNAs中,对应结合了 24个circRNAs,有的miRNA不止结合一个circRNA,如hsa-miR-208-a-5p;而一个circRNA也结合了多个miRNA,其中hsa_circRNA_102410结合了5个miRNA,包括 hsa-miR-92a-1-5p、hsa-miR-92b-5p、hsa-miR-612、hsa-miR-181d-3p、hsa-miR-890。通过hsa_circ_091419/miR-145/mRNA的网络图构建,预测的CHD相关靶基因34个,包括hsa-miR-145-3p的靶基因ITGB8。
3 讨 论
CHD是胚胎发育过程中最为常见的出生缺陷之一,在活产新生儿中发病率为4‰~5‰,是婴幼儿期非感染死亡的首位病因[1]。研究人员认为CHD的发生、发展与基因突变等遗传因素密切相关,但具体发病机制仍不清楚。目前,诊断胎儿CHD没有金标准,只能依赖超声心动图,虽然其诊断特异度高,但其漏诊率却相当高。
心脏发育异常是一个涉及多因素共同作用的复杂过程,其病理机制至今尚不清楚。从基因水平看,CHD的发生、发展与Nkx2-5、GATA4、SRF等基因在不同时空通过Notch、Wnt等信号通路进行调控及相互作用有关[4-5]。分子生物学为理解CHD的发生、发展提供了线索和依据,目前的研究仅限于发现CHD差异表达的基因,但对这些基因差异表达的上游调控机制研究甚少。随着高通量检测技术的成熟和转录组学的发展,有研究表明,微小RNA(miRNA)、长链非编码RNA(lncRNA)和circRNAs等非编码RNA可参与细胞生长、分化调控及细胞增殖与凋亡等生物学过程,在心脏发育中发挥重要作用[6-8]。
高通量的筛查手段,如circRNAs芯片或测序技术使研究疾病中circRNAs的差异表达成为可能,为后续circRNAs功能研究或生物标志物筛选提供了极大的便利,circRNAs及其相关结合蛋白的转录、表达、结构和调控的异常,可能是肿瘤、心血管疾病等多种疾病发生、发展的重要原因。
circRNAs主要通过竞争性吸附miRNA、调控剪接或转录过程及调节RNA结合蛋白等形式来影响生理过程,如组织发育、胰岛素分泌和衰老,且参与了心血管病变、心脏成纤维细胞、心肌肥大、神经系统疾病及癌症等病理过程[9]。circRNAs因自身闭合结构对核酸酶不敏感,要比线性RNA更为稳定,可作为潜在的诊断心血管疾病和癌症的生物标志物[3,10]。
许多心血管疾病和冠状动脉疾病都与circRNAs有关。有研究表明,敲除CIRCDHCR24可以减轻血管平滑肌细胞的增殖、迁移和表型转换,从而预防血管阻塞性狭窄[11]。circMGAT1可通过调节miR-34a/YAP1轴,抑制细胞凋亡,促进细胞增殖,为冠心病的治疗提供靶点[12]。有研究结果表明,miR-22-3p的缺失再现了circMap3k5对血管平滑肌细胞的抗增殖作用[13-14]。在SMC特异性Tet2基因敲除小鼠中,Tet2的缺失消除了circMap3k5介导的血管平滑肌细胞的抗增殖作用。circMAP3K5是TET2介导的血管平滑肌细胞分化的主要调控因子。靶向circMAP3K5/miR-22-3p/TET2轴可能提供了一个潜在的内膜增生相关疾病的治疗策略,包括再狭窄和动脉粥样硬化[13]。文献报道,circRNA-miRNA网络的作用对冠心病具有重要影响,如心肌肥厚、心肌纤维化和心力衰竭[14]。中药也具有抗动脉粥样硬化、抑制凋亡、保护心肌和心肌细胞等作用,可通过调节miRNAs促进细胞生长和保护血管系统[15]。
本研究采用Arraystar circRNA基因芯片对CHD新生儿及健康新生儿血清中circRNAs进行筛查,旨在寻找众多基因在表达上的差异性和相似性规律,找出在CHD发病中起重要作用的基因或通路。以circRNAs表达谱芯片结果为基础筛选出表达显著上调和显著下调的circRNAs,通过生物信息学手段进一步分析得出差异circRNAs线性基因GO分析,以美国Arraystar公司的miRNA结合位点预测软件,对每个差异表达的circRNAs预测5个高匹配值的miRNA结合位点,375个差异表达的circRNAs预测结合了1 546个miRNAs,其中包括14个CHD相关的miRNAs,hsa-miR-145-3p、hsa-miR-499-a-3p、hsa-miR-208-a-5p、hsa-miR-199-a-5p等已被证实参与CHD的相关病理过程[16-19]。应用KEGG数据库对差异表达circRNAs进行功能预测,同时对可能与CHD相关的miRNAs进行生物信号通路分析,最后,以结合CHD相关miRNAs数目最多的hsa-circRNA-091419为例,应用Cytoscape软件构建了hsa-circRNA-091419/miR-145/mRNA的网络图。已有文献报道,miR-145-5p在冠心病患者中低表达,其过度表达可通过抑制Smad4有效减轻H/R诱导的CMEC损伤[16]。提示hsa-circRNA-091419通过作用海绵吸附miR-145,作用于其靶基因ITGB8来影响心肌标志物心钠素、心肌肌钙蛋白Ⅰ的表达,从而影响心肌的发育。
本研究仍有一定的局限性,本研究仅通过生物信息学预测hsa_circ_091419可能在心脏发育过程中发挥作用,但没有通过试验进行验证,其与靶基因ITGB8及吸附标靶miR-145之间的关系也需要进一步的验证。

