铜铝双金属复合离子液体的电化学行为及电沉积铜机理
欧阳萍,张睿,周剑,刘海燕,刘植昌,徐春明,孟祥海
(中国石油大学(北京)重质油国家重点实验室,北京 102249)
引 言
因具有优良的导电性、导热性和力学性能,金属铜被广泛应用于微电子工业、汽车工业、建筑工程等领域,有着较高的经济价值[1-2]。作为一种电势较高的金属,铜可以通过电沉积的方式来制取[3]。常见的电沉积铜的溶液体系包括硫酸盐镀液、焦磷酸盐镀液、氰化物镀液等[4-5]。尽管在这些镀液中都能得到质量较佳的金属铜,但是依然存在镀液腐蚀性强、能耗大、工艺复杂、环境危害大等问题。相比之下,离子液体具有导电性良好、环境友好、电镀工艺简单、无析氢干扰等优势[6-7]。近些年,已有大量关于离子液体电沉积金属铜[8-11]及Cu-Zn[12-13]、Cu-Sn[14]、Cu-Mn[15]、Cu-Ni[16]等高附加值铜合金的相关研究。Tierney 等[17]通过铜丝的阳极溶解获得了含Cu(Ⅰ)的氯铝酸离子液体,并借助电沉积得到了致密结节状的铜沉积物;Dhahbi 等[18]将氯化铜溶于三正辛基甲基氯化铵-氯仿二元混合介质中,并通过电沉积获得了中等致密性的铜薄膜;孙杰等[19]将氯化铜溶于1-丁基-3-甲基咪唑六氟磷酸离子液体中,并通过电沉积得到了单质铜。这些均表明离子液体体系在电沉积铜上具有较大的潜力,而电沉积作为最重要的金属回收技术之一,其行为与电极材料、电解质及传质过程等息息相关,因此,深入探索离子液体电沉积铜的电化学行为及机理可为金属铜的有效回收提供理论指导。
氯铝酸离子液体因其较强的Lewis 酸性在有机反应和工业催化上得到了广泛关注和应用[20-21]。其中,铜铝双金属复合离子液体对碳四烷基化反应有着优异的催化效果,且该复合离子液体碳四烷基化技术已实现工业应用[22-23]。铜铝双金属复合离子液体的制备主要是通过向基础离子液体中加入含铜化合物或者借助电化学手段以铜丝为阳极电解溶入离子液体中来实现的。工业用铜铝双金属复合离子液体中Cu(Ⅰ)含量较高,主要以Cu(Ⅰ)的氧化态形式存在,其中,最主要的存在形式为[CuCl2]-,其他还有少量的[Cu2Cl3]-和[AlCuCl5]-等[24]。复合离子液体碳四烷基化工业运行过程中会外排少量离子液体,对其进行合理处理和有效利用可提高该技术的竞争力,其中,采用电化学处理可通过电沉积的方式实现铜资源的高效回收和利用,是一种有效的处理手段。
目前,文献报道的电沉积铜的离子液体体系多为含Cu(Ⅱ)的离子液体[8-11,18-19,25],如含7 mmol Cu(Ⅱ)的N-丁基吡啶氯铝酸离子液体[8]或含19.58 mmol Cu(Ⅱ)的1-乙基-3-甲基咪唑四氟硼酸离子液体[10]等。而含Cu(Ⅰ)的离子液体体系研究相对较少,如含0.16 mmol Cu(Ⅰ)的1-丁基-3-甲基咪唑氯铝酸离子液体[26]或含22 mmol Cu(Ⅱ)的1-乙基-3-甲基咪唑四氟硼酸离子液体[27]。至于高含量Cu(Ⅰ)离子液体的电化学研究更加少见,但对含Cu(Ⅰ)离子液体,尤其是工业用高Cu(Ⅰ)含量离子液体电化学处理策略的制定十分关键。由于Cu(Ⅰ)含量对离子液体电化学行为及动力学行为影响很大,深入探讨并进一步完善高Cu(Ⅰ)含量离子液体的电化学行为及机理对后续电沉积工艺优化和产物质量提升等方面具有重要作用,这也有利于实现工业运行过程中废料中铜资源的高效利用。此外,即便对于常见的含Cu(Ⅱ)的离子液体,在电沉积过程中铜的还原过程也需要经历两步单电子转移过程,即Cu(Ⅱ)→Cu(Ⅰ)→Cu[8-9],其中,最重要的一步便是Cu(Ⅰ)还原为Cu,这是决定铜沉积形貌和质量的关键步骤。因此,对含Cu(Ⅰ)的离子液体体系的电化学行为及机理深入系统研究为碳四烷基化复合离子液体催化剂的资源化利用奠定了良好的基础,这也与可持续发展目标相符。
本文考察了工作电极和扫描速率对铜铝双金属复合离子液体循环伏安曲线的影响,对其氧化还原过程进行探讨,通过计时安培法研究Cu(Ⅰ)的成核机制,借助扫描电镜(SEM)、能谱仪(EDX)和X射线衍射仪(XRD)等研究铜铝双金属复合离子液体电沉积产物的形貌、组成及元素分布,以此来确定铜在复合离子液体中的还原过程和生长机制,为工业装置外排复合离子液体中金属铜的回收利用奠定基础。
1 实验材料和方法
1.1 试剂
盐酸三乙胺(Et3NHCl,AR)、无水三氯化铝(AlCl3,AR)、氯化亚铜(CuCl,AR)均购自上海阿拉丁生化科技股份有限公司;丙酮(C3H6O,AR)、乙醇(C2H6O,AR)、二氯甲烷(CH2Cl2,AR)均购自北京伊诺凯科技有限公司。
1.2 铜铝双金属复合离子液体的制备
参照文献中的合成方法[23],在室温下向三口烧瓶中加入经干燥后的Et3NHCl,然后在搅拌下将一定量的无水AlCl3分批缓慢加入三口烧瓶中,控制温度为120℃,连续搅拌约2 h。然后在反应体系中加入适量的无水CuCl,升温至150℃,搅拌4 h 至体系为均相,在手套箱中冷却至室温,静置12 h 后过滤除去杂质,所得黄绿色溶液即为铜铝双金属复合离子液体,其可直接用作电解液。该离子液体的基础物性可参考与之相似的高Cu(Ⅰ)含量的1-丁基-3-甲基咪唑氯铝酸离子液体[28]。
1.3 电化学测试与电沉积
室温下采用CHI760E 电化学工作站(上海辰华仪器公司)在三电极体系中进行测试,对电极为Pt片电极(10 mm×10 mm×0.1 mm),准参比电极为Pt 丝电极(1 mm×34 mm),对于循环伏安测试,工作电极包括直径为3 mm 的玻碳电极、Pt 盘电极、W 盘电极。工作电极使用前采用氧化铝粉进行打磨抛光,再用去离子水洗净、吹干待用。循环伏安曲线扫描速率为100~600 mV·s-1,其电化学窗口为-3.0~2.0 V,与咪唑四氟硼酸离子液体[29]的电化学窗口相近。对于计时电流实验,工作电极为Cu 丝电极(1 mm×34 mm),其电位分别为-2.70、-2.75、-2.80、-2.85 V。对于电沉积实验,电沉积前铜铝双金属复合离子液体的体积V为40 ml,工作电极为Ag 片电极(20 mm×10 mm×0.1 mm),恒电势(分别为-1.20、-1.70、-2.60 V)电沉积60 min。电沉积前工作电极使用金相砂纸打磨,再用丙酮除油,最后用去离子水洗净、烘干待用;电沉积结束后,电极片依次采用乙醇、二氯甲烷清洗,再烘干。
1.4 表征
采用扫描电子显微镜(美国FEI 公司,Quanta 200)观察镀层的表面形貌,并用配套的能谱仪(EDX)分析元素组成和分布。采用X 射线衍射仪(德国Bruker 公司,D8 Advance)分析沉积产物的物相组成,测试条件:CuKα辐射,管压40 kV,管流30 mA,扫描范围5°~90°,扫描速度1(°)·s-1。
采用电感耦合等离子体发射光谱仪(美国PerkinElmer 公司,Optima 7000DV,ICP-OES)测量金属元素的含量,测试条件:射频功率1.3 kW,辅助气流量0.2 L·min-1,蠕动泵速1.5 ml·min-1。ICP-OES测得电沉积前离子液体中Cu(Ⅰ)的含量为5.33%(质量),Al(Ⅲ)的含量为11.54%(质量)。已知电沉积前铜铝双金属复合离子液体密度ρ为1.335 g·ml-1,可知电沉积前亚铜和铝的浓度分别为1.12和5.71 mol·L-1。
2 实验结果与讨论
2.1 铜铝双金属复合离子液体的循环伏安研究
图1所示为铜铝双金属复合离子液体在扫描速率为100 mV·cm-2下三种不同工作电极的循环伏安曲线。由于复合离子液体中Cu(Ⅰ)含量较高,可以看出其CV 曲线无论是与含微量Cu(Ⅰ)的氯铝酸离子液体的CV 曲线相比,还是与含Cu(Ⅱ)的氯铝酸离子液体的CV 曲线相比,都有较大的差异。对于含Cu(Ⅰ)的氯铝酸离子液体,含0.16 mmol Cu(Ⅰ)的BMIC-2AlCl3离子液体在低碳钢电极上CV 曲线主要显示铝的还原和氧化,而Cu(Ⅰ)的还原峰非常微弱[26];含5 mmol Cu(Ⅰ)的BMIC-2AlCl3离子液体在玻碳电极上的CV 曲线显示其还原过程包括铜的超电势沉积(overpotential deposition,OPD)和铝铜共沉积过程,其氧化峰对应的氧化过程主要包括Cu(Ⅰ)→Cu(Ⅱ)[30]。含Cu(Ⅱ)的Et3NHCl-2AlCl3离子液体在金盘电极上的CV 曲线显示还原过程包含Cu(Ⅱ)的还原、铝铜共沉积和Al(Ⅲ)的还原[31]。可知铜的价态和含量对氯铝酸离子液体的电化学行为的影响较大。此外,在不同工作电极上离子液体的电化学氧化还原过程也会有轻微差异。基于此,对比三种不同的工作电极,发现W 盘电极与Pt 盘电极、玻碳电极峰形有所不同,Pt 盘电极和玻碳电极明显有形成成核圈的趋势,而W 盘电极并没有该趋势,说明铜铝双金属复合离子液体在Pt 盘电极和玻碳电极上的电沉积很可能是成核控制过程。但是这三者的阳极氧化峰对应的氧化过程均包括Cu→Cu(Ⅰ)、Cu(Ⅰ)→Cu(Ⅱ),这与文献报道结果相吻合[10,18,32]。阴极还原区域均包括铜的欠电势沉积(UPD)、Cu(Ⅰ)的还原[Cu(Ⅰ)→Cu]和铜的超电势沉积(OPD),这与含微量Cu(Ⅰ)的氯铝酸离子液体的CV 曲线[26,30]相比差异较大,这归因于低含量Cu(Ⅰ)的氯铝酸离子液体除了发生铜的还原,还会发生铝的还原或铝铜的共沉积;而铜铝双金属复合离子液体由于Cu(Ⅰ)含量较高,其还原产物比较单一,即该电化学窗口内(1.0~-3.0 V)只涉及铜的还原过程。
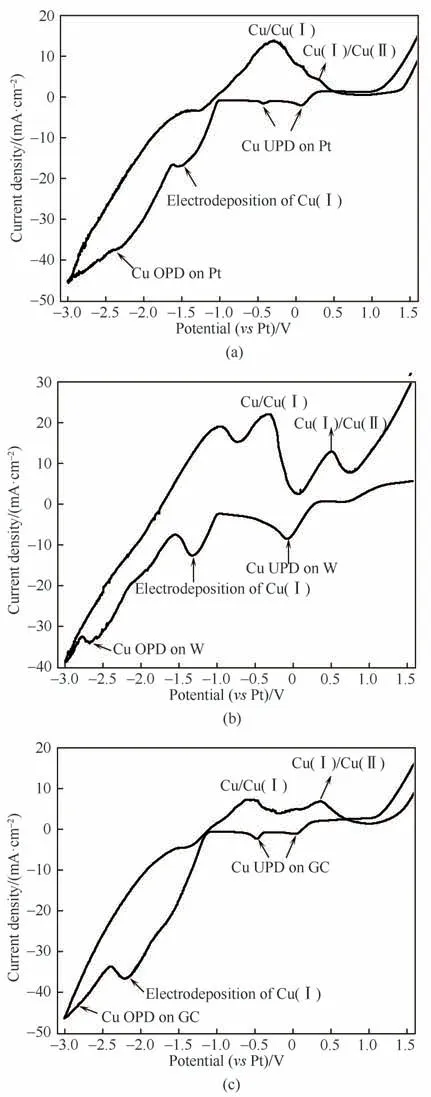
图1 铜铝双金属复合离子液体在Pt盘电极(a)、W盘电极(b)、玻碳电极(c)的循环伏安曲线(扫描速率为100 mV·s-1)Fig.1 Cyclic voltammograms of Cu-Al bimetallic composite ionic liquid on Pt electrode(a),W electrode(b)and glass carbon electrode(c)with the scanning rate of 100 mV·s-1
CV 曲线氧化还原峰位具体数值如表1 所示,Pt盘电极的UPD 峰有两处,其数值分别为0.07和-0.43 V,Cu(Ⅰ)的 还 原 峰 值 为-1.55 V,Cu→Cu(Ⅰ)、Cu(Ⅰ)→Cu(Ⅱ)这两处阳极氧化过程对应的氧化峰值分别为-0.30 和0.29 V。玻碳电极同Pt 盘电极一样,也有两处UPD 峰,其数值分别对应0.04和-0.47 V,其Cu(Ⅰ)的还原峰值为-2.21 V,Cu→Cu(Ⅰ)、Cu(Ⅰ)→Cu(Ⅱ)这两处阳极氧化峰值分别为-0.52和0.36 V。W盘电极的UPD峰值为-0.08 V,Cu(Ⅰ)的还原峰值为-1.32 V,Cu→Cu(Ⅰ)、Cu(Ⅰ)→Cu(Ⅱ)这两处阳极氧化过程对应的氧化峰值分别为-0.31和0.54 V。
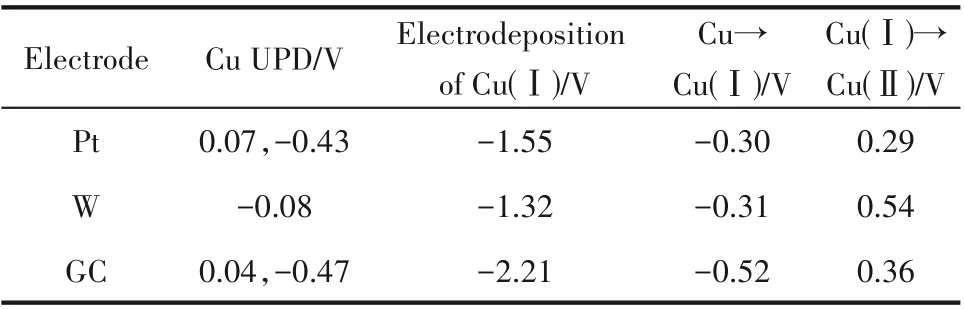
表1 铜铝双金属复合离子液体在不同工作电极上CV曲线峰电位Table 1 Cyclic voltametric data of Cu-Al bimetallic composite ionic liquid on different working electrodes
为了深入分析铜铝双金属复合离子液体的电化学反应动力学过程,记录了铜铝双金属复合离子液体在W 盘电极上不同扫速下的循环伏安曲线,如图2 所示。还原峰c1 和c2 分别归属于铜的欠电势沉积和Cu(Ⅰ)的还原[Cu(Ⅰ)→Cu],氧化峰a2 和a1分别归属于Cu→Cu(Ⅰ)和Cu(Ⅰ)→Cu(Ⅱ)。可以看出,随着扫描速率的增加,这些峰的电流值也相应增大,其中还原峰c1 和c2 的峰位逐步负移,可知峰电位随着扫描速率的改变而变化,这说明UPD 过程和Cu(Ⅰ)的还原过程均为不可逆电化学反应过程。
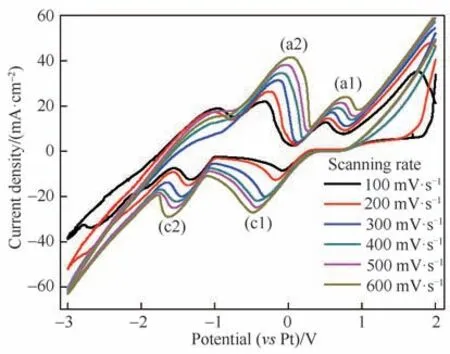
图2 铜铝双金属复合离子液体在W盘电极上不同扫描速率下的循环伏安曲线Fig.2 Cyclic voltammograms of Cu-Al bimetallic composite ionic liquid on W electrode with different scanning rates
为了确定铜在W 盘电极上的UPD 过程和Cu(Ⅰ)的还原过程的控制步骤,需要确定还原峰电流和扫描速率平方根这二者之间的关系,结果如图3 所示。可见,还原峰c1 和c2 的峰电流ip与扫速平方根v1/2均具有良好的线性关系,其相关系数分别为0.9915 和0.9856,符合Randles-Sevčik 方程[33],即式(1)。这可以说明UPD 和Cu(Ⅰ)的还原过程均属于扩散控制。此外,氧化峰a1和a2的可逆性与还原峰相类似。
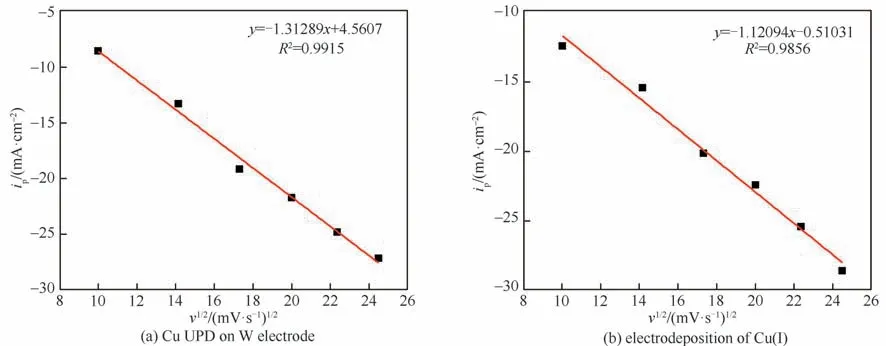
图3 阴极峰电流ip与v1/2的关系Fig.3 Relationship between cathodic peak current ip and v1/2
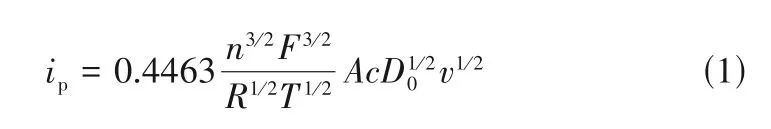
对铜铝双金属复合离子液体在W 盘电极上的循环伏安曲线的电化学参数进一步分析,其结果如表2 和表3 所示。由表2 可知,Cu(Ⅰ)的还原峰电流与氧化峰电流之比Ic2/Ia2平均值为0.63,而不是1,进一步也说明该过程属于不可逆过程,这与氯化铜在1-丁基-3-甲基咪唑六氟磷酸离子液体中的结果[19]是一致的,即Cu→Cu(Ⅰ)过程为不可逆过程。对于受扩散控制的不可逆电化学反应,其峰电流与峰电位分别符合式(1)和式(2)[10]。对于复合离子液体而言,由表3 可知其Cu(Ⅰ)的还原过程的平均电子传递系数αc2为0.30,再通过式(1)可计算得到其扩散系数平均值为2.08×10-6cm2·s-1,由此说明该铜铝双金属复合离子液体非常适合铜的电沉积。
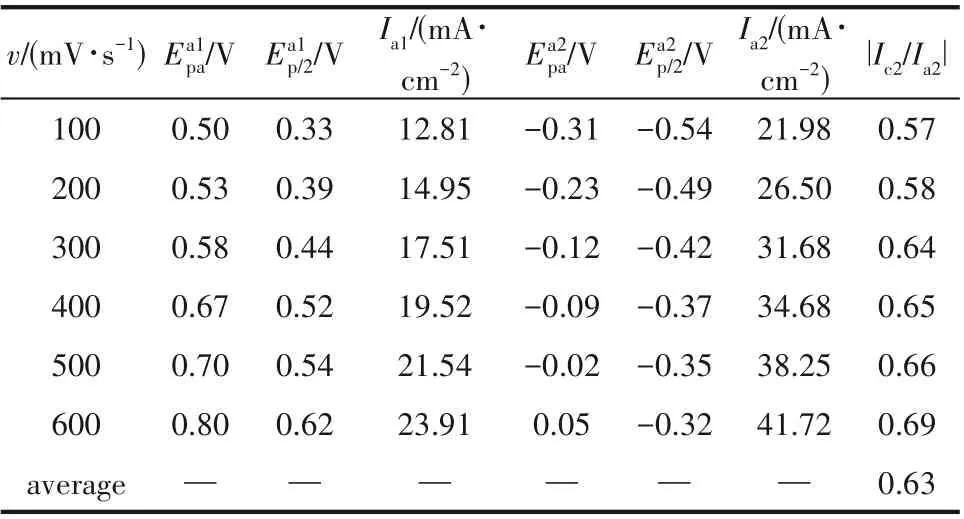
表2 铜铝双金属复合离子液体在W盘工作电极上不同扫描速率下的CV曲线的氧化峰数据Table 2 Data of oxidation peaks of CV curves of Cu-Al bimetallic composite ionic liquid on W electrode under different scanning rates
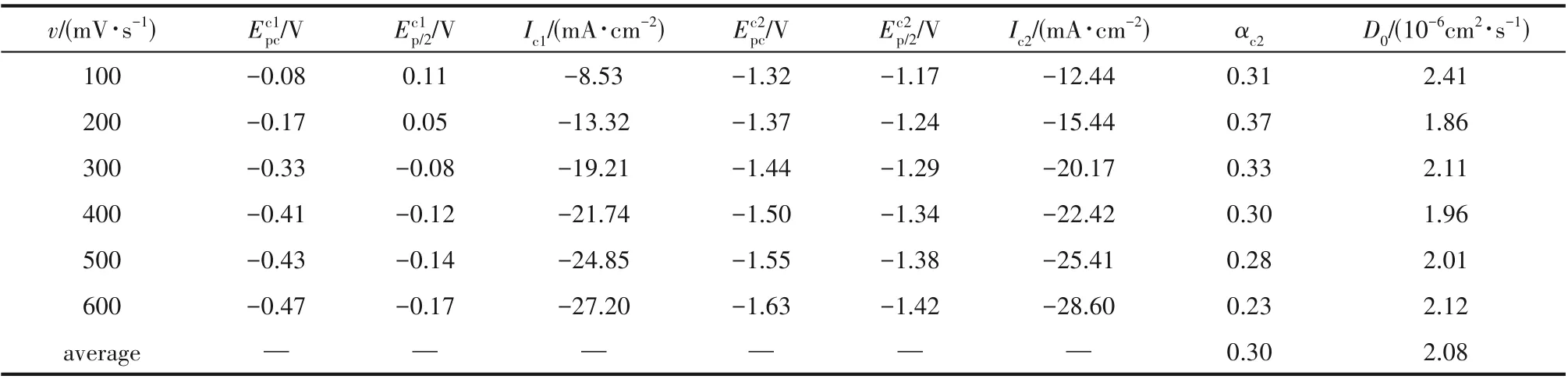
表3 铜铝双金属复合离子液体在W盘工作电极上不同扫描速率下的CV曲线的还原峰数据Table 3 Data of reduction peaks of CV curves of Cu-Al bimetallic composite ionic liquid on W electrode under different scanning rates
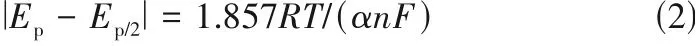
2.2 铜铝双金属复合离子液体的计时安培研究
通过计时安培法更细致地研究了铜电结晶的动力学过程。三维成核生长的两个边界过程即三维瞬时成核过程和三维连续成核过程的理论模型分别对应式(3)和式(4)[34-35]。
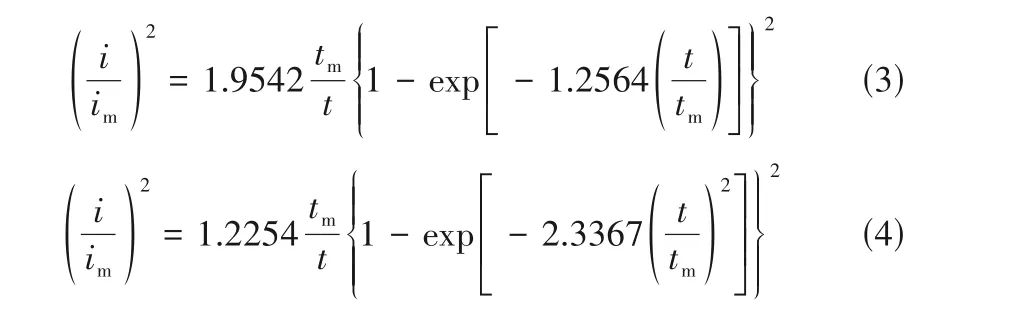
图4 为铜铝双金属复合离子液体在Cu 丝上的电流-时间暂态曲线,可以看出在施加电压后,电流先增大,当到达电流最大值im后逐步下降,最后趋向平缓,但并不接近零,由此可知铜的成核方式是三维成核。

图4 铜铝双金属复合离子液体在Cu丝电极上的电流-时间暂态曲线Fig.4 Current-time transient of Cu-Al bimetallic composite ionic liquid on Cu wire electrode
图5为铜铝双金属复合离子液体不同电压下电流-时间暂态无量纲曲线实验与理论对比,可以看出在-2.70~-2.85 V 电压范围内时,铜铝双金属复合离子液体的电流-时间暂态无量纲曲线更接近三维瞬时成核理论曲线,说明铜的成核方式为三维瞬时成核,这与文献报道的咪唑盐离子液体体系中铜的成核过程相同[19,25]。

图5 铜铝双金属复合离子液体不同电压下电流-时间暂态无量纲曲线实验与理论对比Fig.5 Comparison of the dimensionless experimental currenttime transient of Cu-Al bimetallic composite ionic liquid with the theoretical curves for instantaneous nucleation and progressive nucleation
2.3 铜铝双金属复合离子液体电沉积长周期实验
电沉积过程最重要的定律之一是法拉第定律,即电解质溶液通电后,在电极上发生化学反应的物质量与通入电量成正比[36],其表达式如式(5)所示:


在铜铝双金属复合离子液体电沉积过程中,假设理想状态下的电流效率为100%,长周期实验过程中,当单位时间0.5 h 内恒定通过电量为Q时,电沉积铜的实际质量为mCuindeposits=6.58×10-4Q。由于每组电沉积时间间隔为0.5 h,因此累计电沉积铜的实际质量与电沉积时间t(h)及电量Q(C)的关系式为mCuindeposits=1.32×10-3Qt。
由此可计算铜铝双金属复合离子液体Cu(Ⅰ)浓度随电沉积时间的变化趋势:
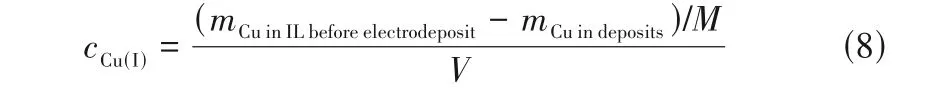
根据电沉积前的数据可计算获得cCu(I)=(1.12~5.20)×10-4Qt。
表4 为铜铝双金属复合离子液体在25℃、电沉积电势为-2.60 V 下长周期电沉积过程不同时间通过的电量,假设电流效率为100%,可计算获得相应电沉积时间阶段铜铝双金属复合离子液体Cu(Ⅰ)浓度随电沉积时间的变化,其结果如图6 所示,可以看出铜铝双金属复合离子液体Cu(Ⅰ)浓度随时间逐步降低,且下降趋势变缓,表明随着时间推移,电沉积铜速率降低。8 h 长周期实验后Cu(Ⅰ)浓度从1.12 mol·L-1降至0.99 mol·L-1,此时Cu(Ⅰ)含量依然很高,对电解液继续电沉积仍然可获得金属铜。
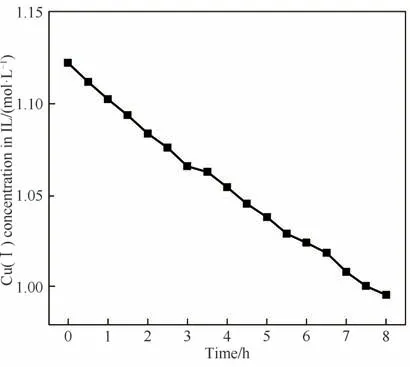
图6 铜铝双金属复合离子液体8 h长周期实验过程Cu(Ⅰ)浓度随时间的变化Fig.6 Trend of Cu(Ⅰ)concentration for Cu-Al bimetallic composite ionic liquid during long-term electrodeposition
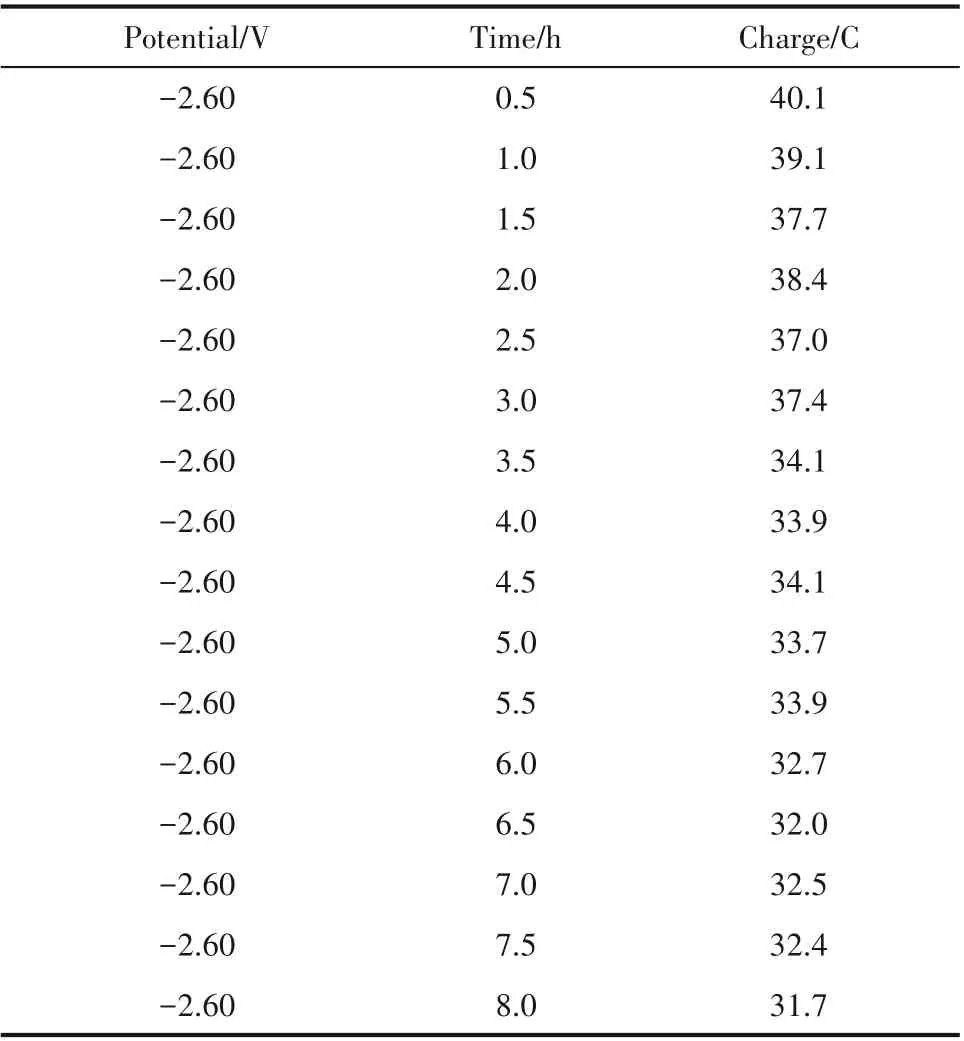
表4 铜铝双金属复合离子液体长周期电沉积过程不同时间通过的电量Table 4 Charge for different time during long-term electrodeposition of Cu-Al bimetallic composite ionic liquid
2.4 铜铝双金属复合离子液体的电沉积产物及组成研究
图7(a)~(c)分别为电沉积时间为0.5 h,电势为-1.20、-1.70、-2.60 V 获得的沉积物的扫描电镜图,可以看出-1.20 V时,电沉积产物的形貌不规则,部分呈现绒球状;当电势为-1.70 V 时,沉积产物呈现不规则的颗粒状;当电势为-2.60 V 时,沉积产物的形貌为尺寸更小的颗粒状,且排布十分规整,此时沉积物变得更致密、平滑。由此表明沉积电势对沉积产物的形貌和尺寸影响较大,随着电位负移,沉积产物尺寸明显减小,且更加规整致密。
对于图7 中沉积电势-2.60 V 下的镀层进行EDX 面扫,结果如图8 所示,除了少量残留的铝[0.47%(质量,下同)]和氯(1.07%)、未完全覆盖的银基底(1.20%)和空气氧化产生的氧(1.85%),可以明显看出颗粒状沉积物绝大部分为金属铜(95.41%),并且铜元素整体分布比较均匀。

图7 铜铝双金属复合离子液体不同电压下获得的阴极沉积物的SEM图Fig.7 SEM images of electrodeposits of Cu-Al bimetallic composite ionic liquid under different potentials

图8 -2.60 V下得到的镀层EDX面扫描谱图Fig.8 EDX mapping images of electrodeposits at the potential of-2.60 V with the elements of Cu,Al,Ag,Cl and O
此外,对于电沉积时间为0.5 h,不同电势下获得的电沉积产物进行XRD 表征,结果如图9 所示。发现在沉积电势分别为-1.20、-1.70、-2.60 V 时,所得沉积产物的XRD 衍射峰与PDF 卡片Cu(89-2838)的相一致,说明沉积产物均为金属铜,其电沉积机理如式(9)所示。长周期实验其他时间阶段获得的电沉积产物的表征结果与上述结果是一致的,说明铜铝双金属复合离子液体在该处理量和该电化学窗口内只电沉积得到金属铜。
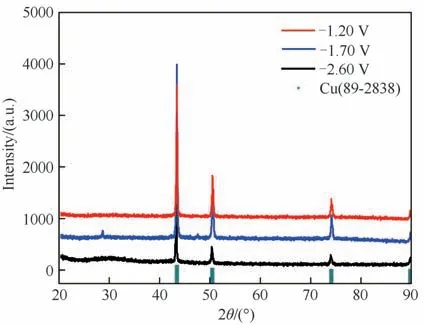
图9 铜铝双金属复合离子液体在不同电势(-1.20、-1.70、-2.60 V,vs Pt)下的电沉积产物的XRD谱图Fig.9 XRD patterns of cathodic electrodeposits from Cu-Al bimetallic composite ionic liquid on the silver electrode at the potentials of-1.20,-1.70 and-2.60 V(vs.Pt)
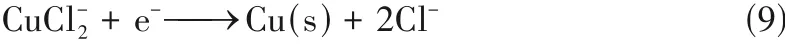
3 结 论
(1) 循环伏安研究表明高含量Cu(Ⅰ)的铜铝双金属复合离子液体在Pt 盘电极、W 盘电极和玻碳电极上的阳极峰均包括Cu→Cu(Ⅰ)和Cu(Ⅰ)→Cu(Ⅱ)两个氧化过程,阴极峰均包括铜的欠电势沉积、Cu(Ⅰ)的还原和铜的超电势沉积。铜的欠电势沉积和Cu(Ⅰ)的还原均是受扩散控制的不可逆电化学反应过程,其中Cu(Ⅰ)还原过程的平均电子传递系数αc2为0.30,扩散系数平均值为2.08×10-6cm2·s-1。
(2)计时安培研究表明复合离子液体中铜的成核方式为三维瞬时成核。
(3)长周期电沉积实验显示铜铝双金属复合离子液体中Cu(Ⅰ)浓度随时间逐步下降的趋势变缓,表明随着时间推移,电沉积铜速率降低。
(4)电沉积电势对沉积产物的形貌和尺寸有较大影响,在-1.20~-2.60 V 电势下得到的沉积产物均为金属铜,而且在-2.60 V下获得的沉积产物更平整致密,且金属铜的分布也更均匀。
符 号 说 明
A——工作电极面积,cm2
c——Cu(Ⅰ)离子浓度,mol·L-1
D0——扩散系数,cm2·s-1
Epa——阳极峰电位,V
Epc——阴极峰电位,V
Ep/2——半峰电位,V
F——法拉第常数,C·mol-1
M——摩尔质量,g·mol-1
m——质量,g
n——转移电子数
Q——电量,C
R——气体常数,J·K-1·mol-1
T——热力学温度,K
V——体积,ml
z——电子计量系数
η——电流效率
ρ——密度,g·ml-1

